혈액 배양
Blood culture| 혈액 배양 | |
|---|---|
 한 실험실 직원이 혈액 배양액을 배양하고 미생물 성장을 감지하는 자동화된 시스템인 BT/알러트 기계에서 혈중 배양병을 내린다. | |
| 메슈 | D000071997 |
| 로인크 | 600-7 |
| 메드라인플러스 | 003744 |
혈액 배양이란 사람의 혈액 속에 있는 박테리아나 곰팡이를 발견하는 데 사용되는 의학 실험실 검사다.정상 상태에서는 혈액에 미생물이 들어 있지 않다. 미생물이 존재하면 균혈증이나 펑지혈증과 같은 혈류 감염을 나타낼 수 있으며, 심한 경우 패혈증을 일으킬 수 있다.혈액을 배양함으로써 미생물을 식별하고 항균제 내성을 시험할 수 있어 임상의가 효과적인 치료를 제공할 수 있다.
검사를 실시하기 위해 배양 배지라고 불리는 미생물 성장을 촉진하는 액체 공식이 들어 있는 병에 혈액을 뽑아 넣는다.보통 한 번의 추첨으로 두 개의 용기가 모이고, 그 중 하나는 산소를 필요로 하는 유산소 생물을 위해 고안되었으며, 그 중 하나는 무산소 생물을 위한 것이다.이 두 용기는 혈액 문화의 집합이라고 불린다.때때로 두 세트의 혈액이 서로 다른 두 곳의 혈액을 채취한다.만약 어떤 유기체가 두 세트 중 하나에만 나타난다면, 그것은 진짜 혈류 감염보다 피부 동식물 오염을 나타낼 가능성이 더 높다.항균제 투여 후 시료를 채취하거나 권장 혈액량을 병에 채우지 않은 경우 거짓 음성 결과가 발생할 수 있다.어떤 유기체들은 혈액 배양에서 잘 자라지 않고 발견을 위한 특별한 기술이 필요하다.
그 용기들은 유기체들이 증식할 수 있도록 며칠 동안 인큐베이터에 넣어진다.미생물 생성이 검출되면 배양병에서 그램 얼룩을 실시해 유기체가 존재하는지 확인하고 그램의 정체성에 대한 예비 정보를 제공한다.그리고 나서 혈액은 하위 배양된다. 즉, 혈액은 한천 판 위에 줄무늬가 있어 완전한 식별과 항균 민감성 검사를 위해 미생물 군집을 격리한다.혈류 감염을 신속하게 진단하고 치료하는 것이 필수적이기 때문에 중합효소 연쇄반응, MALDI-TOF MS 등의 기술을 활용한 신속한 검사 방법이 개발됐다.
혈통을 배양하는 절차는 19세기 중반에 발표되었지만, 이러한 기술들은 노동집약적이었고 현대적인 방법과는 거의 유사하지 않았다.미생물 증식 검출은 1970년대 미생물 대사에 의해 생성되는 가스를 모니터링하는 자동화된 혈액배양 시스템이 도입되기 전까지 배양병의 육안검사가 필요했다.선진국에서는 자동화된 시스템에 의해 수동적인 혈액 배양법이 대부분 쓸모 없게 되었다.
의학적 용법
피는 보통 무균상태다.[1]혈액 속 세균의 존재는 균혈증이라고 하며, 곰팡이의 존재는 펑기증이라고 한다.[2]칫솔질이나 배변과 같은 상황에서 발생할 수 있는 피부나[3] 점막의 경미한 손상은 [4][5]세균을 혈류로 유입시킬 수 있지만, 이 균혈증은 면역체계와 망막체계가 빠르게 격리되어 유기체를 파괴하기 때문에 보통 일시적인 것이며 문화권에서 거의 검출되지 않는다.[3][6]세균은 셀룰러염, UTI, 폐렴 등의 감염으로 혈액에 유입될 수 있으며,[7] 세균성 심내막염이나 정맥선과 관련된 감염과 같은 혈관계 내의 감염은 지속적인 균열을 초래할 수 있다.[4]공황증은 면역체계가 제대로 작동하지 않는 사람들에게서 가장 흔하게 발생한다.[2]혈류에서 세균이나 곰팡이가 제거되지 않으면 다른 장기와 조직으로 퍼지거나,[3] 면역반응을 일으켜 패혈증이라는 전신 염증성 질환으로 이어져 생명을 위협할 수 있다.[8][9]
패혈증이 의심될 때는 혈액문화를 그려서 원인물질을 파악하고 표적항균치료를 할 필요가 있다.[10]병원에 입원하여 열이 나고 체온이 낮으며 백혈구 수치가 높거나 과립구(백혈구의 한 범주)가 적은 사람들은 흔히 혈류 감염 가능성을 감지하기 위해 그려지는 문화를 가지고 있다.[11][12]혈액 배양균은 열 중성미자의 혈류 감염을 감지하는 데 사용되는데, 이는 열이 심하게 낮은 중성미자(세균과 곰팡이 병원균을 방어하는 백혈구)와 함께 발생하는 화학요법의 흔한 합병증이다.[13][14][15]박테레미아는 뇌막염, 패혈성 관절염, 경막외 종기 등 일부 유형의 감염에서 흔하게 나타나기 때문에 이러한 상태에서는 혈액문화가 나타난다.균혈증과 덜 관련이 있는 감염의 경우, 개인이 혈관내 감염에 걸릴 위험이 높거나 주요 감염 부위로부터 배양균을 즉시 얻을 수 없는 경우(예: 혈소판염의 소변 배양 또는 심각한 지역사회취득 폐렴의 가래 배양) 혈액 배양균이 여전히 표시될 수 있다.혈통은 심내막염과[18] 원인불명의 발열에서 근본적인 미생물의 원인을 밝혀낼 수 있다.[16][17][11][19]
혈액문화에서 가장 많이 발견되는 병원균은 포도상구균, 대장균 등 엔테로박테리아과, 엔테로코쿠스종, 녹농균, 칸디다알비칸 등이 있다.[20][21]정상 피부 식물의 일부를 구성하는 이러한 유기체가 진정한 병원균인지 아니면 단순한 오염물질인지 불분명하지만, 코아굴라제 음성 포도상구균(CNS)도 흔히 접하게 된다.[22][21]신생아와 어린이에게서 채취한 혈액 배양액에서 CNS는 상당한 감염을 나타낼 수 있다.[23]혈류 감염의 역학 시간과 장소에. 예를 들면, 그램 양성의 유기체는 1980년대와 1990s,[24]과 진균 혈증의 발생 비율 크게 사람들 immunosup 받는 인구 증가와 제휴가 늘었다 bacteremia의 미국에서 가장 중요한 원인으로Gram-negative 유기체들을 제치고 다양하다.pr화학 [25]요법과 같은 본질적인 치료그람 음성 패혈증은 북미와 서유럽보다 중남미, 동유럽, 아시아에서 더 흔하며, 아프리카에서는 살모넬라균이 박테레미아의 주요 원인이다.[26]
절차
컬렉션
혈액문화는 전형적으로 정사를 통해 그려진다.카테터 관련 감염을 진단하기 위해 정맥주사 및 정맥주사 모두에서 배양액을 수집할 수 있지만 정맥주사 라인에서 샘플을 채취하는 것은 권장되지 않는다.[11][27]채혈 전 각 채수병 상단은 알코올 면봉으로 소독해 오염을 방지한다.[11]그런 다음 구멍 주변의 피부는 세척하고 건조하도록 방치한다. 일부 프로토콜은 알코올 기반 소독제를 사용한 소독과 클로로헥시딘 또는 요오드 기반 소독제를 권장하는 반면,[note 1][27][28] 다른 프로토콜은 알코올 함유 소독제만 사용해도 충분하다고 간주한다.[17][29]혈액 배양과 동시에 다른 검사를 위해 혈액을 채취해야 할 경우 배양병을 먼저 뽑아 오염 위험을 최소화한다.[30]항균요법은 미생물의 성장을 억제함으로써 잘못된 음성 결과를 초래할 수 있기 때문에 중병에 걸린 사람에게는 비실용적일 수 있지만 항균제가 투여되기 전에 혈액문화를 그려보는 것이 좋다.[10]
전형적인 혈액문화 수집은 두 병에 혈액을 끌어들이는 것을 포함하는데, 이것은 함께 하나의 "문화" 또는 "세트"를 형성한다.한 병은 유산소 생물의 성장을 증진시키기 위해 고안되었고, 다른 병은 혐기성 생물을 성장시키기 위해 고안되었다.어린이의 경우 혐기성 박테리아에 감염되는 경우는 드물기 때문에 필요한 혈액의 양을 최소화하기 위해 에어로빅 병 1개를 채취할 수 있다.[31]두 개의 분리된 정맥 위치에서 적어도 두 세트를 수집하는 것이 좋다.이것은 오염물질이 실제 병원균보다 한 세트 이상에서 나타날 가능성이 적기 때문에 감염과 오염을 구별하는 데 도움이 된다.또한, 더 많은 양의 혈액이 모이면 미생물이 발견될 가능성이 높아진다.[32]
혈액배양병에는 미생물의 증식을 촉진하는 배지, 혈액이 응고되지 않도록 하는 항응고제가 들어 있다.[33]폴리아네톨술폰산나트륨(SPS)은 대부분의 생물의 생장에 지장을 주지 않기 때문에 가장 흔히 사용되는 항응고제다[33].[28]배지의 정확한 구성은 다르지만 에어로빅 병은 뇌심장 주입이나 트루실화효소 콩 육수 등 영양소가 풍부한 육수를 사용하며 혐기성 병에는 일반적으로 티오글리콜레이트 등 환원제가 들어 있다.[34]혐기성 병의 빈 공간은 산소가 들어 있지 않은 가스 혼합물로 채워진다.[33][35]
시중에서 제조된 많은 병에는 항생제를 흡수하는 수지가 들어 있어 시료의 미생물에 대한 작용을 감소시킨다.[11]소아용 병들은 낮은 혈액량을 수용하도록 고안되었고 어린이들에게서 더 흔히 발견되는 병원균의 성장을 강화하는 첨가물을 가지고 있다.[36]다른 전문 병들은 곰팡이와 미코박테리아를 검출하기 위해 사용될 수 있다.[35]중저소득 국가에서는 미리 조성된 배양병이 엄청나게 비쌀 수 있으며, 수작업으로 준비하는 것이 필요할 수도 있다.제대로 된 보급품이나 시설에 접근하기 어려울 수 있고,[37] 일부 지역에서는 아예 혈액문화 수행이 불가능할 수도 있다.[38]
병들이 부족하거나 과충전되지 않는 것이 중요하다: 과충전은 표본에 존재하는 유기체가 적기 때문에 잘못된 부정적인 결과를 초래할 수 있는 반면 과충전은 생육 매체 대 혈액의 비율이 상대적으로 낮기 때문에 미생물 성장을 억제할 수 있다.미생물 성장을 최적화하기 위해 혈중배지 대 배양배지 비율을 1:10 대 1:5로 하는 것이 제안된다.[28][39]성인의 일상적인 혈액 배양에 대해 임상시험소표준연구소(CLSI)는 각 세트에 20~30mL의 혈액을 채취하여 서로 다른 두 번의 추첨에서 두 세트의 병을 채취할 것을 권고한다.[11]어린이의 경우 혈액을 뽑아내는 양이 아이의 나이나 몸무게에 따라 결정되는 경우가 많다.[36][40]심내막염이 의심되면 총 6병을 수거할 수 있다.[41]
컬처링
혈액을 채취한 후에는 체온으로 병을 배양해 미생물의 성장을 촉진한다.대부분의 일반적인 혈류 병원균은 48시간 이내에 검출되지만 병은 보통 자동화 시스템에서 최대 5일간 배양된다.[43][44]수동혈액배양법을 사용하거나 심내막염을 일으키는 특정세균 등 성장 속도가 느린 유기체가 의심될 경우 잠복기를 더욱 연장할 수 있다.[43][45]수동 시스템에서 병들은 흐림, 기체의 생산, 눈에 보이는 미생물 군집의 존재 또는 혈액의 소화에서 오는 색의 변화를 포함할 수 있는 미생물 성장 지표를 육안으로 검사하는데, 이를 용혈이라고 한다.일부 수동 혈액 배양 시스템은 가스가 생성될 때 액체로 채워지는 구획이나 병을 기울여서 주기적으로 접종하는 미니어처 아가르 판을 이용하여 성장을 나타낸다.[46]양성 혈액 배양균을 놓치지 않도록 하기 위해 배양 기간이 끝나면 성장 지표의 준수 여부와 관계없이 병에서 채취한 샘플을 한판(하위 배양액)에 접종하는 경우가 많다.[47]
선진국에서는 배양병에 대한 지속적인 전산 모니터링을 제공하는 자동화된 시스템으로 수동 배양 방식이 대체되어 왔다.[48]BATEC, BacT/ALERT, VerusTrek와 같은 이러한 시스템은 배양 병이 지속적으로 혼합되는 인큐베이터로 구성된다.생장은 미생물 대사의 지표 역할을 하는 병 안의 가스 수준(가장 일반적으로 이산화탄소)을 측정하는 센서에 의해 감지된다.[46]경보나 시각 표시기는 미생물학자에게 양성 혈액 배양병의 존재를 알려준다.[49]병균이 배양 기간이 끝나도 음성으로 남아 있으면 일반적으로 하위 배양하지 않고 폐기한다.[47]
용해-중심화 방법이라고 불리는 기술은 곰팡이, 미코박테리아, 레지오넬라 같은 느리게 자라거나 까다로운 유기체의 격리 개선을 위해 사용될 수 있다.[50][51]이 방법은 배지가 채워진 병에 혈액을 배양하기보다는 적혈구와 백혈구를 파괴(라이스)하는 작용제가 들어 있는 관에 혈액을 채취한 뒤 원심분리기로 시료를 돌리는 방식이다.[52]이 과정은 존재하는 경우 미생물을 포함한 샘플의 고체 내용물을 펠릿에 집중시켜 하위 배양 배지를 접종하는 데 사용된다.용해-중심화는 기존 혈액배양법보다 감도가 높은 반면, 시료의 광범위한 조작이 필요하기 때문에 오염되기 쉽다.[53]
식별
생장이 감지되면 미생물학자가 병에서 채취한 혈액 샘플에 그람 얼룩을 일으켜 빠른 예비식별을 할 것이다.[54]그램 얼룩은 박테리아를 그람양성 또는 그람 음성으로 분류하고, 그들의 배열뿐만 아니라 막대모양(바실리), 구형(코치), 나선모양(스파이로체) 등 그 모양에 대한 정보를 제공한다.[55]예를 들어 군집의 그램 양성 코치는 포도상구균종의 전형이다.[56]효모와 다른 곰팡이도 그람 얼룩에서 확인될 수 있다.[57][58]혈액 배양에서 미생물 성장을 식별하는 그램 얼룩은 중요한 결과로 간주되며 즉시 임상의에게 보고해야 한다.[59]그람 얼룩은 유기체의 가능한 정체성에 대한 정보를 제공하는데, 이것은 완전한 문화와 민감성 결과가 완성되기 전에 임상의가 보다 적절한 항균 처리를 선택하는 데 도움을 준다.[54]
전통적인 방법에서, 혈액은 추가 검사를 위해 유기체를 분리하기 위해 한판 위에 하위 배양된다.그램 얼룩 결과는 미생물학자들에게 어떤 종류의 한천판을 사용해야 하는지, 그리고 그 유기체를 식별하는 데 어떤 테스트가 적절할 수 있는지에 대해 알려준다.[60]배양병이 성장지표를 보여주거나 자동화기기로 양성반응을 보였음에도 그램 얼룩에 생물이 보이지 않는 경우도 있다.이것은 거짓 양성 결과를 나타낼 수도 있지만, 유기체가 존재하지만 현미경으로 쉽게 시각화할 수는 없을 가능성이 있다.음의 그램 얼룩이 있는 양성병은 인큐베이터로 돌아가기 전에 하위 배양되며, 종종 느리게 자라는 유기체의 성장을 촉진하는 특별한 배양 배지를 사용한다.[61]
확정적인 식별이 가능하려면 하위문화판에서 충분한 성장이 일어나는 데 일반적으로 24시간에서 48시간이 걸린다.[57]이때 미생물학자는 세균군이나 곰팡이 군락의[62] 외관을 평가하고, 속이나 종 수준에 대한 식별을 허용하는 유기체의 대사 및 생화학적 특징에 대한 정보를 제공하는 검사를 실시할 예정이다.예를 들어 카탈라아제 검사는 연쇄상구균과 포도상구균(그람 양성 cocci의 2세대)[63]을 구별할 수 있고, 코아구라제 검사는 혈류감염의 공통원인 포도상구균 aureus를 병원성이 적은 코아구라제 음성인 포도상구균과 구별할 수 있다.[29][64]
미생물이 또한 생화학적 tests,[65]또는 matrix-assisted 레이저 desorption/ionization에 미생물 단백질과 특징들은mass-to-charge 비율의 기준으로 이온화된다 이동 시보 질량 분석기(MALDI-TOF MS)의 패널을 수행하는 도구가 아니라 각 종의 미생물과 같은 자동화 시스템들을 사용하는 확인될 수 있다.exh질량분석을 통해 분석했을 때 단백질의 특징적인 패턴의 ibits.[66]
혈류 감염은 생명을 위협할 수 있기 때문에 시기적절한 진단과 치료가 중요하며,[67] 이를 위해 여러 가지 신속한 식별 방법이 개발되었다.[57]MALDI-TOF는 분리 및 농도 절차 후 양성 혈액 배양병에서 직접 유기체를 식별하거나,[68] 하위 배양 후 몇 시간 이내에 한천판의 예비 성장으로부터 유기체를 식별하는 데 사용할 수 있다.[69]중합효소 연쇄반응(PCR)이나 마이크로레이와 같은 유전적 방법은 혈액 배양 샘플에서 특정 종에 특정한 DNA 서열을 검출하여 미생물을 식별할 수 있다.공통 혈액 배양 병원균의 식별을 위해 고안된 여러 시스템이 상업적으로 이용 가능하다.[70]일부 생화학적 및 면역학적 테스트는 S. aureus의[57] 식별을 위한 튜브 응고효소 테스트나 스트렙토코쿠스 진폐증에 대한 라텍스 응고 테스트와 같이 양성 혈액 배양에 대해 직접 수행할 수 있으며,[71] PCR 및 MALDI-TOF와는 달리 이러한 방법은 저소득 및 중간 소득 국가의 실험실에 실용적일 수 있다.[42]성장매체의 첨가물이 결과를 방해할 수 있기 때문에 배양균 테스트만큼 신뢰성이 떨어지지는 않지만 양성 배양병에서 나온 혈액으로 미생물 식별패널을 직접 접종하는 것도 가능하다.[72]
배양균을 통째로 우회하고 혈액 샘플에서 병원균을 직접 검출하면 진단이 더욱 빨라질 수 있다.2018년 현재 몇 개의 직접 테스트 시스템이 상용화되었지만, 이 기술은 아직 걸음마 단계에 있다.대부분의 패널은 한정된 수의 병원균만 검출하고, 기존 혈액 배양 방식에 비해 민감도가 떨어질 수 있다.완전한 항균 민감도 테스트를 수행하기 위해서는 배양 작업이 여전히 필요하다.[73]
항생제 민감성 검사
혈류감염의 항균 치료는 초기에는 경험적인 것으로서, 그 병의 인과작용에 대한 임상의사의 의심과 항균 저항의 국소적 패턴에 근거한 것이다.혈액 배양액에서 격리된 병원체에 대한 항생제 민감성 검사(AST)를 수행하면 임상의사가 보다 표적화된 치료를 제공하고, 바람직하지 않은 부작용을 일으킬 수 있는 광범위한 항생제를 중단할 수 있다.[8][10]디스크확산시험과 같은 전통적인 AST 방법에서는 하위문화판에서 유기체의 순수한 군락을 선택하여 2차 배지를 접종하는 데 사용한다.이러한 방법은 결과를 얻기 전에 하룻밤 사이에 배양해야 한다.[74]미리 형성된 항생제 패널을 사용하고, 미생물 성장을 자동으로 측정하며, 알고리즘을 사용하여 민감도 결과를 결정하는 자동화된 시스템이 있다. 이들 중 일부는 5시간 이내에 결과를 제공할 수 있지만, 다른 시스템들은 하룻밤 사이에 배양해야 한다.[65][75]
효과적인 항균제의 신속한 투여는 패혈증 치료에 결정적이기 때문에 항생제 민감도 결과를 더 빠르게 제공하기 위해 여러 가지 방법이 개발되었다.[8]기존의 AST 방법은 하위 배양판,[76] 양혈 배양균의 집중과 정화에 의해 얻은 미생물의 펠릿 또는 배양병에서 직접 성장하여 수행할 수 있다.[77][78]직접 검사 방법은 유기체를 격리시키지 않기 때문에 혈액 배양에서는 드물게 발생하지만 둘 이상의 미생물이 존재할 경우 정확한 결과를 제공하지 못한다.[76]또 다른 오류의 원인으로는 시료(접종)에 들어 있는 세균의 양을 표준화하는 데 어려움이 있어 검사 결과에 지대한 영향을 미친다.[79]
유전자 검사는 특정 항균 저항 표지를 신속하게 검출하는 데 사용될 수 있다.[80]양성 혈액 배양 샘플에 직접 투여할 수 있는 PCR, 마이크로레이 등의 방법은 메티실린 내성 포도상구균 아우레우스에서 발견된 메카 유전자나 반코마이신 내성 장내성 유전자(vanA 및 vanB 유전자) 등 내성을 부여하는 유전자와 연관된 DNA 서열을 검출한다.[70][68]MALDI-TOF는 항생제 존재 시 미생물 성장 측정, 미생물 효소에 의한 항생제 분해 확인, 항생제 내성을 보이는 박테리아 변종과 관련된 단백질 스펙트럼 검출 등 빠른 항균 민감도 검사 방법으로 연구돼 왔다.[79]이러한 방법 중 일부는 양성 혈액 배양 병에서 나온 펠릿에 대해 수행될 수 있다.[81]다만 MALDI-TOF에 의한 AST에 대한 확립된 방법론이 부족하여 임상실무에서의 사용을 제한하고 있으며,[82] MALDI-TOF에 의한 직접 AST는 유전자 검사 방법과 달리 2018년 현재 식약청의 승인을 받지 못하고 있다.[81]
제한 사항
혈액 문화는 잘못된 긍정 오류와 잘못된 부정 오류 둘 다의 대상이 된다.자동화된 배양 시스템에서 양성병의 식별은 세포대사에 의해 생성되는 기체의 검출에 기초하기 때문에 백혈구 수가 많은 시료는 세균이 없을 때 양성인 것으로 보고될 수 있다.계측기에서 생산되는 성장곡선을 검사하면 참과 거짓의 양성문화를 구분하는 데 도움이 될 수 있지만, 그램 스텐딩과 하위 재배는 양성으로 플래그가 표시된 어떤 표본에도 여전히 필요하다.[61]
혈액 배양균은 피부나 환경의 미생물에 오염될 수 있는데, 이는 배양통 내부에 증식되어 혈액 속에 그런 생물이 존재한다는 잘못된 인상을 준다.[11]혈액 배양균이 오염되면 불필요한 항생제 치료와 장기 입원 등으로 이어질 수 있다.[29]혈액배양 채취에 대해 확립된 규약을 따름으로써 오염 빈도를 줄일 수는 있지만 완전히 제거할 수는 없다.[83] 예를 들어, 혈류 채취 부위의 세심한 소독 후에도 더 깊은 피부 층에서 박테리아가 생존할 수 있다.[29]CLSI는 허용 가능한 오염률을 모든 혈액 배양액의 3% 이하로 정의한다.[11]같은 병원의 기관과 부서마다 오염 빈도가 매우 다양하다;[83] 연구는 0.8에서 12.5 퍼센트의 비율을 발견했다.[29]
양성 혈액 배양 결과에 직면했을 때, 임상의는 그 발견이 오염을 나타내는 것인지 아니면 진짜 감염을 나타내는 것인지 결정해야 한다.S. aureus 또는 Streptocococcus permoniae와 같은 일부 유기체는 보통 혈액 배양에서 발견되었을 때 병원성으로 간주되는 반면, 다른 유기체는 피부 동식물과의 오염을 더 잘 나타내지만, 심지어 코글라아제 음성 포도상구균과 같은 흔한 피부 유기체도 특정 조건에서 혈류 감염을 일으킬 수 있다.그러한 유기체가 존재할 때, 배양 결과의 해석은 그 사람의 임상 상태와 다중 배양균이 동일한 유기체에 대해 양성인지 여부를 고려하는 것을 포함한다.[29]
잘못된 부정은 항생제를 투여받은 후 혈통을 그리거나 부족한 양의 혈액을 채집함으로써 발생할 수 있다.채취한 혈액의 양은 병원균이 검출되도록 하는 데 가장 중요한 변수로 꼽힌다. 즉, 채취한 혈액이 많을수록 병원균을 더 많이 회수하는 것이다.[11]그러나 채취한 혈액의 양이 권장량을 훨씬 초과하면 혈액에 존재하는 자연억제제와 병 속의 생장 매개체의 불충분한 양에 의해 세균 성장이 억제될 수 있다.혈액 배양병의 과충전은 또한 이아트로겐성 빈혈의 원인이 될 수 있다.[28]
기존의 혈액 배양법으로 모든 병원균이 쉽게 검출되는 것은 아니다.브루셀라와 미코박테리움 종과 같은 특히 까다로운 유기체들은 긴 잠복기 또는 특별한 배양 매체를 필요로 할 수 있다.일부 유기체는 배양하기 매우 어렵거나 배양에서 전혀 자라지 않기 때문에 이들 유기체와의 감염이 의심되면 PCR과 같은 종양검사나 분자법이 선호된다.[45][84]
역사
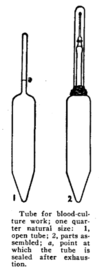
초기 혈액 배양 방법은 노동 집약적이었다.[86]1869년에 발표된 최초의 알려진 절차 중 하나는 거머리들을 환자로부터 혈액을 채취하는 데 사용할 것을 권고했다.[87]1911년의 한 미생물학 교과서는 추첨 장소와 장비의 오염을 제거하는데 1시간이 넘게 걸릴 수 있으며, 효과적인 혈액 보존 방법의 부족으로 인해 때때로 배양균이 환자의 머리맡에서 준비되어야 한다고 지적했다.육수를 하위 배양하는 것 외에도, 일부 프로토콜은 혈액을 녹인 한가와 섞고 혼합물을 페트리 접시에 붓도록 명시했다.[86]1915년에는 포도당 육수가 들어 있는 유리 진공관과 항응고제로 구성된 혈액 배양 시스템이 설명되었다.로버트 제임스 발렌타인 풀버타프트는 1930년에 혈액문화에 관한 정석적인 연구결과를 발표했는데,[88] 다른 통찰력들 중에서는 혈액 대 부류 비율이 1:5라는 최적의 결과를 명시하고 있으며, 이 연구는 오늘날에도 여전히 받아들여지고 있다.[87]SPS를 항응고제 및 방부제로 사용한 것은 1930년대와 40년대에 도입되어 이전의 방법으로 물류상의 문제를 일부 해결하였다.[86]1940년대부터 1980년대까지 모든 공통 혈류 병원체를 수용할 수 있는 배지를 만들겠다는 목표로 국물 제제와 첨가제에 대한 많은 연구가 진행되었다.[87]
1947년, M.R. 카스타녜다는 브루셀라 종의 식별을 위한 "비파식" 배양 병을 발명했는데, 브루셀라 종은 육수와 한천 기울기를 모두 함유하고 있어 육수에서 한천어를 쉽게 하위 배양할 수 있었다.[42] 이것은 수혈 문화를 위한 현대 시스템의 전구였다.[43]E.G. Scott는 1951년에 "현대 혈액 문화 세트의 도래"라고 묘사된 프로토콜을 발표했다.[86]스콧의 방법은 두 개의 고무 밀봉 유리병에 혈액을 접종하는 것을 포함했다. 하나는 에어로브용이고 다른 하나는 애너로브용이었다.에어로빅 병에는 트릴리콜라제 콩 육수와 한천 기울기가 들어 있었고, 혐기성 병에는 티오글리콜라 국물이 들어 있었다.용해-중심화 방법은 1917년 밀드레드 클로에 의해 도입되었지만 1970년대 중반 상업 시스템이 개발되기 전까지는 임상 실습에서 거의 사용되지 않았다.[86][89]
자동화된 혈액 배양 시스템은 1970년대에 처음 이용 가능해졌다.[90]이 중 가장 초창기인 BATEC 시스템은 존스턴 연구소(현 벡튼 디킨슨)에서 생산한 것으로 방사성 동위원소가 라벨로 표시된 영양소를 함유한 배양육수를 사용했다.이러한 기판을 먹고 사는 미생물들은 방사성 이산화탄소를 발생시킬 것이고, 그 농도를 감시함으로써 성장을 감지할 수 있을 것이다.[50][91]이 기술이 혈액문화에 적용되기 전 NASA는 화성의 생명체를 탐지하는 방법으로 제안했었다.[86]1970년대와 80년대에 걸쳐 여러 제조업체가 배양 배지의 전기 전도도 변화를 측정하여 미생물 성장을 탐지하려고 시도했지만, 이 방법들 중 상업적으로 성공한 것은 없었다.[91]
초기 BATEC 시스템의 주요 이슈는 특별한 처리 절차가 필요한 방사성 폐기물을 생산한다는 점이었다.[50] 그래서 1984년에 분광측정법을 사용하여 CO를2 검출하는 새로운 세대의 BATEC 계기가 출시되었다.[91]매체 pH의 감소를 측정해 CO의 생산을2 간접적으로 검출하는 BacT/ALERT 시스템은 1991년 미국 내 사용이 승인됐다.당시 이용 가능한 BATEC 시스템과 달리, BacT/ALERT는 샘플링을 위해 병에 바늘을 삽입할 필요가 없었다. 이는 오염[91] 빈도를 감소시켰고, 혈액 배양에 대한 진정으로 지속적인 모니터링을 제공하는 최초의 시스템이 되었다.[92]이 비침습적 측정법은 1992년 BTEC 9000 시리즈에 의해 채택되었는데, PH 변화를 감지하기 위해 형광등을 사용했다.[93]현대 베르사르의 직접적인 전신인 디프코 ESP압력변화를 측정해 가스생산을 검출하는 TREK 시스템도[86] 1992년 처음 승인됐다.[91]1996년까지 한 국제 연구에 따르면 조사 대상 466개 실험실 중 55%가 BATEC 또는 BacT/ALERT 시스템을 사용했으며, 다른 자동화 시스템은 전체의 10%를 차지했다.[94]
메모들
참조
- ^ 캐롤, KC 외 (2015).755 페이지
- ^ a b 터건, ML (2016. 페이지 510).
- ^ a b c 마혼, CR 외 (2018). 페이지 866.
- ^ a b Procop, GW & Koneman, EW(2017). 페이지 188.
- ^ 피트, SJ (2018). 페이지 26.
- ^ 캐롤, KC 외 (2015) 페이지 755–6.
- ^ 마혼, CR 외 (2018). 페이지 867.
- ^ a b c Martinez, RM; Wolk, DM (2016). "Bloodstream Infections". Microbiology Spectrum. 4 (4). doi:10.1128/microbiolspec.DMIH2-0031-2016. ISSN 2165-0497. PMID 27726765.
- ^ 베넷, JE 외(2019).페이지 990.
- ^ a b c Rhodes, A; Evans, E; Alhazzani, W; Levy, MM; Antonelli, M; Ferrer, R; et al. (2017). "Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016". Intensive Care Medicine. 43 (3): 304–377. doi:10.1007/s00134-017-4683-6. ISSN 0342-4642. PMID 28101605. S2CID 206884481.
- ^ a b c d e f g h i Garcia, RA; Spitzer, ED; Beaudry, J; Beck, C; Diblasi, R; Gilleeny-Blabac, M; et al. (2015). "Multidisciplinary team review of best practices for collection and handling of blood cultures to determine effective interventions for increasing the yield of true-positive bacteremias, reducing contamination, and eliminating false-positive central line–associated bloodstream infections". American Journal of Infection Control. 43 (11): 1222–1237. doi:10.1016/j.ajic.2015.06.030. ISSN 0196-6553. PMID 26298636.
- ^ Willems, E; Smismans, A; Cartuyvels, R; Coppens, G; Van Vaerenbergh, K; Van den Abeele, AM; Frans, J (2012). "The preanalytical optimization of blood cultures: a review and the clinical importance of benchmarking in 5 Belgian hospitals". Diagnostic Microbiology and Infectious Disease. 73 (1): 1–8. doi:10.1016/j.diagmicrobio.2012.01.009. ISSN 0732-8893. PMID 22578933.
- ^ Klastersky, J; de Naurois; Rolston, K; Rapoport, B; Maschmeyer, G; Aapro, M; Herrstedt, J. (2016). "Management of febrile neutropaenia: ESMO Clinical Practice Guidelines". Annals of Oncology. 27 (suppl 5): v111–v118. doi:10.1093/annonc/mdw325. ISSN 0923-7534. PMID 27664247.
- ^ 벽, R 외 (2017). 페이지 1497.
- ^ Territo, M (July 2018). "Neutropenia – Hematology and Oncology". Merck Manuals Professional Edition. Archived from the original on 22 July 2019. Retrieved 30 September 2020.
- ^ Fabre, V; Sharara, SL; Salinas, AB; Carroll, KC; Desai, S; Cosgrove, SE (2020). "Does This Patient Need Blood Cultures? A Scoping Review of Indications for Blood Cultures in Adult Nonneutropenic Inpatients". Clinical Infectious Diseases. 71 (5): 1339–1347. doi:10.1093/cid/ciaa039. ISSN 1058-4838. PMID 31942949.
- ^ a b Doern, GV (3 June 2020). "Detection of bacteremia: Blood cultures and other diagnostic tests". UpToDate. Retrieved 30 September 2020.
- ^ Cahill, TJ; Prendergast, BD (2016). "Infective endocarditis". The Lancet. 387 (10021): 882–893. doi:10.1016/S0140-6736(15)00067-7. ISSN 0140-6736. PMID 26341945. S2CID 205975776.
- ^ Cunha, BA; Lortholary, O; Cunha, CB (2015). "Fever of Unknown Origin: A Clinical Approach". The American Journal of Medicine. 128 (10): 1138.e1–1138.e15. doi:10.1016/j.amjmed.2015.06.001. ISSN 0002-9343. PMID 26093175.
- ^ 포드, M. (2019)페이지 95.
- ^ a b 맥멀런, AR, 윌런, CB, & 번햄, CAD.Dunne, WM & Burnham, CAD Eds. (2018). 제9장 "박테리아".
- ^ 마혼, CR 외 (2018). 페이지 863.
- ^ Fajardo Olivares M, Hidalgo Orozco R, Rodríguez Garrido S, Gaona Álvarez C, Sánchez Silos RM, Hernández Rastrollo R, Martínez Tallo E, Cordero Carrasco JL (March 2012). "[Activity of vancomycin, teicoplanin and linezolid in methicillin resistant coagulase-negative Staphylococci isolates from paediatric blood cultures]". Revista Espanola de Quimioterapia : Publicacion Oficial de la Sociedad Espanola de Quimioterapia (in European Spanish). 25 (1): 25–30. PMID 22488538.
- ^ 마혼, CR 외(2018).865-6 페이지
- ^ 맥멀런, AR, 윌런, CB, & 번햄, CAD.Dunne, WM & Burnham, CAD Eds. (2018). 제9장. "Fungal Bloodstream Information".
- ^ 베넷, JE 외(2019).996 페이지
- ^ a b Septimus, E (1 August 2019). "Collecting Cultures: a Clinician Guide". Centers for Disease Control and Prevention. Archived from the original on 24 September 2020.
- ^ a b c d e 마혼, CR 외 (2018). 페이지 869.
- ^ a b c d e f Doern, GV; Carroll, KC; Diekema, DJ; Garey, KW; Rupp, ME; Weinstein, MP; et al. (2019). "Practical Guidance for Clinical Microbiology Laboratories: A Comprehensive Update on the Problem of Blood Culture Contamination and a Discussion of Methods for Addressing the Problem". Clinical Microbiology Reviews. 33 (1). doi:10.1128/CMR.00009-19. ISSN 0893-8512. PMC 6822992. PMID 31666280. S2CID 204974894.
- ^ Pagana, KD 외 (2014). 페이지 Xii.
- ^ 피트, SJ (2018) 페이지 34.
- ^ 마혼, CR 외 (2018). 페이지 870.
- ^ a b c 앳킨슨던, R. & Dunne, WM.Dunne, WM & Burnham, CAD Eds. (2018). sec. "소개서"
- ^ Procop, GW & Koneman, EW(2017). 페이지 194.
- ^ a b 포드, M(2019).페이지 85.
- ^ a b Dien Bard, J; McElvania TeKippe, E; Kraft, CS (2016). "Diagnosis of Bloodstream Infections in Children". Journal of Clinical Microbiology. 54 (6): 1418–1424. doi:10.1128/JCM.02919-15. ISSN 0095-1137. PMC 4879304. PMID 26818669.
- ^ Baron, EJ (2019). "Clinical Microbiology in Underresourced Settings". Clinics in Laboratory Medicine. 39 (3): 359–369. doi:10.1016/j.cll.2019.05.001. ISSN 0272-2712. PMID 31383262. S2CID 198292851.
- ^ 돈도프, AM 외(2019년).172-3 페이지
- ^ 티벳, RJ & 로빈슨 던, B.Dunne, WM & Burnham, CAD Eds. (2018). sec. "소개서"
- ^ 리벨, P&Doen, C.Dunne, WM & Burnham, CAD Eds. (2018). sec. "규범 컬렉션".
- ^ 베넷, JE 외(2019). 202페이지.
- ^ a b c Ombelet, S; Barbé, B; Affolabi, D; Ronat, JB; Lompo, P; Lunguya, O; et al. (2019). "Best Practices of Blood Cultures in Low- and Middle-Income Countries". Frontiers in Medicine. 6: 131. doi:10.3389/fmed.2019.00131. ISSN 2296-858X. PMC 6591475. PMID 31275940.
- ^ a b c 마혼, CR 외(2018). 페이지 871.
- ^ 포드, M(2019).88 페이지
- ^ a b Procop, GW & Koneman, EW(2017). 페이지 199.
- ^ a b 마혼, CR 외(2018).871-2 페이지
- ^ a b 포드, M(2019).페이지 87.
- ^ 캐롤, KC 외 (2015).페이지 756.
- ^ Procop, GW & Koneman, EW(2017).197-8페이지
- ^ a b c 마혼, CR 외(2018). 페이지 872.
- ^ Procop, GW & Koneman, EW (2017). 196 페이지
- ^ 트루언트, AL (2016). 페이지 12.
- ^ 맥퍼슨, RA&핀커스, MR (2017). 페이지 1207.
- ^ a b 포드, M(2019).89쪽
- ^ 터건, ML (2016년)492-3 페이지
- ^ 캐롤, KC 외 (2016). 203 페이지.
- ^ a b c d 마혼, CR 외 (2018). 페이지 874.
- ^ Procop, GW & Koneman, EW (2017). 페이지 81.
- ^ 마혼, CR 외(2018).868-71 페이지
- ^ 포드, M(2019).91-2 페이지
- ^ a b 포드, M(2019).페이지 90.
- ^ Procop, GW & Koneman, EW(2017).페이지 94.
- ^ 마혼, CR 외 (2018). 페이지 126.
- ^ Procop, GW & Koneman, EW(2017). 페이지 104.
- ^ a b Winstanley, T; Courvalin, P (2011). "Expert Systems in Clinical Microbiology". Clinical Microbiology Reviews. 24 (3): 515–556. doi:10.1128/CMR.00061-10. ISSN 0893-8512. PMC 3131062. PMID 21734247.
- ^ 마혼, CR 외 (2018). 페이지 244.
- ^ 캐롤, KC 외 (2016). 페이지 756.
- ^ a b Opota, O; Croxatto, A; Prod'hom, G; Greub, G (2015). "Blood culture-based diagnosis of bacteraemia: state of the art". Clinical Microbiology and Infection. 21 (4): 313–322. doi:10.1016/j.cmi.2015.01.003. ISSN 1198-743X. PMID 25753137.
- ^ 피트, SJ (2018) 페이지 35.
- ^ a b 파론, ML & 레데보어, NA. 11장 Dunne, WM & Burnham, CAD Eds. (2018). sec. "양혈문화에서 분자 검출"
- ^ 포드, M(2019).페이지 93.
- ^ 포드, M(2019).93-4 페이지
- ^ 곤잘레스, MD & Jerris, RC.Dunne, WM & Burnham, CAD Eds. (2018). sec. "소개"; "요약"
- ^ 마혼, CR 외(2018).273-7페이지
- ^ 마혼, CR 외(2018).287-8페이지
- ^ a b Idelevich, EA; Becker, K (2019). "How to accelerate antimicrobial susceptibility testing". Clinical Microbiology and Infection. 25 (11): 1347–1355. doi:10.1016/j.cmi.2019.04.025. ISSN 1198-743X. PMID 31055166.
- ^ Lamy, B; Sundqvist, M; Idelevich, EA (2020). "Bloodstream infections – Standard and progress in pathogen diagnostics". Clinical Microbiology and Infection. 26 (2): 142–150. doi:10.1016/j.cmi.2019.11.017. ISSN 1198-743X. PMID 31760113.
- ^ "Rapid AST directly from blood culture bottles". European Committee on Antimicrobial Susceptibility Testing. 2020. Archived from the original on 12 May 2020. Retrieved 1 October 2020.
- ^ a b Dubourg, G; Lamy, B; Ruimy, R (2018). "Rapid phenotypic methods to improve the diagnosis of bacterial bloodstream infections: meeting the challenge to reduce the time to result". Clinical Microbiology and Infection. 24 (9): 935–943. doi:10.1016/j.cmi.2018.03.031. ISSN 1198-743X. PMID 29605563.
- ^ 패런, ML & 레데보어, NA. 던, WM & 번햄, CAD Eds. (2018). sec. "급격한 진단"
- ^ a b 파론, ML & 레데보어, NA. 던, WM & 번햄, CAD Eds. (2018). 초. "직접 항균 저항 시험"
- ^ Benkova, M; Soukup, O; Marek, J (2020). "Antimicrobial susceptibility testing: currently used methods and devices and the near future in clinical practice". Journal of Applied Microbiology. 129 (4): 806–822. doi:10.1111/jam.14704. ISSN 1364-5072. PMID 32418295. S2CID 218679078.
- ^ a b Dawson, S (2014). "Blood culture contaminants". Journal of Hospital Infection. 87 (1): 1–10. doi:10.1016/j.jhin.2014.02.009. ISSN 0195-6701. PMID 24768211.
- ^ 마혼, CR 외(2018).872-4 페이지
- ^ Judd, CCW; Simon, CE (1915). "The vacuum tube of Keidel, as applied to blood-culture work". Journal of the American Medical Association. LXIV (10): 822. doi:10.1001/jama.1915.25710360002018a. ISSN 0002-9955.
- ^ a b c d e f g 던, WM.Dunne, WM & Burnham, CAD Eds. (2018)의 1장.
- ^ a b c Hansen, GT (2016). "Laboratory Blood Cultures: Past, Present, and Future". Clinical Microbiology Newsletter. 38 (15): 119–128. doi:10.1016/j.clinmicnews.2016.07.001. ISSN 0196-4399.
- ^ Pulvertaft, RJV (1930). "The Clinical Interpretation of Aids to Diagnosis". The Lancet. 215 (5563): 821–822. doi:10.1016/S0140-6736(00)88443-3. ISSN 0140-6736.
- ^ TeKippe, EM & Pens, MA. Dunne, WM & Burnham, CAD Eds. (2018). sec. "용해-중심화 혈류 배양법의 역사"
- ^ Murray, PR; Masur, H (2012). "Current approaches to the diagnosis of bacterial and fungal bloodstream infections in the intensive care unit". Critical Care Medicine. 40 (12): 3277–3282. doi:10.1097/CCM.0b013e318270e771. ISSN 0090-3493. PMC 4201853. PMID 23034460.
- ^ a b c d e Ryan, MR; Murray, PR (1993). "Historical evolution of automated blood culture systems". Clinical Microbiology Newsletter. 15 (14): 105–108. doi:10.1016/0196-4399(93)90051-N. ISSN 0196-4399.
- ^ 트루언트, AL (2016). 페이지 13.
- ^ 체임벌랜드, RR.Dunne, WM & Burnham, CAD eds. (2018). sec. "History"; "Bactec 9000 Series Studies"
- ^ Rohner, P; Auckenthaler, R (1999). "Review on evaluations of currently available blood-culture systems". Clinical Microbiology and Infection. 5 (9): 513–529. doi:10.1111/j.1469-0691.1999.tb00429.x. ISSN 1198-743X. PMID 11851703.
참고 문헌 목록
- Bennett, JE; Dolin, R; Blaser, MJ (8 August 2019). Mandell, Douglas, and Bennett's Principles and Practice of Infectious Diseases. Elsevier Health Sciences. ISBN 978-0-323-48255-4.
- Carroll, KC; Butel, JS; Morse, SA (12 August 2015). Jawetz Melnick & Adelbergs Medical Microbiology 27 E. McGraw-Hill Education. ISBN 978-0-07-182503-0.
- Dondorp, AM; Dünser, MW; Schultz, MJ (8 February 2019). Sepsis Management in Resource-limited Settings. Springer. ISBN 978-3-030-03143-5.
- Dunne, WM; Burnham, CAD (2018). The Dark Art of Blood Cultures. Wiley. ISBN 978-1-68367-306-4.
- Ford, M (5 June 2019). Medical Microbiology. Oxford University Press. ISBN 978-0-19-881814-4.
- Mahon, CR; Lehman, DC; Manuselis, G (18 January 2018). Textbook of Diagnostic Microbiology. Elsevier Health Sciences. ISBN 978-0-323-48212-7.
- McPherson, RA; Pincus, MR (5 April 2017). Henry's Clinical Diagnosis and Management by Laboratory Methods (23 ed.). Elsevier Health Sciences. ISBN 978-0-323-41315-2.
- Pagana, KD; Pagana, TJ; Pagana, TN (19 September 2014). Mosby's Diagnostic and Laboratory Test Reference - E-Book. Elsevier Health Sciences. ISBN 978-0-323-22592-2.
- Pitt, SJ (2018). Clinical Microbiology for Diagnostic Laboratory Scientists. Wiley. ISBN 978-1-118-74582-3.
- Procop, GW; Koneman, EW (2017). Koneman's Color Atlas and Textbook of Diagnostic Microbiology. Wolters Kluwer Health. ISBN 978-1-4511-1659-5.
- Truant, AL (28 March 2016). Manual of Commercial Methods in Clinical Microbiology. Wiley. ISBN 978-1-119-02186-5.
- Turgeon, ML (2016). Linné & Ringsrud's Clinical Laboratory Science: Concepts, Procedures, and Clinical Applications (7 ed.). Elsevier Mosby. ISBN 978-0-323-22545-8.
- Walls, R; Hockberger, R; Gausche-Hill, M (9 March 2017). Rosen's Emergency Medicine - Concepts and Clinical Practice (9 ed.). Elsevier Health Sciences. ISBN 978-0-323-39016-3.