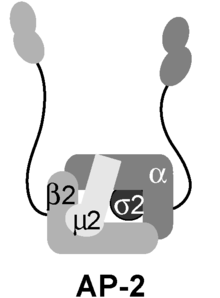
AP2 어댑터 복합체
AP2 adaptor complexAP2 어댑터 복합체는 세포막에서 작용하여 클라트린 매개 엔도사이토시스(Endocytosis)[1]에서 화물을 내부화하는 다량체 단백질입니다.폴리펩타이드 링커에 의해 코어 도메인과 코어 도메인에 2개의 부가 도메인이 부착된 구조를 발생시키는 4개의 어댑틴의 안정적인 복합체이다.이러한 추가 도메인을 '이어'라고 부르기도 합니다.핵심 도메인은 멤브레인 및 내부화를 위한 화물과 결합합니다.알파 및 베타 부가 도메인은 보조 단백질과 클라트린에 결합합니다.그들의 상호작용은 클라트린으로 코팅된 소포의 집합과 그들의 내구증의 시간적, 공간적 조절을 가능하게 한다.
AP-2 복합체는 두 개의 큰 아답틴(α 및 β), 중간 아답틴(μ) 및 작은 아답틴(δ)으로 구성된 헤테로테트라머이다.
구조.
AP2 어댑터 콤플렉스는 오픈컨피규레이션(액티브스테이트)과 클로즈드컨피규레이션(비액티브스테이트)[2]의 2가지 주요 컨피규레이션으로 존재합니다.활성 상태에서 β 서브유닛에서 발견된 클라트린 결합부위 및 μ 서브유닛에서 발견된 카고 결합부위가 세포졸에 [2]노출되어 각각의 상호작용이 일어난다.비액티브 상태에서는 콤플렉스는 양쪽 사이트를 커버하는 Configuration 변경을 일으켜 프라이머리 [3]기능을 방해합니다.복합체의 α 및 β 중쇄는 AP2의 폴리펩타이드 배열의 약 60%를 구성하며, 14개의 HEAT 반복으로 긴밀하게 구조되어 클래트린 [4][2]삼량체의 나선형 "다리"와 상호작용하는 지그재그 α-나선 구조를 형성한다.

기능.
AP2는 엔도사이토시스 발생이 필요할 때 다른 AP2 복합체와 함께 활성 형태로 [4]응집함으로써 클라트린 격자의 조립을 촉진한다.이러한 AP2 집합체는 β-활성 부위에 의해 개별 클라트린 단백질과 상호작용하며, 세포 [4]내막을 형성하는 클라트린 "케이지"로 방향을 잡는다.
규정
AP2 활동의 조절은 주로 2개의 구별되는(및 잠재적인 제3 및 제4의) 구성으로의 구조 재배열을 통해 이루어집니다."열린" 배치는 클래트린과 화물의 "핏" 또는 활성 결합 부위가 드러나기 때문에 복합체의 활성 상태입니다.한편, "닫힌" 확인은 이러한 동일한 [6]사이트의 폐쇄 또는 접근 불능으로 나타납니다.
액티베이션
클래트린의 존재는 화물과의 결합을 유도하는 것으로 밝혀졌으며, 마찬가지로 화물의 존재는 클래트린 결합을 유도하는 것으로 보인다.이는 복합구조의 2차 안정화에 의해 발생하는 것으로 생각되며, 이는 각각의 [7][8]피트에 부분적인 활성화 또는 접근을 가능하게 한다.포스파티딜이노시톨-(4,5)-비스인산(PIP2)은 결합하는 신호 배열로서 기능하며 AP2에 의해 인식된다.PIP2는 화물을 포함하는 리포좀 내에서 발견될 수 있으며, 이들은 AP2와 상호작용하여 클라트린을 결합하고 그 기능을 수행합니다.닫힌 형태에서는 PIP2 결합 부위가 노출되어 배향 조절이 일어난다.[9]이 때문에, PIP2 바인딩, 카고 시퀀스 바인딩, 그리고 마지막으로 클라트린 [9]바인딩 등, 약간의 구조 변화가 완전 개방적인 배열을 가져옵니다.뮤니스신이라고 불리는 단백질군은 AP2 관련 피트에서의 유병 및 AP2 매개 내세포증의 [11][12]감소를 초래하는 억제 때문에 AP2 어댑터 [10]복합체의 1차 알로스테릭 활성제로 생각됩니다.또한 복합체는 그 (mu) 서브유닛의 [13][14]인산화로 조절되고 활성화되는 것으로 밝혀졌다.
비활성화
비활성화 또는 "닫힌" 구성으로의 변경은 여전히 불분명합니다.NECAPs는 AP2의 [6]α 서브유닛에 결합함으로써 그 역할을 하는 것으로 생각된다.알려진 것은 많지 않지만, 인산화된 AP2의 개방 배치는 NCAP1이 [3]코어 내에서 결합하기 위해 필요한 것으로 보인다.동작 과정은 아직 알려지지 않았지만, 이 상호작용에 의해 AP2 어댑터 복합체의 탈인화가 발생하여 비활성화됩니다.
의료 관련성
AP2는 응집 [15]단백질의 분해에 책임이 있는 자가 세포 경로에 밀접하게 참여하는 것으로 확인되었다.실제로 포스파티딜이노시톨클라트린 조립체 림프골수성백혈병(PIALM)과 복합하는 것으로 보이며, 이는 미소관 관련 단백질 1 경쇄 3(LC3)의 중요한 수용체 그룹 역할을 할 수 있다.LC3는 일부 자동 파지 [16]경로에서 중요한 역할을 합니다.이 때문에 AP2 결핍이나 기능장애가 가족성 알츠하이머병의 [15]전조가 될 수 있다는 의혹이 제기되고 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ Pearse BM, Smith CJ, Owen DJ (April 2000). "Clathrin coat construction in endocytosis". Current Opinion in Structural Biology. 10 (2): 220–228. doi:10.1016/S0959-440X(00)00071-3. PMID 10753805. (설명 필요)
- ^ a b c Collins BM, McCoy AJ, Kent HM, Evans PR, Owen DJ (2002-05-17). "Molecular Architecture and Functional Model of the Endocytic AP2 Complex". Cell. 109 (4): 523–535. doi:10.1016/S0092-8674(02)00735-3.
- ^ a b Beacham GM, Partlow EA, Lange JJ, Hollopeter G (January 2018). "NECAPs are negative regulators of the AP2 clathrin adaptor complex". eLife. 7: e32242. doi:10.7554/eLife.32242. PMC 5785209. PMID 29345618.
- ^ a b c Kirchhausen T, Owen D, Harrison SC (May 2014). "Molecular structure, function, and dynamics of clathrin-mediated membrane traffic". Cold Spring Harbor Perspectives in Biology. 6 (5): a016725. doi:10.1101/cshperspect.a016725. PMC 3996469. PMID 24789820.
- ^ Partlow EA, Baker RW, Beacham GM, Chappie JS, Leschziner AE, Hollopeter G (August 2019). "A structural mechanism for phosphorylation-dependent inactivation of the AP2 complex". eLife. 8: e50003. doi:10.7554/eLife.50003. PMC 6739873. PMID 31464684.
- ^ a b Beacham GM, Partlow EA, Hollopeter G (October 2019). "Conformational regulation of AP1 and AP2 clathrin adaptor complexes". Traffic. 20 (10): 741–751. doi:10.1111/tra.12677. PMC 6774827. PMID 31313456.
- ^ Ehrlich M, Boll W, Van Oijen A, Hariharan R, Chandran K, Nibert ML, Kirchhausen T (September 2004). "Endocytosis by random initiation and stabilization of clathrin-coated pits". Cell. 118 (5): 591–605. doi:10.1016/j.cell.2004.08.017. PMID 15339664.
- ^ Rapoport I, Miyazaki M, Boll W, Duckworth B, Cantley LC, Shoelson S, Kirchhausen T (May 1997). "Regulatory interactions in the recognition of endocytic sorting signals by AP-2 complexes". The EMBO Journal. 16 (9): 2240–2250. doi:10.1093/emboj/16.9.2240. PMC 1169826. PMID 9171339.
- ^ a b Kadlecova Z, Spielman SJ, Loerke D, Mohanakrishnan A, Reed DK, Schmid SL (January 2017). "Regulation of clathrin-mediated endocytosis by hierarchical allosteric activation of AP2". The Journal of Cell Biology. 216 (1): 167–179. doi:10.1083/jcb.201608071. PMC 5223608. PMID 28003333.
- ^ Reider A, Barker SL, Mishra SK, Im YJ, Maldonado-Báez L, Hurley JH, et al. (October 2009). "Syp1 is a conserved endocytic adaptor that contains domains involved in cargo selection and membrane tubulation". The EMBO Journal. 28 (20): 3103–3116. doi:10.1038/emboj.2009.248. PMC 2771086. PMID 19713939.
- ^ Henne WM, Boucrot E, Meinecke M, Evergren E, Vallis Y, Mittal R, McMahon HT (June 2010). "FCHo proteins are nucleators of clathrin-mediated endocytosis". Science. 328 (5983): 1281–1284. doi:10.1126/science.1188462. PMC 2883440. PMID 20448150.
- ^ Cocucci E, Aguet F, Boulant S, Kirchhausen T (August 2012). "The first five seconds in the life of a clathrin-coated pit". Cell. 150 (3): 495–507. doi:10.1016/j.cell.2012.05.047. PMC 3413093. PMID 22863004.
- ^ Ghosh P, Kornfeld S (March 2003). "AP-1 binding to sorting signals and release from clathrin-coated vesicles is regulated by phosphorylation". The Journal of Cell Biology. 160 (5): 699–708. doi:10.1083/jcb.200211080. PMID 12604586.
- ^ Ricotta D, Conner SD, Schmid SL, von Figura K, Honing S (March 2002). "Phosphorylation of the AP2 mu subunit by AAK1 mediates high affinity binding to membrane protein sorting signals". The Journal of Cell Biology. 156 (5): 791–795. doi:10.1083/jcb.200111068. PMC 2173304. PMID 11877457.
- ^ a b Tian Y, Chang JC, Fan EY, Flajolet M, Greengard P (October 2013). "Adaptor complex AP2/PICALM, through interaction with LC3, targets Alzheimer's APP-CTF for terminal degradation via autophagy". Proceedings of the National Academy of Sciences of the United States of America. 110 (42): 17071–17076. doi:10.1073/pnas.1315110110. PMC 3801056. PMID 24067654.
- ^ Dhingra A, Alexander D, Reyes-Reveles J, Sharp R, Boesze-Battaglia K (2018). "Microtubule-Associated Protein 1 Light Chain 3 (LC3) Isoforms in RPE and Retina". Advances in Experimental Medicine and Biology. 1074: 609–616. doi:10.1007/978-3-319-75402-4_74. PMID 29721994.