요오드-131
Iodine-131| 일반 | |
|---|---|
| 기호. | 131나 |
| 이름 | 요오드-131, I-131, 방사성 요오드 |
| 양성자 (Z) | 53 |
| 중성자 (N) | 78 |
| 핵종 데이터 | |
| 반감기 (t1/2) | 8.0197일 |
| 동위원소 질량 | 130.9061246(12) Da |
| 과잉 에너지 | 971 keV |
| 요오드 동위 원소 핵종 전체 표 | |
요오드-131(131I, I-131)은 1938년 캘리포니아 [1]버클리 대학에서 Glenn Seaborg와 John Livingood에 의해 발견된 요오드의 중요한 방사성 동위원소입니다.방사성 붕괴의 반감기는 약 8일입니다.원자력 에너지, 의료 진단 및 치료 절차, 천연 가스 생산과 관련이 있습니다.또한 핵분열 생성물에 존재하는 방사성 동위원소로서 중요한 역할을 하며, 1950년대 노천 원자폭탄 실험과 체르노빌 참사의 건강 위험과 후쿠시마 핵 위기 첫 주에 발생한 오염 위험의 큰 부분을 차지했다.왜냐하면 나는 우라늄과 플루토늄의 주요 핵분열 생성물이며, 핵분열 생성물(중량 기준)의 약 3%를 차지하고 있기 때문이다.다른 방사성 핵분열 생성물과의 비교는 핵분열 생성물 수율을 참조하십시오.131나는 또한 토륨에서 생성된 우라늄-233의 주요 핵분열 생성물이다.
요오드-131은 베타 붕괴의 양상으로 인해 침투하는 세포와 수 밀리미터 떨어진 다른 세포에서 돌연변이와 죽음을 일으킨다.이러한 이유로, 방사선 때문에 암이 될 수 있는 갑상선 조직을 죽이는 경향이 있기 때문에, 동위원소의 고용량이 저용량보다 덜 위험할 수 있다.예를 들어, 갑상선종에 대해 적당한 용량으로 I를 치료받은 아이들은 갑상선암이 눈에 띄게 증가했지만, 훨씬 더 높은 용량으로 치료받은 어린이들은 그렇지 않았다.[2]마찬가지로 그레이브스병 치료를 위한 매우 높은 용량 I에 대한 대부분의 연구는 적당한 [3]용량에서 I를 흡수하는 갑상선암 위험이 선형적으로 증가함에도 불구하고 갑상선암의 증가를 발견하지 못했다.따라서 요오드-131은 의료용 소량(특히 어린이용)에서 점점 더 적게 사용되지만 표적 조직을 죽이는 방법으로 크고 최대 치료 용량에서만 점점 더 많이 사용된다.이를 "치료적 사용"이라고 합니다.
요오드-131은 에너지와 방사선량의 약 10%가 감마선에 의한 것이기 때문에 치료용으로 제공될 때마다 핵의학 이미징 기법(예: 감마 카메라)으로 "보여질 수 있다".그러나 나머지 90%의 방사선(베타 방사선)은 동위원소를 보거나 "이미징"하는 능력에 기여하지 않고 조직 손상을 일으키기 때문에 핵 이미징만 필요한 상황에서는 요오드-123(요오드 동위원소 참조)과 같이 손상이 덜한 다른 요오드의 방사성 동위원소가 선호된다.동위원소 I은 다른 요오드 방사성 동위원소에 비해 비용이 낮기 때문에 순수 진단(즉, 영상촬영) 작업에 여전히 가끔 사용된다.매우 적은 양의 의료 영상 투여량에서도 갑상선암은 증가하지 않았습니다.I의 저비용 가용성은 원자로에서 천연 텔루륨의 중성자 충격에 의해 I를 생성하고 다양한 간단한 방법(휘발성 요오드를 제거하기 위한 가열)으로 분리하는 상대적 용이성 때문이다.이와는 대조적으로, 다른 요오드 방사성 동위원소는 보통 훨씬 더 비싼 기술로 만들어지는데, 이는 가압된 제논 [4]가스 캡슐의 사이클로트론 방사로부터 시작됩니다.
또한 요오드-131은 가장 일반적으로 사용되는 감마 방출 산업용 추적기 중 하나이다.방사성 트레이서 동위원소에 유압파쇄유체를 주입하여 유압파쇄에 [5]의해 생기는 분사프로파일 및 파쇄위치를 결정한다.
일부 연구에 따르면 요오드-131의 부수적인 용량은 의료 치료 과정에 사용되는 용량보다 훨씬 작으며, 우발적인 핵 오염 후 갑상선암 증가의 주요 원인으로 추정된다.이러한 연구는 암이 I에 의해 야기된 잔류 조직 방사선 손상에서 발생하며, I가 [6][7]부패한 후 피폭된 지 몇 년이 지난 후에 대부분 나타나야 한다고 가정한다.다른 연구들은 [8][9]상관관계를 발견하지 못했다.
생산.
대부분의 I 생산은 원자로 내 천연 텔루 타깃의 중성자 조사를 통해 이루어진다.대부분의 가벼운 텔루 동위원소가 더 무거운 안정 동위원소이거나 그렇지 않으면 안정적인 요오드나 제논이 되기 때문에 천연 텔루 조사에서는 거의 전체가 몇 시간 이상 반감기가 긴 유일한 방사성 핵종으로 생성된다.그러나 자연발생 텔루루 핵종 중 가장 무거운 Te(천연 텔루 34%)는 중성자를 흡수해 텔루-131이 되고, 이 중성자는 베타붕괴가 25분 동안 I로 분해된다.
이온교환칼럼에 산화물로 결합하면서 텔루 화합물을 조사하여 진화한 I를 알칼리성 [10]용액으로 용출시킬 수 있다.일반적으로 분말 상태의 텔루르 원소를 조사하여 증기압력이 월등히 높은 요오드를 건조 증류하여 분리한다.그런 다음 이 원소는 표준 방식으로 약한 알칼리 용액에 용해되어 I를 요오드화물 및 하이포요오드산염([11]곧 요오드화물로 환원됨)으로 생성합니다.
131나는 우라늄-235의 [12]수율 2.878%의 핵분열 생성물로 핵무기 실험이나 핵 사고로 방출될 수 있다.그러나 반감기가 짧다는 것은 반감기가 I의 거의 10억 배에 달하는 요오드-129와는 달리 냉각된 사용후핵연료에는 유의한 양이 존재하지 않는다는 것을 의미한다.
그것은 일부 원자력 [13]발전소에 의해 소량 대기 중으로 배출된다.
방사성 붕괴
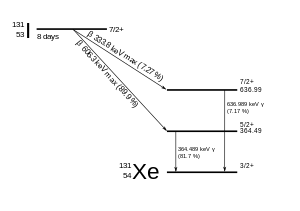
131나는 베타 마이너스 및 감마 방출로 8.02일의 반감기로 붕괴한다.이 요오드의 동위원소는 핵에 78개의 중성자를 가지고 있는 반면, 유일하게 안정된 핵종인 I는 74개의 중성자를 가지고 있다.붕괴 시, 나는 가장 자주(89%) 971 keV의 붕괴 에너지를 소비하며, 베타 붕괴 후 감마 붕괴가 빠르게 뒤따른다.
따라서 I 붕괴의 1차 방출은 최대 에너지 606 keV(89% 풍부, 기타 248-807 keV)와 364 keV 감마선(81% 풍부, 기타 723 keV)[14]의 전자이다.베타 붕괴는 또한 다양한 양의 베타 붕괴 에너지를 전달하는 안티뉴트리노를 생성한다.높은 평균 에너지(190 keV, 전형적인 베타 감쇠 스펙트럼이 있음)로 인해 전자는 0.6 - 2 [15]mm의 조직 투과성을 가진다.
노출의 영향
음식 중의 요오드는 체내에 흡수되어 갑상선의 기능에 필요한 갑상선에 우선적으로 농축된다.방사성 낙진에 의해 환경에 고농도로 존재하게 되면 오염된 음식으로 흡수되어 갑상선에 축적될 수 있습니다.부패하면서 갑상선에 손상을 줄 수 있습니다.I에 대한 노출로 인한 주요 위험은 나중에 방사능에 의해 유발되는 암의 위험 증가이다.다른 위험으로는 비암성 성장 및 갑상선염의 [3]가능성이 있다.
노출 시 연령이 증가함에 따라 만년의 갑상선암 위험은 감소하는 것으로 보인다.대부분의 위험 추정치는 어린이 또는 청소년에게 방사선 피폭을 발생시킨 연구에 기초한다.성인이 피폭되었을 때, 역학자들이 유사하지만 그렇지 않으면 노출되지 [3][17]않은 그룹의 갑상선 질환 비율보다 통계적으로 유의한 차이를 발견하는 것은 어려웠다.
이 위험은 요오드 보충제를 복용함으로써 완화될 수 있으며, 이는 체내 요오드의 총량을 증가시켜 얼굴과 가슴의 흡수 및 체류를 감소시키고 방사성 요오드의 상대적 비율을 감소시킨다.그러나, 그러한 보충제는 폴란드의 아이들에게 널리 보급되었지만,[18] 재난 이후 체르노빌 원자력 발전소와 가장 가까운 곳에 사는 인구에게 일관되게 분배되지 않았다.
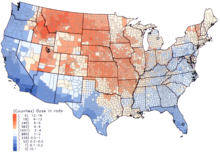
미국 내에서는 1950년대와 1960년대 초에 핵무기 [6]지상 실험의 결과로 오염된 선원의 신선한 우유를 섭취한 어린이에게 가장 높은 I 낙진 선량이 발생했다.국립암연구소는 미국의 3070개 카운티 각각에 대해 1971년 이전에 출생한 사람에 대한 개별 추정치뿐만 아니라 [19]낙진 시 I 피폭에 따른 건강 영향에 대한 추가 정보를 제공한다.이 계산은 네바다 [20]실험장에서 실시된 핵무기 실험의 낙진과 관련하여 수집된 데이터에서 가져온 것이다.
2011년 3월 27일, 매사추세츠 공중 보건부는 미국 매사추세츠에서 채취한 샘플에서 매우 낮은 농도의 빗물이 검출되었으며, 이는 후쿠시마 [21]발전소에서 발생한 것일 수 있다고 보고했다.이 공장 근처의 농부들은 생우유를 버렸고, 미국에서 실험한 결과 우유 샘플에서 리터당 0.8피코퀴리의 요오드-131이 검출되었지만, 방사능 수치는 FDA의 "확정 개입 수준"보다 5,000배 낮았다.그 수준은 비교적[22] 빨리 떨어질 것으로 예상되었다.
치료 및 예방
요오드-131 피폭을 방지하기 위한 일반적인 처리방법은 요오드화염 또는 요오드화염으로서 갑상선을 규칙적이고 안정된 요오드-127로 포화시키는 것이다.유리 원소 요오드는 부식성 산화제이므로 필요한 [23]양만큼 섭취하면 독성이 있기 때문에 갑상선을 포화시키는 데 사용해서는 안 된다.갑상선은 비방사성 요오드화물로 포화된 후 방사성 요오드-131을 거의 흡수하지 않기 때문에 방사성 요오드로부터의 방사능 피해를 피할 수 있다.
공통 처리 방법
가장 일반적인 치료 방법은 위험에 처한 사람들에게 요오드화칼륨을 주는 것이다.성인용 요오드화칼륨은 1일 130mg으로 1회 복용하거나 65mg으로 2회 복용한다.이는 요오드 100mg과 맞먹으며 하루 0.150mg(하루 150마이크로그램)인 요오드의 영양섭취량보다 약 700배 크다.원자력 사고 중 또는 핵 의학적인 이유로 갑상선에 의한 방사성 요오드 흡수 방지에 대한 자세한 내용은 요오드화 칼륨을 참조하십시오.이러한 목적을 위해 FDA가 승인한 요오드화칼륨의 투여량은 다음과 같다: 생후 1개월 미만의 영아, 16mg, 1개월에서 3세까지의 영아, 32mg, 3살에서 18세까지의 영아, 65mg, 성인 [24]130mg.그러나 일부 소스에서는 대체 투약 [25]요법을 권장한다.
세계보건기구(WHO)는 방사성[26] 요오드와 관련된 방사선 비상사태에 대한 투여량을 매일 권고했다.| 나이 | KI(밀리그램) | KIO3(mg) |
|---|---|---|
| 12세 이상 | 130 | 170 |
| 3~12세 | 65 | 85 |
| 생후 1~36개월 | 32 | 42 |
| 생후 1개월 미만 | 16 | 21 |
예방 요오드화물 및 요오드산염의 섭취에도 위험이 따른다. 요오드화칼륨 또는 요오드 보충제를 불필요하게 사용하면 플럼머 효과, 조드 베이스로 현상, 울프-차이코프 효과, 트리거 및/또는 갑상선 항진증 및/또는 악화와 같은 조건을 야기할 수 있기 때문에 요오드화칼륨 또는 요오드 보충제를 대량 복용하는 데 주의해야 할 이유가 있다.갑상선 기능 항진증, 그리고 궁극적으로 일시적인 혹은 영구적인 갑상선 질환의 원인이 된다.그것은 또한 침샘의 염증, 위장 장애, 알레르기 반응 그리고 발진을 일으킬 수 있습니다.
요오드정
휴대용 정수기에 사용되는 특정 "요오드 태블릿"의 사용도 방사성 요오드 흡수를 줄이는데 어느 정도 효과적인 것으로 확인되었다.인간을 대상으로 한 실험에 대한 작은 연구에서, 그들의 90일간의 재판 동안 하루에, 각 태블릿 무료 적정 요오드의 8mg(ppm)을 발매하고,[27]이 방사성 요오드의 이러한 인간적 과목에서 생물학적 섭취에 가서 값에 머물러 떨어졌다 발견되었다(TGHP)물 정제 hydroperiodide 420밀리그램 tetraglycine 소화시켰네요.의치료 [28]없이 방사성 요오드에 완전히 피폭된 대조군 피험자에서 관찰된 방사성 요오드 흡수율 2% 미만.
고이트로겐
알려진 고이트로겐 물질의 투여는 또한 요오드의 생물학적 웁타케를 감소시키는 예방책으로 사용될 수 있다(신체가 서로 다른 요오드 동위원소를 구별할 수 없기 때문에 영양적인 비방사성 요오드-127이든 방사성 요오드, 방사성 요오드-131이든).항공우주산업으로 인해 미국에서 흔한 수질오염물질인 과염소산 이온은 요오드 흡수를 감소시키는 것으로 나타나 고이트로겐으로 분류된다.과염소산 이온은 요오드화물이 갑상선 모낭 세포에 활발하게 축적되는 과정의 경쟁적 억제제이다.건강한 성인 지원자를 포함한 연구는 하루에 킬로그램 당 0.007 밀리그램(mg/(kg·d) 이상의 수준에서 과염소산염이 혈류로부터 요오드를 흡수하는 갑상선의 능력을 일시적으로 억제하기 시작한다고 결정했다(요오드화물 흡수 억제, 따라서 과염소산염은 알려진 고이트로겐이다).[29]과염소산염에 의한 요오드화물 풀의 감소는 이중 효과를 가진다. 즉, 초과 호르몬 합성과 갑상선 기능 항진증의 감소와 갑상선 억제제 합성과 갑상선 기능 저하증의 감소이다.과염소산염은 갑상선에서 [30]요오드화물의 추가 대사의 많은 다른 방해의 결과로 갑상선에 축적된 방사성 요오드 배출량을 측정하는 시험에서 단일 용량 적용으로 매우 유용하다.
갑상선독성증
과염소산칼륨(과염소산칼륨 430–1,400mg)을 사용한 갑상선 중독증(그레이브스병 포함) 치료는 한 때 특히 유럽에서 [29][31]일상적이었으며 [32]갑상선 문제를 치료하기 위해 저용량에서 과염소산염 사용을 오늘날까지 지속하고 있다.처음에는 4~5회 일일 용량으로 나눈 과염소산칼륨 400mg이 사용되었고 효과가 있는 것으로 확인되었지만, 모든 [29][30]피험자에서 갑상선독증을 통제하지 않는 것으로 판명되었을 때 더 높은 용량들이 도입되었다.
환자가 요오드의 추가 공급원에 노출되었을 때 갑상선독성증(그레이브스병 포함) 치료를 위한 현재 요법에는 일반적으로 하루에 두 번 과염소산칼륨 500mg이 18-40일 [29][33]동안 포함된다.
과염소산염이 함유된 물을 17ppm 농도로 섭취한 예방은 1일이 70kg이고 하루에 2L의 물을 소비하는 경우 기준 방사성 요오드 흡수를 67%[29] 감소시키는 것으로 조사되었으며 이는 하루에 총 35mg의 과염소산 이온을 섭취하는 것에 해당한다.실험 대상자가 하루에 과염소산염 함유 물을 10ppm 농도로 1리터만 마신 다른 연구에서, 즉 매일 10mg의 과염소산 이온을 섭취한 결과,[34] 요오드 흡수량이 평균 38% 감소하는 것으로 나타났다.
단, 상기 항과 같이 과염소산염 플랜트 작업자의 평균 과염소산염 흡수가 약 0.5mg/kg-day로 추정될 경우 요오드 흡수가 67% 감소할 것으로 예상된다.만성적으로 피폭된 근로자들에 대한 연구는 지금까지 [35]요오드 섭취를 포함한 갑상선 기능의 이상을 발견하지 못했다.이것은 근로자들 사이에서 매일 충분한 양의 건강한 요오드-127을 섭취하거나 [29]체내 과염소산염의 짧은 생물학적 반감기에 기인할 수 있다.
요오드-131의 섭취
따라서 0.5mg/kg-day 용량 또는 17ppm의 물 농도를 목표로 과염소산 이온을 의도적으로 모집단의 물 공급에 추가하여 요오드-131의 흡수를 완전히 차단하는 것은 방사성 요오드 흡수를 진정으로 줄이는데 매우 불충분하다.따라서 지역 물 공급의 과염소산 이온 농도는 훨씬 더 높아야 하며, 적어도 하루에 총 체중 7.15mg/kg의 용적을 목표로 해야 하며, 이는 물 농도 250mg/kg 또는 250ppm의 물 농도로 매일 2리터의 물을 소비함으로써 달성될 수 있다.ns per l; 이 수준에서만 과염소산염 소비가 적절한 보호를 제공하며 방사성 요오드 [29][33]환경에 노출되었을 때 생물 축적을 방지하는 데 모집단에 진정으로 유익하다.이것은 요오드산염 또는 요오드화 약물의 가용성과는 완전히 무관하다.
물 공급에 과염소산염의 지속적인 첨가는 방사성 요오드의 최초 방출이 검출된 직후에 시작하여 80-90일 이상 지속되어야 한다. 80-90일이 경과한 후 방출된 방사성 요오드-131은 초기 양의 0.1% 미만으로 분해되므로 요오드의 생물 섭취에 따른 위험이 있다.Ine-Diagness는 근본적으로 끝났다.[36]
방사성 요오드 방출
방사성 요오드 방출의 경우 예방 요오드화칼륨 또는 요오드산염(사용 가능한 경우) 섭취가 과염소산염 투여보다 우선하며 방사성 요오드 방출로부터 모집단을 보호하는 첫 번째 방어선이 될 것이다.그러나 방사성 요오드 방출의 행사에 너무 요오드 및의 제한된 주식에 의해 조절되는 것 광범위한;iodate 예방 약, 과염소산 이온의 물 공급, 또는 과염소산염 정제의 배급,에 발암성 방사성 요오드 bi에 대한 방어의고 효율적인 싼 둘째 선을 하게 될 것이다 거대한.oac누적.
요오드화칼륨과 마찬가지로 갑상선 기능 저하증과 같은 위험성이 없는 것은 아니다.그러나 이러한 모든 경우 위험에도 불구하고 요오드화물, 요오드산염 또는 과염소산염 개입의 예방적 편익이 환경을 충분히 오염시킨 지역의 방사성 요오드 생물 축적에 의한 심각한 발암 위험을 능가한다.
의료용

요오드-131은 핵의학에서 몇 가지 상태를 치료하기 위해 밀봉되지 않은 방사선 치료에 사용된다.또한 영상 진단을 위해 감마 카메라에 의해 검출될 수 있지만, 영상촬영은 진단 목적으로만 투여되는 경우는 거의 없으며, 일반적으로 치료 [38]용량에 따라 수행됩니다.요오드화염으로서 I를 사용하는 것은 갑상선의 정상세포에 의한 요오드 흡수 메커니즘을 이용한다.
갑상선독성증 치료
I의 주요 용도는 그레이브스병으로 인한 갑상선독성증(갑상선 항진증)의 치료와 때로는 활동성이 높은 갑상선 결절(악성이 아닌 비정상적으로 활동적인 갑상선 조직)을 포함한다.그레이브스병으로 인한 갑상선 기능 항진증을 치료하기 위해 방사성 요오드를 사용하는 것은 1941년 Saul Hertz에 의해 처음 보고되었다.선량은 통원 환자 환경에서 일반적으로 (액체 또는 캡슐로) 경구 투여되며, 일반적으로 400–600 메가큐렐(MBq)[39]이다.방사성 요오드(요오드-131)만으로도 치료 후 며칠 안에 갑상선 독성을 악화시킬 수 있습니다.치료의 한 가지 부작용은 갑상선 증상의 초기 며칠간의 증가이다.이것은 방사성 요오드가 갑상선 세포를 파괴할 때, 갑상선 호르몬을 혈류로 방출할 수 있기 때문이다.이 때문에 때로는 메티마졸 등의 갑상선 정전기 약물로 환자를 전처리하거나 프로프라놀롤 등의 증상 치료를 한다.모유수유 및 임신[40] 시 방사성 요오드 치료가 금지됩니다
갑상선암의 치료
갑상선암 [41][39]치료를 위한 완전한 갑상선 절제 후 남은 갑상선 조직의 절제에는 갑상선 독성증보다 높은 용량으로 요오드-131이 사용된다.
절제를 위한 I-131 투여
I-131의 대표적인 치료용량은 2220~7400메가 큐렐(MBq)[42]이다.이러한 높은 방사능과 베타 방사선에 대한 위 조직의 노출이 용해되지 않은 캡슐 근처에서는 높기 때문에 I-131을 소량의 액체로 사람에게 투여하기도 한다.이 액체 형태의 투여는 보통 차폐된 [43]용기에서 천천히 조심스럽게 액체를 흡입하는 데 사용되는 빨대로 이루어집니다.동물(예를 들어 갑상선 기능 항진증 고양이)에 투여하기 위해서는 실질적인 이유로 동위원소를 주입해야 한다.유럽 지침은 "환자에게 훨씬 쉽고 [44]간병인에 대한 방사선 방호가 우수하기 때문에" 캡슐 관리를 권장한다.
시술 후 격리
Ablation 양은 보통 입원 환자 기본으로 하고 있으며, IAEA국제 Basic의 경우 안전 표준까지 그 활동은 환자들 방사성 핵종 요법들을 겪" 원해서 간병인"1100MBq.[45]ICRP 조언 국가 아래 국민의 선량이 다르기 때문은 회원들에게로 처리해야 합니다. 그 환자들 제대하지 않어 지는 것을 추천한다.tpurposes 및 환자에 대한 모든 제한은 이 [46]원칙에 따라 설계되어야 한다.
I-131 방사성 요오드 치료를 받는 환자에게는 1개월(또는 주어진 용량에 따라서는 더 짧음) 동안 성관계를 갖지 말 것을 경고하고, 여성은 그 후 6개월 동안 임신하지 말 것을 권고할 수 있다."이는 비록 남아 있는 방사능의 양이 적을 수 있고 방사성 요오드 치료의 실제 위험에 대한 의학적인 증거가 없음에도 불구하고 발달 중인 태아에게 이론적인 위험이 존재하기 때문입니다.이러한 예방조치는 근본적으로 태아가 방사능에 직접 노출되는 것을 없애고 이론적으로 방사성 [47]요오드 노출에 의해 손상되었을 수 있는 정자에 대한 수정 가능성을 현저히 감소시킬 것이다."이러한 지침은 병원마다 다르며, 국가 법률과 지침, 주어진 방사선량에 따라 달라진다.또한 일부에서는 방사선이 여전히 높을 때 어린이를 안아주거나 안아주지 말 것을 권고하며, 다른 사람들과 1-2m 거리를 두는 것이 [48]권장될 수 있다.
I-131은 투여 후 몇 주 동안 체내에서 제거될 것이다.I-131의 대부분은 자연 부패와 땀과 소변 배설을 통해 3~5일 안에 인체에서 제거될 것이다.인체가 I-131로 생성된 갑상선 호르몬을 처리함에 따라 소량의 양이 다음 몇 주 동안 계속해서 방출될 것이다.따라서 치료를 받은 사람이 사용하는 화장실, 싱크대, 침대 시트, 의류를 정기적으로 청소하는 것이 좋습니다.또한 환자는 항상 슬리퍼나 양말을 신어야 하며, 다른 사람들과의 오랜 친밀한 접촉을 피해야 합니다.이것은 가족, 특히 [49]어린이들에 의한 우발적인 노출을 최소화합니다.방사성 요오드 제거를 위해 특별히 제작된 오염 제거제를 사용하는 것이 권장될 수 있다.염소 표백제 또는 염소 표백제를 포함한 세척제는 방사성 원소 요오드 가스가 [50]방출될 수 있으므로 사용하지 않는 것이 좋습니다.공기 중 I-131은 오염을 넓은 영역으로 확산시켜 간접 노출의 더 큰 위험을 초래할 수 있습니다.가족과의 의도하지 않은 노출을 제한하기 위해 가능하면 욕실이 연결된 방에 머무르시는 것이 좋습니다.
현재 많은 공항에는 방사능 물질의 밀수를 탐지하기 위한 방사선 탐지기가 설치되어 있다.환자에게 항공편으로 이동할 경우 [51]I로 치료한 후 최대 95일까지 공항에서 방사선 검출기를 작동시킬 수 있음을 경고해야 한다.
기타 치료 용도
I 동위원소는 또한 치료에 사용할 수 있는 특정 방사성 의약품의 방사성 라벨로 사용된다. 예를 들어, I-메타요오드벤질구아니딘(131I-MIBG)은 페오크로모세포종과 신경아세포종의 영상 및 치료에 사용된다.이 모든 치료에서, 저는 단거리 베타 방사선에 의해 조직을 파괴합니다.조직에 대한 방사선 손상의 약 90%는 베타 방사선을 통해 발생하며, 나머지는 감마선을 통해 발생한다(방사성 동위원소로부터 더 먼 거리).치료제로 사용한 후 진단 스캔에서 볼 수 있습니다. 저도 감마선 방출자이기 때문입니다.
진단 용도
소량의 갑상선 베타 방사선의 발암성 때문에 I-131은 주로 또는 진단만을 위해 거의 사용되지 않았다. (과거에는 이 동위원소의 생산 용이성과 낮은 비용 때문에 더 흔했다.)대신 보다 순수하게 감마 방출되는 방사성 요오드-123이 진단 테스트(갑상선 핵의학 스캔)에 사용된다.더 긴 반감기 요오드-125는 진단을 위해 더 긴 반감기 방사성 요오드가 필요할 때 간혹 사용되며 베타 성분이 없는 저에너지 감마선이 요오드-125를 유용하게 만드는 브라키테라피(작은 씨앗과 같은 금속 캡슐에 제한됨) 치료에도 사용된다.요오드의 다른 방사성 동위원소들은 브라키테라피에는 전혀 사용되지 않는다.
I를 의료용 동위원소로 사용하는 것은 캐나다-미국 [52]국경 통과에서 바이오솔리드의 일상적인 수송이 거부되는 원인으로 지목되어 왔다.이러한 물질은 의료시설에서 직접 하수구로 유입되거나 치료 후 환자에 의해 배출될 수 있습니다.
산업용 방사성 추적기 사용
1951년 독일 뮌헨의 식수 공급 시스템에서 누출을 국지화하기 위해 처음으로 사용된 요오드-131은 동위원소 수문학 및 누출 [53][54][55][56]탐지에 응용되어 가장 일반적으로 사용되는 산업용 방사능 추적기 중 하나가 되었다.
1940년대 후반부터 석유 산업에 의해 방사능 추적기가 사용되어 왔다.지표면에 태그를 부착한 물은 적절한 감마 검출기를 사용하여 흐름을 결정하고 지하 누출을 감지하기 위해 아래로 추적된다.I-131은 [57][58][59]요오드화나트륨 수용액에서 가장 널리 사용되는 태그 동위원소이다.유압 파쇄 오일의 특성을 파악하여 유압 [60][61][62]파쇄로 인해 발생하는 분사 프로파일과 파쇄 위치를 파악하는 데 도움이 됩니다.
「 」를 참조해 주세요.
레퍼런스
- ^ "UW-L Brachy Course". wikifoundry. April 2008. Retrieved 11 April 2014.
- ^ Dobyns, B. M.; Sheline, G. E.; Workman, J. B.; Tompkins, E. A.; McConahey, W. M.; Becker, D. V. (June 1974). "Malignant and benign neoplasms of the thyroid in patients treated for hyperthyroidism: a report of the cooperative thyrotoxicosis therapy follow-up study". The Journal of Clinical Endocrinology and Metabolism. 38 (6): 976–998. doi:10.1210/jcem-38-6-976. ISSN 0021-972X. PMID 4134013.
- ^ a b c Rivkees, Scott A.; Sklar, Charles; Freemark, Michael (1998). "The Management of Graves' Disease in Children, with Special Emphasis on Radioiodine Treatment". Journal of Clinical Endocrinology & Metabolism. 83 (11): 3767–76. doi:10.1210/jcem.83.11.5239. PMID 9814445.
- ^ Rayyes, Al; Hamid, Abdul (2002). "Technical meeting of project counterparts on cyclotron production of I-123" (pdf). International Nuclear Information System. IAEA.
- ^ Reis, John C.(1976)석유공학의 환경관리.걸프 전문 출판사.
- ^ a b Simon, Steven L.; Bouville, André; Land, Charles E. (January–February 2006). "Fallout from Nuclear Weapons Tests and Cancer Risks". American Scientist. 94: 48–57. doi:10.1511/2006.1.48.
In 1997, NCI conducted a detailed evaluation of dose to the thyroid glands of U.S. residents from I-131 in fallout from tests in Nevada. (...) we evaluated the risks of thyroid cancer from that exposure and estimated that about 49,000 fallout-related cases might occur in the United States, almost all of them among persons who were under age 20 at some time during the period 1951–57, with 95-percent uncertainty limits of 11,300 and 212,000.
- ^ "National Cancer Institute calculator for thyroid cancer risk as a result of I-131 intake after nuclear testing before 1971 in Nevada". Ntsi131.nci.nih.gov. Archived from the original on 23 July 2012. Retrieved 17 June 2012.
- ^ Guiraud-Vitaux, F.; Elbast, M.; Colas-Linhart, N.; Hindie, E. (February 2008). "Thyroid cancer after Chernobyl: is iodine 131 the only culprit ? Impact on clinical practice". Bulletin du Cancer. 95 (2): 191–5. doi:10.1684/bdc.2008.0574 (inactive 31 July 2022). PMID 18304904.
{{cite journal}}: CS1 유지 : 2022년 7월 현재 DOI 비활성화 (링크) - ^ Centre for Disease Control (2002). The Hanford Thyroid Disease Study (PDF). Retrieved 17 June 2012.
no associations between Hanford's iodine-131 releases and thyroid disease were observed. [The findings] show that if there is an increased risk of thyroid disease from exposure to Hanford's iodine-131, it is probably too small to observe using the best epidemiologic methods available
이그제큐티브 서머리 - ^ Chattopadhyay, Sankha; Saha Das, Sujata (2010). "Recovery of 131I from alkaline solution of n-irradiated tellurium target using a tiny Dowex-1 column". Applied Radiation and Isotopes. 68 (10): 1967–9. doi:10.1016/j.apradiso.2010.04.033. PMID 20471848.
- ^ "I-131 Fact Sheet" (PDF). Nordion. August 2011. Retrieved 26 October 2010.[영구 데드링크]
- ^ "Nuclear Data for Safeguards, Table C-3, Cumulative Fission Yields". International Atomic Energy Agency. Retrieved 14 March 2011. (중성자 핵분열)
- ^ Effluent Releases from Nuclear Power Plants and Fuel-Cycle Facilities. National Academies Press (US). 29 March 2012.
- ^ "Nuclide Safety Data Sheet" (PDF). Retrieved 26 October 2010.
- ^ Skugor, Mario (2006). Thyroid Disorders. A Cleveland Clinic Guide. Cleveland Clinic Press. p. 82. ISBN 978-1-59624-021-6.
- ^ Council, National Research (11 February 2003). Exposure of the American Population to Radioactive Fallout from Nuclear Weapons Tests: A Review of the CDC-NCI Draft Report on a Feasibility Study of the Health Consequences to the American Population from Nuclear Weapons Tests Conducted by the United States and Other Nations. nap.edu. doi:10.17226/10621. ISBN 978-0-309-08713-1. PMID 25057651. Retrieved 3 April 2018.
- ^ Robbins, Jacob; Schneider, Arthur B. (2000). "Thyroid cancer following exposure to radioactive iodine". Reviews in Endocrine and Metabolic Disorders. 1 (3): 197–203. doi:10.1023/A:1010031115233. ISSN 1389-9155. PMID 11705004. S2CID 13575769.
- ^ Frot, Jacques. "The Causes of the Chernobyl Event". Ecolo.org. Retrieved 17 June 2012.
- ^ "Radioactive I-131 from Fallout". National Cancer Institute. Retrieved 14 November 2007.
- ^ "Individual Dose and Risk Calculator for Nevada Test Site fallout". National Cancer Institute. 1 October 2007. Archived from the original on 18 October 2007. Retrieved 14 November 2007.
- ^ "Low Concentrations Of Radiation Found In Mass. WCVB Home – WCVB Home". Thebostonchannel.com. 27 March 2011. Archived from the original on 3 April 2012. Retrieved 17 June 2012.
- ^ "워싱턴주 우유에서 검출된 방사성 요오드 흔적" 로스앤젤레스 타임스[데드링크]
- ^ Sepe, S. M.; Clark, R. A. (March 1985). "Oxidant membrane injury by the neutrophil myeloperoxidase system. I. Characterization of a liposome model and injury by myeloperoxidase, hydrogen peroxide, and halides". Journal of Immunology. 134 (3): 1888–1895. ISSN 0022-1767. PMID 2981925.
- ^ Kowalsky RJ, Falen, SW. 원자력 약국 및 핵의학 분야의 방사선 의약품.제2판워싱턴 DC: 미국 약사 협회; 2004.
- ^ Olivier, Pierre; et al. (29 December 2002). "Guideline for Radioiodinated MIBG Scintigraphy in Children" (PDF). European Association of Nuclear Medicine. Retrieved 27 September 2018.
- ^ Guidelines for Iodine Prophylaxis following Nuclear Accidents (PDF), Geneva: World Health Organization, 1999
- ^ "Potable Aqua Questions and Answers". www.pharmacalway.com. Archived from the original on 14 January 2013. Retrieved 3 April 2018.
- ^ Lemar, H. J. (1995). "Thyroid adaptation to chronic tetraglycine hydroperiodide water purification tablet use". Journal of Clinical Endocrinology & Metabolism. 80 (1): 220–223. doi:10.1210/jcem.80.1.7829615. PMID 7829615.
- ^ a b c d e f g Greer, Monte A.; Goodman, Gay; Pleus, Richard C.; Greer, Susan E. (2002). "Health Effects Assessment for Environmental Perchlorate Contamination: The Dose Response for Inhibition of Thyroidal Radioiodine Uptake in Humans". Environmental Health Perspectives. 110 (9): 927–37. doi:10.1289/ehp.02110927. PMC 1240994. PMID 12204829.
- ^ a b Wolff, J. (1998). "Perchlorate and the thyroid gland". Pharmacological Reviews. 50 (1): 89–105. PMID 9549759.
- ^ Barzilai, D.; Sheinfeld, M. (1966). "Fatal complications following use of potassium perchlorate in thyrotoxicosis. Report of two cases and a review of the literature". Israel Journal of Medical Sciences. 2 (4): 453–6. PMID 4290684.
- ^ Woenckhaus, U.; Girlich, C. (2005). "Therapie und Prävention der Hyperthyreose" [Therapy and prevention of hyperthyroidism]. Der Internist (in German). 46 (12): 1318–23. doi:10.1007/s00108-005-1508-4. PMID 16231171. S2CID 13214666.
- ^ a b Bartalena, L.; Brogioni, S.; Grasso, L.; Bogazzi, F.; Burelli, A.; Martino, E. (1996). "Treatment of amiodarone-induced thyrotoxicosis, a difficult challenge: Results of a prospective study". Journal of Clinical Endocrinology & Metabolism. 81 (8): 2930–3. doi:10.1210/jcem.81.8.8768854. PMID 8768854.
- ^ Lawrence, J. E.; Lamm, S. H.; Pino, S.; Richman, K.; Braverman, L. E. (2000). "The Effect of Short-Term Low-Dose Perchlorate on Various Aspects of Thyroid Function". Thyroid. 10 (8): 659–63. doi:10.1089/10507250050137734. PMID 11014310.
- ^ Lamm, Steven H.; Braverman, Lewis E.; Li, Feng Xiao; Richman, Kent; Pino, Sam; Howearth, Gregory (1999). "Thyroid Health Status of Ammonium Perchlorate Workers: A Cross-Sectional Occupational Health Study". Journal of Occupational & Environmental Medicine. 41 (4): 248–60. doi:10.1097/00043764-199904000-00006. PMID 10224590.
- ^ "Nuclear Chemistry: Half-Lives and Radioactive Dating – For Dummies". Dummies.com. 6 January 2010. Retrieved 17 June 2012.
- ^ 나카조, M, 샤피로, BSisson, J.C., Swanson, D.P. 및 Beierwaltes, W.H. 침샘 메타흡수 [I131]요오드벤질구아니딘J 누클 메드 25:2-6, 1984
- ^ Carpi, Angelo; Mechanick, Jeffrey I. (2016). Thyroid Cancer: From Emergent Biotechnologies to Clinical Practice Guidelines. CRC Press. p. 148. ISBN 9781439862223.
- ^ a b Stokkel, Marcel P. M.; Handkiewicz Junak, Daria; Lassmann, Michael; Dietlein, Markus; Luster, Markus (13 July 2010). "EANM procedure guidelines for therapy of benign thyroid disease". European Journal of Nuclear Medicine and Molecular Imaging. 37 (11): 2218–2228. doi:10.1007/s00259-010-1536-8. PMID 20625722. S2CID 9062561.
- ^ 브런튼, 로렌스 L. 등Goodman & Gilman's The Pharmacological Basis of Therapeutics, 2011년 12e.제39장
- ^ Silberstein, E. B.; Alavi, A.; Balon, H. R.; Clarke, S. E. M.; Divgi, C.; Gelfand, M. J.; Goldsmith, S. J.; Jadvar, H.; Marcus, C. S.; Martin, W. H.; Parker, J. A.; Royal, H. D.; Sarkar, S. D.; Stabin, M.; Waxman, A. D. (11 July 2012). "The SNMMI Practice Guideline for Therapy of Thyroid Disease with 131I 3.0". Journal of Nuclear Medicine. 53 (10): 1633–1651. doi:10.2967/jnumed.112.105148. PMID 22787108. S2CID 13558098.
- ^ Yama, Naoya; Sakata, Koh-ichi; Hyodoh, Hideki; Tamakawa, Mitsuharu; Hareyama, Masato (June 2012). "A retrospective study on the transition of radiation dose rate and iodine distribution in patients with I-131-treated well-differentiated thyroid cancer to improve bed control shorten isolation periods". Annals of Nuclear Medicine. 26 (5): 390–396. doi:10.1007/s12149-012-0586-3. ISSN 1864-6433. PMID 22382609. S2CID 19799564.
- ^ Rao, V. P.; Sudhakar, P.; Swamy, V. K.; Pradeep, G.; Venugopal, N. (2010). "Closed system vacuum assisted administration of high dose radio iodine to cancer thyroid patients: NIMS techniqe". Indian J Nucl Med. 25 (1): 34–5. doi:10.4103/0972-3919.63601. PMC 2934601. PMID 20844671.
- ^ Luster, M.; Clarke, S. E.; Dietlein, M.; Lassmann, M.; Lind, P.; Oyen, W. J. G.; Tennvall, J.; Bombardieri, E. (1 August 2008). "Guidelines for radioiodine therapy of differentiated thyroid cancer". European Journal of Nuclear Medicine and Molecular Imaging. 35 (10): 1941–1959. doi:10.1007/s00259-008-0883-1. PMID 18670773. S2CID 81465.
- ^ Nuclear medicine in thyroid cancer management: a practical approach. Vienna: International Atomic Energy Agency. 2009. ISBN 978-92-0-113108-9.
- ^ Valentine, J. (June 2004). "ICRP Publication 94: Release of Nuclear Medicine Patients after Therapy with Unsealed Sources". Annals of the ICRP. 34 (2): 1–27. doi:10.1016/j.icrp.2004.08.003. S2CID 71901469.
- ^ "Radioiodine Therapy: Information for Patients" (PDF). AACE. 2004. Archived from the original (PDF) on 10 September 2008.
- ^ "Instructions for Receiving Radioactive Iodine Therapy after a Thyroid Cancer Survey". University of Washington Medical Center. Archived from the original on 28 February 2009. Retrieved 12 April 2009.
- ^ "Precautions after Out-patient Radioactive Iodine (I-131) Therapy" (PDF). Department of Nuclear Medicine McMaster University Medical Centre. Archived from the original (PDF) on 29 September 2011.
- ^ Biosafety Manual for Perdue University (PDF). Indianapolis. 2002. p. 7. Archived from the original (PDF) on 23 March 2012. Retrieved 28 April 2011.
- ^ Sutton, Jane (29 January 2007). "Radioactive patients". reuters. Retrieved 15 May 2009.
- ^ "Medical isotopes the likely cause of radiation in Ottawa waste". CBC News. 4 February 2009. Retrieved 30 September 2015.
- ^ Moser, H.; Rauert, W. (2007). "Isotopic Tracers for Obtaining Hydrologic Parameters". In Aggarwal, Pradeep K.; Gat, Joel R.; Froehlich, Klaus F. (eds.). Isotopes in the water cycle : past, present and future of a developing science. Dordrecht: Springer. p. 11. ISBN 978-1-4020-6671-9. Retrieved 6 May 2012.
- ^ Rao, S. M. (2006). "Radioisotopes of hydrological interest". Practical isotope hydrology. New Delhi: New India Publishing Agency. pp. 12–13. ISBN 978-81-89422-33-2. Retrieved 6 May 2012.
- ^ "Investigating leaks in Dams & Reservoirs" (PDF). IAEA.org. Retrieved 6 May 2012.
- ^ Araguás, Luis Araguás; Plata Bedmar, Antonio (2002). "Artificial radioactive tracers". Detection and prevention of leaks from dams. Taylor & Francis. pp. 179–181. ISBN 978-90-5809-355-4. Retrieved 6 May 2012.
- ^ Reis, John C. (1976). "Radioactive materials". Environmental Control in Petroleum Engineering. Gulf Professional Publishers. p. 55. ISBN 978-0-88415-273-6.
- ^ McKinley, R. M. (1994). "Radioactive tracer surveys" (PDF). Temperature, radioactive tracer, and noise logging for injection well integrity. Washington: U.S. Environmental Protection Agency. Retrieved 6 May 2012.
- ^ Schlumberger Ltd. "Radioactive-tracer log". Schlumberger.com. Retrieved 6 May 2012.
- ^ 미국 특허 5635712, Scott, George L., 1997-06-03 '지하층 수압파쇄를 감시하는 방법' 발행
- ^ 미국 특허 4415805, Pertl, Walter H., "시추공 주위의 다단계 균열 또는 지형을 평가하는 방법 및 장치", 1983-11-15. 발행
- ^ 미국 특허 5441110, Scott, George L., "수압 골절 처리 중 골절 성장을 모니터링하는 시스템 및 방법", 1995-08-15 출판
외부 링크
- "ANL factsheet" (PDF). Archived from the original (PDF) on 14 June 2003.
- 방사선학정보 – 환자용 방사선 정보 리소스: 방사성 요오드(I-131) 치료
- 환경 의학 사례 연구: 요오드 131로부터의 방사선 피폭
- 의료용 방사성핵종에 대한 개인 국토안보 방사선 검출기의 민감도 및 핵의학 환자의 상담에 미치는 영향
- NLM 유해물질 데이터뱅크 – 요오드, 방사성