에포틸론
Epothilone| 에포틸론 | |
|---|---|
 에피토틸론 A(R = H) 및 B(R = CH3) | |
| 화학공식 | A: C26H39NO6S |
| 분자질량 | A: 493.66 g/mol |
| CAS 번호 | A: 152044-53-6 |
| 펍켐 | A: 448799 |
 에피토틸론 C(R = H) 및 D(R = CH3) | |
| 화학공식 | C: C26H39NO5S |
| 분자질량 | C: 477.66 g/mol |
| CAS 번호 | D: 189453-10-9 |
| 펍켐 | C: 9891226 |
 에피토틸론 E(R = H) 및 F(R = CH3) | |
| 화학공식 | E: C26H39NO7S |
| 분자질량 | E: 509.66 g/mol |
| 거부권 및 참조 | |
에피틸론은 잠재적인 암 치료제의 일종이다. 택사인과 마찬가지로 투불린에 간섭하여 암세포가 분열되는 것을 방지하지만, 초기 실험에서는 에피틸론이 택사인에 비해 효능이 좋고 부작용이 약한 편이다.[1]
2008년[update] 9월 현재, epothilone A ~ F가 확인되고 특성화되었다.[2] 암세포 라인과 인간 암 환자의 초기 연구는 조세인보다 뛰어난 효능을 보여준다. 그들의 작용기전은 비슷하지만 화학적 구조는 더 단순하다. 더 나은 수용성 때문에 화장기(심장 기능에 영향을 주고 심한 과민증을 유발할 수 있는 팩리탁셀에 사용되는 용해제)는 필요하지 않다.[3] 에포틸론 B에서는 염증성 사이토카인과 질소산화물을 합성하는 대식세포의 활성화와 같이 paclitaxel로부터 알려진 엔도톡신 같은 특성이 관찰되지 않는다.[4]
에피토틸론은 원래 토양에 오염된 멕소박테리움 소랑기움 셀룰로오섬에 의해 생성되는 대사물로 확인되었다.
역사
epothilone A의 구조는 x-ray 결정학을 이용하여 1996년에 결정되었다.[5]
작용기전
에포틸론 등급의 주요 메커니즘은 미세관 기능의 억제다.[6] 마이크로튜브는 세포분열에 필수적이며, 따라서 에피틸론은 세포분열을 막는다. 에피토틸론 B는 체외 및 배양 세포에서 모두 pacitaxel과 동일한 생물학적 효과를 가지고 있다. 마이크로튜브에 대한 바인딩 친화력은 물론 동일한 바인딩 사이트를 공유하기 때문이다. paclitaxel과 마찬가지로 epothilone B는 αβ-tubulin hythetodimer subunit에 결합한다. 한 번 바운드되면 αβ-tubulin disocation rate가 감소하여 마이크로튜브를 안정화시킨다. 나아가 epothilone B는 GTP가 없는 상태에서 튜불린 중합체를 마이크로튜브로 유도하는 것으로도 나타났다. 이것은 세포질 전체에 미세관 뭉치가 형성되어 발생한다. 마지막으로 에피토틸론 B는 G2-M 전환 단계에서 세포주기 구속을 유발하여 세포독성 및 결국 세포사멸을 초래한다.[7] 스핀들 기능을 억제하는 에포틸론의 능력은 일반적으로 미세관 역학 억제에 기인하지만,[8] 최근의 연구는 역학 억제가 유사분열을 차단하는 데 필요한 것보다 더 낮은 농도에서 발생한다는 것을 입증했다. 높은 항정신병 농도에서 paclitaxel은 체세포 분리를 억제하여 작용하는 것으로 나타나는데, 이것은 체세포 분열 중에 정상적으로 활성화되는 과정이다. 에포틸론도 비슷한 메커니즘을 가지고도 활동할 수 있다는 것은 꽤 가능하다.[9]
의료용으로 승인된 아날로그
한 아날로그인 ixabepilone은 2007년 10월 미국 식품의약국(FDA)으로부터 공격적인 전이성 또는 국소적으로 발달한 유방암 치료에 사용되어 현재 이용 가능한 화학요법에 더 이상 반응하지 않는 것으로 승인을 받았다.[10] 2008년 11월, EMEA는 Ixabepilone에 대한 마케팅 허가를 거절했다.[11]
임상시험
이 섹션은 갱신되어야 한다. (1919년 1월) |
몇몇 합성 에포틸론 아날로그는 현재 다양한 암의 치료를 위한 임상 개발을 진행 중이다.
Epothilone B는 몇몇 인간 이종 이식 모델에서 허용 선량 수준에서 강력한 생체내 항암 활동을 포함하고 있는 것으로 입증되었다.[12] 그 결과 에피토틸론 B(파투필론)와 다양한 유사점들이 다양한 임상 단계를 거치는 2001년[update] 현재를 기준으로 파투필론과 완전합성 사고필론[SH-Y03757A, ZK-EPO, 화학구조]이 2단계 임상, 1단계 임상에서는 BMS-310705이다.
전이성 유방암에 있는 카피타빈과 결합하여 ixabepilone (BMS-247550)을 사용한 3단계 임상시험 결과가 발표되었다(2007년 - FDA 승인까지 이어졌다).[13]
파투필론은 2010년 난소암 3기 임상시험에 실패했다.[14]
우티델론은 유전공학으로 만들어진 에피틸론 아날로그로, 케이프치타빈에 첨가되었을 때 3단계 유방암 실험에서 이점을 보여 왔다.[15]
총합성
암 치료에 대한 높은 효력과 임상적 필요성 때문에 에피토틸론은 많은 총합물의 대상이 되어 왔다.[16] 에피틸론 총합성을 최초로 발표한 그룹은 1996년 S. J. 다니셰프스키 외 그룹이었다.[7][17] 이 에포틸론 A의 총합성은 근육내 에스테르 에놀레이트-알데히드 응축을 통해 달성되었다. 에포틸론의 다른 합성물들은 니콜라우,[18] 쉰저,[19] 멀저,[20] 그리고 카레라에서 출판되었다.[21] 이 접근방식은 알데히드, 글리시돌, 케토아시드를 주요 건물블록으로 구성하여 올레핀 메타텍스 전구체에 알돌반응을 거쳐 에스테르화 커플링으로 결합하였다. 그루브스의 촉매는 전구 화합물의 bis 단자 올레핀을 닫기 위해 사용되었다. 그 결과 화합물은 뚜렷한 스테레오센트를 가진 시스 및 시스-매크로사이클링 이소머였다. 시스와 트랜스올레핀의 에폭시드는 에포틸론 A와 그 유사성을 산출한다.
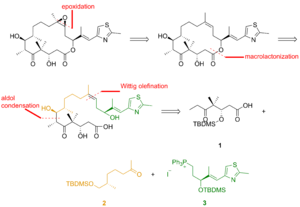
에포틸론 B의 전체 합성물 중 하나는 아래에 간략히 설명되어 있으며 K. C의 실험실에서 설명하였다. 니콜라우.[22] 역합성 분석 결과 1, 2, 3이 빌딩 블록으로 나타났다(그림 1).
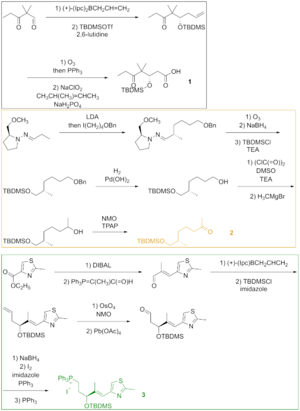
그림 2에서 보듯이, 케토산 1은 비대칭 동맹과 결과 알코올의 실화를 통해 실릴 에테르로 변환된 케토알데히드에서 생성되었다. 실릴 에테르의 오조놀리시스, 알데히드의 린드그렌-피닉 산화가 케토산을 공급했다. 케톤 2는 하이드라존에서 시작하여 엔더스 알킬화(Enders alkylation)를 통해 제작되었다. 엔더스 알킬화의 마지막 단계인 오조놀리시스(Ozonolyis)는 알데히드 감소와 결과 알코올의 실화가 뒤따랐다. 벤질 에테르의 수소 분해는 그 알코올을 주었는데, 그 알콜은 스웨른 조건 하에서 산화되어 그리그나드 시약으로 알킬화하여 2차 알코올을 산출했다. 레이-그리피스 시약으로 이 알코올을 산화시키면 원하는 케톤이 나왔다. 티아졸레3는 에스테르에서 합성되어 디이소부틸릴루미늄 하이드라이드(diisobutyluminium hydriide)로 감소되었으며, 알데히드는 위티그 반응에서 안정화된 이라이드와 반응하였다. α,β-불포화 알데히드의 비대칭적 동맹과 히드록시 그룹의 보호는 실릴 에테르를 주었고, 실릴 에테르에게는 단자 올레핀이 납 테트라아세테이트로 갈라져 알데히드를 공급한 디올에틸에테르가 반응했다. 환원, 요오드화, 트리페닐인산염 치료는 인산염으로 이어졌다.
조각 1, 2, 3은 위티그 반응, 알돌 반응, 야마구치 에스테르화(그림 3) 등의 접근방식에서 에포틸론 B를 전달하기 위해 서로 반응했다. 준비성 얇은 층 크로마토그래피는 분쇄기를 분리하는데 사용되었다.
생합성
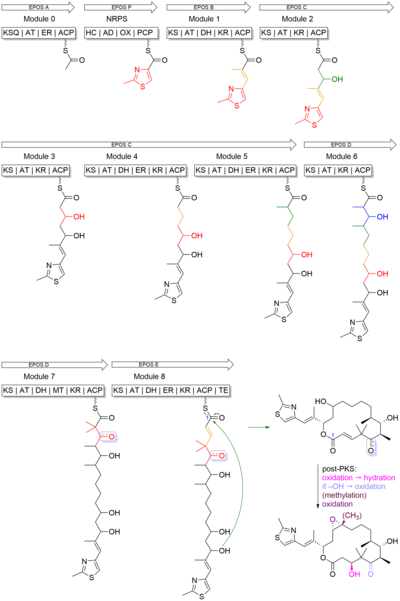
에포틸론 B는 올레피니컬 본드로 매크로사이클에 메틸시아졸 그룹이 연결된 16mb의 폴리케티드 마크로락톤이다. 폴리케타이드 백본은 타입 I PKS(Polyketide Synthase)에 의해 합성되었고 티아졸 링은 비리보솜 펩타이드 합성효소(NRPS)에 의해 통합된 시스테인에서 파생되었다. 이 생합성에서는 PKS와 NRPS 모두 인포판테민 그룹에 의해 번역 후 변형된 운반체 단백질을 사용하여 성장 사슬에 합류한다. PKS는 코엔자임-A 티오에스터를 사용하여 히드록실(Ketorductase, KR), 알켄(탈수화물, DH), 알칸(Enoyl Reducate, ER)에 대한 β 카보닐을 선택적으로 감소시켜 반응을 촉진하고 기판을 수정한다. PKS-I는 기질의 α 탄소를 메틸화시킬 수도 있다. 반면 NRPS는 효소에 작용하는 아미노산을 아미노산 아데닐산물로 사용한다. PKS와는 달리 경구화, N-메틸화, 헤테로사이클 형성이 NRPS 효소에서 발생한다.[23]
Epothilone B는 PKS, EPOS A(epoA) 모듈 및 NRPS, EPOS P(epoP) 모듈 사이의 변환 결합을 통해 형성된 2-메틸-4-카복시티아졸 스타터 유닛으로 시작한다. EPOS A에는 변형된 β-케토아실-신타아제(말론닐-ACP 데카르복실라제, KSQ), 아킬트랜스퍼레이제(AT), 에노일 환원효소(ER), 아킬 캐리어 단백질 도메인(ACP)이 포함되어 있다. 그러나 EPOS P는 이질화, 아데닐화, 산화효소 및 티올화 도메인을 포함한다. 이들 영역은 티아졸의 5mb(membed) 헤테로사이클릭 링의 형성에 관여하기 때문에 중요하다. 그림 4에서 보듯이, EPOS P는 시스테인을 활성화하고 활성화된 시스테인을 아미노산-S-PCP로 결합한다. 일단 사이스틴이 결합되면, EPOS A는 아세테이트 유닛을 EPOS P 콤플렉스에 적재하여, 따라서 분자 내 사이클로이드하이드레이션에 의한 티아졸린 링 형성을 개시한다.[23]
Once the 2-methylthiazole ring has been made, it is then transferred to the PKS EPOS B (epoB), EPOS C (epoC), EPOS D (epoD), EPOS E (epoE), and EPOS F (epoF) for subsequent elongation and modification to generate the olefinic bond, the 16-membered ring, and the epoxide, as seen in Figure 5. 한 가지 주목해야 할 중요한 것은 모듈 7의 젬-디메틸 유닛의 합성이다. 이 두 다이메틸은 두 번의 연속적인 C-메틸레이션으로 합성되지 않았다. 대신 프로피온산 확장기에서 메틸 그룹 중 하나가 파생되었고, 두 번째 메틸 그룹은 C-메틸-전달효소 도메인에 의해 통합되었다.[23]
참고 항목
참조
- ^ Rosenberg, Steven; DeVita, Vincent T.; Hellman, Samuel (2005). Cancer: Principles & Practice of Oncology (7th ed.). Hagerstwon, MD: Lippincott Williams & Wilkins. ISBN 0-7817-4450-4.
- ^ H. Spreitzer (September 15, 2008). "Neue Wirkstoffe – Sagobepilon – eine synthetische Variation von Epothilon B als Hoffnungsträger gegen Krebs". Österreichische Apothekerzeitung (in German) (19/2008): 978.
- ^ Julien, B.; Shah, S. (2002). "Heterologous Expression of Epothilone Biosynthetic Genes in Myxococcus xanthus". Antimicrob. Agents Chemother. 46 (9): 2772–8. doi:10.1128/AAC.46.9.2772-2778.2002. PMC 127399. PMID 12183227.
- ^ Muhlradt, P.F.; Sasse, F. (1997). "Epothilone B stabilizes microtubuli of macrophages like taxol without showing taxol-like endotoxin activity". Cancer Research. 57 (16): 3344–6. PMID 9269992.
- ^ Höfle, G.; Bedorf, N.; Steinmertz, H.; Schomburg, D.; Gerth, K.; Reichenbach, H. (1996). "Epothilone A and B—Novel 16-Membered Macrolides with Cytotoxic Activity: Isolation, Crystal Structure, and Conformation in Solution". Angew. Chem. 35 (1314): 1567. doi:10.1002/anie.199615671.
- ^ Goodin S, Kane MP, Rubin EH (May 2004). "Epothilones: mechanism of action and biologic activity". J. Clin. Oncol. 22 (10): 2015–25. doi:10.1200/JCO.2004.12.001. PMID 15143095. Archived from the original on 2006-02-13. Retrieved 2006-05-14.
- ^ Jump up to: a b Balog, D. M.; Meng, D.; Kamanecka, T.; Bertinato, P.; Su, D.-S.; Sorensen, E. J.; Danishefsky, S. J. (1996). "Totalsynthese von (—)-Epothilon A". Angew. Chem. 108 (23–24): 2976. doi:10.1002/ange.19961082318.
- ^ Jordan MA, Wilson L (April 2004). "Microtubules as a target for anticancer drugs". Nature Reviews Cancer. 4 (4): 253–65. doi:10.1038/nrc1317. PMID 15057285. S2CID 10228718.
- ^ Ganguly A, Yang H, Cabral F (November 2010). "Paclitaxel-dependent cell lines reveal a novel drug activity". Mol. Cancer Ther. 9 (11): 2914–23. doi:10.1158/1535-7163.MCT-10-0552. PMC 2978777. PMID 20978163.
- ^ 오늘 의학 뉴스: FDA, 에포틸론 B의 반합성 아날로그인 IXEMPRA(TM) (ixabepilone), 고도 유방암 치료를 위해 승인
- ^ 2008년 11월 20일 런던. 참조: EMEA/602569/2008
- ^ 오지마, I.; G.D., 알트만, K.H., 2001년 항암제: 암 화학 요법의 프런티어. 워싱턴 DC의 미국 화학 협회
- ^ "Phase III Ixabepilone Study Demonstrated Significant Improvement In Progression-Free Survival In Patients With Advanced Metastatic Breast Cancer". Medical News Today. 4 June 2007.
- ^ "ESMO: Failed Trials Dominate Gyn Cancer Session". 14 October 2010.
- ^ 우티델론은 전이성 유방암에서 활동한다. 2016년 6월
- ^ Luduvico, I.; Hyaric, M. L.; Almeida, M. V.; Da Silva, A. D. (2006). "Synthetic Methodologies for the Preparation of Epothilones and Analogs". Mini-Reviews in Organic Chemistry (Review). 3: 49–75. doi:10.2174/157019306775474194.
- ^ Su, D.-S.; Meng, D.; Bertinato, P.; Balog, D. M.; Sorensen, E. J.; Danishefsky, S. J.; Zheng, Y.-H.; Chou, T.-C.; He, L.; Horwitz, S. B. (1997). "Total Synthesis of(–)-Epothilone B: An Extension of the Suzuki Coupling Method and Insights into Structure–Activity Relationships of the Epothilones". Angew. Chem. Int. Ed. Engl. 36 (7): 757. doi:10.1002/anie.199707571.
- ^ Yang, Z.; He, Y.; Vourloumis, D.; Vallberg, H.; Nicolaou, K. C. (1997). "Total Synthesis of Epothilone A: The Olefin Metathesis Approach". Angew. Chem. Int. Ed. Engl. 36 (12): 166. doi:10.1002/anie.199701661.
- ^ Schinzer, D.; Limberg, A.; Bauer, A.; Böhm, O. M.; Cordes, M. (1997). "Total Synthesis of(−)-Epothilone A". Angew. Chem. Int. Ed. Engl. 36 (5): 523. doi:10.1002/anie.199705231.
- ^ Mulzer, J.; Mantoulidis, A.; Öhler, E. (2000). "Total syntheses of epothilones B and D". J. Org. Chem. 65 (22): 7456–67. doi:10.1021/jo0007480. PMID 11076603.
- ^ Bode, J. W.; Carreira, E. M. (2001). "Stereoselective syntheses of epothilones A and B via directed nitrile oxide cycloaddition". J. Am. Chem. Soc. 123 (15): 3611–2. doi:10.1021/ja0155635. PMID 11472140.
- ^ Nicolaou, K.C.; Ninkovic, S.; Sarabia, F.; Vourloumis, D.; He, Y.; Vallberg, H.; Finlay, M.R.V.; Yang, Z. (1997). "Total Syntheses of Epothilones A and B via a Macrolactonization-Based Strategy". J. Am. Chem. Soc. 119 (34): 7974. doi:10.1021/ja971110h.
- ^ Jump up to: a b c Molnar, I.; Schupp, T.; Ono, M.; Zirkle, RE.; Milnamow, M.; Nowak-Thompson, B.; Engel, N.; Toupet, C.; Stratmann, A.; Cyr, DD.; Gorlach, J.; Mayo, JM.; Hu, A.; Goff, S.; Schmid, J.; Ligon, JM. (2000). "The biosynthetic gene cluster for the microtubule-stabilizing agents epothilones A and B from Sorangium cellulosum So ce90". Chemistry and Biology. 7 (2): 97–109. doi:10.1016/S1074-5521(00)00075-2. PMID 10662695.