실릴 에테르
Silyl ether실릴 에테르(Silyl ethers)는 알코시 그룹에 균일하게 결합된 실리콘 원자를 포함하는 화학 화합물의 그룹이다.일반적인 구조는 RRRSi-O-R이고1234 여기서 R은4 알킬 그룹 또는 아릴 그룹이다.실릴 에테르들은 유기 합성에서 알코올을 보호하는 그룹으로 주로 사용된다.RRR은123 많은 실릴 에테르를 제공하기 위해 변화될 수 있는 서로 다른 그룹의 조합일 수 있기 때문에, 이 화학 화합물 그룹은 그룹 화학 보호를 위한 광범위한 선택성 스펙트럼을 제공한다.일반적인 실릴 에테르로는 트리메틸실릴(TMS), 테르트-부틸디페닐실릴(TBDPS), 테르트-부틸디메틸실릴(TBS/TBDMS), 트리이소프로필릴(TIPS) 등이 있다.그것들은 약한 조건하에서 매우 선택적으로 설치되고 제거될 수 있기 때문에 특히 유용하다.null
밀실 에테르
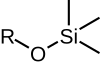 |  |  |  | 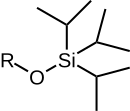 |
| TMS | 테스 | TBS/TBDMS | TBDPS | 팁들 |
| 트리메틸실릴에테르 | 트리에틸실릴에테르 | 테르트-부틸디메틸실릴 에테르 | 테르트-부틸디페닐실릴 에테르 | 삼이소프로필릴에테르 |
포메이션
일반적으로 알코올을 실링하려면 염화 실릴과 아민 베이스가 필요하다.신뢰할 수 있고 빠른 절차 중 하나는 DMF에서 높은 농도의 염화 실릴과 이미다졸과 알코올이 반응하는 코리 프로토콜이다.[1] DMF를 디클로로메탄으로 대체하면 반응은 다소 느리지만 화합물의 정화는 단순화된다.실릴 트리플플레이트 사용에 대한 일반적인 방해 기반은 2,6루티딘이다.[2]1차 알코올은 1시간 이내에 보호될 수 있지만 일부 방해 알코올은 반응 시간이 며칠이 걸릴 수 있다.null
염화실릴을 사용할 때는 대량의 물을 제외하고 특별한 주의사항이 일반적으로 필요하지 않다.염화실릴을 초과하는 염화물은 사용할 수 있지만 필요하지 않다.잉여 시약을 사용하면 과잉 실탄올과 실록산을 제거하기 위해 플래시 크로마토그래피가 필요하다.null
때때로 실릴 트리플레이트 및 방해 아민 베이스가 사용된다.실릴 트리플레이트(silyl triflates)는 해당 염소 처리물보다 반응성이 높기 때문에 방해받는 위치에 실릴 그룹을 설치하는 데 사용할 수 있다.실릴 트리플레이트(Silyl triflate)는 반응성이 더 높으며 케톤을 실릴 에놀 에테르로 변환하기도 한다.실릴 트리플렛은 물에 민감하므로 불활성 대기 조건에서 작동해야 한다.정화에는 포화암모늄 염화암모늄 용액과 같은 수산이 첨가된다.물은 남은 실릴 시약을 조이고 양성자는 반응 혼합물에서 제거하기 전에 아민 베이스를 조인다.추출 후 플래시 크로마토그래피로 정화가 가능하다.null
케톤은 금속 촉매가 있는 곳에서 하이드로실레인과 반응한다.[3][4]null
실릴 에테르 보호 그룹[5] 제거
테트라-n-부티람모늄 불소와 같은 산이나 불소와의 반응은 보호가 더 이상 필요하지 않을 때 실릴 그룹을 제거한다.대용품이 클수록 가수 분해에 대한 저항력이 높아지지만 실릴 그룹의 도입도 더 어려워진다.null
산성 매체에서 상대 저항은 다음과 같다.
- TMS(1) < TES (64) < TBS (20,000) > TIPS (70만) < TBDPS (500만)
기본 매체에서 상대적 저항은 다음과 같다.
- TMS (1) < TES (10-100) > TBS ~TBDPS (20 000) TIPS (10,000) > TIPS (10,000)
대칭 다이올의 단극화
대칭 diol은 때때로 문제가 있는 것으로 알려져 있지만 단조롭게 해석하는 것은 가능하다.예를 들어 다음과 같은 단조화가 보고되었다.[6]
하지만 이런 반응은 반복하기 어려운 것으로 나타났다.만약 반응이 열역학만으로 제어되었다면, 통계학적으로, 만약 디아니온이 모노아니온과 반응성이 비슷하다면, 그에 상응하는 통계적 혼합이 1:2:1 디스틸리온:모노실리온:비실리디올이 발생할 것이다.그러나 THF의 반응은 첫 음이온의 운동성 감퇴와 모노애니언의 불용성이라는 두 가지 요인에 의해 선택적으로 이루어진다.TBSCl을 처음 추가할 때 용액에는 소량의 모노anion만 있고 나머지는 중단된다.이 작은 부분은 반응하여 모노아니온의 평형을 변화시켜 용액으로 더 많이 끌어들여 모노-TBS 화합물의 높은 수율을 얻을 수 있다.경우에 따라 우수한 결과를 버터리튬으로 얻을 수 있다.[7]
세 번째 방법은 DMF와 DIPEA의 혼합물을 사용한다.[8]null
- 또는 diol의 초과(4 eq)를 사용할 수 있어 단독복제에 대한 반응을 강요할 수 있다.
선택적 절제
실릴 그룹의 선택적 감방은 많은 경우에 가능하다.예를 들어, taxol의 합성에서:[9]
실릴 에테르들은 주로 스테틱스나 전자제품에 기초하여 구별된다.일반적으로 산성의 감산은 실리콘의 황색 덩어리가 산소의 황색 덩어리보다 더 중요하기 때문에 방해받지 않는 실릴 그룹을 더 빨리 방지한다.불소에 기반한 감산은 전자가 풍부한 실릴 그룹보다 전자 불량 실릴 그룹을 더 빨리 보호한다.일부 silyl detectives가 고밸런스 실리콘 종을 통해 진행된다는 증거가 있다.null
실릴 에테르에 대한 선별적 감제는 광범위하게 검토되었다.[10][11]비록 선택적 감지는 많은 다른 조건에서 달성되었지만, 아래에 요약된 일부 절차는 더 신뢰할 수 있다.스테틱스(예: 1차 TBS 대 2차 TBS 또는 1차 TES 대 1차 TBS) 또는 전자장치(예: 1차 TBDPS 대 1차 TBS)에 상당한 차이가 있는 경우 선택적 절제가 성공할 가능성이 높다.불행히도 일부 최적화는 불가피하게 필요하며 종종 절충된 부품과 재활용 재료를 실행하는 것이 필요하다.null
- 일부 일반적인 산성 조건
- MeOH의 100% mol% 10-CSA(camphorsulfonic acid, 실온; 산의 "블라스팅")는 10분 이내에 1차 TBS 그룹을 보호한다.
- 10 mol% 10-CSA, 1:1 MeOH:DCM, -20 °C 또는 0 °C; 2시간 이내에 1차 TBS 그룹을 0으로 보호; CSA를 PPTS로 교체할 경우 속도가 약 10배 느림; p-TsOH로 약 10배 빠름; 용제 혼합물이 중요하다.
- 4:1:1 v/v/v AcOH:THF:물, 실내 온도.; 이것은 매우 느리지만 매우 선택적일 수 있다.
- 몇 가지 일반적인 기본 조건
- HF-피리딘, 10:1 THF:피리딘, 0°C, 뛰어난 제독; 8시간 이내에 1차 TBS 그룹을 제거; HF를 사용한 반응은 플라스틱 용기에서 실행되어야 한다.
- TBAF, THF 또는 1:1 TBAF/ACOH, THF; TBDPS 및 TBS 그룹은 서로 다른 조건에서 서로 있는 상태에서 감청될 수 있다.[12]
참조
- ^ 코리, E. J.; 벤카테츠와루, A. "하이드록실 그룹을 테르트-부틸디메틸릴 유도체로 보호" J. A. A. Chem. Soc. 1972, 94, 6190–6191. doi:10.1021/ja00772a043
- ^ 코리, E. J.; 조, H.; 뤼커 C;화, D. H. "삼알킬릴릴리플라이트를 사용한 연구: 새로운 합성물과 응용."테트라헤드론 1981, 22, 3455–3458. doi:10.1016/S0040-4039(01)81930-4
- ^ 하야시, T.; 하야시, C.; 우오즈미, Y.사면체: 1995년 6, 2503년 비대칭.
- ^ . doi:10.1016/0957-4166(95)00326-K.
{{cite journal}}: Cite 저널은 (도움말)을 요구한다.누락 또는 비어 있음(도움말) - ^ Greene, T. W.; Wuts, P. G. M. (1999). Protective Groups In Organic Synthesis. New York: John Wiley & Sons. p. 114. ISBN 9780471160199.
- ^ McDougal, P. G.; Rico, J. G.; Oh, Y.I.; Condon, B. D. "대칭 1,n-diols의 단조로움을 위한 편리한 절차." J. Org. Chem. 1986, 51, 3388–3390. doi:10.1021/jo00367a033
- ^ 루쉬, W. R.; 길리스, H. R.; 에센펠드. "수소화산은 분자 내 디엘-알데르 반응 "J. Org. Chem. 1983, 49, 4674–4682. doi:10.1021/jo00198a018
- ^ 후, L.; 류, B.; 유, C.4면체 레트2000, 41, 4281. doi:10.1016/S0040-4039(00)00626-2
- ^ 홀튼, R. A. 외"첫 번째 총합. 2. C와 D링의 완성."J. Am. Chem. Soc. 1994, 116, 1599–1600. doi:10.1021/ja00083a067
- ^ 넬슨, T. D.; R. D. "실릴 에테르 선택적 박멸"합성 1996, 1031–1069. doi:10.1055/s-1996-4350
- ^ R. D. 크라우치 "bis-silyl 에테르를 선별적으로 단단백분해"4면체 2004, 60, 5833–5871. doi:10.1016/j.tet.2004.04.042
- ^ Higashibayashi, S.; Shinko, K.; Ishizu, T.; Hashimoto, K.; Shirahama, H.; Nakata, M. "Selective deprotection of t-butyldiphenylsilyl ethers in the presence of t-butyldimethylsilyl ethers by tetrabutylammonium fluoride, acetic acid, and water."Synlett 2000, 1306–1308. doi:10.1055/s-2000-7158




