T관절
T-tubule| T관절 | |
|---|---|
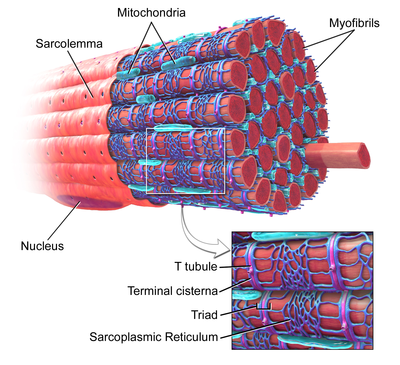 이미지를 확대하여 라벨이 표시된 T 관이 있는 골격 근육 섬유. | |
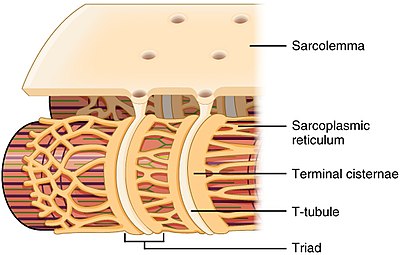 T관 구조와 골격근의 사코플라스믹 레티쿨룸과의 관계 | |
| 세부 사항 | |
| 의 일부 | 골격과 심장 근육 세포의 세포막. |
| 식별자 | |
| 라틴어 | 튜불루스 트랜스퍼스 |
| TH | H2.00.05.2.01018, H2.00.05.2.02013 |
| 해부학적 용어 | |
T관(T-tubulle)은 골격과 심장 근육 세포의 중앙으로 침투하는 세포막을 확장한 것이다.T관에는 이온 채널, 전달체, 펌프가 다량 함유된 막이 있어 작용 전위를 세포로 빠르게 전달하고 세포 칼슘 농도를 조절하는 데도 중요한 역할을 한다.
이러한 메커니즘을 통해 T관(T-tubulle)은 세포 전체에서 사코플라스믹 레티쿨럼에서 칼슘 방출량을 동기화함으로써 심장 근육 세포가 더 강력하게 수축할 수 있게 한다.[1]T관절 구조와 기능은 질병뿐만 아니라 [2]심장근육 수축에 의해 박동수로 영향을 받아 심부전과 부정맥에 잠재적으로 기여할 수 있다.이러한 구조물은 1897년에 처음 발견되었지만, T관부 생물학에 대한 연구는 현재 진행 중이다.
구조
T관(T-tubule)은 골격이나 심장근육세포의 표면막이나 사코렐레마(sarcolema)와 동일한 인광 빌리버로 형성된 관이다.[1]그것들은 세포 내에서 깊이 이동하기 전에 한쪽 끝에서 사르코일렘마와 직접 연결되며, 사르코일렘마와 수직(횡단) 및 평행(축간)을 이루는 관절로 된 네트워크를 형성한다.[1]이러한 복잡한 방향 때문에 T-tubulle을 횡축관계라고 부르는 경우도 있다.[3]T관의 내부나 내강(Lumen)은 세포 표면에 열려 있는데, 이는 T튜브가 세포 주위를 둘러싸고 있는 용액(세포외액)과 동일한 성분을 함유한 액체로 채워져 있다는 것을 의미한다.수동식 연결관일 뿐이 아니라 L형 칼슘 통로, 나트륨-칼슘 교환기, ATPAS, 베타 아드레노셉터 등 단백질이 박혀 T관을 형성하는 막이 활발하다.[1]
T관절은 심방과 심실심장근육세포(심실성심근세포) 모두에서 발견되는데, 이 세포들은 생후 몇 주 안에 발달한다.[4]그것들은 대부분의 종에서 심실근육세포와 큰 포유류에서 나온 심방근육세포에서 발견된다.[5]심장 근육 세포에서, 다른 종에 걸쳐, T-튜브는 지름이 20에서 450 나노미터 사이이고, 보통 세포 내에 액틴 근막이 고정되는 Z-디스크라고 불리는 지역에 위치한다.[1]심장 내 T관(T-tubule)은 말기 시스테르네라고 불리는 특정 부위의 사코플라스믹 레티쿨룸으로 알려진 세포내 칼슘 저장소와 밀접하게 관련되어 있다.T-튜브와 단자 시스터의 연관성을 디아드라고 한다.[6]
골격근세포에서 T관절은 심장근육세포에 비해 3~4배 좁고 지름이 20~40nm 정도 된다.[1]이들은 일반적으로 미오신 스트립의 양쪽에 위치하며, A 밴드와 I 밴드 사이의 오버랩(A-I 연결부) 접합부에 위치한다.[7]골격근의 T관절은 삼두근으로 알려진 두 개의 말단 시스테르네와 연관되어 있다.[1][8]
규제 기관
T관 체계의 모양은 다양한 단백질에 의해 생산되고 유지된다.단백질 앰프히신-2는 유전자 BIN1에 의해 인코딩되며 T관 구조를 형성하고 T관막 내에 적절한 단백질(특히 L형 칼슘 통로)이 위치하도록 하는 역할을 담당한다.[9]Junctophilin-2는 유전자 JPH2에 의해 암호화되며, T관막과 사코플라스믹 레티쿨룸 사이의 접합부를 형성하는데 도움을 주며, 이는 흥분-연락 커플링에 필수적이다.[6]텔레토닌으로 알려진 티틴 캡핑 단백질은 TCAP 유전자에 의해 암호화되어 T관 발달에 도움을 주며 근육이 자라면서 보이는 T관 증대의 원인이 될 가능성이 있다.[6]
함수
호기-연축 커플링
T-튜브는 셀의 전기적 흥분에서 후속 수축까지 체인에서 중요한 연결고리다.근육의 수축이 필요할 때, 신경이나 인접한 근육 세포로부터의 자극은 작용 전위로 알려진 세포막을 가로질러 전하 입자의 특징적인 흐름을 일으킨다.안면에서는 외측에 비해 막의 내면에 양전하 입자가 적으며, 막은 극성을 띠는 것으로 기술하고 있다.작용 전위 동안 양전하 입자(대부분 나트륨과 칼슘 이온)가 외부에서 내부로 막 위를 가로질러 흐른다.이것은 전하 입자의 정상적인 불균형을 역전시켜 탈분극화라고 한다.막의 한 영역은 인접한 지역을 탈극화시키고, 그 결과 발생하는 탈극화의 파동은 세포막을 따라 확산된다.[10]칼륨 이온이 세포 안쪽에서 바깥쪽으로 다시 막막을 가로질러 흐르면서 막의 양극화가 복원된다.
심장근육세포에서는 작용전위가 T관막을 통과할 때 T관막에서 L형 칼슘 채널을 활성화한다.L형 칼슘 채널의 활성화로 칼슘이 세포 안으로 들어갈 수 있다.T관에는 나머지 사르코레마보다 L형 칼슘 채널의 농도가 높아 세포에 들어가는 칼슘의 대부분이 T관을 통해 발생한다.[11]이 칼슘은 세포의 내부 칼슘 저장소인 사코플라스믹 레티쿨룸에 위치한 라이아노딘 수용체라고 알려진 수용체에 결합되어 활성화된다.라이아노딘 수용체가 활성화되면 사코플라즘 망막에서 칼슘이 분비되어 근육세포가 수축하게 된다.[12]그러나 골격근 세포에서는 L형 칼슘 채널이 사코플라즘 망막의 라이아노딘 수용체에 직접 부착되어 칼슘의 유입 없이도 라이오딘 수용체를 직접 활성화할 수 있다.[13]
T관의 중요성은 L형 칼슘 채널의 농도 때문만이 아니라 세포 내 칼슘 방출을 동기화하는 능력에도 있다.T관망을 따라 작용전위가 빠르게 확산되어 모든 L형 칼슘 채널이 거의 동시에 활성화된다.T-tubulle이 세포 전체의 모든 부위에서 사르코플라스믹 레티쿨럼에 매우 가까이 다가오기 때문에, 칼슘은 세포 전체를 가로지르는 사르코플라스믹 레티쿨룸에서 동시에 방출될 수 있다.칼슘 방출의 이러한 동기화는 근육 세포가 더 강하게 수축할 수 있게 한다.[14]평활근 세포나 병든 심장근육세포, T관이 인위적으로 제거된 근육세포 등 T관이 부족한 세포에서는 사르코일레마에서 들어가는 칼슘이 세포 전체로 점차 확산되어야 하며, 칼슘의 파동으로 힘줄기가 덜한 수축으로 이어지는 만큼 훨씬 느리게 라이아노딘 수용체를 활성화시켜야 한다.[14]
T-tubulle은 흥분-연축 커플링을 위한 1차 위치인 만큼 이온 채널과 이 과정에 관여하는 단백질이 여기에 집중되어 있으며, 나머지 사르코레마보다 T-tubulle 멤브레인 내에 위치한 L형 칼슘 채널이 3배나 많다.나아가 베타 아드레노셉터도 T관막에 고도로 농축되어 있으며,[15] 그 자극으로 사코플라스믹 레티쿨럼에서 칼슘의 방출량이 증가한다.[16]
칼슘조절
T관주 내 공간은 셀을 둘러싸고 있는 공간(세포외 공간)과 연속되므로 둘 사이의 이온 농도는 매우 유사하다.그러나 T관내 이온의 중요성(특히 심장근육의 칼슘) 때문에 이러한 농도가 비교적 일정하게 유지되는 것이 매우 중요하다.T-튜브는 매우 얇기 때문에, 그들은 이온을 본질적으로 가둔다.이것은 세포의 다른 곳에 있는 이온 농도와 상관없이, T관에는 여전히 근육수축을 허용하기에 충분한 칼슘 이온이 있기 때문에 중요하다.따라서 세포 밖의 칼슘 농도가 떨어져도(고칼슘혈증) T관내 칼슘 농도는 비교적 일정하게 유지돼 심장수축이 지속될 수 있다.[6]
T관(T-tubulle)이 세포에 칼슘이 침투하는 장소일 뿐만 아니라 칼슘 제거의 장소이기도 하다.이것은 세포 내의 칼슘 수준이 작은 영역(즉, T관절과 국소 조절로 알려진 사코플라스믹 레티쿨룸 사이)에서 엄격하게 조절될 수 있다는 것을 의미하기 때문에 중요하다.[17]나트륨-칼슘 교환기와 사르코레말 ATPase와 같은 단백질은 주로 T관막에 위치한다.[6]나트륨-칼슘 교환기는 세 개의 나트륨 이온과 교환하여 하나의 칼슘 이온을 세포에서 수동적으로 제거한다.따라서 수동적 과정으로서 이온의 상대적 농도와 세포막을 가로지르는 전압의 조합에 따라 칼슘이 세포 안으로 또는 세포 밖으로 흐르도록 할 수 있다(전기화학 구배).[10]ATPase 칼슘은 아데노신 삼인산(ATP)에서 파생된 에너지를 이용해 세포에서 칼슘을 적극적으로 제거한다.[10]
디터볼루션
T-tubule 기능을 연구하기 위해 T-tubule을 디터블링(detubulation)이라는 기법을 사용하여 표면 막에서 인위적으로 분리할 수 있다.세포를 둘러싸고[18] 있는 세포외 용액에 글리세롤이나 포름아미드[14](각각 골격 및 심장 근육용)와 같은 화학물질을 첨가할 수 있다.이러한 작용제는 세포외 용액의 삼몰래성을 증가시켜 세포가 위축되게 한다.이들 작용제가 철수하면 세포는 빠르게 팽창해 정상 크기로 돌아온다.이러한 세포의 수축과 재팽창으로 T관막이 표면 막에서 분리된다.[19]또는 세포외 용액의 삼몰래성을 감소시킬 수 있으며, 예를 들어 저온성 식염수를 사용하여 일시적인 세포 붓기를 유발할 수 있다.세포외 용액을 정상 삼몰래로 되돌리면 세포가 이전 크기로 되돌아가 다시 배란으로 이어진다.[20]
역사
후에 T관(T-tubule)으로 알려지게 된 세포구조의 아이디어는 1881년에 처음 제안되었다.변형된 근육 세포를 자극하는 것과 그 이후의 수축 사이의 아주 짧은 시차는 너무 짧아서 사코플레마사와 사코플라스믹 레티쿨럼 사이의 거리를 이동하는 신호 전달 화학물질에 의해 야기되었다.따라서 세포에 도달하는 막의 주머니가 관찰된 매우 빠른 수축의 시작을 설명할 수 있을 것이라고 제안되었다.[21][22]인디아 잉크로 주입된 심장근육을 연구하기 위해 가벼운 현미경을 사용하여 최초의 T관절(T관절)이 보이기까지 1897년까지 걸렸다.영상 기술은 발전하였고, 전송 전자 현미경의 출현과 함께 T관 구조가 더욱[23] 뚜렷해짐으로써 1971년 T관망의 종적 구성요소에 대한 설명으로 이어졌다.[24]1990년대와 2000년대에는 공초점 현미경 검사로 T관망의 3차원 재구성 및 T관 크기와 분포의 정량화가 가능했으며,[25] 칼슘 스파크가 발견되면서 T관망과 칼슘 방출 사이의 중요한 관계가 풀리기 시작했다.[26]초기 작업이 심실심근육과 골격근육에 초점을 맞춘 반면, 2009년에는 심방심근육세포의 광범위한 T관망(T-tubule)이 관찰되었다.[27]현재 진행 중인 연구는 T관 구조의 조절과 어떻게 T관이 심혈관 질환의 영향을 받고 기여하는지에 초점을 맞추고 있다.[28]
임상적 유의성
T관의 구조는 질병에 의해 변형될 수 있으며, 심장 내에서는 심장 근육의 약함이나 비정상적인 심장 박동에 기여할 수 있다.질병에서 볼 수 있는 변화는 T관절의 완전한 손실에서부터 방향이나 분기 패턴의 보다 미묘한 변화까지 다양하다.[29]T관도 심근경색에 따라 손실되거나 교란될 [29]수 있으며, 심부전 환자의 심실에서도 교란되어 수축력을 감소시키고 잠재적으로 회복의 기회를 감소시키는 데 기여한다.[30]또한 심부전은 심방 심근 세포로부터 T관절의 거의 완전한 상실을 야기하여 심방 수축성을 감소시키고 잠재적으로 심방세동에 기여할 수 있다.[27]
T관의 구조적 변화는 L형 칼슘 채널을 라이언오딘 수용체로부터 멀어지게 할 수 있다.이것은 세포 내의 칼슘 수치가 상승하는 데 걸리는 시간을 증가시켜 수축과 부정맥이 약해지는 결과를 가져올 수 있다.[6][27]다만 인터벌 트레이닝을 통해 T관 리모델링이 역전될 수 있다는 의견도 있어 흐트러진 T관 구조는 영구적이지 않을 수 있다.[6]
참고 항목
참조
- ^ a b c d e f g Hong, TingTing; Shaw, Robin M. (2017-01-01). "Cardiac T-Tubule Microanatomy and Function". Physiological Reviews. 97 (1): 227–252. doi:10.1152/physrev.00037.2015. ISSN 0031-9333. PMC 6151489. PMID 27881552.
- ^ Rog-Zielinska EA, et al. (2021). "Beat-by-Beat Cardiomyocyte T-Tubule Deformation Drives Tubular Content Exchange". Circ. Res. 128 (2): 203–215. doi:10.1161/CIRCRESAHA.120.317266. PMC 7834912. PMID 33228470.
- ^ Ferrantini, Cecilia; Coppini, Raffaele; Sacconi, Leonardo; Tosi, Benedetta; Zhang, Mei Luo; Wang, Guo Liang; Vries, Ewout de; Hoppenbrouwers, Ernst; Pavone, Francesco (2014-06-01). "Impact of detubulation on force and kinetics of cardiac muscle contraction". The Journal of General Physiology. 143 (6): 783–797. doi:10.1085/jgp.201311125. PMC 4035744. PMID 24863933.
- ^ Haddock, Peter S.; Coetzee, William A.; Cho, Emily; Porter, Lisa; Katoh, Hideki; Bers, Donald M.; Jafri, M. Saleet; Artman, Michael (1999-09-03). "Subcellular [Ca2+]i Gradients During Excitation-Contraction Coupling in Newborn Rabbit Ventricular Myocytes". Circulation Research. 85 (5): 415–427. doi:10.1161/01.RES.85.5.415. ISSN 0009-7330. PMID 10473671.
- ^ Richards, M. A.; Clarke, J. D.; Saravanan, P.; Voigt, N.; Dobrev, D.; Eisner, D. A.; Trafford, A. W.; Dibb, K. M. (November 2011). "Transverse tubules are a common feature in large mammalian atrial myocytes including human". American Journal of Physiology. Heart and Circulatory Physiology. 301 (5): H1996–2005. doi:10.1152/ajpheart.00284.2011. ISSN 1522-1539. PMC 3213978. PMID 21841013.
- ^ a b c d e f g Ibrahim, M.; Gorelik, J.; Yacoub, M. H.; Terracciano, C. M. (2011-09-22). "The structure and function of cardiac t-tubules in health and disease". Proceedings of the Royal Society B: Biological Sciences. 278 (1719): 2714–2723. doi:10.1098/rspb.2011.0624. PMC 3145195. PMID 21697171.
- ^ di Fiore, Mariano SH; Eroschenko, Victor P (2008). Di Fiore's Atlas of histology: with functional correlations. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. p. 124. ISBN 0-7817-7057-2.
- ^ "4. Calcium reuptake and relaxation". www.bristol.ac.uk. Retrieved 2017-02-21.
- ^ Caldwell, Jessica L.; Smith, Charlotte E. R.; Taylor, Rebecca F.; Kitmitto, Ashraf; Eisner, David A.; Dibb, Katharine M.; Trafford, Andrew W. (2014-12-05). "Dependence of cardiac transverse tubules on the BAR domain protein amphiphysin II (BIN-1)". Circulation Research. 115 (12): 986–996. doi:10.1161/CIRCRESAHA.116.303448. ISSN 1524-4571. PMC 4274343. PMID 25332206.
- ^ a b c M., Bers, D. (2001). Excitation-contraction coupling and cardiac contractile force (2nd ed.). Dordrecht: Kluwer Academic Publishers. ISBN 9780792371588. OCLC 47659382.
- ^ Scriven, D. R.; Dan, P.; Moore, E. D. (November 2000). "Distribution of proteins implicated in excitation-contraction coupling in rat ventricular myocytes". Biophysical Journal. 79 (5): 2682–2691. Bibcode:2000BpJ....79.2682S. doi:10.1016/S0006-3495(00)76506-4. ISSN 0006-3495. PMC 1301148. PMID 11053140.
- ^ Bers, Donald M. (2002-01-10). "Cardiac excitation-contraction coupling". Nature. 415 (6868): 198–205. Bibcode:2002Natur.415..198B. doi:10.1038/415198a. ISSN 0028-0836. PMID 11805843. S2CID 4337201.
- ^ Rebbeck, Robyn T.; Karunasekara, Yamuna; Board, Philip G.; Beard, Nicole A.; Casarotto, Marco G.; Dulhunty, Angela F. (2014-03-01). "Skeletal muscle excitation-contraction coupling: who are the dancing partners?". The International Journal of Biochemistry & Cell Biology. 48: 28–38. doi:10.1016/j.biocel.2013.12.001. ISSN 1878-5875. PMID 24374102.
- ^ a b c Ferrantini, Cecilia; Coppini, Raffaele; Sacconi, Leonardo; Tosi, Benedetta; Zhang, Mei Luo; Wang, Guo Liang; de Vries, Ewout; Hoppenbrouwers, Ernst; Pavone, Francesco (2014-06-01). "Impact of detubulation on force and kinetics of cardiac muscle contraction". The Journal of General Physiology. 143 (6): 783–797. doi:10.1085/jgp.201311125. ISSN 1540-7748. PMC 4035744. PMID 24863933.
- ^ Laflamme, M. A.; Becker, P. L. (1999-11-01). "G(s) and adenylyl cyclase in transverse tubules of heart: implications for cAMP-dependent signaling". The American Journal of Physiology. 277 (5 Pt 2): H1841–1848. doi:10.1152/ajpheart.1999.277.5.H1841. ISSN 0002-9513. PMID 10564138.
- ^ Bers, Donald M. (2006-05-15). "Cardiac ryanodine receptor phosphorylation: target sites and functional consequences". Biochemical Journal. 396 (Pt 1): e1–3. doi:10.1042/BJ20060377. ISSN 0264-6021. PMC 1450001. PMID 16626281.
- ^ Hinch, R, Greenstein, J.L., Tanskanen, A.J., Shu, L., Winslow, R.L.(2004) '심실심실 근세포에서 칼슘 유도 칼슘 방출의 단순화된 국소 제어 모델' 87(6)
- ^ Fraser, James A.; Skepper, Jeremy N.; Hockaday, Austin R.; Huang1, Christopher L.-H. (1998-08-01). "The tubular vacuolation process in amphibian skeletal muscle". Journal of Muscle Research & Cell Motility. 19 (6): 613–629. doi:10.1023/A:1005325013355. ISSN 0142-4319. PMID 9742446. S2CID 12312117.
- ^ Kawai M, Hussain M, Orchard CH (1999). "Excitation-contraction coupling in rat ventricular myocytes after formamide-induced detubulation". Am J Physiol. 277 (2): H603-9. doi:10.1152/ajpheart.1999.277.2.H603. PMID 10444485.
- ^ Moench, I.; Meekhof, K. E.; Cheng, L. F.; Lopatin, A. N. (July 2013). "Resolution of hyposmotic stress in isolated mouse ventricular myocytes causes sealing of t-tubules". Experimental Physiology. 98 (7): 1164–1177. doi:10.1113/expphysiol.2013.072470. ISSN 1469-445X. PMC 3746342. PMID 23585327.
- ^ Huxley, A. F. (1971-06-15). "The activation of striated muscle and its mechanical response". Proceedings of the Royal Society of London. Series B, Biological Sciences. 178 (1050): 1–27. doi:10.1098/rspb.1971.0049. ISSN 0950-1193. PMID 4397265. S2CID 30218942.
- ^ Hill, A. V. (October 1949). "The abrupt transition from rest to activity in muscle". Proceedings of the Royal Society of London. Series B, Biological Sciences. 136 (884): 399–420. Bibcode:1949RSPSB.136..399H. doi:10.1098/rspb.1949.0033. ISSN 0950-1193. PMID 18143369. S2CID 11863605.
- ^ Lindner, E. (1957). "[Submicroscopic morphology of the cardiac muscle]". Zeitschrift für Zellforschung und Mikroskopische Anatomie. 45 (6): 702–746. ISSN 0340-0336. PMID 13456982.
- ^ Sperelakis, N.; Rubio, R. (August 1971). "An orderly lattice of axial tubules which interconnect adjacent transverse tubules in guinea-pig ventricular myocardium". Journal of Molecular and Cellular Cardiology. 2 (3): 211–220. doi:10.1016/0022-2828(71)90054-x. ISSN 0022-2828. PMID 5117216.
- ^ Savio-Galimberti, Eleonora; Frank, Joy; Inoue, Masashi; Goldhaber, Joshua I.; Cannell, Mark B.; Bridge, John H. B.; Sachse, Frank B. (August 2008). "Novel features of the rabbit transverse tubular system revealed by quantitative analysis of three-dimensional reconstructions from confocal images". Biophysical Journal. 95 (4): 2053–2062. Bibcode:2008BpJ....95.2053S. doi:10.1529/biophysj.108.130617. ISSN 1542-0086. PMC 2483780. PMID 18487298.
- ^ Cheng, H.; Lederer, W. J.; Cannell, M. B. (1993-10-29). "Calcium sparks: elementary events underlying excitation-contraction coupling in heart muscle". Science. 262 (5134): 740–744. Bibcode:1993Sci...262..740C. doi:10.1126/science.8235594. ISSN 0036-8075. PMID 8235594.
- ^ a b c Dibb, Katharine M.; Clarke, Jessica D.; Horn, Margaux A.; Richards, Mark A.; Graham, Helen K.; Eisner, David A.; Trafford, Andrew W. (September 2009). "Characterization of an extensive transverse tubular network in sheep atrial myocytes and its depletion in heart failure". Circulation: Heart Failure. 2 (5): 482–489. doi:10.1161/CIRCHEARTFAILURE.109.852228. ISSN 1941-3297. PMID 19808379.
- ^ Eisner, David A.; Caldwell, Jessica L.; Kistamás, Kornél; Trafford, Andrew W. (2017-07-07). "Calcium and Excitation-Contraction Coupling in the Heart". Circulation Research. 121 (2): 181–195. doi:10.1161/CIRCRESAHA.117.310230. ISSN 1524-4571. PMC 5497788. PMID 28684623.
- ^ a b Pinali, Christian; Malik, Nadim; Davenport, J. Bernard; Allan, Laurence J.; Murfitt, Lucy; Iqbal, Mohammad M.; Boyett, Mark R.; Wright, Elizabeth J.; Walker, Rachel (2017-05-04). "Post-Myocardial Infarction T-tubules Form Enlarged Branched Structures With Dysregulation of Junctophilin-2 and Bridging Integrator 1 (BIN-1)". Journal of the American Heart Association. 6 (5). doi:10.1161/JAHA.116.004834. ISSN 2047-9980. PMC 5524063. PMID 28473402.
- ^ Seidel, Thomas; Navankasattusas, Sutip; Ahmad, Azmi; Diakos, Nikolaos A.; Xu, Weining David; Tristani-Firouzi, Martin; Bonios, Michael J.; Taleb, Iosif; Li, Dean Y. (2017-04-25). "Sheet-Like Remodeling of the Transverse Tubular System in Human Heart Failure Impairs Excitation-Contraction Coupling and Functional Recovery by Mechanical Unloading". Circulation. 135 (17): 1632–1645. doi:10.1161/CIRCULATIONAHA.116.024470. ISSN 1524-4539. PMC 5404964. PMID 28073805.


