나트륨-칼륨 펌프
Sodium–potassium pump| Na⁺/K⁺-ATPase 펌프 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 나트륨-칼륨 펌프, E2-Pi 상태.지질 이중층의 계산된 탄화수소 경계는 파란색(세포 내) 및 빨간색(세포 외) 평면으로 표시됩니다. | |||||||||
| 식별자 | |||||||||
| 에코. | 7.2.2.13 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 항목 | ||||||||
| ExPASy | 니스 짐 뷰 | ||||||||
| KEGG | KEGG 항목 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| PRIAM | 옆모습 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||


나트륨-칼륨 펌프() 또는 나트륨-칼륨 아데노신 삼인산가수분해효소()는 모든 동물 세포의 세포막에서 발견되는 효소(전자막 통과 ATPase)입니다.그것은 세포 생리학에서 여러 가지 기능을 수행합니다.
Na⁺/K⁺-ATPase 효소는 활성(즉, ATP의 에너지를 사용함)입니다.펌프가 사용하는 모든 ATP 분자에 대해 세 개의 나트륨 이온이 내보내고 두 개의 칼륨 이온이 가져옵니다.[1]따라서 펌프 사이클당 한 개의 양전하가 순유출됩니다.순효과는 세포내 농도의 5배인 나트륨 이온의 세포외 농도와 세포외 [1]농도의 30배인 칼륨 이온의 세포내 농도입니다.
나트륨-칼륨 펌프는 1997년 노벨상을 수상한 덴마크 과학자 옌스 크리스티안 스쿠에 의해 1957년에 발견되었습니다.그것의 발견은 어떻게 이온이 세포 안으로 들어가고 나오는지 이해하는 데 중요한 진전을 보여주었고, 그것은 자극에 반응하고 충동을 전달하기 위해 이 펌프에 의존하는 신경 세포와 같은 흥분하기 쉬운 세포에 특별한 의미를 가지고 있습니다.
모든 포유류는 네 가지 다른 나트륨 펌프 하위 유형, 즉 등각형을 가지고 있습니다.각각은 고유한 특성과 조직 [2]표현 패턴을 가지고 있습니다.이 효소는 P형 ATPase 계열에 속합니다.
기능.
Na⁺/K⁺-ATPase는 휴식 전위를 유지하고 운송에 영향을 미치며 세포 부피를 [3]조절하는 데 도움이 됩니다.또한 MAPK 경로, 활성산소종(ROS) 및 세포 내 칼슘을 조절하는 신호 변환기/통합기로 기능합니다.사실, 모든 세포는 필요한 세포질 Na 및 K [4]농도를 유지하기 위해 그들이 생산하는 ATP의 큰 부분(일반적으로 신경 세포에서 30%와 최대 70%)을 소비합니다.뉴런의 경우 Na⁺/K⁺-ATPase가 세포 에너지 [5]지출의 최대 3/4을 담당할 수 있습니다.많은 유형의 조직에서 Na⁺/K⁺-AT 단계에 의한 ATP 소비는 해당과정과 관련이 있습니다.이것은 적혈구에서 처음 발견되었지만(슈라이어,[6] 1966),[7] 나중에 신장 세포, 혈관을 둘러싼 평활근 및 심장 푸르키네 [8]세포에서 입증되었습니다.최근 해당과정은 골격근에서 Na⁺/K⁺-ATPase에 특히 중요한 것으로 나타났는데, 여기서 글리코젠 분해(해당과정의 기질)의 억제는 Na⁺/K⁺-ATPase 활성을 감소시키고 힘 생산을 [9][10][11]감소시킵니다.
휴지 전위

세포막 전위를 유지하기 위해, 세포는 세포 내에서 낮은 농도의 나트륨 이온과 높은 수준의 칼륨 이온을 유지합니다.나트륨-칼륨 펌프 메커니즘은 3개의 나트륨 이온을 밖으로 이동시키고 2개의 칼륨 이온을 안으로 이동시켜 세포 내 공간에서 하나의 양전하 운반체를 제거합니다(자세한 내용은 메커니즘 참조).또한 막에는 칼륨에 대한 단락 채널(고 K 투과성 이온 채널)이 있으므로 플라즈마 막을 가로지르는 전압은 칼륨의 네른스트 전위에 가깝습니다.
반전 전위
K⁺와 Na⁺ 이온이 모두 동일한 전하를 가지더라도 외부 및/또는 내부 농도 모두에 대해 매우 다른 평형 전위를 가질 수 있습니다.나트륨-칼륨 펌프는 세포 내부와 외부 모두에 대해 Na⁺과 K⁺의 상대적인 농도로 비평형 상태로 이동합니다.예를 들어, 세포질의 K⁺ 농도는 100 mM인 반면, Na⁺ 농도는 10 mM입니다.반면 세포외 공간에서 K⁺의 농도는 5mM인 반면 Na⁺의 농도는 150mM입니다.
운송
세포에서 나트륨 이온을 내보내는 것은 막 수송 단백질과 같은 몇 가지 2차 활성 수송체에 원동력을 제공합니다. 막 수송 단백질은 나트륨 이온 구배를 사용하여 포도당, 아미노산 및 기타 영양소를 세포로 가져옵니다.
Na⁺-K⁺ 펌프의 또 다른 중요한 작업은 특정 캐리어 프로세스에서 사용되는 Na⁺ 구배를 제공하는 것입니다.예를 들어, 내장에서 나트륨은 Na⁺-K⁺ 펌프를 통해 혈액(간극액) 측의 재흡수 세포 밖으로 운반되는 반면, 재흡수 측에서는 생성된 Na⁺ 기울기를 에너지원으로 사용하여 Na⁺와 포도당을 모두 수입하는데, 이는 단순 확산보다 훨씬 효율적입니다.유사한 과정이 신관 시스템에 위치합니다.
셀 볼륨 조절
Na⁺-K⁺ 펌프가 고장 나면 셀이 부풀어 오를 수 있습니다.세포의 삼투압은 다양한 이온 종과 세포 내의 많은 단백질과 다른 유기 화합물의 농도의 합입니다.이것이 세포 밖의 삼투압보다 높을 때, 물은 삼투압을 통해 세포 안으로 유입됩니다.이것은 세포가 부풀어오르게 하고 용해되게 할 수 있습니다.Na⁺-K⁺ 펌프는 적절한 이온 농도를 유지하는 데 도움이 됩니다.또한, 셀이 부풀기 시작하면 펌프가 [12]민감한 Na⁺-K⁺의 내부 농도를 변화시키기 때문에 Na⁺-K⁺ 펌프가 자동으로 활성화됩니다.
신호 변환기로 작동
지난[when?] 10년 동안, 많은 독립적인 실험실은 이 막 단백질이 고전적인 이온 수송 외에도 단백질 티로신 인산화의 조절을 통해 세포 외 우아베인 결합 신호 전달을 세포로 전달할 수 있다는 것을 증명했습니다.예를 들어, 한 연구는 활성 [13]상태와 진정 상태를 비교하여 족근과 육지 달팽이 오탈라 락테아의 간췌장에서 Na+/K ATPase의+ 기능을 조사했습니다.그들은 가역적 인산화가 O. 락테아를 추정할 때 이화 경로에 의한 ATP 생성 속도와 함께 이 이온 펌프에 의한 ATP 사용을 조정하는 동일한 수단을 제어할 수 있다고 결론지었습니다.와베인 유발 단백질 인산화 이벤트를 통한 다운스트림 신호는 마이토겐 활성 단백질 키네이스(MAPK) 신호 캐스케이드, 미토콘드리아 활성 산소 종(ROS) 생산을 포함합니다.다른 세포 내 [14]구획에서 포스포리파아제 C(PLC)와 이노시톨 삼인산(IP3R) 수용체의 활성화뿐만 아니라.
단백질-단백질 상호작용은 Na⁺-K⁺ 펌프 매개 신호 전달에서 매우 중요한 역할을 합니다.예를 들어 Na⁺-K⁺ 펌프는 비수용체 티로신 키네이스인 Src와 직접 상호작용하여 신호 수용체 [15]복합체를 형성합니다.Src는 처음에 Na⁺-K⁺ 펌프에 의해 억제됩니다.그러나 후속적인 우아베인 결합 시, Srckinase 도메인이 해제된 후 활성화됩니다.이 시나리오를 바탕으로 Na⁺-K⁺ 펌프에서 파생된 펩타이드 Src 억제제인 NaKtide가 기능적 ouabain-Na⁺-K⁺ 펌프 매개 신호 [16]전달로 개발되었습니다.Na⁺-K⁺ 펌프는 또한 안키린,[17] IP3R, PI3K, PLC 감마1 및 코필린과 상호 작용합니다.
뉴런 활동 상태 제어
Na⁺-K⁺ 펌프는 소뇌 푸르킨제 뉴런,[18] 부속 후각 전구 승모 세포[19] 및 아마도 다른 뉴런 [20]유형의 고유 활동 모드를 제어하고 설정하는 것으로 나타났습니다.이것은 펌프가 단순히 이온 그레이디언트를 위한 항상성, "집을 유지하는" 분자가 아니라 소뇌와 [21]뇌의 계산 요소일 수 있음을 시사합니다.실제로 Na⁺-K⁺ 펌프의 돌연변이는 소뇌 [22]계산의 병리학임을 나타내는 증상을 가진 급속한 발병 디스토니아 파킨슨병을 유발합니다.게다가, 살아있는 쥐의 소뇌에서 Na⁺-K⁺ 펌프의 오아베인 블록은 그것이 무감각과 디스토니아를 [23]보여주는 결과를 낳습니다.알코올은 소뇌에서 나트륨-칼륨 펌프를 억제하며, 이것이 소뇌 계산과 신체 [24][25]조정을 손상시킬 가능성이 높습니다.인간 뇌의 골수화된 축삭에 Na⁺-K⁺ 펌프의 분포는 이전에 [26]생각했던 것처럼 노달 축삭 내에 있지 않고 내막 축삭을 따라 있는 것으로 입증되었습니다.Na⁺-K⁺ 펌프의 기능 장애는 간질과 뇌 [27]기형을 포함한 다양한 질병과 연관되어 있습니다.
메커니즘
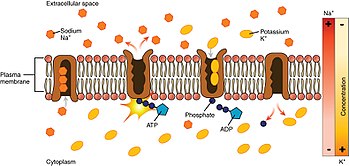
셀 내부에서 시작하는 프로세스를 살펴보면 다음과 같습니다.
- 펌프는 K-이온보다 Na-이온에 대한 친화력이 높기 때문에 ATP를 결합한 후 3개의 세포 내 [3]Na-이온을 결합합니다.
- ATP는 가수분해되어 고도로 보존된 아스파르트산 잔기에서 펌프의 인산화를 유도하고 이후 ADP의 방출을 유도합니다.이 프로세스는 펌프의 형상 변화로 이어집니다.
- 구조 변화는 Na⁺ 이온을 세포 외 영역에 노출시킵니다.펌프의 인산화된 형태는 Na⁺ 이온에 대한 친화력이 낮기 때문에 방출됩니다. 대조적으로 K⁺ 이온에 대한 친화력이 높습니다.
- 펌프는 2개의 세포외 Kγ 이온을 결합하여 펌프의 탈인산화를 유도하여 이전의 형태 상태로 되돌리고, 따라서 Kγ 이온을 세포로 방출합니다.
- 펌프의 비인산화 형태는 Na⁺ 이온에 대한 친화력이 더 높습니다.ATP가 결합하고, 그 과정은 다시 시작됩니다.
규정
내인성
Na⁺/K⁺-AT 단계는 [28]cAMP에 의해 상향 조절됩니다.따라서, cAMP 증가를 유발하는 물질은 Na⁺/K⁺-ATase를 상향 조절합니다.여기에는 G-결합s GPCR의 리간드가 포함됩니다.대조적으로, cAMP 감소를 유발하는 물질은 Na⁺/K⁺-ATase를 다운조절합니다.여기에는 G-결합i GPCR의 리간드가 포함됩니다.참고: 초기 연구에서는 반대 효과를 나타냈지만, 나중에 추가적인 복잡한 [citation needed]요인으로 인해 부정확한 것으로 밝혀졌습니다.
Na⁺/K⁺-ATPase는 IP6K1에 의해 생성된 세포 내 신호 전달 분자인 이노시톨 피로인산 5-InsP7에 의해 내인성으로 조절되며, 이는 PI3K p85α의 자가 억제 도메인을 완화하여 세포 내 분열 및 [29]분해를 촉진합니다.
Na⁺/K⁺-ATPase는 또한 가역적인 인산화에 의해 조절됩니다.연구에 따르면, 동물을 추정할 때 Na⁺/K⁺-ATPase는 인산화되고 낮은 활성 형태입니다.Na⁺/K⁺-ATPase의 탈인산화는 높은 활성 [30]형태로 복구할 수 있습니다.
외인성
Na⁺/K⁺-ATPase는 약물을 외래로 투여함으로써 약리학적으로 수정될 수 있습니다.그것의 발현은 또한 갑상선 [30][31]호르몬인 트라이아이오도티로닌과 같은 호르몬을 통해 수정될 수 있습니다.
예를 들어, 심장 세포막에서 발견되는 Na⁺/K⁺-ATPase는 수축력을 증가시켜 심장 성능을 향상시키는 데 사용되는 심장 글리코사이드(예: 디곡신 및 와베인)의 중요한 표적입니다.
근육 수축은 근육 세포의 비소플라스틱망막에서 Ca²γ가 방출되어 발생하는 세포 내 Ca²γ 농도보다 100배에서 10-10,000배 더 높은 농도에 의존합니다.근육 수축 직후, 세포 내 Ca²⁺는 혈장막에 있는 운반 효소와 석소체 그물망에 있는 칼슘 펌프에 의해 빠르게 정상 농도로 돌아와 근육을 이완시킵니다.
Blaustein-hypothesis에 [32]따르면, 이 운반 효소(Na⁺/Ca²⁺ exchanger, NCX)는 Na⁺-K⁺ 펌프에 의해 생성된 Na 구배를 사용하여 세포 내 공간에서 Ca²를 제거하고, 따라서 Na⁺-K⁺ 펌프를 느리게 함으로써 근육에서 Ca² 수준이 영구적으로 상승합니다.이는 디곡신과 같은 심장 글리코사이드의 장기적인 이노트로픽 효과의 메커니즘일 수 있습니다.이 가설의 문제는 디지탈리스의 약리학적 농도에서 Na/K-ATPase 분자의 5% 미만, 특히 심장 및 동맥 평활근의 α2 등포름d(K = 32nM)이 억제되어 Na⁺의 세포 내 농도에 영향을 줄 정도는 아니라는 것입니다.그러나, 이온 수송을 담당하는 혈장 막에서 Na/K-ATPase의 모집단 외에도, 동굴 내에는 디기탈리스 수용체로 작용하고 [33][34][35][36]EGF 수용체를 자극하는 또 다른 모집단이 있습니다.
약리학적 규제
심장 질환의 경우와 같은 특정 조건에서는 약리학적 방법을 통해 Na⁺/K⁺-ATPase를 억제해야 할 수 있습니다.심장 질환 치료에 일반적으로 사용되는 억제제는 디곡신(심장 글리코사이드)으로, 이는 본질적으로 "인산화된 상태에 있을 때 칼륨을 [37]결합하여 세포 내에서 칼륨을 전달하는 효소의 세포 외 부분에 결합"합니다.심장 질환의 영향을 감소시키는 알파 서브 유닛의 탈인산화가 발생합니다.나트륨 농도가 세포 내에서 증가하기 시작하여 나트륨-칼슘 교환기를 통해 궁극적으로 세포 내 칼슘 농도를 증가시키는 것은 Na⁺/K⁺-ATase의 억제를 통해 이루어집니다.칼슘의 증가된 존재는 수축력을 증가시킵니다.심장이 신체에 필요한 것을 제공할 수 있을 정도로 강하게 펌프질을 하지 않는 환자의 경우, 이 접근법은 일시적으로 이를 극복할 수 있게 합니다.
디스커버리
Na⁺/K⁺-ATPase는 1957년 덴마크 오르후스 대학교 생리학과 조교수로 근무하던 중 옌스 크리스티안 스쿠에 의해 발견되었습니다.그는 그 [38]해에 그의 작품을 출판했습니다.
1997년, 그는 "이온 전달 효소인 Na⁺, K⁺-ATPase"[39]를 최초로 발견한 공로로" 노벨 화학상의 절반을 수상했습니다.
유전자
- 알파: ATP1A1ATP1A1, ATP1A2ATP1A2, ATP1A3ATP1A3, ATP1A4ATP1A4.ATP1A1은 척추동물에서 보편적으로 발현되고, ATP1A3는 신경조직에서 발현됩니다.ATP1A2는 또한 "alpha(+)"로 알려져 있습니다. ATP1A4는 포유류에 특이적입니다.
- 베타: ATP1B1ATP1B1, ATP1B2, ATP1B3ATP1B3, ATP1B4
곤충에서
초필라 melanogaster에서 Na⁺/K⁺-ATPase의 α-하위 [40]단위는 곤충에서 고대의 복제로 인한 Atpα와 JYalpha라는 두 개의 평행선을 가지고 있습니다.Zhen et al.(2012)은 이 평행선을 각각 Atpα1 및 Atpα2로 이름을 변경했습니다.Drosophila에서 Atpα1은 어디에나 있고 고도로 발현되는 반면, Atpα2는 남성 고환에서 가장 고도로 발현되며 남성 생식에 필수적입니다.곤충들은 적어도 두 유전자의 사본을 가지고 있으며, 때때로 복제도 합니다.ATPα2의 낮은 발현은 다른 곤충에서도 발견되었습니다.Atpα1의 복제 및 신기능화는 카르데놀리드 [40][41][42][43][44]및 부파디에놀리드와 같은 심장병 스테로이드 독소에 적응한 곤충에서 관찰되었습니다.카디오톤성 스테로이드에 적응한 곤충들은 전형적으로 많은 아미노산 치환을 가지고 있는데, 대부분의 경우 Atpα1의 첫 번째 세포외 루프에서 카디오톤성 스테로이드 [45][46]억제에 대한 내성을 제공합니다.
참고 항목
레퍼런스
- ^ a b Gagnon KB, Delpire E (2021). "Sodium Transporters in Human Health and Disease (Figure 2)". Frontiers in Physiology. 11: 588664. doi:10.3389/fphys.2020.588664. PMC 7947867. PMID 33716756.
- ^ Clausen MV, Hilbers F, Poulsen H (June 2017). "The Structure and Function of the Na,K-ATPase Isoforms in Health and Disease". Frontiers in Physiology. 8: 371. doi:10.3389/fphys.2017.00371. PMC 5459889. PMID 28634454.
- ^ a b Hall JE, Guyton AC (2006). Textbook of medical physiology. St. Louis, Mo: Elsevier Saunders. ISBN 978-0-7216-0240-0.
- ^ Voet D, Voet JG (December 2010). "Section 20-3: ATP-Driven Active Transport". Biochemistry (4th ed.). John Wiley & Sons. p. 759. ISBN 978-0-470-57095-1.
- ^ Howarth C, Gleeson P, Attwell D (July 2012). "Updated energy budgets for neural computation in the neocortex and cerebellum". Journal of Cerebral Blood Flow and Metabolism. 32 (7): 1222–32. doi:10.1038/jcbfm.2012.35. PMC 3390818. PMID 22434069.
- ^ Sanders MJ, Simon LM, Misfeldt DS (March 1983). "Transepithelial transport in cell culture: bioenergetics of Na-, D-glucose-coupled transport". Journal of Cellular Physiology. 114 (3): 263–6. doi:10.1002/jcp.1041140303. PMID 6833401. S2CID 22543559.
- ^ Lynch RM, Paul RJ (March 1987). "Compartmentation of carbohydrate metabolism in vascular smooth muscle". The American Journal of Physiology. 252 (3 Pt 1): C328-34. doi:10.1152/ajpcell.1987.252.3.c328. PMID 3030131.
- ^ Glitsch HG, Tappe A (January 1993). "The Na+/K+ pump of cardiac Purkinje cells is preferentially fuelled by glycolytic ATP production". Pflügers Archiv. 422 (4): 380–5. doi:10.1007/bf00374294. PMID 8382364. S2CID 25076348.
- ^ Dutka TL, Lamb GD (September 2007). "Na+-K+ pumps in the transverse tubular system of skeletal muscle fibers preferentially use ATP from glycolysis". American Journal of Physiology. Cell Physiology. 293 (3): C967-77. doi:10.1152/ajpcell.00132.2007. PMID 17553934. S2CID 2291836.
- ^ Watanabe D, Wada M (December 2019). "Effects of reduced muscle glycogen on excitation-contraction coupling in rat fast-twitch muscle: a glycogen removal study". Journal of Muscle Research and Cell Motility. 40 (3–4): 353–364. doi:10.1007/s10974-019-09524-y. PMID 31236763. S2CID 195329741.
- ^ Jensen R, Nielsen J, Ørtenblad N (February 2020). "Inhibition of glycogenolysis prolongs action potential repriming period and impairs muscle function in rat skeletal muscle". The Journal of Physiology. 598 (4): 789–803. doi:10.1113/JP278543. PMID 31823376. S2CID 209317559.
- ^ Armstrong CM (May 2003). "The Na/K pump, Cl ion, and osmotic stabilization of cells". Proceedings of the National Academy of Sciences of the United States of America. 100 (10): 6257–62. Bibcode:2003PNAS..100.6257A. doi:10.1073/pnas.0931278100. PMC 156359. PMID 12730376.
- ^ Ramnanan CJ, Storey KB (February 2006). "Suppression of Na+/K+-ATPase activity during estivation in the land snail O. lactea". The Journal of Experimental Biology. 209 (Pt 4): 677–88. doi:10.1242/jeb.02052. PMID 16449562. S2CID 39271006.
- ^ Yuan Z, Cai T, Tian J, Ivanov AV, Giovannucci DR, Xie Z (September 2005). "Na/K-ATPase tethers phospholipase C and IP3 receptor into a calcium-regulatory complex". Molecular Biology of the Cell. 16 (9): 4034–45. doi:10.1091/mbc.E05-04-0295. PMC 1196317. PMID 15975899.
- ^ Tian J, Cai T, Yuan Z, Wang H, Liu L, Haas M, et al. (January 2006). "Binding of Src to Na+/K+-ATPase forms a functional signaling complex". Molecular Biology of the Cell. 17 (1): 317–26. doi:10.1091/mbc.E05-08-0735. PMC 1345669. PMID 16267270.
- ^ Li Z, Cai T, Tian J, Xie JX, Zhao X, Liu L, et al. (July 2009). "NaKtide, a Na/K-ATPase-derived peptide Src inhibitor, antagonizes ouabain-activated signal transduction in cultured cells". The Journal of Biological Chemistry. 284 (31): 21066–76. doi:10.1074/jbc.M109.013821. PMC 2742871. PMID 19506077.
- ^ Lee K, Jung J, Kim M, Guidotti G (January 2001). "Interaction of the alpha subunit of Na,K-ATPase with cofilin". The Biochemical Journal. 353 (Pt 2): 377–85. doi:10.1042/0264-6021:3530377. PMC 1221581. PMID 11139403.
- ^ Forrest MD, Wall MJ, Press DA, Feng J (December 2012). "The sodium-potassium pump controls the intrinsic firing of the cerebellar Purkinje neuron". PLOS ONE. 7 (12): e51169. Bibcode:2012PLoSO...751169F. doi:10.1371/journal.pone.0051169. PMC 3527461. PMID 23284664.
- ^ Zylbertal A, Kahan A, Ben-Shaul Y, Yarom Y, Wagner S (December 2015). "Prolonged Intracellular Na+ Dynamics Govern Electrical Activity in Accessory Olfactory Bulb Mitral Cells". PLOS Biology. 13 (12): e1002319. doi:10.1371/journal.pbio.1002319. PMC 4684409. PMID 26674618.
- ^ Zylbertal A, Yarom Y, Wagner S (2017). "The Slow Dynamics of Intracellular Sodium Concentration Increase the Time Window of Neuronal Integration: A Simulation Study". Frontiers in Computational Neuroscience. 11: 85. doi:10.3389/fncom.2017.00085. PMC 5609115. PMID 28970791.
- ^ Forrest MD (December 2014). "The sodium-potassium pump is an information processing element in brain computation". Frontiers in Physiology. 5 (472): 472. doi:10.3389/fphys.2014.00472. PMC 4274886. PMID 25566080.
- ^ Cannon SC (July 2004). "Paying the price at the pump: dystonia from mutations in a Na+/K+ -ATPase". Neuron. 43 (2): 153–4. doi:10.1016/j.neuron.2004.07.002. PMID 15260948.
- ^ Calderon DP, Fremont R, Kraenzlin F, Khodakhah K (March 2011). "The neural substrates of rapid-onset Dystonia-Parkinsonism". Nature Neuroscience. 14 (3): 357–65. doi:10.1038/nn.2753. PMC 3430603. PMID 21297628.
- ^ Forrest MD (April 2015). "Simulation of alcohol action upon a detailed Purkinje neuron model and a simpler surrogate model that runs >400 times faster". BMC Neuroscience. 16 (27): 27. doi:10.1186/s12868-015-0162-6. PMC 4417229. PMID 25928094.
- ^ Forrest M (4 April 2015). "The Neuroscience Reason We Fall Over When Drunk". Science 2.0. Retrieved 30 May 2018.
- ^ Young EA, Fowler CD, Kidd GJ, Chang A, Rudick R, Fisher E, Trapp BD (April 2008). "Imaging correlates of decreased axonal Na+/K+ ATPase in chronic multiple sclerosis lesions". Annals of Neurology. 63 (4): 428–35. doi:10.1002/ana.21381. PMID 18438950. S2CID 14658965.
- ^ Smith RS, Florio M, Akula SK, Neil JE, Wang Y, Hill RS, et al. (June 2021). "Early role for a Na+,K+-ATPase (ATP1A3) in brain development". Proceedings of the National Academy of Sciences of the United States of America. 118 (25): e2023333118. Bibcode:2021PNAS..11823333S. doi:10.1073/pnas.2023333118. PMC 8237684. PMID 34161264.
- ^ Burnier M (2008). Sodium In Health And Disease. CRC Press. p. 15. ISBN 978-0-8493-3978-3.
- ^ Chin AC, Gao Z, Riley AM, Furkert D, Wittwer C, Dutta A, et al. (October 2020). "The inositol pyrophosphate 5-InsP7 drives sodium-potassium pump degradation by relieving an autoinhibitory domain of PI3K p85α". Science Advances. 6 (44): eabb8542. Bibcode:2020SciA....6.8542C. doi:10.1126/sciadv.abb8542. PMC 7608788. PMID 33115740. S2CID 226036261.
- ^ a b Ramnanan CJ, Storey KB (February 2006). "Suppression of Na⁺/K⁺-ATPase activity during estivation in the land snail Otala lactea". The Journal of Experimental Biology. 209 (Pt 4): 677–88. doi:10.1242/jeb.02052. PMID 16449562. S2CID 39271006.
- ^ Lin HH, Tang MJ (January 1997). "Thyroid hormone upregulates Na,K-ATPase α and β mRNA in primary cultures of proximal tubule cells". Life Sciences. 60 (6): 375–382. doi:10.1016/S0024-3205(96)00661-3. PMID 9031683.
- ^ Blaustein MP (May 1977). "Sodium ions, calcium ions, blood pressure regulation, and hypertension: a reassessment and a hypothesis". The American Journal of Physiology. 232 (5): C165-73. doi:10.1152/ajpcell.1977.232.5.C165. PMID 324293. S2CID 9814212.
- ^ Schoner W, Scheiner-Bobis G (September 2008). "Role of endogenous cardiotonic steroids in sodium homeostasis". Nephrology, Dialysis, Transplantation. 23 (9): 2723–9. doi:10.1093/ndt/gfn325. PMID 18556748.
- ^ Blaustein MP, Hamlyn JM (December 2010). "Signaling mechanisms that link salt retention to hypertension: endogenous ouabain, the Na(+) pump, the Na(+)/Ca(2+) exchanger and TRPC proteins". Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1802 (12): 1219–29. doi:10.1016/j.bbadis.2010.02.011. PMC 2909369. PMID 20211726.
- ^ Fuerstenwerth H (2014). "On the differences between ouabain and digitalis glycosides". American Journal of Therapeutics. 21 (1): 35–42. doi:10.1097/MJT.0b013e318217a609. PMID 21642827. S2CID 20180376.
- ^ Pavlovic D (2014). "The role of cardiotonic steroids in the pathogenesis of cardiomyopathy in chronic kidney disease". Nephron Clinical Practice. 128 (1–2): 11–21. doi:10.1159/000363301. PMID 25341357.
- ^ "NA+/K+-ATPase and inhibitors (Digoxin)". Pharmacorama. Archived from the original on 2020-09-28. Retrieved 2019-11-08.
- ^ Skou JC (February 1957). "The influence of some cations on an adenosine triphosphatase from peripheral nerves". Biochimica et Biophysica Acta. 23 (2): 394–401. doi:10.1016/0006-3002(57)90343-8. PMID 13412736. S2CID 32516710.
- ^ "The Nobel Prize in Chemistry 1997". NobelPrize.org. Nobel Media AB. 15 October 1997.
- ^ a b Zhen, Ying; Aardema, Matthew L.; Medina, Edgar M.; Schumer, Molly; Andolfatto, Peter (2012-09-28). "Parallel Molecular Evolution in an Herbivore Community". Science. 337 (6102): 1634–1637. Bibcode:2012Sci...337.1634Z. doi:10.1126/science.1226630. ISSN 0036-8075. PMC 3770729. PMID 23019645.
- ^ Yang, L.; Ravikanthachari, N.; Mariño-Pérez, R.; Deshmukh, R.; Wu, M.; Rosenstein, A.; Kunte, K.; Song, H.; Andolfatto, P. (2019). "Predictability in the evolution of Orthopteran cardenolide insensitivity". Philosophical Transactions of the Royal Society of London, Series B. 374 (1777): 20180246. doi:10.1098/rstb.2018.0246. PMC 6560278. PMID 31154978.
- ^ 페첸카 게오르크, 베라 바그샬, 마이클 폰 치른하우스, 알렉산더 도나트, 수잔 도블러 2017.
- ^ 도블러 수잔, 베라 바그샬, 닐스 피에치, 나자 다둘리, 페 마인저, 렌자 로메이글뤼싱, 카이 슈테.2019 "New ways to acquire resistance: imperfect convergence in insect adaptations to a potent plant toxin".
- ^ 루양, 플로라 본, 매튜 라르데마, 잉젠, 줄리 펭, 마리아나 우, 레지나 비스콘티, 안자 베츠, 바르톨로뮤 P 롤랜드, 아론 D 탈스마, 마이크 J 팔라디노, 게오르크 페첸카, 피터, 그리고 페톨파토.2023 "The path to "femmes fatales": the evolution of toxin resistance in predatory fireflies". doi:10.1101/2023.03.08.531760. PMC 10028858. PMID 36945443.
- ^ Labeyrie E, Dobler S (2004). "Molecular adaptation of Chrysochus leaf beetles to toxic compounds in their food plants". Molecular Biology and Evolution. 21 (2): 218–21. doi:10.1093/molbev/msg240. PMID 12949136.
- ^ Dobler, S., Dalla, S., Wagschal, V., & Agrawal, A. A. (2012).Na, K-AT 단계의 치환에 의한 독성 카데놀라이드에 대한 곤충 적응의 지역사회 전체의 수렴 진화.국립 과학 아카데미의 의사록, 109(32), 13040–13045.https://doi.org/10.1073/pnas.1202111109
