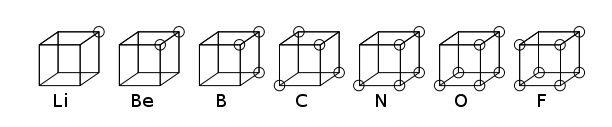
큐빅 원자
Cubical atom입체 원자는 비극 원자나 분자의 입방체의 여덟 모서리에 전자가 위치하는 초기 원자 모델이었다. 이 이론은 1902년 길버트 N에 의해 개발되었다. 루이스(Lewis)와 1916년 "원자와 분자(The Atom and the Divider)"라는 글에 발표되었고, 용맹의 현상을 설명하곤 했다.[1] 루이스의 이론은 아베그의 통치에 바탕을 두고 있었다. 1919년 어빙 랑무르에 의해 입체 옥텟 원자로 더욱 발전하였다.[2] 아래 그림은 주기율표의 두 번째 행 원소에 대한 구조적 표현을 보여준다.
비록 원자의 입체 모델은 슈뢰딩거 방정식에 기초한 양자역학 모델에 유리하게 곧 포기되었고, 따라서 지금은 주로 역사적 관심사가 되고 있지만, 그것은 화학적 결합의 이해를 향한 중요한 단계를 나타냈다. 1916년 루이스의 기사에서는 공가결합, 옥텟 규칙, 그리고 현재 루이스 구조로 불리는 전자쌍의 개념을 소개하기도 했다.
입체 원자 모델의 본딩
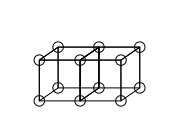
단일 공밸런트 결합은 아래 구조 C에서와 같이 두 원자가 하나의 가장자리를 공유할 때 형성된다. 이것은 두 개의 전자를 공유하는 결과를 낳는다. 이온 결합은 가장자리(구조 A)를 공유하지 않고 한 입방체에서 다른 입방체로 전자가 전달되면서 형성된다. 한쪽 구석만 공유하는 중간 상태(구조 B)도 루이스에 의해 상정되었다.
이중 결합은 두 입방 원자들 사이에 얼굴을 공유함으로써 형성된다. 이로써 4개의 전자를 공유하게 된다.
세 개의 결합은 세 개의 평행 가장자리를 두 개의 입방체로 공유하는 방법이 없기 때문에 입체 원자 모델로는 설명할 수 없었다. 루이스는 원자 결합의 전자 쌍은 아래 그림에서와 같이 사면체 구조를 초래하는 특별한 매력을 가지고 있다고 제안했다(전자의 새로운 위치는 두꺼운 가장자리 가운데 점 원으로 표현된다). 이를 통해 코너를 공유함으로써 단일 결합을 형성하고, 엣지를 공유함으로써 이중 결합을, 얼굴을 공유함으로써 삼중 결합을 형성할 수 있다. 그것은 또한 단일 결합을 중심으로 한 자유 회전과 메탄의 사면 기하학도 설명한다.
참고 항목
참조
- ^ Lewis, Gilbert N. (1916-04-01). "The Atom and the Molecule". Journal of the American Chemical Society. 38 (4): 762–785. doi:10.1021/ja02261a002.
- ^ Langmuir, Irving (1919-06-01). "The Arrangement of Electrons in Atoms and Molecules". Journal of the American Chemical Society. 41 (6): 868–934. doi:10.1021/ja02227a002.