발사르탄
Valsartan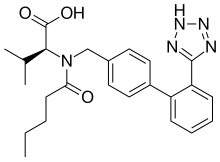 | |
 | |
| 임상자료 | |
|---|---|
| 상명 | 디오반 등 |
| AHFS/Drugs.com | 모노그래프 |
| 메드라인플러스 | a697015 |
| 라이센스 데이터 | |
| 임신 범주 |
|
| 경로: 행정 | 입으로 |
| 마약류 | 안지오텐신 2 수용체 길항제 |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 | |
| 약동학 데이터 | |
| 생체이용가능성 | 25% |
| 단백질 결합 | 95% |
| 제거 반감기 | 6시간 |
| 배설 | 신장 30%, 담즙관 70% |
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| IUPHAR/BPS | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 켐벨 | |
| CompTox 대시보드 (EPA) | |
| ECHA InfoCard | 100.113.097 |
| 화학 및 물리적 데이터 | |
| 공식 | C24H29N5O3 |
| 어금질량 | 435.528 g·1998−1 |
| 3D 모델(JSmol) | |
| |
| |
| (iii) | |
그중에서도 디오반이라는 상표명으로 판매되는 발사르탄은 고혈압, 심부전, 당뇨병성 신장질환 등을 치료할 때 사용하는 약이다.[7] 고혈압에 대한 합리적인 초기 치료법이다.[7] 그것은 입으로 가져간다.[7] 버전들은 발사르탄/하이드로클로로티아지드, 발사르탄/암로드핀, 발사르탄/암로드핀/하이드로클로디아지드 또는 발사르탄/사쿠비트릴의 조합으로 이용할 수 있다.[7][8]
일반적인 부작용으로는 피로감, 현기증, 고혈중 칼륨, 설사, 관절통 등이 있다.[7] 다른 심각한 부작용으로는 신장 질환, 저혈압, 혈관부종 등이 있을 수 있다.[7] 임신 중에 사용하면 아기가 다칠 수 있으며 모유 수유를 권장하지 않을 때 사용한다.[9] Angiotensin II 수용체 길항제로서 Angiotensin II의 효과를 차단하여 작용한다.[7]
발사르탄은 1990년에 특허를 받았으며, 1996년에 의학적으로 사용되었다.[10] 그것은 일반적인 약으로 이용할 수 있다.[11] 2019년에는 미국에서 154번째로 가장 많이 처방된 약으로 400만 건 이상의 처방전을 받았다.[12][13]
의학적 용법
발사르탄은 고혈압, 심부전을 치료하고 심장마비를 일으킨 뒤 좌심실 기능장애를 가진 사람들의 죽음을 줄이는 데 쓰인다.[14][6]
고혈압
ACE 억제제, 칼슘-채널 차단제, 티아자이드 이뇨제처럼 고혈압에 대한 합리적인 초기 치료법이다.[7]
심부전
심부전이 있는 사람을 발사르탄과 안지오텐신전환효소억제제 같은 안지오텐신 수용체 차단제를 조합한 치료제로 치료하는 것과 관련해 모순된 증거가 있는데, 2개의 주요 임상시험에서는 사망 감소 효과가 나타났고, 그 외 2개의 임상시험에서는 아무런 이점도 보이지 않았으며, 심장마비, 피하 등 부작용도 더 많이 나타났다.긴장과 신장 기능 장애.[14]
당뇨병 신장병
제2형 당뇨병과 소변에 고혈압이나 알부민이 있는 사람에서는 발사르탄을 사용하여 악화되고 말기 신장병의 발달을 늦춘다.[15]
콘트라인커뮤니케이션
발사르탄 포장에는 당뇨가 있는 사람들에게 레닌 억제제 알리스키렌과 함께 약을 사용해서는 안 된다는 경고가 포함되어 있다. 또한 신장병을 앓고 있는 사람들에게 이 약을 사용해서는 안 된다고 명시하고 있다.[6]
발사르탄에는 태아 독성에 대한 블랙박스 경고가 포함되어 있다.[6][9] 이들 약제의 단종은 임신 검출 즉시 권고되며 대체 약물을 투여해야 한다.[6] 모유 수유는 권장하지 않는다.[6][16][17]
부작용
부작용의 비율은 약을 사용하는 이유에 따라 달라진다.
심부전
부작용의 비율은 심부전이 있는 사람들의 플라시보 대 비교에 근거한다.[6] 가장 흔한 부작용으로는 어지럼증(17% vs 9%), 저혈압(7% vs 2%), 설사(5% vs 4%)[6] 등이 있다. 덜 흔한 부작용으로는 관절통, 피로, 요통(3% 대 2% 모두)이 있다.[6]
고혈압
고혈압 대 위약에 대한 발사르탄 치료 임상시험에서는 바이러스 감염(3% 대 2%), 피로(2% 대 1%), 복통(2% 대 1%) 등의 부작용이 나타난다. 1%에서 발생했지만 위약 집단의 비율과 유사한 경미한 부작용은 다음을 포함한다.[6]
신장부전
발사르탄이나 이뇨제를 포함한 ARB로 치료하는 사람은 신장 내 혈관이 비정상적으로 좁아지는 등 신장, 고혈압, 신장동맥협착증, 심부전, 만성신장질환, 심각한 울혈성 심부전, 신장의 기능이 부분적으로 의존하는 볼륨감퇴 등 낮은 신장 혈류로 발전하는 상태에 취약하다. 안지오텐신 II에 의해 행해진 폐동맥 혈관수축과 같은 레닌-안지오텐신 시스템의 활동은 급성 신장 기능 저하, 과두리아, 악화되는 아지오텐혈증 또는 고조된 혈청 크레아티닌으로 구성되는 신기능의 악화 위험이 높다.[6] 신장으로 가는 혈류가 감소하면 신장은 일련의 반응을 활성화시켜 혈관 수축과 신장의 혈액 흐름을 원활하게 하기 위해 안지오텐신 분비를 촉발한다.[18] 네프론 기능 저하가 진행 중이거나 임상적으로 유의한 수준에 도달하는 한 발사르탄을 보류하거나 중단하는 것이 보증된다.[6][19][20][21]
상호작용
미국의 처방 정보에는 발사르탄에 대한 다음과 같은 약물 상호작용이 열거되어 있다.
- 레닌-안지오텐신 시스템의 다른 억제제는 저혈압, 신장질환, 고칼륨의 위험을 증가시킬 수 있다.
- 칼륨 스프레이링 이뇨제, 칼륨 보충제, 칼륨을 함유한 소금 대체제는 고칼륨혈증의 위험을 증가시킬 수 있다.
- NSAIDs는 신장 문제의 위험을 증가시킬 수 있고 혈압 저하 효과를 방해할 수 있다.
- 발사르탄은 리튬의 농도를 높일 수 있다.[6]
- 발사르탄과 다른 혈관신 관련 혈압약들은 심장마비로 인한 갑작스러운 사망 위험을 증가시키기 위해 항생제 공동 트리목사졸 또는 시프로플로락사신과 상호작용을 할 수 있다.[22]
식품 상호작용
이 태블릿으로, 음식은 발사르탄 타블렛 테이커의 발사르탄 노출도를 약 40%, 피크 플라즈마 농도(Cmax)[6]를 약 50% 감소시킨다.
약리학
작용기전
발사르탄은 혈관을 수축시키고 알도스테론을 활성화시키는 등의 안지오텐신 2세의 작용을 차단해 혈압을 낮춘다.[23] 이 약은 안지오텐신 1형 수용체(AT1)에 결합해 대항제 역할을 한다. 이 작용기전은 안지오텐신 1세의 안지오텐신 2로의 전환을 막는 ACE 억제제 약과는 다르다. 발사르탄은 수용체에서 작용하므로 ACE뿐만 아니라 다른 효소에 의해 안지오텐신 II가 생성되기 때문에 보다 완전한 안지오텐신 II 길항작용제를 제공할 수 있다. 또한 발사르탄은 ACE 억제제처럼 브래디키닌의 신진대사에 영향을 주지 않는다.[23]
약리역학
약동학
발사르탄의 AUC와 Cmax 값은 치료용 투여 범위에 비해 약 선형 선량에 의존하는 것으로 관찰된다. 비교적 짧은 제거 반감기 귀인 때문에, 발사르탄 농도는 반복 투여에 반응하여 축적되지 않는다.[6]
사회와 문화
경제학
2010년 발사르탄(무역명 디오반)은 미국에서 연간 20억5200만 달러, 전 세계적으로 60억5300만 달러의 매출을 달성했다.[24] 발사르탄과 발사르탄/하이드로클로로티아자이드의 특허는 2012년 9월에 만료되었다.[25][26]
조합
발사르탄은 암로디핀이나 염산염(HCTZ)(또는 둘 다)과 결합해 여러 약물로 고혈압을 치료하는 단일필 제형으로 만든다.[7][27][28][29] 발사르탄은 발사르탄/사쿠비트릴 조합으로도 이용할 수 있다.[8][30][31] 그것은 심장마비를 감소된 방출 분율로 치료하는데 사용된다.[31][32]
회상하다
2018년 7월 6일, 유럽 의약청(EMA)은 유럽, 캐나다 등 22개국에서 유통되는 발사르탄과 발사르탄/하이드로클로로티아자이드 필름코팅 알약의 특정 묶음을 회수했다.[33] 중국 린하이시에 있는 저장화하이제약(ZHP)은 발암물질인 N-니트로소디메틸아민(NDMA)에 오염된 벌크 성분을 제조했다.[34] 이후 노바티스를 포함한 다수의 일반 제약회사들이 이 약품을 수입했고, 자회사인 산도즈 라벨에 따라 유럽과 아시아에서, 덱셀 파마 Ltd와 어코드 헬스케어가 영국에서 판매했다.[33]
캐나다에서는 이번 리콜에 5개 업체가 참여하고 있으며 한 민간 로펌에 의해 집단소송이 시작됐다.[35][36] 당국은 오염 정도가 미미하다고 보고, 약을 복용하는 사람들에게 의사와 상의하고 갑작스럽게 약을 끊지 말라고 충고한다. 2018년 7월 12일, 미국 식품의약국(NA-DFC 또는 바단 POM 인도네시아)은 액타비스 인도네시아와 디파 파말라브 인터세인이 생산한 발사르탄이 함유된 2개 제품에 대한 자발적 리콜을 발표했다.[37] 미국 식품의약국(FDA)은 2018년 7월 13일 솔코헬스케어 LLC, 메이저약품, 테바제약인더스트리가 유통하는 미국 내 발사르탄과 발사르탄/하이드로클로로티아자이드의 특정 공급품에 대한 자발적 리콜을 발표했다.[38][34] 홍콩 보건부는 이와 유사한 리콜을 시작했다.[39] 2018년 8월 2일, FDA는 발사르탄이 함유된 수백 개의 특정 미국 제품을 리콜 대상에서 제외된 제품들로 분류하면서 두 개의 장황하고 업데이트된 목록을 발표했다.[40][41] 일주일 후, FDA는 오염된 발사르탄 성분의 추가 공급원으로 중국의 저장톈유 제약사와 인도의 헤테로 랩스 유한회사 등 두 개의 제약회사를 인용했다.[42][41]
2018년 9월 FDA는 모든 발사르탄 공급품을 재검사한 결과 중국에서 ZHP가 제조해 미국에서 토렌트제약(인도) 브랜드로 판매한 리콜 제품에서 두 번째 발암성 불순물인 N-니트로소디에틸아민(NDEA)이 검출됐다고 발표했다.[43]
로이터통신이 2018년 국가 의약품 기관의 기록을 분석한 결과 전 세계 50여 개 기업이 오염된 발사르탄 원료로 제조된 발사르탄 모노 준비물이나 콤비네이션 제품을 리콜한 것으로 나타났다. 오염은 EDQM과 FDA 당국이 제조 공정을 변경하고 승인한 2012년 이후 존재했을 가능성이 높다. 양 기관은 2018년 말 점검을 토대로 중국과 인도 제조업체의 유럽연합(EU)과 미국 발사르탄 공급 적합성 증명서를 정지했다.[44]
2019년에는 오염물질 NDMA의 존재로 발사르탄과 그 조합의 많은 준비가 회수되었다.[45][46][47]
유럽 의약품청(EMA)은 2020년 8월, 인체의약품에 니트로사민 불순물이 함유되지 않도록 하는 방법에 대해 시판허가권자에게 지침을 제공하고, 니트로사민의 존재 가능성에 대해 모든 화학적·생물학적 인간 의약품을 검토하고, 위험에 처한 제품을 시험해 줄 것을 요청했다.[48]
부족
2018년 7월 이후, 로사르탄, 발사르탄, 이르베사르탄 의약품에 대한 수많은 리콜이 북미와 유럽, 특히 발사르탄에 대한 이러한 구명 의약품의 현저한 부족을 야기했다. 2019년 3월 FDA는 이 문제를 해결하기 위해 일반 버전의 Diovan™을 추가로 승인했다.[49] 소속사에 따르면 발사르탄 부족은 2020년 4월 3일 해소됐지만,[50] 일반형식의 가용성은 2020년 7월까지 불안정한 상태를 유지했다. 유럽의 약국들은 특히 높은 복용량의 약의 공급은 2020년 12월까지 불안정한 상태를 유지할 것이라는 통보를 받았다.[51]
리서치
포도당 내성이 손상된 사람들에게 발사르탄은 당뇨병의 발병률을 감소시킬 수 있다. 다만 절대위험감소(연 1% 미만)가 적고 식이요법, 운동, 기타 약물이 더 보호적일 수 있다. 같은 연구에서는 심혈관계 사건(사망 포함)의 비율의 감소가 나타나지 않았다.[52]
당뇨병 없는 사람에 대한 한 연구에서 발사르탄은 주로 고혈압을 가진 사람들을 위해 암로디핀보다 숙성된 당뇨병에 걸릴 위험을 줄였다.[53]
알츠하이머병과 치매의 발병률과 진행률의 감소를 예상한 연구가 있었다.[54]
참조
- ^ "Valsartan Use During Pregnancy". Drugs.com. 28 March 2019. Retrieved 12 February 2020.
- ^ "Diovan valsartan 40mg film-coated tablet blister pack". Therapeutic Goods Administration (TGA). Retrieved 24 October 2021.
- ^ "Diovan valsartan 80mg film-coated tablet blister pack". Therapeutic Goods Administration (TGA). Retrieved 24 October 2021.
- ^ "Diovan valsartan 160mg film-coated tablet blister pack". Therapeutic Goods Administration (TGA). Retrieved 24 October 2021.
- ^ "Valsartan 160 mg capsules - Summary of Product Characteristics (SmPC)". (emc). 19 February 2019. Retrieved 12 February 2020.
- ^ a b c d e f g h i j k l m n o "Diovan- valsartan tablet". DailyMed. 12 June 2019. Retrieved 12 February 2020.
- ^ a b c d e f g h i "Valsartan Monograph for Professionals". Drugs.com. American Society of Health-System Pharmacists. Retrieved 3 March 2019.
- ^ a b "Sacubitril and Valsartan Monograph for Professionals". Drugs.com. 7 November 2019. Retrieved 12 February 2020.
- ^ a b "Valsartan Pregnancy and Breastfeeding Warnings". Drugs.com. Retrieved 3 March 2019.
- ^ Fischer J, Ganellin CR (2006). Analogue-based Drug Discovery. John Wiley & Sons. p. 470. ISBN 9783527607495.
- ^ British national formulary : BNF 76 (76 ed.). Pharmaceutical Press. 2018. p. 179. ISBN 9780857113382.
- ^ "The Top 300 of 2019". ClinCalc. Retrieved 16 October 2021.
- ^ "Valsartan - Drug Usage Statistics". ClinCalc. Retrieved 16 October 2021.
- ^ a b Randa H (2011). "Chapter 26. Renin and Angiotensin". In Brunton LL, Chabner B, Knollmann BC (eds.). Goodman & Gilman's The Pharmacological Basis of Therapeutics (12th ed.). New York: McGraw-Hill. ISBN 978-0-07-162442-8.
- ^ Inzucchi SE, Bergenstal RM, Buse JB, Diamant M, Ferrannini E, Nauck M, et al. (January 2015). "Management of hyperglycemia in type 2 diabetes, 2015: a patient-centered approach: update to a position statement of the American Diabetes Association and the European Association for the Study of Diabetes". Diabetes Care. 38 (1): 140–9. doi:10.2337/dc14-2441. PMID 25538310.
- ^ "Diovan Product Monograph". Health Canada Drug Product Database. Novartis Pharmaceuticals Canada Inc. Archived from the original on 30 December 2012. Retrieved 5 November 2015.
- ^ https://pdf.hres.ca/dpd_pm/00030565.PDF
- ^ Kumar A, Fausto A (2010). "11". Pathologic Basis of Disease (8th ed.). Saunders Elsevier. p. 493. ISBN 978-1-4160-3121-5.
- ^ Smith SC, Benjamin EJ, Bonow RO, Braun LT, Creager MA, Franklin BA, et al. (November 2011). "AHA/ACCF Secondary Prevention and Risk Reduction Therapy for Patients with Coronary and other Atherosclerotic Vascular Disease: 2011 update: a guideline from the American Heart Association and American College of Cardiology Foundation". Circulation. Ovid Technologies (Wolters Kluwer Health). 124 (22): 2458–73. doi:10.1161/cir.0b013e318235eb4d. PMID 22052934.
- ^ "KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease" (PDF). 3 (1). KDIGO. January 2013. Archived from the original (PDF) on 6 February 2019.
{{cite journal}}: Cite 저널은 필요로 한다.journal=(도움말) - ^ Zar T, Graeber C, Perazella MA (7 June 2007). "Recognition, treatment, and prevention of propylene glycol toxicity". Seminars in Dialysis. Wiley. 20 (3): 217–9. doi:10.1111/j.1525-139x.2007.00280.x. PMID 17555487. S2CID 41089058.
- ^ Fralick M, Macdonald EM, Gomes T, Antoniou T, Hollands S, Mamdani MM, et al. (October 2014). "Co-trimoxazole and sudden death in patients receiving inhibitors of renin-angiotensin system: population based study". BMJ. 349: g6196. doi:10.1136/bmj.g6196. PMC 4214638. PMID 25359996.
- ^ a b Katzung BG, Trevor AJ (2015). "Chapter 11". Basic & Clinical Pharmacology (13 ed.). McGraw-Hill Education. ISBN 978-0071825054.
- ^ "Novartis Annual Report 2010" (PDF).
- ^ Philip Moeller (29 April 2011). "Blockbuster Drugs That Will Go Generic Soon". U.S. News & World Report.
- ^ Eva Von Schaper (5 August 2011). "Novartis's Jimenez Has Blockbuster Plans For Diovan After Patent Expires". Bloomberg.
- ^ "Exforge- amlodipine besylate and valsartan tablet, film coated". DailyMed. 12 June 2019. Retrieved 12 February 2020.
- ^ "Diovan HCT- valsartan and hydrochlorothiazide tablet, film coated". DailyMed. Retrieved 12 February 2020.
- ^ "Exforge HCT- amlodipine valsartan and hydrochlorothiazide tablet, film coated". DailyMed. Retrieved 12 February 2020.
- ^ "Entresto- sacubitril and valsartan tablet, film coated". DailyMed. 1 September 2019. Retrieved 12 February 2020.
- ^ a b Fala L (September 2015). "Entresto (Sacubitril/Valsartan): First-in-Class Angiotensin Receptor Neprilysin Inhibitor FDA Approved for Patients with Heart Failure". Ah & Db. 8 (6): 330–334. PMC 4636283. PMID 26557227.
- ^ Khalil P, Kabbach G, Said S, Mukherjee D (2018). "Entresto, a New Panacea for Heart Failure?". Cardiovascular & Hematological Agents in Medicinal Chemistry. 16 (1): 5–11. doi:10.2174/1871525716666180313121954. PMID 29532764. S2CID 3880750.
- ^ a b Christensen J. "Common heart drug recalled in 22 countries for possible cancer link". CNN. Retrieved 14 July 2018.
- ^ a b Edney A, Berfield S, Yu E (12 September 2019). "Carcinogens Have Infiltrated the Generic Drug Supply in the U.S." Bloomberg News. Retrieved 17 September 2019.
- ^ "Several drugs containing valsartan being recalled due to contamination with a potential carcinogen". Health Canada. 9 July 2018. Retrieved 15 July 2018.
- ^ "Valsartan Class Action". valsartanclassaction.com. Retrieved 15 July 2018.
- ^ "Penjelasan BPOM RI Tentang Penarikan Obat Antihipertensi Yang Mengandung Zat Aktif Valsartan". National Agency of Drug and Food Control of Republic of Indonesia (Badan POM) (in Indonesian). Retrieved 18 July 2018.
- ^ Christensen J. "FDA joins 22 countries' recall of common heart drug". CNN. Retrieved 15 July 2018.
- ^ "Hong Kong health department issues recall for five heart drugs containing valsartan that was made in China". South China Morning Post. 20 July 2018. Retrieved 20 July 2018.
- ^ "FDA updates on valsartan recalls". Food and Drug Administration (FDA). 2 August 2018. Retrieved 8 August 2018.
- ^ a b "FDA Updates and Press Announcements on Angiotensin II Receptor Blocker (ARB) Recalls (Valsartan, Losartan, and Irbesartan)". Food and Drug Administration (FDA). 20 August 2018. Retrieved 17 September 2019.
- ^ Patrice Wendling (13 August 2018). "More Drug Makers Tagged as Valsartan Recall Grows". WebMD. Retrieved 13 August 2018.
- ^ "FDA provides update on its ongoing investigation into valsartan products; and reports on the finding of an additional impurity identified in one firm's already recalled products". Food and Drug Administration (FDA) (Press release). 13 September 2018. Retrieved 14 September 2018.
- ^ Harney A, Hirschler B (22 August 2018). "Toxin at heart of drug recall shows holes in medical safety net". Reuters. Retrieved 23 November 2018.
- ^ Abdin, Ahmad Yaman; Yeboah, Prince; Jacob, Claus (January 2020). "Chemical Impurities: An Epistemological Riddle with Serious Side Effects". International Journal of Environmental Research and Public Health. 17 (3): 1030. doi:10.3390/ijerph17031030. PMC 7038150. PMID 32041209.
- ^ Radcliffe S (19 June 2019). "Blood Pressure Medications Recall". Healthline. Retrieved 16 September 2019.
- ^ "ARB Recalls: Valsartan, Losartan and Irbesartan". U.S. Food and Drug Administration (FDA). 3 February 2020. Retrieved 12 February 2020.
- ^ "Nitrosamine impurities". European Medicines Agency. 23 October 2019. Retrieved 6 August 2020. 본문은 유럽 의약청인 이 출처로부터 복사되었다. 출처가 인정되면 재생산은 허가된다.
- ^ 노스캐롤라이나 주 클랜턴(2019년 3월 13일). FDA는 아틀란타 저널-헌법 리콜로 인한 혈압 부족을 완화하기 위해 일반 혈압약을 승인했다. 2020년 7월 13일 회수
- ^ 현재 및 해결된 약물 부족 및 중단이 FDA에 보고됨 accessdata.fda.gov 2020년 7월 13일 회수
- ^ Liefengpass Valsartan-CT 160mg. 겔베 리스트(독일어). 제약 지수. 2020년 7월 13일 회수
- ^ McMurray JJ, Holman RR, Haffner SM, Bethel MA, Holzhauer B, Hua TA, et al. (April 2010). "Effect of valsartan on the incidence of diabetes and cardiovascular events". The New England Journal of Medicine. 362 (16): 1477–90. doi:10.1056/NEJMoa1001121. hdl:2381/21817. PMID 20228403.
- ^ Kjeldsen SE, McInnes GT, Mancia G, Hua TA, Julius S, Weber MA, et al. (2008). "Progressive effects of valsartan compared with amlodipine in prevention of diabetes according to categories of diabetogenic risk in hypertensive patients: the VALUE trial". Blood Pressure. 17 (3): 170–7. doi:10.1080/08037050802169644. PMID 18608200. S2CID 3426921.
- ^ Li NC, Lee A, Whitmer RA, Kivipelto M, Lawler E, Kazis LE, et al. (January 2010). "Use of angiotensin receptor blockers and risk of dementia in a predominantly male population: prospective cohort analysis". BMJ. 340: b5465. doi:10.1136/bmj.b5465. PMC 2806632. PMID 20068258.
외부 링크
- "Valsartan". Drug Information Portal. U.S. National Library of Medicine.
- "Amlodipine mixture with valsartan". Drug Information Portal. U.S. National Library of Medicine.
- "Amlodipine besylate mixture with hydrochlorothiazide and valsartan". Drug Information Portal. U.S. National Library of Medicine.
- "Hydrochlorothiazide mixture with valsartan". Drug Information Portal. U.S. National Library of Medicine.
- "Sacubitril mixture with valsartan". Drug Information Portal. U.S. National Library of Medicine.

