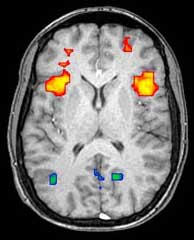
신경영상화
Neuroimaging| 신경영상화 | |
|---|---|
 양성 가족성 대뇌증이 있는 환자의 머리에 대한 Para-Sagital MRI. | |
| 목적 | 간접적으로(비교적으로) 영상 구조, 신경계의 기능/신경계 연구 |
신경영상화(Neuroimizing)는 중추신경계의 구조와 기능을 연구하기 위한 정량적(컴퓨팅) 기법을 사용하는 것으로, 건강한 인간의 뇌를 비침습적으로 과학적으로 연구하는 객관적인 방법(예: SPM FSL AFNI)으로 개발되었다.뇌질환과 정신질환에 대한 정량적 연구에도 점차 이용되고 있다.신경영상촬영은 다학제 연구분야로 의학 전문 분야가 아니다.
신경영상촬영은 의학 전문인 뉴로라디오학과는 다르며 임상 환경에서 뇌 영상촬영을 사용한다.뉴로라디오는 방사선 전문의들이 시술한다.뉴로라디오학은 주로 혈관 질환, 뇌졸중, 종양, 염증성 질환과 같은 뇌 병변을 확인하는 데 초점을 맞추고 있다.신경영상화와는 대조적으로 뉴로라디컬은 질적(주관적 인상과 광범위한 임상훈련에 근거)이지만 때로는 기본적인 정량적 방법을 사용한다.기능성 자기공명영상(fMRI)과 같은 기능성 뇌영상 기법은 신경영상에서는 일반적이지만 뉴로라디오학에서는 거의 사용되지 않는다.신경 영상촬영은 크게 두 가지 범주로 나뉜다.
- 복셀 기반 형태측정법을 사용하여 뇌 구조를 정량화하는 데 사용되는 구조 영상.
- 뇌 기능을 연구하기 위해 사용되는 기능성 영상촬영은 종종 fMRI와 PET, MEG와 같은 다른 기법을 사용한다(아래 참조).
역사
신경영상 역사의 첫 장은 이탈리아의 신경과학자 안젤로 모소가 정서적, 지적 활동 중 비침습적으로 혈액의 재분배를 측정할 수 있는 '인간순환 균형'을 발명한 것으로 거슬러 올라간다.[1]
1918년 미국의 신경외과 의사 월터 댄디가 심실조영술을 도입했다.뇌 내 심실계의 X선 영상은 여과된 공기를 뇌의 한 쪽 또는 양쪽 측면 심실에 직접 주입하여 얻었다.댄디는 또한 요추의 척추 구멍을 통해 아음부 공간에 유입된 공기가 대뇌 심실로 들어갈 수 있다는 것을 관찰했고 뇌 밑부분과 그 표면 위로 뇌척수액 구획을 증명했다.이 기술은 폐뇌술이라고 불렸다.
1927년, Egas Moniz는 뇌 혈관조영술을 도입했는데, 뇌 내부와 주변의 정상 혈관과 비정상 혈관을 모두 매우 정밀하게 시각화할 수 있었다.
1970년대 초 앨런 맥러드 코맥과 고드프리 뉴볼드 혼스필드는 컴퓨터화된 축단층촬영(CAT 또는 CT 스캔)을 도입했고, 뇌의 보다 상세한 해부학적 이미지를 진단과 연구 목적으로 사용할 수 있게 되었다.코맥과 혼스필드는 그들의 업적으로 1979년 노벨 생리의학상을 받았다.1980년대 초 CAT가 도입된 직후, 방사광다이저 개발로 단광방출 컴퓨터단층촬영(SPEP)과 뇌의 양전자단층촬영(PET)이 가능해졌다.
거의 동시에 자기공명영상(MRI 또는 MR 스캐닝)은 2003년 노벨 생리의학상을 수상한 피터 맨스필드, 폴 라우터버 등 연구자들에 의해 개발되었다.1980년대 초 MRI가 임상적으로 도입되었고, 1980년대에는 기술적 개선과 진단적 MR 애플리케이션의 실질적인 폭발이 일어났다.과학자들은 곧 PET가 측정한 큰 혈류 변화 또한 정확한 MRI 유형에 의해 이미징될 수 있다는 것을 알게 되었다.기능성 자기공명영상(fMRI)이 탄생했고, 1990년대 이후 지속성이 낮고 방사선 노출이 부족하며 상대적으로 가용성이 넓다는 이유로 fMRI가 뇌 지도화 분야를 장악하게 됐다.
2000년대 초반 신경영상 분야는 기능 뇌영상의 제한적 실용화가 가능해진 단계에 이르렀다.주요 적용 분야는 조잡한 형태의 뇌-컴퓨터 인터페이스다.
적응증
뉴로라디오학은 신경학적 장애가 있거나 있을 수 있는 환자를 의사가 더 깊이 조사할 수 있는 원인을 찾아낸 신경학적 검사를 따른다.
한 사람이 경험할 수 있는 더 흔한 신경학적 문제들 중 하나는 단순한 동기유발이다.[2][3]환자의 이력이 다른 신경학적 증상을 나타내지 않는 단순 동기형의 경우, 신경학적 검사를 포함하지만, 중추신경계에서 원인을 찾을 가능성이 극히 낮고 절차상 환자에게 유리할 가능성이 낮기 때문에 정기적인 신경학적 영상촬영은 표시되지 않는다.e.[3]
편두통으로 진단되는 안정적 두통을 가진 환자에게는 뉴로라디컬이 나타나지 않는다.[4]연구는 편두통의 존재가 환자의 두개내 질환의 위험을 증가시키지 않는다는 것을 보여준다.[4]자궁경부종과 같은 다른 문제가 없다는 편두통의 진단은 방사선 조사의 필요성을 나타내지 않을 것이다.[4]정밀 진단을 하는 과정에서 의사는 두통이 편두통 이외의 원인이 있는지, 방사선 조사가 필요할 수 있는지 여부를 고려해야 한다.[4]
신경외과의의 또 다른 징후는 CT, MRI, PET 유도 입체 수술 또는 두개내 종양, 동맥 기형 및 기타 외과적 치료 가능 조건의 치료를 위한 방사선 수술이다.[5][6][7][8]
뇌 영상화 기법
컴퓨터 축단층촬영
컴퓨터 단층촬영(CT) 또는 컴퓨터 축단층촬영(CAT) 스캐닝은 다양한 방향에서 채취한 머리의 일련의 X선을 사용한다.일반적으로 뇌 손상을 빠르게 보기 위해 사용되는 CT 스캐닝은 측정된 X선 시리즈에서 수치 적분 계산(역라돈 변환)을 수행하는 컴퓨터 프로그램을 사용하여 X선 빔이 뇌의 작은 볼륨에 얼마나 흡수되는지 추정한다.전형적으로 그 정보는 뇌의 단면으로 제시된다.[9]
확산 광학 이미징
분산형 광학영상(DOI) 또는 분산형 광학단층촬영(DOT)은 신체의 이미지를 생성하기 위해 근적외선을 사용하는 의료용 영상촬영 촬영장비다.이 기술은 헤모글로빈의 광학 흡수를 측정하며, 헤모글로빈의 산소화 상태에 따라 다양한 흡수 스펙트럼에 의존한다.고밀도 확산 광학 단층촬영(HD-DOT)은 두 기법으로 연구한 과목에서 시각 자극에 대한 반응을 사용해 fMRI와 직접 비교한 결과 안심할 수 있다.[10]HD-DOT는 언어 작업 및 휴식 상태 기능 연결 측면에서도 fMRI와 비교되었다.[11]
이벤트 관련 광신호(EROS)는 광섬유를 통해 적외선을 이용해 대뇌피질 활성 영역의 광학적 특성 변화를 측정하는 뇌스캔 기법이다.분산형 광학영상(DOT)이나 근적외선 분광학(NIRS)과 같은 기법이 헤모글로빈의 광학적 흡수를 측정하여 혈류를 기반으로 하는 반면, EROS는 뉴런 자체의 산란 특성을 이용하여 세포 활동을 훨씬 더 직접적으로 측정한다.EROS는 밀리미터 이내(공간적으로)와 밀리초 이내(임시적으로) 뇌의 활동을 정확히 찾아낼 수 있다.그것의 가장 큰 단점은 수 센티미터 이상의 활동을 감지할 수 없다는 것이다.EROS는 시험 대상에 비침습적인 새롭고 비교적 저렴한 기법이다.그것은 일리노이 대학교의 Urbana-Champaign에서 개발되었으며, 현재 Gabriele Gratton 박사와 Monica Fabiani 박사의 인지 신경영상 실험실에서 사용되고 있다.
자기공명영상
자기공명영상(MRI)은 자기장과 전파를 이용해 전리방사선(X선)이나 방사능 추적기를 사용하지 않고 뇌 구조의 고품질 2차원 또는 3차원 영상을 만들어낸다.
온전한 뇌(사후)의 가장 높은 공간 분해능에 대한 기록은 매사추세츠 종합병원에서 100미크론이다.이 데이터는 2019년 10월 30일 네이처에 게재됐다.[12][13]
기능성 자기공명영상
기능성 자기공명영상(fMRI)과 동맥 스핀 라벨링(ASL)은 신경 활동과 연관된 뇌의 혈류 변화 영상을 보기 위해 산소와 탈산성의 파라마그네틱 특성에 의존한다.이것은 어떤 뇌 구조가 다른 과제의 수행 중에 활성화되는지(그리고 어떻게)를 반영하는 영상이 생성될 수 있도록 한다.산소화 가설에 따르면, 인지 활동이나 행동 활동 중 지역 뇌혈류에서 산소 사용량의 변화는 참여 중인 인지 또는 행동 과제와 직접 관련이 있는 것으로 지역 뉴런과 연관될 수 있다.
대부분의 fMRI 스캐너는 피실험자에게 다른 시각적 영상, 소리, 촉각 자극을 제시하고 버튼을 누르거나 조이스틱을 움직이는 등 다른 행동을 할 수 있게 해준다.결과적으로, fMRI는 지각, 사고, 행동과 관련된 뇌의 구조와 과정을 밝히는 데 사용될 수 있다.fMRI의 분해능은 현재 약 2~3mm로 신경 활동에 대한 혈류역학적 반응의 공간적 확산에 의해 제한된다.그것은 주로 뇌 활성화 패턴 연구를 위해 PET를 대체했다.그러나 PET는 방사선으로 된 수용체 "리간즈"를 영상화하는 능력을 통해 특정 신경전달물질과 관련된 특정 뇌 수용체(또는 전달체)를 식별할 수 있다는 유의미한 장점을 가지고 있다(수용체 리간드는 수용체에 달라붙는 모든 화학물질이다).
건강한 주제에 대한 연구뿐만 아니라, fMRI는 질병의 의학 진단에 점점 더 많이 사용되고 있다.fMRI는 혈류 중의 산소 사용량에 정교하게 민감하기 때문에 뇌졸중에 따른 변화 등 허혈(보통 혈류량이 낮음)으로 인한 뇌의 초기 변화에 극도로 민감하다.혈전을 녹이는 물질은 특정 유형의 뇌졸중이 발생한 후 처음 몇 시간 안에 사용될 수 있지만 그 후에 사용하기는 위험하기 때문에 신경학에서는 특정 유형의 뇌졸중에 대한 조기 진단이 점점 더 중요하다.fMRI에서 볼 수 있는 뇌 변화는 이러한 요원으로 치료하는 결정을 내리는 데 도움이 될 수 있다.우연이 0.[14]8%를 달성하는 72% ~ 90%의 정확도로, fMRI 기법은 피험자가 보고 있는 알려진 이미지의 집합을 결정할 수 있다.[15]
자석뇌술
자기 뇌파(MEG)는 초전도 양자 간섭 소자(SQUID)나 스핀 교환 완화[16](SPIRF) 자기계 등 극도로 민감한 장치를 통해 뇌에서 전기적 활동에 의해 생성되는 자기장을 측정하는 영상 기법이다.MEG는 시간 분해능은 매우 높지만 공간 분해능은 상대적으로 낮은 신경 전기적 활동(예를 들어 fMRI와 비교)을 매우 직접적으로 측정한다.신경 활동에 의해 생성되는 자기장을 측정할 때의 장점은 뇌전파(EEG)로 측정한 전기장에 비해 주변 조직(특히 두개골과 두피)에 의해 왜곡될 가능성이 적다는 것이다.구체적으로는 전기적 활동에 의해 생성되는 자기장이 주변 헤드 조직의 영향을 받지 않는다는 것을 보여줄 수 있는데, 헤드가 동심원 구면 쉘의 집합으로 모델링되었을 때 각각은 등방성 균질 도체가 된다.실제 머리는 비구형이며 대부분 비등방성 전도성(특히 백색 물질과 두개골)을 가지고 있다.두개골 음이소트로피는 MEG에 무시할 수 있는 영향을 미치는 반면(EEG와는 달리), 백색 물질 음이소트로피는 방사상 및 심층 선원에 대한 MEG 측정에 강한 영향을 미친다.[17]그러나, 이 연구에서 두개골은 균일하게 비등방성으로 가정되었는데, 이는 실제 머리에는 해당되지 않는다: 디플로와 테이블 층의 절대적 및 상대적 두께는 두개골 뼈들 사이와 내부에서 다양하다.이것은 비록 EEG와 같은 정도는 아닐지라도 [18]MEG 또한 두개골의 비등각성에 의해 영향을 받을 가능성이 높다.
MEG에는 많은 용도가 있는데, 여기에는 의사들이 병리학의 국소화를 돕는 것, 연구자들이 뇌의 다양한 부분의 기능을 결정하는 것을 돕는 것, 신경피드백 등을 포함한다.
양전자 방출 단층 촬영
양전자 방출 단층촬영(PET)과 뇌 양전자 방출 단층촬영은 혈류로 주입된 신진대사 활성 화학물질의 방사선을 측정한다.배출 데이터는 컴퓨터 처리로 뇌 전체에서 화학 물질의 분포를 2차원 또는 3차원 영상으로 만들어 낸다.[19]: 57 사용되는 양전자 방출 방사성 동위원소는 사이클로트론에 의해 생산되며, 화학 물질은 이러한 방사성 원자로 표기가 되어 있다.라벨이 붙은 이 화합물은 라디오트레이커라고 불리며 혈류로 주입되어 결국 뇌로 전달된다.PET 스캐너의 센서는 화합물이 뇌의 다양한 부위에 축적되면서 방사능을 감지한다.컴퓨터는 센서에 의해 수집된 데이터를 사용하여 뇌에서 화합물이 작용하는 곳을 보여주는 다색의 2차원 또는 3차원 이미지를 만든다.특히 유용한 것은 신경전달물질 활동의 다른 측면을 매핑하는 데 사용되는 광범위한 리간드인데, 지금까지 가장 일반적으로 사용되는 PET 추적기는 라벨이 부착된 형태의 포도당이다(Fludeoxyglucose (18F) (FDG) 참조).
PET 스캐닝의 가장 큰 이점은 서로 다른 화합물이 작용하는 뇌의 조직에서 혈액의 흐름과 산소 및 포도당 신진대사를 보여줄 수 있다는 것이다.이러한 측정은 뇌의 다양한 부위의 뇌 활동량을 반영하며 뇌가 어떻게 작용하는지 더 많이 알 수 있게 해준다.PET 스캔은 처음 사용할 수 있게 되었을 때 분해능과 완료 속도(최소 30초) 면에서 다른 모든 대사 영상 방법보다 우수했다.향상된 분해능은 특정한 과제에 의해 활성화된 뇌의 영역에 대해 더 나은 연구를 할 수 있게 했다.PET 스캐닝의 가장 큰 단점은 방사능이 빠르게 감소하기 때문에 짧은 작업을 모니터링하는 데 국한된다는 점이다.[19]: 60 fMRI 기술이 온라인에 등장하기 전에는 PET 스캐닝이 (구조적 뇌 영상과는 반대로) 선호되는 기능적 뇌 이미징 방법이었으며, 신경 과학에 큰 기여를 계속 하고 있다.
PET스캔은 뇌질환 진단에도 사용되는데, 특히 치매(알츠하이머병 등)를 유발하는 뇌종양, 뇌졸중, 뉴런 손상질환 모두 뇌대사에 큰 변화를 일으키며, 이는 결국 PET스캔에서 쉽게 감지할 수 있는 변화를 일으키기 때문이다.PET는 초기 손상이 너무 확산되어 뇌 부피와 총구조의 차이가 너무 적어 CT와 표준 MRI 영상을 "정상" 범위와 신뢰성 있게 구별할 수 있을 정도로 변경하지 못하는 특정 치매(알츠하이머병과 픽스병)의 초기 사례에서 가장 유용할 것이다.노화와 함께 발생하는 피질 위축증은 임상적 치매를 유발하지 않는다.
싱글 포토톤 방출 컴퓨터 단층 촬영
단일광자 방출 컴퓨터 단층촬영(SPEP)은 PET와 유사하며 감마선 방출 방사성 동위원소와 감마 카메라를 사용하여 컴퓨터가 활성 뇌 영역의 2차원 또는 3차원 영상을 구성하는 데 사용하는 데이터를 기록한다.[20]SPECT는 뇌에 의해 빠르게 흡수되지만 재분배되지 않는 방사성 추적제, 즉 "SPECT"의 주입에 의존한다.SPECT 제제의 흡수는 30~60초 이내에 100%에 육박해 주사 당시 뇌혈류(CBF)를 반영한다.이러한 SPECT의 성질은 뇌전증 영상촬영에 특히 적합하며, 이는 대개 환자의 움직임과 가변적 발작 유형의 문제로 인해 어려워진다.SPECT는 발작 종료 후(발작 당시 방사능 추적기가 주입된 경우) 스캔을 획득할 수 있기 때문에 뇌혈류 '스냅샷'을 제공한다.SPECT의 경우 MRI에 비해 분해능(약 1cm)이 떨어진다는 점이 큰 한계다.오늘날 이중 검출기 헤드가 장착된 SPECT 기계는 일반적으로 사용되고 있지만, 트리플 검출기 헤드 기계는 시장에서 구입할 수 있다.단층 재구성(주로 뇌의 기능적 "스냅샷"에 사용)은 인간의 두개골을 중심으로 회전하는 검출기 헤드의 다중 투영을 필요로 하기 때문에, 일부 연구자들은 영상 시간을 줄이고 더 높은 해상도를 제공하기 위해 6기와 11대의 검출기 헤드 SPECT 기계를 개발했다.[21][22]
SPECT는 PET와 마찬가지로 치매를 일으키는 여러 종류의 질병 과정을 구분하는 데도 사용할 수 있으며, 이를 위해 점점 더 많이 사용되고 있다.신경-PET는 FDG와 같이 반감기가 최대 110분인 트래커를 사용하도록 하는 단점이 있다.이것들은 사이클로트론에서 만들어져야 하며, 필요한 수송 시간이 몇 개 반 리브 이상 길어지면 비싸거나 심지어 사용할 수 없다.그러나 SPECT는 테크네튬-99m와 같이 훨씬 긴 반감기를 가진 트래커를 사용할 수 있고, 그 결과 훨씬 더 널리 이용할 수 있게 되었다.
두개 초음파
두개골 초음파는 보통 아기들에게만 사용되는데, 아기들의 열린 폰타넬은 뇌의 초음파 영상을 촬영할 수 있는 음향 창을 제공한다.장점은 이온화 방사선의 부재와 침대 옆 스캐닝의 가능성이다. 그러나 소프트 이슈 디테일이 없다는 것은 MRI가 어떤 조건에서는 선호된다는 것을 의미한다.
기능성 초음파 영상촬영
기능 초음파 영상촬영(fUS)은 일반적으로 혈류나 혈류역학적 변화 측정을 통해 신경활동이나 신진대사의 변화를 감지하거나 측정하는 의료 초음파 영상기법이다.기능성 초음파는 초음파 감도가 높은 도플러와 초고속 초음파 영상에 의존해 고감도 혈류 영상촬영이 가능하다.
양자 광학점프 자력계
2021년 6월, 연구원들은 자기 이미징을 사용하는 최초의 모듈형 양자 뇌 스캐너가 개발되었고 새로운 전뇌 스캐닝 접근법이 될 수 있다고 보고했다.[23][24]
신경 이미지 생성 기술의 장점과 우려 사항
기능성 자기공명영상(fMRI)
fMRI는 일반적으로 다른 영상 방법에 비해 비침습성으로 인해 최소-모더링 위험으로 분류되며, fMRI는 혈액 산소 농도 의존성(BOLD)-대조도를 사용하여 영상 형태를 생성한다.볼드-대조도는 신체에서 자연적으로 발생하는 과정이기 때문에 방사능 마커가 유사한 영상을 생성하도록 요구하는 영상 방법보다 fMRI가 선호되는 경우가 많다.[25]fMRI의 사용에서 우려되는 점은 의료용 임플란트나 기기, 그리고 신체에 금속성 물품이 있는 개인에게 사용하는 것이다.장비에서 방출되는 자기공명(MR)은 의료기기의 고장을 유발할 수 있으며, 적절히 선별하지 않을 경우 신체의 금속 물체를 끌어당길 수 있다.현재 FDA는 MR 호환성에 따라 MR-safe(모든 MR 환경에서 안전), MR-safe(모든 MR 환경에서 안전하지 않음), MR-조건(특정 환경에서는 MR-호환성, 추가 정보가 필요함)[26]의 3가지 범주로 의료용 임플란트와 장치를 분류하고 있다.
- 삽입물 및 장치에 대한 FDA MR 안전 라벨
MR 세이프[27]
컴퓨터 단층 촬영(CT) 스캔
CT 스캔은 1970년대에 도입되었고 빠르게 가장 널리 사용되는 영상 방법 중 하나가 되었다.CT 스캔은 1초 이내에 수행될 수 있으며 임상의에게 빠른 결과를 제공할 수 있으며, 사용이 용이하여 1980년 300만 개에서 2007년 6200만 개로 미국에서 수행된 CT 스캔이 증가하였다.임상의사들은 종종 여러 번 스캔을 하는데, CT 스캔 사용에 대한 한 연구에서 30%의 사람들이 적어도 3번 스캔을 받는다.[28]CT 스캔은 환자를 기존 X선보다 100~500배 높은 방사선 수준에 노출시킬 수 있으며, 방사선량이 높으면 분해능이 더 좋아진다.[29]사용이 쉽지만 특히 무증상 환자의 CT 스캔 사용 증가가 관심의 대상이다. 환자가 상당히 높은 수준의 방사선에 노출되기 때문이다.[28]
양전자 방출 단층 촬영(PET)
PET 스캔에서 이미징은 본질적인 생물학적 과정에 의존하지 않고 뇌로 이동하는 혈류로 주입된 이물질에 의존한다.환자들은 뇌에서 대사되는 방사성 동위원소를 주사하고 양전자(positron)를 방출하여 뇌 활동을 시각화한다.[25]PET 스캔에서 환자가 노출되는 방사선량은 비교적 작으며, 1년 동안 개인이 노출되는 환경 방사선의 양에 비견된다.PET 방사성동위원소는 보통 매우 짧은 반감기(약 2시간)를 가지고 있고 빠르게 부패하기 때문에 체내 노출 시간이 제한된다.[30]현재 fMRI는 방사선을 동반하지 않고 PET보다 시간 분해능이 높고 대부분의 의료 환경에서 쉽게 사용할 수 있어 PET에 비해 뇌 활동을 영상화하는 데 선호되는 방법이다.[25]
자기뇌파(MEG)와 뇌파(EEG)
MEG와 EEG의 높은 시간 분해능은 이러한 방법들이 뇌 활동을 밀리초까지 측정할 수 있게 해준다.MEG와 EEG 모두 기능을 위해 방사선에 대한 환자의 노출을 요구하지 않는다.EEG 전극은 뇌 활동을 측정하기 위해 뉴런에 의해 생성된 전기 신호를 감지하고, MEG는 이러한 전류가 생성하는 자기장의 진동을 사용하여 활동을 측정한다.MEG 시스템의 광범위한 사용의 장벽은 가격 책정 때문이다. MEG 시스템은 수백만 달러의 비용이 들 수 있기 때문이다.EEG는 EEG 시스템이 MEG 시스템보다 훨씬 비용이 적게 들기 때문에 그러한 일시적 해결을 위해 훨씬 더 널리 사용되는 방법이다.EEG와 MEG의 단점은 두 방법 모두 fMRI에 비해 공간 분해능이 떨어진다는 점이다.[25]
참고 항목
참조
- ^ Sandrone S, Bacigaluppi M, Galloni MR, Martino G (November 2012). "Angelo Mosso (1846-1910)". Journal of Neurology. 259 (11): 2513–4. doi:10.1007/s00415-012-6632-1. hdl:2318/140004. PMID 23010944. S2CID 13365830.
- ^ Miller TH, Kruse JE (October 2005). "Evaluation of syncope". American Family Physician. 72 (8): 1492–500. PMID 16273816.
- ^ a b American College of Physicians (September 2013), "Five Things Physicians and Patients Should Question", Choosing Wisely: an initiative of the ABIM Foundation, American College of Physicians, retrieved 10 December 2013, 어느 것을 인용하는가.
- American College of Radiology; American Society of Neuroradiology (2010), "ACR-ASNR practice guideline for the performance of computed tomography (CT) of the brain", Agency for Healthcare Research and Quality, Reston, VA, USA: American College of Radiology, archived from the original on 15 September 2012, retrieved 9 September 2012
- Transient loss of consciousness in adults and young people: NICE guideline, National Institute for Health and Clinical Excellence, 25 August 2010, retrieved 9 September 2012
- Moya A, Sutton R, Ammirati F, Blanc JJ, Brignole M, Dahm JB, Deharo JC, Gajek J, Gjesdal K, Krahn A, Massin M, Pepi M, Pezawas T, Ruiz Granell R, Sarasin F, Ungar A, van Dijk JG, Walma EP, Wieling W (November 2009). "Guidelines for the diagnosis and management of syncope (version 2009)". European Heart Journal. 30 (21): 2631–71. doi:10.1093/eurheartj/ehp298. PMC 3295536. PMID 19713422.
- ^ a b c d American Headache Society (September 2013), "Five Things Physicians and Patients Should Question", Choosing Wisely: an initiative of the ABIM Foundation, American Headache Society, archived from the original on 3 December 2013, retrieved 10 December 2013, 어느 것을 인용하는가.
- Lewis DW, Dorbad D (September 2000). "The utility of neuroimaging in the evaluation of children with migraine or chronic daily headache who have normal neurological examinations". Headache. 40 (8): 629–32. doi:10.1046/j.1526-4610.2000.040008629.x. PMID 10971658. S2CID 14443890.
- Silberstein SD (September 2000). "Practice parameter: evidence-based guidelines for migraine headache (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology". Neurology. 55 (6): 754–62. doi:10.1212/WNL.55.6.754. PMID 10993991.
- "Neuroimaging for the evaluation of chronic headaches: an evidence-based analysis". Ontario Health Technology Assessment Series. 10 (26): 1–57. 2010. PMC 3377587. PMID 23074404.
- ^ Thomas DG, Anderson RE, du Boulay GH (January 1984). "CT-guided stereotactic neurosurgery: experience in 24 cases with a new stereotactic system". Journal of Neurology, Neurosurgery, and Psychiatry. 47 (1): 9–16. doi:10.1136/jnnp.47.1.9. PMC 1027634. PMID 6363629.
- ^ Heilbrun MP, Sunderland PM, McDonald PR, Wells TH, Cosman E, Ganz E (1987). "Brown-Roberts-Wells stereotactic frame modifications to accomplish magnetic resonance imaging guidance in three planes". Applied Neurophysiology. 50 (1–6): 143–52. doi:10.1159/000100700. PMID 3329837.
- ^ Leksell L, Leksell D, Schwebel J (January 1985). "Stereotaxis and nuclear magnetic resonance". Journal of Neurology, Neurosurgery, and Psychiatry. 48 (1): 14–8. doi:10.1136/jnnp.48.1.14. PMC 1028176. PMID 3882889.
- ^ Levivier M, Massager N, Wikler D, Lorenzoni J, Ruiz S, Devriendt D, David P, Desmedt F, Simon S, Van Houtte P, Brotchi J, Goldman S (July 2004). "Use of stereotactic PET images in dosimetry planning of radiosurgery for brain tumors: clinical experience and proposed classification". Journal of Nuclear Medicine. 45 (7): 1146–54. PMID 15235060.
- ^ Jeeves MA (1994). Mind Fields: Reflections on the Science of Mind and Brain. Grand Rapids, MI: Baker Books. p. 21.
- ^ Eggebrecht AT, White BR, Ferradal SL, Chen C, Zhan Y, Snyder AZ, Dehghani H, Culver JP (July 2012). "A quantitative spatial comparison of high-density diffuse tomography and fMRI cortical mapping". NeuroImage. 61 (4): 1120–8. doi:10.1016/j.neuroimage.2012.01.124. PMC 3581336. PMID 22330315.
- ^ Eggebrecht AT, Ferradal SL, Robichaux-Viehoever A, Hassanpour MS, Dehghani H, Snyder AZ, Hershey T, Culver JP (June 2014). "Mapping distributed brain function and networks with diffuse optical tomography". Nature Photonics. 8 (6): 448–454. Bibcode:2014NaPho...8..448E. doi:10.1038/nphoton.2014.107. PMC 4114252. PMID 25083161.
- ^ Dockrill, Peter. "100-Hour-Long MRI of Human Brain Produces Most Detailed 3D Images Yet". www.sciencealert.com.
- ^ Hospital, Massachusetts General. "Team publishes on highest resolution brain MRI scan". medicalxpress.com.
- ^ Smith K (March 5, 2008). "Mind-reading with a brain scan". Nature News. Nature Publishing Group. Retrieved 2008-03-05.
- ^ Keim B (March 5, 2008). "Brain Scanner Can Tell What You're Looking At". Wired News. CondéNet. Retrieved 2015-09-16.
- ^ Boto, Elena; Holmes, Niall; Leggett, James; Roberts, Gillian; Shah, Vishal; Meyer, Sofie S.; Muñoz, Leonardo Duque; Mullinger, Karen J.; Tierney, Tim M. (March 2018). "Moving magnetoencephalography towards real-world applications with a wearable system". Nature. 555 (7698): 657–661. Bibcode:2018Natur.555..657B. doi:10.1038/nature26147. ISSN 1476-4687. PMC 6063354. PMID 29562238.
- ^ Wolters CH, Anwander A, Tricoche X, Weinstein D, Koch MA, MacLeod RS (April 2006). "Influence of tissue conductivity anisotropy on EEG/MEG field and return current computation in a realistic head model: a simulation and visualization study using high-resolution finite element modeling". NeuroImage. 30 (3): 813–26. doi:10.1016/j.neuroimage.2005.10.014. hdl:11858/00-001M-0000-0019-1079-8. PMID 16364662. S2CID 5578998.
- ^ Ramon C, Haueisen J, Schimpf PH (October 2006). "Influence of head models on neuromagnetic fields and inverse source localizations". BioMedical Engineering OnLine. 5 (1): 55. doi:10.1186/1475-925X-5-55. PMC 1629018. PMID 17059601.
- ^ a b Nilsson L, Markowitsch HJ (1999). Cognitive Neuroscience of Memory. Seattle: Hogrefe & Huber Publishers.
- ^ 필립 볼 브레인 이미징 설명
- ^ "SPECT Systems for Brain Imaging". Retrieved July 24, 2014.
- ^ "SPECT Brain Imaging". Retrieved January 12, 2016.
- ^ "Researchers build first modular quantum brain sensor, record signal". phys.org. Retrieved 11 July 2021.
- ^ Coussens, Thomas; Abel, Christopher; Gialopsou, Aikaterini; Bason, Mark G.; James, Tim M.; Orucevic, Fedja; Kruger, Peter (10 June 2021). "Modular optically-pumped magnetometer system". arXiv:2106.05877 [physics]. arXiv:2106.05877. Retrieved 11 July 2021.
- ^ a b c d Crosson B, Ford A, McGregor KM, Meinzer M, Cheshkov S, Li X, Walker-Batson D, Briggs RW (2010). "Functional imaging and related techniques: an introduction for rehabilitation researchers". Journal of Rehabilitation Research and Development. 47 (2): vii–xxxiv. doi:10.1682/jrrd.2010.02.0017. PMC 3225087. PMID 20593321.
- ^ Tsai LL, Grant AK, Mortele KJ, Kung JW, Smith MP (October 2015). "A Practical Guide to MR Imaging Safety: What Radiologists Need to Know". Radiographics. 35 (6): 1722–37. doi:10.1148/rg.2015150108. PMID 26466181.
- ^ Center for Devices and Radiological Health. "MRI (Magnetic Resonance Imaging) - MRI Safety Posters". www.fda.gov. Retrieved 2018-04-10.
- ^ a b Brenner DJ, Hall EJ (November 2007). "Computed tomography--an increasing source of radiation exposure". The New England Journal of Medicine. 357 (22): 2277–84. doi:10.1056/NEJMra072149. PMID 18046031.
- ^ Smith-Bindman R (July 2010). "Is computed tomography safe?". The New England Journal of Medicine. 363 (1): 1–4. doi:10.1056/NEJMp1002530. PMID 20573919.
- ^ "What happens during a PET scan?". PubMed Health. 2016-12-30.
외부 링크
| 위키미디어 커먼즈에는 뉴로이미징과 관련된 미디어가 있다. |
- 하버드 대학교의 통 브레인 아틀라스
- 런던대학의 윌 페니에 의한 신경 이미지 생성의 수학적 측면에 대한 강의 노트
- MIT AI 연구소와 연계한 마이클 레벤턴의 '트랜스크라닉 자기 자극'.
- NeuroDebian – NeuroDebian을 대상으로 하는 완벽한 운영 체제