시스타티오닌β합성효소
Cystathionine beta synthase| CBS | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||||||||
| 에일리어스 | CBS, HIP4, 시스타티오닌 베타합성효소, CBSL, 시스타티오닌 베타합성효소 | ||||||||||||||||||||||||||||||
| 외부 ID | OMIM: 613381 MGI: 88285 HomoloGene: 37258 GeneCard: CBS | ||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| 위키데이터 | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
CBS로도 알려진 시스타티오닌-β-합성효소는 CBS 유전자에 의해 인간에서 암호화되는 효소(EC 4.2.1.22)이다.황화 경로의 첫 단계인 호모시스테인에서 시스타티오닌으로 [5]촉매한다.
CBS는 보조인자 피리독살인산(PLP)을 사용하며, 유비쿼터스 보조인자 S-아데노실-L-메티오닌(adoMet)과 같은 이펙터에 의해 알로스테릭하게 조절될 수 있다.이 효소는 분해효소, 구체적으로는 탄소-산소 결합을 분해하는 가수분해효소군에 속합니다.
CBS는 N 말단 효소 도메인과 2개의 CBS 도메인으로 구성된 다중 도메인 효소이다.CBS 유전자는 [6]호모시스티뇨증과 관련된 돌연변이의 가장 흔한 흔적이다.
명명법
이 효소 클래스의 계통명은 L-세린 가수분해효소(호모시스테인 첨가, L-시스타티오닌 형성)이다.일반적으로 사용되는 다른 이름은 다음과 같습니다.
- β-티오나아제
- 시스테인 합성효소
- L-세린 가수분해효소(호모시스테인 첨가),
- 메틸시스테인합성효소
- 세린술피드라아제 및
- 세린술피드릴라아제
메틸시스테인 합성효소는 1961년에 EC 번호 4.2.1.23으로 지정되었다.CBS의 반작용이 이것을 야기했다.EC 번호 4.2.1.23은 [7]1972년에 삭제되었다.
구조.

인간 효소 시스타티오닌β-합성효소는 사량체이며, 서브유닛 분자량 61kDa의 아미노산 551개로 구성되어 있다.N 터미널 헴 도메인과 PLP 보조 [9]계수를 포함하는 코어에 이은 3개의 모듈 구성을 표시합니다.보조 인자는 헴 도메인에 깊숙이 있으며 쉬프 [10]기지에 의해 연결됩니다.시프염기는 아릴기 또는 알킬기에 연결된 질소원자와의 C=N결합을 포함하는 관능기이다.헴 도메인은 70개의 아미노산으로 구성되며 헴은 포유류 CBS에만 존재하며 효모와 원생동물 CBS에는 없는 것으로 보인다.CBS의 조절영역은 CBS의 다른 [9]단백질에서 발견되는 2차 구조 모티브인 β-α-β-α의 2개의 CBS영역의 탠덤 반복을 포함한다.CBS에는 C 말단 억제 도메인이 있습니다.시스타티오닌 β-합성효소의 C 말단 도메인은 인트라스터릭 효과와 알로스테릭 효과 모두를 통해 활성을 조절하며 단백질의 [9]사량체 상태를 유지하는 데 중요하다.이러한 억제는 알로스테릭 이펙터인 아도메트의 결합 또는 조절 영역의 결실로 완화되지만 효과의 크기는 다르다.[9]이 영역의 돌연변이는 유전병과 [11]관련이 있다.
헴 도메인은 헴을 결합하고 축방향 리간드 C52 및 H65를 제공하는 N-말단 루프를 포함합니다.PLP 결합 부위로부터의 헴의 거리는 촉매 작용에서 헴의 비역할을 나타내지만, 헴 도메인의 결실은 레독스 감수성 상실을 야기하므로 헴은 레독스 [10]센서라는 가설이 있다.CBS에서 프로토포르피린 IX의 존재는 독특한 PLP 의존성 효소이며 포유류 CBS에서만 발견된다.D. melanogaster 및 D. discoides는 N 말단 확장을 잘라서 보존된 히스티딘 및 시스테인 헴 리간드 잔기를 방지한다.단, 아노펠레스 감비아 배열은 인간 효소보다 긴 N 말단 확장을 가지며, 인간 헴과 같이 보존된 히스티딘 및 시스테인 헴 리간드 잔기를 포함한다.따라서 슬라임 곰팡이와 곤충의 CBS는 헴 도메인이 동물과 슬라임 [9]곰팡이가 분리되기 전에 생겨난 초기 진화적 혁신임을 시사하는 혈단백질일 가능성이 있다.PLP는 내부 알디민이며 활성 부위에서 K119와 쉬프 염기를 형성합니다.촉매 도메인과 조절 도메인 사이에는 단백질 분해 분열을 일으키고 원래 효소보다 더 활성화된 잘린 이합체 효소를 생성하는 과민성 부위가 존재한다.잘린 효소와 효모에서 발견되는 효소는 모두 adoMet에 의해 조절되지 않는다.효모 효소는 또한 C 말단의 결실로 활성화되어 이합체 [9]효소를 생성한다.
2007년 말 현재, 이 등급의 효소에 대해 PDB 가입 코드 1JBQ와 1M54의 두 가지 구조가 해결되었다.
효소 활성
| 시스타티오닌β합성효소 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
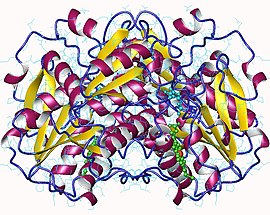 시스타티오닌β신타아제 호모디머, 인간 | |||||||||
| 식별자 | |||||||||
| EC 번호 | 4.2.1.22 | ||||||||
| CAS 번호 | 9023-99-8 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 엔트리 | ||||||||
| ExPASy | NiceZyme 뷰 | ||||||||
| 케그 | KEGG 엔트리 | ||||||||
| 메타사이크 | 대사 경로 | ||||||||
| 프라이머리 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBum | ||||||||
| 진 온톨로지 | AmiGO / QuickGO | ||||||||
| |||||||||

CBS에 의해 촉매된 황화 작용은 호모시스테인을 시스타티오닌으로 변환하고, 시스타티온 감마 리아제는 시스테인으로 [12]변환합니다.
CBS는 메티오닌을 보존하거나 황화 경로를 통해 메티오닌을 시스테인으로 변환하는 결정이 이루어지는 호모시스테인 접합부에서 포유류의 황 대사에서 중추적인 위치를 차지한다.또한 황화경로는 [9]초과조건에서 황 함유 아미노산을 제거할 수 있는 유일한 경로이다.
다른 β 치환 효소와 마찬가지로 CBS에 의해 촉매되는 반응은 일련의 adoMet 결합 중간체를 포함할 것으로 예측된다.세린을 첨가하면 외부 알디민이 되는 트랜스치프화 반응을 일으킨다.알디민은 α-탄소에서 양성자 추상화를 거쳐 아미노 아크릴산 중간체를 생성한다.아미노아크릴산염에 대한 호모시스테인의 티올레이트 및 Cα에서의 재토네이션에 의한 친핵성 공격은 시스타티오닌의 외부 알디민을 생성한다.최종적인 트랜스알디미네이션 반응은 최종 생성물인 시스타티오닌을 [9]방출한다.최종 생성물인 L-시스타티오닌은 또한 아미노아크릴산 중간체를 형성할 수 있으며, 이는 CBS의 전체 반응이 [13]가역적이라는 것을 나타낸다.
효소 촉매 반응의 측정된0 V는 일반적으로 정상 상태([ES]가 일정)를 반영하지만, V는0 반응의 초기 부분에 제한되며, 이러한 초기 속도의 분석을 정상 상태 속도론이라고 한다.효모 CBS의 정상 상태 운동 분석 결과 평행선이 생성된다.이러한 결과는 세린 결합과 물의 방출이 호모시스테인 결합과 시스타티오닌의 방출이 이어지는 탁구 메커니즘과 일치한다.이와는 대조적으로 랫드 CBS의 정상상태 효소 동태는 교차선을 산출하여 호모시스테인의 [9]결합 전에 세린의 β-치환물이 효소로부터 방출되지 않음을 나타낸다.
CBS와 관련된 대체 반응 중 하나는 시스테인과 호모시스테인이 응축되어 시스타티오닌과 황화수소(HS2)[13]를 형성하는 것이다.뇌의2 HS는 CBS에 의해 L-시스테인으로부터 생성된다.이 대체 대사 경로는 또한 [14]adoMet에 의존합니다.
CBS 효소 활성은 모든 조직과 세포에서 발견되지 않는다.쥐의 심장, 폐, 고환, 부신, 비장에 없다.인간에서는 심장 근육과 인간 대동맥 내피 세포의 1차 배양에 없는 것으로 나타났다.이러한 조직에 CBS가 부족하다는 것은 이러한 조직이 시스테인을 합성할 수 없고 시스테인이 세포 외 공급원으로부터 공급되어야 한다는 것을 의미한다.또한 이러한 조직들은 과도한 호모시스테인을 트랜스황화를 [13]통해 이화시킬 수 없기 때문에 호모시스테인 독성에 대한 감수성을 증가시켰을 수 있음을 시사한다.
규정
AdoMet에 의한 CBS의 알로스테릭 활성화는 호모시스테인의 대사 운명을 결정한다.포유류의 CBS는 AdoMet에 의해 15μM의 해리 [6]상수로 2.5~5배 활성화된다.AdoMet은 CBS 반응의 V를max 증가시키는 알로스테릭 활성제이지만 기질의 K에는m 영향을 주지 않습니다.즉 AdoMet은 효소에 [9]대한 기질의 결합보다는 회전율을 높여 CBS 활성을 자극한다.이 단백질은 알로스테릭 [15]조절의 모르핀 모델을 사용할 수 있다.
인간 CBS는 AdoMet에 대한 조절 제어점을 제공함으로써 시스테인의 생합성 경로에서 중요한 단계를 수행한다.호모시스테인은 메티오닌으로 메틸화된 후 AdoMet으로 전환될 수 있으며, AdoMet은 다양한 기질(예: 신경전달물질, 단백질 및 핵산)에 메틸기를 기증한다.AdoMet은 CBS의 알로스테릭 활성화제로 기능하며 생합성을 제어한다. AdoMet의 농도가 낮으면 CBS 활성이 낮아져 호모시스테인이 AdoMet 형성을 향해 전달 사이클로 유입된다.반면, 높은 adoMet 농도는 호모시스테인을 시스테인 생합성을 위한 [16]황화 경로로 유입시킨다.
포유류에서 CBS는 레독스 [11]센서로 기능하는 헴 보조 인자를 포함하는 고도로 조절된 효소이며 레독스 전위의 변화에 반응하여 활성을 조절할 수 있습니다.세포 내 CBS의 휴지 형태가 철(Fe2+) 헴을 가지고 있으면 철([9]Fe3+) 상태로 변환함으로써 산화 조건 하에서 효소를 활성화시킬 가능성이 존재한다.효소의 Fe 형태는 CO2+ 또는 일산화질소와 결합할 때 억제되는 반면, Fe가2+ Fe로3+ 산화되면 효소 활성은 두 배로 증가한다.헴의 산화환원 상태는 pH에 의존하며 낮은 pH 조건에서 [17]Fe–CBS에서 Fe–CBS로 산화가2+3+ 선호된다.
포유동물 CBS는 헴 보조 인자를 포함하고 있는 반면, Trypanosoma cruzi의 효모와 원생동물은 헴 보조 인자를 가지고 있지 않기 때문에, 연구자들은 CBS 활동에 [9]헴이 필요하지 않다고 추측했다.
CBS는 NF-Y, SP-1 및 SP-3에 의해 문자 변환 수준에서 규제됩니다.또한 글루코콜티코이드와 글리코겐에 의해 전사적으로 상향 조절되고 인슐린에 의해 하향 조절된다.메티오닌은 CBS를 복제 후 수준으로 상향 조정한다.
인간의 질병
다운증후군은 시스타티오닌 베타합성효소(CBS)의 과잉 발현과 혈중 호모시스테인 저수준으로 특징지어지는 의학적 질환이다.시스타티오닌 베타 합성효소 과발현이 이 질환의 주범일 수 있다고 추측되어 왔다(GabaA 및 Dyrk1a의 기능 장애와 함께).다운증후군의 표현형은 고호모시스테인혈증(아래 설명)의 반대이다.CBS의 약리학적 억제제는 Jerome Lejeune Foundation(2011년 11월)과 시험(동물과 인간이 계획됨)에 의해 특허를 받았다.
고호모시스테인혈증은 혈중 호모시스테인 수치가 비정상적으로 높은 것이 특징인 질환이다.CBS의 돌연변이는 유전성 고호모시스테인혈증의 가장 흔한 원인이다.MTHFR, MTR 및 MTR/MS 효소 경로에 영향을 미치는 유전적 결함도 높은 호모시스테인 수준에 기여할 수 있습니다.CBS의 선천적 오류는 심혈관계의 합병증을 동반한 고호모시스테인혈증을 유발하며 초기 및 공격적 동맥질환으로 이어진다.고호모시스테인혈증은 또한 안구, 중추신경, [9]골격을 포함한 다른 세 가지 주요 장기 체계에 영향을 미친다.
CBS 결핍으로 인한 호모시스틴뇨증은 고호모시스테인혈증의 특별한 유형이다.일반적으로 소아기에 진단되는 희귀한 유전성 열성 상염색체 질환이다.총 131개의 서로 다른 호모시스티뇨 유발 돌연변이가 확인되었다.CBS 도메인에서의 돌연변이의 일반적인 기능적 특징은 돌연변이가 [16]adoMet에 의한 활성화를 폐지하거나 강하게 감소시킨다는 것이다.호모시스티뇨증에 대한 특별한 치료법은 발견되지 않았지만, 많은 사람들이 CBS의 보조인자인 비타민6 B의 고용량을 사용하여 치료된다.
생명공학
시스타티오닌 베타합성효소(CBS)는 난모세포 발달에 관여한다.그러나 CBS의 난소 내 지역 및 세포 발현 패턴에 대해서는 거의 알려져 있지 않으며, 연구는 현재 난소 [18]내 난포 발달 중 위치와 발현을 결정하는 데 초점을 맞추고 있다.
생쥐에서 시스타티오닌 베타 합성효소가 없으면 자궁 단백질 [19]발현 상실로 인한 불임이 유발된다.
돌연변이
CBS 효소 발현을 조절하는 유전자는 이 유전자에 영향을 미치는 SNP 중 하나를 가진 개인에서 100% 효율로 작동하지 않을 수 있습니다.기존의 배리언트에는 A360A, C699T, I278T, N212N 및 T42N SNP(특히)가 있습니다.효소의 효과에 다양한 영향을 미치는 이러한 SNP는 표준 DNA 검사 방법으로 검출될 수 있다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c GRCh38: 앙상블 릴리즈 89: ENSG00000160200 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG000024039 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Entrez Gene: CBS cystathionine-beta-synthase".
- ^ a b Janosík M, Kery V, Gaustadnes M, Maclean KN, Kraus JP (September 2001). "Regulation of human cystathionine beta-synthase by S-adenosyl-L-methionine: evidence for two catalytically active conformations involving an autoinhibitory domain in the C-terminal region". Biochemistry. 40 (35): 10625–33. doi:10.1021/bi010711p. PMID 11524006.
- ^ EC 4.2.1.23
- ^ PDB: 1JBQ; Meier M, Janosik M, Kery V, Kraus JP, Burkhard P (August 2001). "Structure of human cystathionine beta-synthase: a unique pyridoxal 5'-phosphate-dependent heme protein". The EMBO Journal. 20 (15): 3910–6. doi:10.1093/emboj/20.15.3910. PMC 149156. PMID 11483494.
- ^ a b c d e f g h i j k l m Banerjee R, Zou CG (January 2005). "Redox regulation and reaction mechanism of human cystathionine-beta-synthase: a PLP-dependent hemesensor protein". Archives of Biochemistry and Biophysics. 433 (1): 144–56. doi:10.1016/j.abb.2004.08.037. PMID 15581573.
- ^ a b Yamanishi M, Kabil O, Sen S, Banerjee R (December 2006). "Structural insights into pathogenic mutations in heme-dependent cystathionine-beta-synthase". Journal of Inorganic Biochemistry. 100 (12): 1988–95. doi:10.1016/j.jinorgbio.2006.08.020. PMID 17069888.
- ^ a b Kabil O, Zhou Y, Banerjee R (November 2006). "Human cystathionine beta-synthase is a target for sumoylation". Biochemistry. 45 (45): 13528–36. doi:10.1021/bi0615644. PMID 17087506.
- ^ Nozaki T, Shigeta Y, Saito-Nakano Y, Imada M, Kruger WD (March 2001). "Characterization of transsulfuration and cysteine biosynthetic pathways in the protozoan hemoflagellate, Trypanosoma cruzi. Isolation and molecular characterization of cystathionine beta-synthase and serine acetyltransferase from Trypanosoma". The Journal of Biological Chemistry. 276 (9): 6516–23. doi:10.1074/jbc.M009774200. PMID 11106665.
- ^ a b c Jhee KH, Kruger WD (2005). "The role of cystathionine beta-synthase in homocysteine metabolism". Antioxidants & Redox Signaling. 7 (5–6): 813–22. doi:10.1089/ars.2005.7.813. PMID 15890029.
- ^ Eto K, Kimura H (November 2002). "A novel enhancing mechanism for hydrogen sulfide-producing activity of cystathionine beta-synthase". The Journal of Biological Chemistry. 277 (45): 42680–5. doi:10.1074/jbc.M205835200. PMID 12213817.
- ^ T. Selwood & E. K. Jaffe (2011). "Dynamic dissociating homo-oligomers and the control of protein function". Arch. Biochem. Biophys. 519 (2): 131–43. doi:10.1016/j.abb.2011.11.020. PMC 3298769. PMID 22182754.
- ^ a b Ignoul S, Eggermont J (December 2005). "CBS domains: structure, function, and pathology in human proteins". American Journal of Physiology. Cell Physiology. 289 (6): C1369–78. doi:10.1152/ajpcell.00282.2005. PMID 16275737.
- ^ Puranik M, Weeks CL, Lahaye D, Kabil O, Taoka S, Nielsen SB, Groves JT, Banerjee R, Spiro TG (May 2006). "Dynamics of carbon monoxide binding to cystathionine beta-synthase". The Journal of Biological Chemistry. 281 (19): 13433–8. doi:10.1074/jbc.M600246200. PMC 2745537. PMID 16505479.
- ^ Liang R, Yu WD, Du JB, Yang LJ, Shang M, Guo JZ (November 2006). "Localization of cystathionine beta synthase in mice ovaries and its expression profile during follicular development". Chinese Medical Journal. 119 (22): 1877–83. doi:10.1097/00029330-200611020-00006. PMID 17134586. S2CID 23891500.
- ^ Guzmán MA, Navarro MA, Carnicer R, Sarría AJ, Acín S, Arnal C, Muniesa P, Surra JC, Arbonés-Mainar JM, Maeda N, Osada J (November 2006). "Cystathionine beta-synthase is essential for female reproductive function". Human Molecular Genetics. 15 (21): 3168–76. doi:10.1093/hmg/ddl393. PMID 16984962.
추가 정보
- Kraus JP (1994). "Komrower Lecture. Molecular basis of phenotype expression in homocystinuria". J. Inherit. Metab. Dis. 17 (4): 383–90. doi:10.1007/BF00711354. PMID 7967489. S2CID 42317828.
- Kraus JP, Janosík M, Kozich V, et al. (1999). "Cystathionine beta-synthase mutations in homocystinuria". Hum. Mutat. 13 (5): 362–75. doi:10.1002/(SICI)1098-1004(1999)13:5<362::AID-HUMU4>3.0.CO;2-K. PMID 10338090.
- Jones AL (1999). "The localization and interactions of huntingtin". Philos. Trans. R. Soc. Lond. B Biol. Sci. 354 (1386): 1021–7. doi:10.1098/rstb.1999.0454. PMC 1692601. PMID 10434301.
- Griffiths R, Tudball N (1977). "The molecular defect in a case of (cystathionine beta-synthase)-deficient homocystinuria". Eur. J. Biochem. 74 (2): 269–73. doi:10.1111/j.1432-1033.1977.tb11390.x. PMID 404147.
- Kraus J, Packman S, Fowler B, Rosenberg LE (1978). "Purification and properties of cystathionine beta-synthase from human liver. Evidence for identical subunits". J. Biol. Chem. 253 (18): 6523–8. doi:10.1016/S0021-9258(19)46963-9. PMID 681363.
- Longhi RC, Fleisher LD, Tallan HH, Gaull GE (1977). "Cystathionine beta-synthase deficiency: a qualitative abnormality of the deficient enzyme modified by vitamin B6 therapy". Pediatr. Res. 11 (2): 100–3. doi:10.1203/00006450-197702000-00003. PMID 840498.
- Kozich V, Kraus JP (1993). "Screening for mutations by expressing patient cDNA segments in E. coli: homocystinuria due to cystathionine beta-synthase deficiency". Hum. Mutat. 1 (2): 113–23. doi:10.1002/humu.1380010206. PMID 1301198. S2CID 36663527.
- Münke M, Kraus JP, Ohura T, Francke U (1988). "The gene for cystathionine beta-synthase (CBS) maps to the subtelomeric region on human chromosome 21q and to proximal mouse chromosome 17". Am. J. Hum. Genet. 42 (4): 550–9. PMC 1715237. PMID 2894761.
- Hu FL, Gu Z, Kozich V, et al. (1994). "Molecular basis of cystathionine beta-synthase deficiency in pyridoxine responsive and nonresponsive homocystinuria". Hum. Mol. Genet. 2 (11): 1857–60. doi:10.1093/hmg/2.11.1857. PMID 7506602.
- Sperandeo MP, Panico M, Pepe A, et al. (1995). "Molecular analysis of patients affected by homocystinuria due to cystathionine beta-synthase deficiency: report of a new mutation in exon 8 and a deletion in intron 11". J. Inherit. Metab. Dis. 18 (2): 211–4. doi:10.1007/BF00711769. PMID 7564249. S2CID 40407615.
- Chassé JF, Paly E, Paris D, et al. (1995). "Genomic organization of the human cystathionine beta-synthase gene: evidence for various cDNAs". Biochem. Biophys. Res. Commun. 211 (3): 826–32. doi:10.1006/bbrc.1995.1886. PMID 7598711.
- Shih VE, Fringer JM, Mandell R, et al. (1995). "A missense mutation (I278T) in the cystathionine beta-synthase gene prevalent in pyridoxine-responsive homocystinuria and associated with mild clinical phenotype". Am. J. Hum. Genet. 57 (1): 34–9. PMC 1801250. PMID 7611293.
- Kluijtmans LA, Blom HJ, Boers GH, et al. (1995). "Two novel missense mutations in the cystathionine beta-synthase gene in homocystinuric patients". Hum. Genet. 96 (2): 249–50. doi:10.1007/BF00207394. PMID 7635485. S2CID 6642338.
- Sebastio G, Sperandeo MP, Panico M, et al. (1995). "The molecular basis of homocystinuria due to cystathionine beta-synthase deficiency in Italian families, and report of four novel mutations". Am. J. Hum. Genet. 56 (6): 1324–33. PMC 1801112. PMID 7762555.
- Marble M, Geraghty MT, de Franchis R, et al. (1995). "Characterization of a cystathionine beta-synthase allele with three mutations in cis in a patient with B6 nonresponsive homocystinuria". Hum. Mol. Genet. 3 (10): 1883–6. doi:10.1093/hmg/3.10.1883. PMID 7849717.
- Kraus JP, Le K, Swaroop M, et al. (1994). "Human cystathionine beta-synthase cDNA: sequence, alternative splicing and expression in cultured cells". Hum. Mol. Genet. 2 (10): 1633–8. doi:10.1093/hmg/2.10.1633. PMID 7903580.
- de Franchis R, Kozich V, McInnes RR, Kraus JP (1995). "Identical genotypes in siblings with different homocystinuric phenotypes: identification of three mutations in cystathionine beta-synthase using an improved bacterial expression system". Hum. Mol. Genet. 3 (7): 1103–8. doi:10.1093/hmg/3.7.1103. PMID 7981678.
- Kruger WD, Cox DR (1994). "A yeast system for expression of human cystathionine beta-synthase: structural and functional conservation of the human and yeast genes". Proc. Natl. Acad. Sci. U.S.A. 91 (14): 6614–8. Bibcode:1994PNAS...91.6614K. doi:10.1073/pnas.91.14.6614. PMC 44253. PMID 8022826.
- Kozich V, de Franchis R, Kraus JP (1993). "Molecular defect in a patient with pyridoxine-responsive homocystinuria". Hum. Mol. Genet. 2 (6): 815–6. doi:10.1093/hmg/2.6.815. PMID 8353501.









