CBS 도메인
CBS domain| CBS 도메인 | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
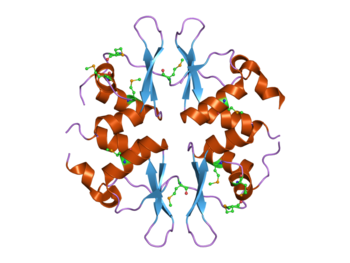 4개의 CBS 도메인을 포함하는 효모 SNF4 단백질 구조.[1]이 단백질은 AMP 활성 단백질 키나아제(AMPK) 복합체의 일부다. | |||||||||||
| 식별자 | |||||||||||
| 기호 | CBS | ||||||||||
| Pfam | PF00571 | ||||||||||
| 인터프로 | IPR000644 | ||||||||||
| 스마트 | CBS | ||||||||||
| 프로사이트 | PS51371 | ||||||||||
| SCOP2 | 1zfj / SCOPe / SUPFAM | ||||||||||
| CDD | cd02205 | ||||||||||
| |||||||||||
분자생물학에서 CBS 영역은 박테리아에서 인간에 이르는 모든 종의 단백질 범위에서 발견되는 단백질 영역이다.1997년에 보존된 염기서열 지역으로 처음 확인되었고, 이 염기서열에서 발견되는 단백질 중 하나인 시스타티오닌 베타 신타아제의 이름을 따서 명명되었다.[2]CBS 영역은 또한 이노신 단인산 탈수소효소,[3] 전압 게이트 염화물 채널[4][5][6][7][8] 및 AMP 활성 단백질 키나아제(AMPK)와 같은 매우 다양한 단백질에서 발견된다.[9][10]CBS 도메인은 AMP와 ATP와 같은 [11]아데노실 그룹 또는 s-adenosylmethionine과 같은 아데노실 그룹과의 결합 분자에 대응하여 관련 효소 및 전달 영역의 활동을 규제한다.
구조
CBS 도메인은 베타카베타알파 2차 구조 패턴으로 구성되어 있으며, 한쪽 면에 2개의 α-헬리크가 있는 3단 반팔렐 β-시트(sheet)를 포함하는 구상형 3차 구조로 접혀 있다.CBS 도메인은 항상 단백질 서열에서 쌍으로 발견되며, 이들 도메인의 각 쌍은 소위 CBS-페어 또는 베이트만 도메인을 형성하는 그들의 β-시트들을 통해 사이비 조광기 배열로 밀접하게 연관된다.[12][13]이러한 CBS 도메인 쌍은 디스크와 같은 콤팩트 구조를 형성하는 정면(즉, PDB 코드 3KPC, 1PVM, 2OOX) 또는 정면(즉, PDB 코드 1O50, 1PBJ) 방식으로 연결할 수 있다.그렇게 함으로써 그들은 정관 리간드 결합 부위를 구성하는 구획을 형성한다.[14][15][16][17][18]원칙적으로 정식 결합 사이트 수는 분자 내 CBS 도메인 수와 일치하며, 전통적으로 뉴클레오티드의 리보스와 잠재적으로 상호작용하는 보존 아스파테이트 잔여물을 각각 포함하는 CBS 도메인에 따라 번호가 매겨진다.[19]그러나 이러한 충치가 모두 반드시 뉴클레오티드를 결합하거나 기능하지는 않을 수 있다.최근에는 AMP를 위한 비카노니컬 사이트도 M. jannaschi의 단백질 MJ1225에 기술되어 있지만, 그 기능적 역할은 아직 알려져 있지 않다.[20]

리간드 바인딩
CBS 도메인은 AMP, ATP,[11] s-adenosylmethionine과 같은 분자의 아데노실 그룹에 바인딩되지만 [21]Mg와2+ 같은 금속 이온도 바인딩할 수 있다.[22][23] 이러한 다른 리간드를 바인딩하면 CBS 도메인은 관련 효소 도메인의 활동을 규제한다.[24]이 규제의 기초가 되는 분자 메커니즘이 이제 막 해명되기 시작하고 있다.[16][17][21][22][25]현재, 두 가지 다른 유형의 메커니즘이 제안되었다.첫 번째 것은 리간드의 뉴클레오티드 부분이 단백질 구조에 아무런 변화를 유발하지 않는다고 주장하는데, 결합 현장의 정전기 전위는 아데노신 뉴클레오티드 결합의 가장 중요한 특성이다.[17][26]이러한 "정적" 대응은 에너지 전하에 의한 규제가 유리한 프로세스에 관련될 것이다.[17][26]반면에, 메커니즘("동적"로 표시)의 두번째 유형 및 Mg2+트럭 MgtE의 Thermus에서 알 수 없는 기능 단백질 MJ0100 M.jannaschii[21][27]에서 그리고 규제 regio thermophilus,[22]은의 시토졸의 도메인에 대한 것으로 알려졌다 항체 바인딩에 단백질 구조의 극적인 형태 변화를 포함한다.Clostrid의 nIum perfringens pyrophosphatase.[28] 이음 관류
연결된 도메인
CBS 도메인은 종종 다른 도메인을 포함하는 단백질에서 발견된다.이 영역은 보통 효소, 막 전달체 또는 DNA 결합 도메인이다.그러나 특히 원핵생물에서 CBS 도메인만을 포함하는 단백질도 종종 발견된다.이러한 독립형 CBS 도메인 단백질은 그들이 상호작용하고 조절하는 키나제 같은 다른 단백질과 결합할 때 콤플렉스를 형성할 수 있다.
질병으로 이어지는 돌연변이
인간 CBS 도메인을 포함하는 단백질의 돌연변이는 유전 질환으로 이어진다.[3]예를 들어, 낭포성-베타-신타아제 단백질의 돌연변이는 호모시스티누리아(OMIM: 236200)[29]라고 불리는 신진대사의 유전적 장애를 초래한다.AMPK 효소의 감마 소단위 돌연변이는 월프 파킨슨-화이트 증후군을 동반한 가족성 비대성 심근병증을 유발하는 것으로 나타났다(OMM: 600858).IMPDH 효소의 CBS 영역에서의 돌연변이는 눈 질환 망막염 색소증(OMIM: 180105)으로 이어진다.
인간은 다수의 전압 게이트 염화 채널 유전자를 가지고 있으며, 이들 중 몇 개의 CBS 도메인에서 돌연변이가 유전 질환의 원인으로 확인되었다.Mutations in CLCN1 lead to myotonia (OMIM: 160800),[30] mutations in CLCN2 can lead to idiopathic generalised epilepsy (OMIM: 600699), mutations in CLCN5 can lead to Dent's disease (OMIM: 300009), mutations in CLCN7 can lead to osteopetrosis (OMIM: 259700),[31] and mutations in CLCNKB can lead to Bartter syndrome (OMIM: 241200).
참조
- ^ PDB: 2nye;Rudolph MJ, Amodeo GA, Iram SH, Hong SP, Pirino G, Carlson M, Tong L (January 2007). "Structure of the Bateman2 domain of yeast Snf4: dimeric association and relevance for AMP binding". Structure. 15 (1): 65–74. doi:10.1016/j.str.2006.11.014. PMID 17223533.
- ^ Bateman A (January 1997). "The structure of a domain common to archaebacteria and the homocystinuria disease protein". Trends Biochem. Sci. 22 (1): 12–3. doi:10.1016/S0968-0004(96)30046-7. PMID 9020585.
- ^ a b Ignoul S, Eggermont J (December 2005). "CBS domains: structure, function, and pathology in human proteins". Am. J. Physiol., Cell Physiol. 289 (6): C1369–78. doi:10.1152/ajpcell.00282.2005. PMID 16275737.
- ^ Ponting CP (March 1997). "CBS domains in CIC chloride channels implicated in myotonia and nephrolithiasis (kidney stones)". J. Mol. Med. 75 (3): 160–3. PMID 9106071.
- ^ Meyer S, Dutzler R (February 2006). "Crystal structure of the cytoplasmic domain of the chloride channel ClC-0". Structure. 14 (2): 299–307. doi:10.1016/j.str.2005.10.008. PMID 16472749.
- ^ Yusef YR, Zúñiga L, Catalán M, Niemeyer MI, Cid LP, Sepúlveda FV (April 2006). "Removal of gating in voltage-dependent ClC-2 chloride channel by point mutations affecting the pore and C-terminus CBS-2 domain". J. Physiol. 572 (Pt 1): 173–81. doi:10.1113/jphysiol.2005.102392. PMC 1779660. PMID 16469788.
- ^ Markovic S, Dutzler R (June 2007). "The structure of the cytoplasmic domain of the chloride channel ClC-Ka reveals a conserved interaction interface". Structure. 15 (6): 715–25. doi:10.1016/j.str.2007.04.013. PMID 17562318.
- ^ Meyer S, Savaresi S, Forster IC, Dutzler R (January 2007). "Nucleotide recognition by the cytoplasmic domain of the human chloride transporter ClC-5". Nat. Struct. Mol. Biol. 14 (1): 60–7. doi:10.1038/nsmb1188. PMID 17195847. S2CID 20733119.
- ^ Day P, Sharff A, Parra L, et al. (May 2007). "Structure of a CBS-domain pair from the regulatory gamma1 subunit of human AMPK in complex with AMP and ZMP". Acta Crystallogr. D. 63 (Pt 5): 587–96. doi:10.1107/S0907444907009110. PMID 17452784.
- ^ Rudolph MJ, Amodeo GA, Iram SH, et al. (January 2007). "Structure of the Bateman2 domain of yeast Snf4: dimeric association and relevance for AMP binding". Structure. 15 (1): 65–74. doi:10.1016/j.str.2006.11.014. PMID 17223533.
- ^ a b Kemp BE (January 2004). "Bateman domains and adenosine derivatives form a binding contract". J. Clin. Invest. 113 (2): 182–4. doi:10.1172/JCI20846. PMC 311445. PMID 14722609.
- ^ Kemp BE (January 2004). "Bateman domains and adenosine derivatives form a binding contract". J. Clin. Invest. 113 (2): 182–4. doi:10.1172/JCI20846. PMC 311445. PMID 14722609.
- ^ Zhang R, Evans G, Rotella FJ, Westbrook EM, Beno D, Huberman E, Joachimiak A, Collart FR (April 1999). "Characteristics and crystal structure of bacterial inosine-5'-monophosphate dehydrogenase". Biochemistry. 38 (15): 4691–700. CiteSeerX 10.1.1.488.2542. doi:10.1021/bi982858v. PMID 10200156.
- ^ Rudolph MJ, Amodeo GA, Iram SH, Hong SP, Pirino G, Carlson M, Tong L (January 2007). "Structure of the Bateman2 domain of yeast Snf4: dimeric association and relevance for AMP binding". Structure. 15 (1): 65–74. doi:10.1016/j.str.2006.11.014. PMID 17223533.
- ^ Meyer S, Savaresi S, Forster IC, Dutzler R (January 2007). "Nucleotide recognition by the cytoplasmic domain of the human chloride transporter ClC-5". Nat. Struct. Mol. Biol. 14 (1): 60–7. doi:10.1038/nsmb1188. PMID 17195847. S2CID 20733119.
- ^ a b Amodeo GA, Rudolph MJ, Tong L (September 2007). "Crystal structure of the heterotrimer core of Saccharomyces cerevisiae AMPK homologue SNF1". Nature. 449 (7161): 492–5. doi:10.1038/nature06127. PMID 17851534. S2CID 4342092.
- ^ a b c d Townley R, Shapiro L (March 2007). "Crystal structures of the adenylate sensor from fission yeast AMP-activated protein kinase". Science. 315 (5819): 1726–9. doi:10.1126/science.1137503. PMID 17289942. S2CID 38983201.
- ^ Jin X, Townley R, Shapiro L (October 2007). "Structural insight into AMPK regulation: ADP comes into play". Structure. 15 (10): 1285–95. doi:10.1016/j.str.2007.07.017. PMID 17937917.
- ^ Kemp BE, Oakhill JS, Scott JW (October 2007). "AMPK structure and regulation from three angles". Structure. 15 (10): 1161–3. doi:10.1016/j.str.2007.09.006. PMID 17937905.
- ^ Gómez-García I, Oyenarte I, Martínez-Cruz LA (May 2010). "The Crystal Structure of Protein MJ1225 from Methanocaldococcus jannaschii Shows Strong Conservation of Key Structural Features Seen in the Eukaryal gamma-AMPK". J Mol Biol. 399 (1): 53–70. doi:10.1016/j.jmb.2010.03.045. PMID 20382158.
- ^ a b c Lucas M, Encinar JA, Arribas EA, Oyenarte I, García IG, Kortazar D, Fernández JA, Mato JM, Martínez-Chantar ML, Martínez-Cruz LA (February 2010). "Binding of S-methyl-5'-thioadenosine and S-adenosyl-L-methionine to protein MJ0100 triggers an open-to-closed conformational change in its CBS motif pair". J. Mol. Biol. 396 (3): 800–20. doi:10.1016/j.jmb.2009.12.012. PMID 20026078.
- ^ a b c Ishitani R, Sugita Y, Dohmae N, Furuya N, Hattori M, Nureki O (October 2008). "Mg2+-sensing mechanism of Mg2+ transporter MgtE probed by molecular dynamics study". Proc. Natl. Acad. Sci. U.S.A. 105 (40): 15393–8. doi:10.1073/pnas.0802991105. PMC 2563093. PMID 18832160.
- ^ Hattori M, Nureki O (March 2008). "[Structural basis for the mechanism of Mg2 homeostasis by MgtE transporter]". Tanpakushitsu Kakusan Koso (in Japanese). 53 (3): 242–8. PMID 18326297.
- ^ Scott JW, Hawley SA, Green KA, et al. (January 2004). "CBS domains form energy-sensing modules whose binding of adenosine ligands is disrupted by disease mutations". J. Clin. Invest. 113 (2): 274–84. doi:10.1172/JCI19874. PMC 311435. PMID 14722619.
- ^ Tuominen H, Salminen A, Oksanen E, Jämsen J, Heikkilä O, Lehtiö L, Magretova NN, Goldman A, Baykov AA, Lahti R (May 2010). "Crystal structures of the CBS and DRTGG domains of the regulatory region of Clostridiumperfringens pyrophosphatase complexed with the inhibitor, AMP, and activator, diadenosine tetraphosphate". J. Mol. Biol. 398 (3): 400–13. doi:10.1016/j.jmb.2010.03.019. PMID 20303981.
- ^ a b Xiao B, Heath R, Saiu P, Leiper FC, Leone P, Jing C, Walker PA, Haire L, Eccleston JF, Davis CT, Martin SR, Carling D, Gamblin SJ (September 2007). "Structural basis for AMP binding to mammalian AMP-activated protein kinase". Nature. 449 (7161): 496–500. doi:10.1038/nature06161. PMID 17851531. S2CID 4345919.
- ^ Lucas M, Kortazar D, Astigarraga E, et al. (October 2008). "Purification, crystallization and preliminary X-ray diffraction analysis of the CBS-domain pair from the Methanococcus jannaschii protein MJ0100". Acta Crystallographica Section F. 64 (Pt 10): 936–41. doi:10.1107/S1744309108027930. PMC 2564890. PMID 18931440.
- ^ Tuominen H, Salminen A, Oksanen E, et al. (May 2010). "Crystal Structures of the CBS and DRTGG Domains of the Regulatory Region of Clostridium perfringens Pyrophosphatase Complexed with the Inhibitor, AMP, and Activator, Diadenosine Tetraphosphate". J Mol Biol. 398 (3): 400–413. doi:10.1016/j.jmb.2010.03.019. PMID 20303981.
- ^ Shan X, Dunbrack RL, Christopher SA, Kruger WD (March 2001). "Mutations in the regulatory domain of cystathionine beta synthase can functionally suppress patient-derived mutations in cis". Hum. Mol. Genet. 10 (6): 635–43. doi:10.1093/hmg/10.6.635. PMID 11230183.
- ^ Pusch M (April 2002). "Myotonia caused by mutations in the muscle chloride channel gene CLCN1". Hum. Mutat. 19 (4): 423–34. doi:10.1002/humu.10063. PMID 11933197.
- ^ Cleiren E, Bénichou O, Van Hul E, et al. (December 2001). "Albers-Schönberg disease (autosomal dominant osteopetrosis, type II) results from mutations in the ClCN7 chloride channel gene". Hum. Mol. Genet. 10 (25): 2861–7. doi:10.1093/hmg/10.25.2861. PMID 11741829.



