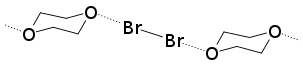할로겐 결합
Halogen bond할로겐 결합(XB)은 분자 개체의 할로겐 원자와 관련된 전기영역 영역과 다른 개체 또는 동일한 분자 개체의 핵영역 간에 순전히 매력적인 상호작용의 증거가 있을 때 발생한다.[1]
할로겐 본딩은 다양한 생물학적 시스템과 공정에서 발생하기 때문에 약물 설계에 활용할 수 있다.[2]
또한 XB는 크리스탈 엔지니어링, 초분자 화학, 폴리머 과학, 액정, 전도성 물질 및 약용 화학과 같은 다양한 기능적 용도에 이용되고 있다.[3][4]
본딩
정의 및 일반 특성
할로겐 원자는 전기적 극지방(할로겐이 공밸런으로 결합되는 원자로부터 가장 멀리 있는 지역)이 음전하 종에 접근할 때 정전기적 접촉을 한다. 오직 전기영양 할로겐만이 할로겐 결합을 만든다. 할로겐 본딩에 참여하는 할로겐에는 요오드(I), 브롬(Br), 염소(Cl), 때로는 플루오린(F)이 포함된다. 네 개의 할로겐 모두 XB 기증자 역할을 할 수 있으며(이론 및 실험 데이터를 통해 입증된 바와 같이) 일반적인 추세를 따를 수 있다. F < Cl < Br < I, 일반적으로 요오드가 가장 강한 상호작용을 형성한다.[5]
디할로겐(I2, Br2 등)은 강한 할로겐 결합을 형성하는 경향이 있다. XB 형성에 있어 염소와 불소의 강도와 효과는 XB 기증자의 특성에 따라 달라진다. 할로겐이 전기적(전자가 철수) 모이에 접착되면 더 강한 할로겐 결합을 형성할 가능성이 높다.[6]
예를 들어 요오드operfluoroalkanes는 XB 결정 공학용으로 잘 설계되어 있다. 게다가 F가2 강력한 XB 기증자 역할을 할 수 있는 것도 이 때문이지만, 불소와 연결된 알킬 그룹이 전기적 결합이 아니기 때문에 불소 기증자가 약한 것도 이 때문이다. 게다가, 루이스 베이스 (XB 수용자) 역시 전기적인 경향이 있고 음이온은 중성 분자보다 XB 수용자가 더 낫다.
결합강도
할로겐 결합은 잘 정의된 구조를 발생시키는 강력하고 구체적이며 방향적인 상호작용이다. 할로겐 본드 에너지의 범위는 10–200 kJ/mol이다.[7] XB의 강점은 약간의 에너지가 약한 수소 결합의 강도와 경쟁할 수 있게 한다. 할로겐 결합 강도에 영향을 주는 또 다른 요인은 할로겐(Lewis acid, XB delivery)과 루이스 베이스(XB acceptor) 사이의 짧은 거리에서 발생한다. 할로겐 결합의 매력적인 특성은 기증자와 수용자 사이의 거리가 Van der Waals radi의 합보다 짧다는 결과를 낳는다. 할로겐 베이스와 루이스 베이스 사이의 거리가 줄어들수록 XB 상호작용은 더욱 강력해진다. 음이온은 보통 중성종보다 XB 수용체가 더 좋다: 이온쌍이 더 분리되고 음이온과 함께 형성된 XB가 더 강하다.[8]
σ홀[9]
많은 공동결합 할로겐은 σ-hole이라 불리는 공동결합(covalent bond)의 확장을 따라 예기치 않은 양의 정전기 전위의 극지방이 있다. 자유 원자 X에서 발란스 구성은 절반으로 채워진 pz 궤도(p arbit)를 나타낸다. 분자 RX에서 (z축을 따라 놓여 있는) R-X 결합은 반만 채워진 pz 궤도(아마도 sp-hybridization의 어느 정도 수준일 것이다. 거의 혼합되지 않는 것을 고려해 볼 때, 거의 순수한 p 궤도 안에서 전자에 의해 결합이 형성되고 있다. 이 궤도 외엽은 전하가 부족하여 양성 전위가 발생할 수 있다. σ구멍은 반만 채워진 p 본딩 궤도(bonding arbon)의 전자결함 외엽이다.
불소의 높은 전기율 때문에, 불균형적으로 큰 비율의 결합 전자가 F 원자 근처에 있다. 또한 RX(X=F) 본드 축을 따라 더 많은 sp-하이브리드화가 관찰된다. 이러한 효과는 불소 원자에 있는 σ-구멍을 중화시키는 데 기여하며, 불소를 포함하는 할로겐 결합의 알려진 예는 거의 없다.[10]
σ홀 개념은 그룹 15와 16의 원자로 쉽게 확장될 수 있으며, 각각 pnictogen과 chalcogen 결합이라는 유사한 상호작용을 형성할 수 있다.
구조상세
할로겐 결합은 180° 각도로 형성되는 경향이 있는데, 이는 1954년 브롬과 1,4-다이옥산(Dioxane)을 사용한 Old Hassel의 연구에서 나타났다. 할로겐 결합은 매우 방향적인 상호작용이고 짧은 상호작용은 긴 상호작용보다 방향성이 더 높다. 할로겐 원자 주위의 전자 밀도의 비등방성 분포의 결과는 - Y 에서 할로겐 원자 주위의 공밸런트와 비공밸런트 결합 사이의 각도가 약 180°라는 것이다.
에테르와 아민과 같은 n-전자 기증자가 XB 수용자로서 기능할 때, 기증된 한 쌍의 전자 축을 따라 우선적으로 상호작용이 개발된다. 피리딘 유도체를 포함하는 할로겐 결합에서 XY 공밸런트 결합은 피리딘 링과 대략적으로 일치하며, 두 X{CN 각도는 약 120°이다. O 원자 주위에 삼각 평면 형상이 있는 카보닐 그룹은 하나 또는 두 개의 XB에 대한 수용자 역할을 할 수 있다.[7]
수소 결합과 할로겐 결합의 비교
- 수소결합
- 할로겐 본딩
두 경우 모두 D는 전자 빈곤종인 H-R이나 X-R에 전자를 기증하는 원자, 그룹 또는 분자다. H는 수소 본딩에 관여하는 수소 원자, X는 할로겐 본딩에 관여하는 할로겐 원자다. 할로겐 결합 공여자(원자 X)는 전자를 수용하는 반면 할로겐 결합 수용자(엔티 D)는 전자를 기증한다는 점에 유의하십시오.
할로겐 본딩과 수소 본딩 사이에 병렬 관계를 쉽게 그릴 수 있다. 두 상호작용 모두 전자 기증자/전자 수용자 관계가 존재한다. 수소 본딩에서 수소 원자는 전자 수용체 역할을 하며 전자 부지에서 전자 밀도를 수용함으로써 비균등 상호작용을 형성한다. 할로겐 결합에서 할로겐 원자는 전자 수용기다. 두 종류의 상호작용의 차이점은 어떤 종들이 전자공여자인 D로서 역할을 할 수 있느냐 하는 것이다.
동시에 H나 X와 R의 정상적인 공밸런트 결합이 약해져 H나 X의 전자 밀도가 감소하는 것으로 보인다. 전자 밀도가 전달되면 반데르발스 볼륨이 침투하게 된다.[11]
할로겐 본딩은 수소 본딩보다 더 방향성이 높은 상호작용이며 XB는 수소 본딩보다 더 큰 본딩 에너지를 가질 수 있다.
역사
1814년 장자크 콜린은 마른 기체 암모니아와 마른 요오드를 함께 섞었을 때 (금속 광택이 있는) 액체의 형성을 묘사했다. 결과2 I···NH3 콤플렉스의 정밀한 구성은 50년 후 프레데릭 거스리에 의해 성립되었다.[12] 그의 실험에서 그는 수성 암모니아에 I를2 첨가했다. 분자 상호작용의 진정한 본질은 아마도 로버트 S에 이어 처음으로 이해되었을 것이다. 멀리켄은 전하 전달 상호작용에 대한 획기적인 발견과 오드 하셀의 자세한 설명을 들었다.
1950년대에 멀리켄은 전자 공여-수용자 복합체에 대한 상세한 이론을 개발하여 이를 외부 또는 내부 복합체로 분류하였다.[13][14][15] 외부 콤플렉스는 전자 공여자와 수용자 사이의 분자간 상호작용이 약하고 전하 전달이 거의 없는 콤플렉스였다. 내부 단지는 요금 재분배가 광범위하다. 멀리켄의 이론은 XB 형성이 발생하는 메커니즘을 설명하기 위해 사용되어 왔다.
멀리켄이 이론을 발전시킨 같은 시기에 하셀에 의해 수행된 결정학적 연구가 나타나기 시작했고, XB 형성과 그 특성을 이해하는 데 전환점이 되었다.
하셀 그룹의 첫 X-ray 결정학 연구는 1954년에 나왔다. 실험에서 그의 그룹은 X선 회절 기술을 사용하여 브롬 1,4-다이옥산염의 구조를 보여줄 수 있었다.[16] 이 실험은 다이옥산 원자와 브로민 원자의 산소 원자 사이에 짧은 분자간 상호작용이 존재한다는 것을 밝혀냈다. 결정의 O-Br 거리는 2.71 å으로 측정되었는데, 이는 브롬 원자와 산소 원자의 강한 상호작용을 나타낸다. 또한 거리는 산소와 브로민(3.35 å)의 반데르 바알스 반지름의 합보다 작다. O-Br 본드와 Br-Br 본드 사이의 각도는 약 180° 이것은 할로겐 결합형성에서 발견되는 전형적인 특징의 첫 번째 증거였고, 하셀은 할로겐 원자가 전자쌍 기증자 분자 내 외로운 쌍의 궤도축과 일치하는 결합 방향을 가진 전자쌍 기증자와 직접 연결되어 있다는 결론을 내리게 했다.[17]
1969년 하셀은 할로겐이 전기영역, 전자수용체 역할을 할 수 있으며 전자 기증자가 있는 곳에서 고도로 조직된 전하전달 복합체로 자가 조립될 수 있다는 탁월한 발견으로 노벨 화학상을 받았다.[18] 전자 기증자 수용자에 대한 초기 검토는 1968년 벤트에 의해 제공되었다.[19] '할로겐 본드'라는4444 용어의 사용은 유기용매에서 테트라하이드로푸란, 테트라하이드로푸란, 피리딘, 아니솔레, 디-n-butyl 에테르 등의 콤플렉스를 조사한 뒤마와 동료들이 1978년에야 구현했다.[20]
그러나 할로겐 결합의 성격과 응용이 집중적으로 연구되기 시작한 것은 1990년대 중반이 되어서였다. 극초단파 분광법을 통해 가스 단계에서 형성되는 다양한 할로겐 결합 유도체를 연구한 레곤과 동료들의 체계적이고 광범위한 연구는 할로겐 결합과 더 잘 알려진 수소 결합 상호작용의 유사성에 주목했다.[21]
2007년 폴리티저와 머레이의 연산 계산은 할로겐 결합의 높은 방향성이 할로겐 핵 주위의[22] 전자 밀도의 비등방성 분포의 결과라는 것을 밝혀내고 "σ-hole"[2]의 정의로 가는 길을 닦았기 때문에 특히 의미가 컸다. σ홀의 비등방성 전하 분포는 켈빈 프로브 힘 현미경을 사용하여 실험적으로 관찰되었다.[23]
적용들
이 섹션은 위키백과 편집자의 개인적인 감정을 진술하거나 주제에 대한 원론적인 주장을 제시하는 개인적인 성찰, 개인적인 에세이 또는 논쟁적인 에세이처럼 쓰여진다.으로 하여 하십시오. (2013년 8월)(이 및 시기 |
크리스털 엔지니어링
크리스탈 공학은 고체 상태와 초분자 화학적 관계를 연결하는 연구 분야로 성장하고 있다.[24] 이 독특한 분야는 학제간이며 결정학, 유기화학, 무기화학 등과 같은 전통적인 학문들을 융합한다. 결정공학의 범위는 결정화를 위한 분자간 상호작용의 활용과 서로 다른 원하는 물리화학적 성질을 가진 새로운 물질의 개발을 위한 것이다. 할로겐 본딩이 발견되기 전 액체-크리스탈린 및 고체-크리스탈린 소재의 개발에 수소 본딩, 조정 화학 및 이온 간 상호작용이 사용된다. 할로겐 결합의 발견 이후, 새로운 분자 어셈블리가 존재한다.[25] 게다가 할로겐 본딩은 분자 도체의 제작인 과격한 양이온염의 조직에 사용된다. 그것의 방향성과 XBs의 독특한 화학적 특성 때문에, 이 분자간 상호작용은 결정 공학 발전을 위한 추가적인 도구 역할을 한다.[26]
액체 결정 형성에 할로겐 본딩의 첫 번째 사용 보고는 응우옌과 브루스였다.[28] 액정을 형성하기 위한 노력에는 알크시스티틸바졸과 펜타플루오로오디오벤젠이 사용되었다. 메트랑골로와 레사티에 의한 이전 연구는 고체 상태의 구조물에 대한 펜타플루오로오디오벤젠의 효용성을 입증했다.[11] 비선형 광학 및 야금체에는 다양한 알톡시틸바졸이 활용되었다.[29] 레사티(예: N-I 콤플렉스가 강하게 형성됨)의 또 다른 발견을 사용하여, 이 그룹은 요오드포텐타플루오르벤젠과 4-alkoxystilbazoles를 포함하는 할로겐 본드 콤플렉스를 설계했다. X선 결정학에서 N-I 거리는 2.811(4) å이고 본딩 각도는 168.4°인 것으로 밝혀졌다. 유사한 N-I 거리를 고체 가루로 측정했다.[30] 발견된 N-I 거리는 질소와 요오드용 반데르 바알스 반지름의 합(3.53 than)보다 짧다. 분자의 단일 결정 구조는 4극 상호작용이 없음을 나타냈다. 수치상 실세쿼이옥사네 단지는 액상 크리스탈린으로 판명되었다.
할로겐 본딩의 강도에 대한 편광성 관여의 개념을 시험하기 위해, 브롬펜타플루오르벤젠을 루이스 베이스로 사용하였다. 결과적으로 할로겐 본드 복합형성에 대한 검증은 얻어지지 않았다. 이 발견은 원자 편광성에 대한 할로겐 결합의 의존성에 대한 더 많은 지지를 제공한다. 저자들은 유사한 기증자 수용체 프레임워크를 활용하여 액체 결정 상태의 할로겐 결합 강도가 수소 결합 메소균과 비교 가능하다는 것을 증명했다.
폴리(다이오디오다이오드틸렌)의 조제
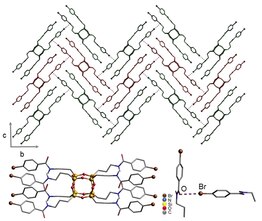
희거, 맥디아미드, 시라카와 등의 작업에서 결합 폴리머의 특성을 활용한 어플리케이션이 나왔으며, 폴리아세틸렌은 재료 가공이 어렵지만 전도성이라는 사실이 밝혀졌다. 그 이후 이 결합 폴리머의 등뼈(예: 폴리(p-페닐렌비닐렌))를 모방하는 작업이 이루어졌다. 결합 폴리머는 실용적 용도가 많으며, 광전지, 유기발광다이오드, 전계효과 트랜지스터, 화학 센서 등의 장치에 사용된다. 고로프 외 연구진은 할로겐 결합 비계와의 모노머(2)의 사전 배분을 통해 주문한 폴리(다이오디오다이오드테틸렌)를 준비했다.[31] PIDA는 요오드가 쉽게 변형될 수 있기 때문에 다른 결합 중합체의 탁월한 전구체다. 예를 들어, C-I 갈라짐은 전기화학적 감소가 가능하다.[31]
모노머(2)의 결정 구조는 다양한 구성과 연결성을 가진 질서 정연한 물질이다. 호스트(3-7)는 주로 모노머(2)와 각 호스트의 코크리스탈을 연구하여 분자 패킹에 대해 조사되었다. (3)과 (4) 모두 사전에 조직된 모노머(2)를 사용했지만 요오드 주위에 황색 혼잡으로 인해 모노머의 위상 중합이 성공적으로 이루어지지 못했다. 호스트(5-7)는 수소 결합과 할로겐 결합을 활용해 모노머(2)를 서로 최적의 거리에서 잡아 중합이 용이하도록 한다.
실제로 숙주(7)를 사용했을 때, 코크리스탈의 격리에 따라 중합이 자연적으로 발생하였다. 결정 구조는 폴리머 가닥이 모두 수소결합망과 평행하며, 숙주질질소는 각각 할로겐결합과 요오드원자를 나타낸다. 결정에서 (1)의 요오드 원자의 절반은 옥사미드 산소 원자와 밀접하게 접촉한다. 숙주의 산소원자(7)는 수소와 할로겐 결합 수용체 역할을 모두 하고 있다. 이 약한 할로겐 결합은 아래 그림과 같이 이 고치를 더욱 안정시킨다.
다공성 구조물
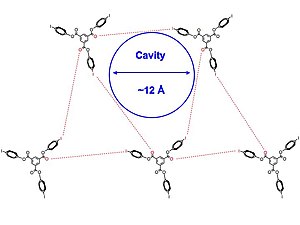
다공성 구조는 다양한 용도를 가지고 있다. 많은 화학자들과 물질 과학자들은 수소를 자동차에 저장하기 위해 금속-유기체 프레임워크(MOF)를 개선하기 위해 노력하고 있다. 이러한 고도로 조직화된 결정체 포함 복합체들은 촉매와 분자 분리 장치에 잠재적인 용도를 가지고 있다. 분자 조직은 수소 결합과 같은 분자간 힘을 통해 제어되는 경우가 많다. 그러나 수소 본딩을 활용하면 촘촘한 패킹으로 인해 사용 가능한 모공 크기의 범위가 제한되는 경우가 많다.
Pigge 등은 아민, 질소 헤테로사이클, 카보닐 그룹 및 기타 유기 할로겐 결합 상호작용을 이용하여 다공성 구조를 구성했다. 수소 결합보다 현저히 약한 상호작용인 할로겐 결합에 의해 매개되는 유기 결정망은 드물기 때문에 이것은 중요하다.[32]
화합물 1과 2(그림에 표시)는 다공성 결정 구조를 형성하며, 디클로로메탄, 피리딘, 벤젠과 같은 다양한 용매에서 얻는다. 저자들은 다공성 포함 복합체가 부분적으로 전례 없는 I-배출 상호작용과 요오드와 카보닐 그룹 사이의 할로겐 결합에 의해 매개되는 것처럼 보인다는 점에 주목한다. 결정 구조(그림으로 표시)는 삼각형 배열로 함께 나타나며, 2의 분자는 대략 대칭이다. 또한 할로겐 본딩 상호작용의 모든 세트는 동일하지 않으며, 할로겐과 할로겐 본드 수용자 사이의 분자간 상호작용은 반데르발스 반경의 합계를 약간 초과하여 약간 약한 할로겐 본드를 나타내며, 이는 구조물에 더 많은 유연성을 가져온다. 2D 레이어는 서로 평행하게 쌓여 용매로 채워진 채널을 만든다.
용제 상호작용은 특히 피리딘과 클로로포름에서 육각 구조물의 형성에 있어서도 기록된다. 처음에, 이러한 용액을 형성하는 결정들은 채널 구조를 형성한다. 시간이 지남에 따라 바늘과 같은 솔베이트가 없는 새로운 구조물 형태는 더 촘촘하게 채워지고, 이 바늘들은 실제로 열역학적으로 선호되는 결정체다. 저자들은 작은 분자가 구조를 예측하는 구조를 설계하기 위해 수소 결합과 할로겐 결합의 상호 보완적인 성격을 더 잘 이해하기 위해 이 정보를 이용하기를 희망한다.
생물학적 고분자 내 할로겐 결합
한동안 생물학적 고분자 구조에 대한 할로겐 결합의 중요성은 간과되었다. 단백질 데이터 뱅크(PDB)의 단결정 구조(2004년 7월 버전)를 기반으로 한 아우핑거 등의 PDB에 대한 분해능(이상)이 3 3인 단일결정 구조물에 대한 연구 결과 할로겐화 핵산 6개 구조와 할로겐옥시그용 단백질-하중 복합체 66개에서 100개 이상의 할로겐 결합이 검출됐다.교호작용에 있어서 할로겐-산소 상호작용만큼 빈번하지는 않지만 할로겐-니트로겐 및 할로겐-황색 접촉도 확인되었다.[33] 이러한 과학적 발견은 생물학적 시스템에서 할로겐 결합의 역할을 해명하는 독특한 근거를 제공한다.
생체 분자 수준에서 할로겐 결합은 기질 특수성, 결합 및 분자 접기에 중요하다.[34] 단백질-리간 상호작용의 경우, 편광 가능한 할로겐을 가진 가장 일반적인 충전-전송 결합은 백본 카보닐 및/또는 아미노산 잔류물의 히드록실 및 카르복실산 그룹을 포함한다. 일반적으로 DNA와 단백질-리간드 복합체에서는 루이스의 기본 공여원자(예: O, S, N)와 루이스산(할로겐) 사이의 결합 거리가 반데르발스 반경의 합보다 짧다. 구조 및 화학 환경에 따라 할로겐 본딩 상호작용이 약하거나 강할 수 있다. 일부 단백질-리간드 복합체의 경우, 할로겐 결합은 기증자와 수용자의 방향성이 일치한다면 수소 결합과 에너지 및 기하학적으로 비교 가능하다. 이러한 분자간 상호작용은 안정화되고 있고 단백질-리간드와 DNA 구조에서 일치 결정요소가 있는 것으로 나타났다.
분자 인식 및 결합의 경우 할로겐 결합이 유의할 수 있다. 약물 설계에서 이러한 주장을 보여주는 예로는 그림에서와 같이 억제제 IDD 594를 인간 알도저감효소에 결합하기 위한 기질 특수성이 있다.[35] E.I. 하워드는 이 단조로운 효소에 대한 최고의 분해능을 보고했다. 이 생물학적 고분자는 316개의 잔류물로 구성되어 있으며, 알도스, 코르티코스테로이드, 알데히드를 감소시킨다. D-글루코스의 효소 변환의 산물인 D-소르비톨은 당뇨병 병리학의 하류적 효과에 기여하는 것으로 생각된다.[36] 따라서 이 효소를 억제하는 것은 치료상의 장점이 있으며 IDD 594는 당뇨병 합병증 치료의 치료 대상이다.
알데히드 기반 및 카르복실산 억제제는 효과적이지만 알데히드 환원효소의 기능 활성도가 저하되기 때문에 독성이 있다. 카복시산염과 알데히드 억제제는 Trp 111, Tyr 48, His 110과 수소 결합에 나타났다. 억제제 결합의 결과로 만들어진 "특정성 포켓"은 Leu 300, Ala 299, Phe 122, Thr 113, Trp 111로 구성되어 있다. 억제제가 효과적이기 위해 상호작용의 주요 잔류물은 113과 111로 확인되었다. IDD 594는 할로겐이 선택성을 제공하고 강력하도록 설계되었다. 결합 시 이 화합물은 스르 산소와 억제제의 브롬 사이에서 할로겐 결합을 유발하는 순응적 변화를 유도한다. 결합 거리는 2.973(4) å로 측정되었다. 이 O-Br 할로겐 결합은 알데히드 환원효소보다 인간의 알데하이드 환원효소에 대한 억제제의 큰 효력에 기여한다.
참조
- ^ Desijaru, G. R.; Ho, P. S.; Kloo, L.; Legon, A. C.; Marquardt, R.; Metrangolo, P.; Politzer, P.; Resnati, G.; Rissanen, K. (2013). "Definition of the Halogen Bond (IUPAC Recommendations 2013)". Pure Appl. Chem. 85 (8): 1711–1713. doi:10.1351/pac-rec-12-05-10.
- ^ a b Clark, T.; Hennemann, M.; Murray, J. hS.; Politzer, P. (2007). "Halogen Bonding: The σ-Hole". J. Mol. Model. 13 (2): 291–296. doi:10.1007/s00894-006-0130-2. PMID 16927107. S2CID 93970509.
- ^ Cavallo, G.; Metrangolo, P.; Milani, R.; Pilati, T.; Priimagi, A.; Resnati, G.; Terraneo, G. (2016). "The Halogen Bond". Chem. Rev. 116 (4): 2478–2601. doi:10.1021/acs.chemrev.5b00484. PMC 4768247. PMID 26812185.
- ^ Gilday, L. C.; Robinson, S. W.; Barendt, T. A.; Langton, M. J.; Mullaney, B. R.; Beer, P. D. (2015). "Halogen Bonding in Supramolecular Chemistry". Chem. Rev. 115 (15): 7118–7195. doi:10.1021/cr500674c. PMID 26165273.
- ^ Politzer, P.; et al. (2007), "An Overview of Halogen Bonding", J. Mol. Model, 13 (2): 305–311, doi:10.1007/s00894-006-0154-7, PMID 17013631, S2CID 39255577
- ^ Metrangolo, P.; Neukirch, H; Pilati, T; Resnati, G. (2005), "Halogen Bonding Based Recognition Processes: A World Parallel to Hydrogen Bonding†", Acc. Chem. Res., 38 (5): 386–395, doi:10.1021/ar0400995, PMID 15895976
- ^ a b Metrangolo, Pierangelo; Meyer, Franck; Pilati, Tullio; Resnati, Giuseppe; Terraneo, Giancarlo (2008-08-04). "Halogen Bonding in Supramolecular Chemistry". Angewandte Chemie International Edition. 47 (33): 6114–6127. doi:10.1002/anie.200800128.
- ^ Liantonio, Rosalba; Metrangolo, Pierangelo; Pilati, Tullio; Resnati, Giuseppe (2003-05-01). "Fluorous Interpenetrated Layers in a Three-Component Crystal Matrix". Crystal Growth & Design. 3 (3): 355–361. doi:10.1021/cg0340244. ISSN 1528-7483.
- ^ Clark, Timothy; Hennemann, Matthias; Murray, Jane S.; Politzer, Peter (2007-01-24). "Halogen bonding: the σ-hole: Proceedings of "Modeling interactions in biomolecules II", Prague, September 5th–9th, 2005". Journal of Molecular Modeling. 13 (2): 291–296. doi:10.1007/s00894-006-0130-2. ISSN 1610-2940.
- ^ Eskandari, Kiamars; Lesani, Mina (2015). "Does Fluorine Participate in Halogen Bonding?". Chemistry – A European Journal. 21 (12): 4739–4746. doi:10.1002/chem.201405054. ISSN 1521-3765.
- ^ a b Metrangolo, P.; Resnati, G. (2001), "Halogen Bonding: A Paradigm in Supramolecular Chemistry", Chem. Eur. J., 7 (12): 2511–2519, doi:10.1002/1521-3765(20010618)7:12<2511::AID-CHEM25110>3.0.CO;2-T, PMID 11465442
- ^ Guthrie, F. (1863), "Xxviii.—On the Iodide of Iodammonium", J. Chem. Soc., 16: 239–244, doi:10.1039/js8631600239
- ^ Mulliken, R.S. (1950), "Structures of Complexes Formed by Halogen Molecules with Aromatic and with Oxygenated Solvents1", J. Am. Chem. Soc., 72 (1): 600, doi:10.1021/ja01157a151
- ^ Mulliken, R.S. (1952), "Molecular Compounds and their Spectra. II", J. Am. Chem. Soc., 74 (3): 811–824, doi:10.1021/ja01123a067
- ^ Mulliken, R.S. (1952), "Molecular Compounds and their Spectra. III. The Interaction of Electron Donors and Acceptors", J. Phys. Chem., 56 (7): 801–822, doi:10.1021/j150499a001
- ^ Hassel, O.; Hvoslef, J.; Vihovde, E. Hadler; Sörensen, Nils Andreas (1954), "The Structure of Bromine 1,4-Dioxanate" (PDF), Acta Chem. Scand., 8: 873, doi:10.3891/acta.chem.scand.08-0873
- ^ Hassel, O. (1970), "Structural Aspects of Interatomic Charge-Transfer Bonding", Science, 170 (3957): 497–502, Bibcode:1970Sci...170..497H, doi:10.1126/science.170.3957.497, PMID 17799698
- ^ Hassel, O. (1972). "Structural Aspects of Interatomic Charge-Transfer Bonding". In Nobel Lectures, Chemistry 1963-1970: 314–329.
- ^ Bent, H. A. (1968). "Structural Chemistry of Donor-Acceptor Interactions". Chem. Rev. 68 (5): 587–648. doi:10.1021/cr60255a003.
- ^ Dumas, J.-M.; Peurichard, H.; Gomel, M. (1978). "CX4...Base Interactions as Models of Weak Charge-transfer Interactions: Comparison with Strong Charge-transfer and Hydrogen-bond Interactions". J. Chem. Res.(S). 2: 54–57.
- ^ Legon, A. C. (1999). "Prereactive Complexes of Dihalogens XY with Lewis Bases B in the Gas Phase: A Systematic Case for the Halogen Analogue B···XY of the Hydrogen Bond B···HX". Angew. Chem. Int. Ed. 38 (18): 2686–2714. doi:10.1002/(sici)1521-3773(19990917)38:18<2686::aid-anie2686>3.0.co;2-6.
- ^ Politzer, P.; Murray, J. S.; Clark, T. (2010). "Halogen Bonding: An Electrostatically-driven Highly Directional Noncovalent Interaction". Phys. Chem. Chem. Phys. 101: 16789–16794.
- ^ Mallada, B.; Gallardo, A.; Lamanec, M.; de la Torre, B.; Špirko, V.; Hobza, P.; Jelinek, P. (2021), "Real-space imaging of anisotropic charge of σ-hole by means of Kelvin probe force microscopy", Science, 374 (6569): 863–867, doi:10.1126/science.abk1479, PMID 34762455, S2CID 244039573
- ^ Braga, D.; Desiraju, Gautam R.; Miller, Joel S.; Orpen, A. Guy; Price, Sarah (Sally) L.; et al. (2002), "Innovation in Crystal Engineering", CrystEngComm, 4 (83): 500–509, doi:10.1039/b207466b
- ^ Metrangolo, P.; Resnati, Giuseppe; Pilati, Tullio; Liantonio, Rosalba; Meyer, Franck; et al. (2007), "Engineering Functional Materials by Halogen Bonding", J. Polym. Sci., Part A: Polym. Chem., 45 (1): 1–14, Bibcode:2007JPoSA..45....1M, doi:10.1002/pola.21725
- ^ Metrangolo, Pierangelo; Resnati, Giuseppe; Pilati, Tullio; Terraneo, Giancarlo; Biella, Serena (2009), "Anion coordination and anion-templated assembly under halogen bonding control", CrystEngComm, 11 (7): 1187–1196, doi:10.1039/B821300C
- ^ Janeta, Mateusz; Szafert, Sławomir (2017-10-01). "Synthesis, characterization and thermal properties of T8 type amido-POSS with p-halophenyl end-group". Journal of Organometallic Chemistry. 847: 173–183. doi:10.1016/j.jorganchem.2017.05.044. ISSN 0022-328X.
- ^ Nguyen, HL; Horton, PN; Hursthouse, MB; Legon, AC; Bruce, DW (2004), "Halogen Bonding: A New Interaction for Liquid Crystal Formation", J. Am. Chem. Soc., 126 (1): 16–17, doi:10.1021/ja036994l, PMID 14709037
- ^ Bruce, D.W. (2001), "The Materials Chemistry of Alkoxystilbazoles and Their Metal Complexes", Adv. Inorg. Chem., Advances in Inorganic Chemistry, 52: 151–204, doi:10.1016/S0898-8838(05)52003-8, ISBN 9780120236527
- ^ Weingarth, M.; Raouafi, N.; Jouvelet, B.; Duma, L.; Bodenhausen, G.; Boujlel, K.; Scöllhorn, B.; Tekley, P. (2008), "Revealing molecular self-assembly and geometry of non-covalent halogen bonding by solid-state NMR spectroscopy", Chem. Commun., no. 45, pp. 5981–5983, doi:10.1039/b813237b, PMID 19030559
- ^ a b Sun, A.; Lauher, J.W.; Goroff, N.S. (2006), "Preparation of Poly(Diiododiacetylene), an Ordered Conjugated Polymer of Carbon and Iodine", Science, 312 (5776): 1030–1034, Bibcode:2006Sci...312.1030S, doi:10.1126/science.1124621, PMID 16709780, S2CID 36045120
- ^ Pigge, F.; Vangala, V.; Kapadia, P.; Swenson, D.; Rath, N.; Chem, Comm (2008), "Hexagonal crystalline inclusion complexes of 4-iodophenoxy trimesoate", Chemical Communications, 38 (39): 4726–4728, doi:10.1039/b809592b, PMID 18830473, S2CID 40424594
- ^ Auffinger, P.; Hays, FA; Westhof, E; Ho, PS; et al. (2004), "Halogen Bonds in Biological Molecules", Proc. Natl. Acad. Sci. U.S.A., 101 (48): 16789–16794, Bibcode:2004PNAS..10116789A, doi:10.1073/pnas.0407607101, PMC 529416, PMID 15557000
- ^ Steinrauf, L.K.; Hamilton, JA; Braden, BC; Murrell, JR; Benson, MD; et al. (1993), "X-ray crystal structure of the Ala-109-->Thr variant of human transthyretin which produces euthyroid hyperthyroxinemia", J. Biol. Chem., 268 (4): 2425–2430, doi:10.1016/S0021-9258(18)53793-5, PMID 8428916
- ^ a b Howard, E.I.; et al. (2004), "Ultrahigh Resolution Drug Design I: Details of Interactions in Human Aldose Reductase-Inhibitor Complex at 0.66 Å", Proteins: Structure, Function, and Bioinformatics, 55 (4): 792–804, doi:10.1002/prot.20015, PMID 15146478, S2CID 38388856
- ^ Yabe-nishimura, C. (1998), "Aldose reductase in glucose toxicity: a potential target for the prevention of diabetic complications", Pharmacol Rev, 50 (1): 21–33, PMID 9549756