파이-스택링(화학)
Pi-Stacking (chemistry)화학에서 파이 쌓기(pi stacking, π–π stacking이라고도 함)는 방향족 고리 사이에 파이 결합을 포함하기 때문에 매력적이고 비균등적인 상호작용을 말한다. 이러한 상호작용은[1] DNA와 RNA 분자 내의 뉴클레오바제 쌓기, 단백질 접기, 템플릿 지향 합성, 재료 과학 및 분자 인식에서 중요한데, 비록 일부 연구에서는 파이 쌓기가 이러한 용도의 일부에서 작용하지 않을 수 있다고 제안하지만 말이다. 강렬한 실험 및 이론적 관심에도 불구하고, 파이 쌓기 상호작용에 기여하는 요인에 대한 통일된 설명은 없다.
파이 쌓기 증거
벤젠 다이머는 파이 쌓기 연구를 위한 시제품 시스템으로, T형 다이머의 질량 중심 사이에 4.96 96의 간격을 두고 가스 단계에서 8–12 kJ/mol(2–3 kcal/mol)로 시험적으로 결합된다. 결합에너지가 작아 벤젠디머는 실험적으로 연구하기 어렵고, 디머 자체는 저온에서만 안정적이고 군집화되기 쉽다.[2]
파이 쌓기를 위한 다른 증거는 X선 결정 구조 결정에서 나온다. 수직 및 오프셋 병렬 구성은 많은 간단한 방향족 화합물의 결정 구조에서 관찰할 수 있다.[2] 단백질 데이터 뱅크의 고해상도 X선 단백질 결정 구조에 대한 조사에서 유사한 오프셋 병렬 또는 수직 기하학이 관찰되었다.[3] 방향족 아미노산 페닐알라닌, 티로신, 히스티딘, 트립토판의 분석은 이들 사이드 체인의 디머가 평균 반데르발스 반지름보다 더 큰 거리에서 많은 가능한 안정화 상호작용을 가지고 있음을 나타낸다.[4]
기하학적 구성
선호되는 벤젠 다이머의 기하학적 구조는 MP2-R12/A 연산 및 매우 큰 대반사 보정 아우구-cc-PVTZ 기반 세트로 높은 수준의 이론으로 모델링되었다.[2] 가장 안정적인 두 가지 순응은 평행 변위형 및 T자형이며, 이는 본질적으로 등화관념이다. 이와는 대조적으로 샌드위치 구성은 pi 시스템의 중첩을 최대화하여 상호작용을 불안정하게 한다. 샌드위치 구성은 X선 결정 데이터에서 이 구성의 상대적 희귀성과 일치하는 정력적인 안장 지점을 나타낸다.
벤젠 다이머의 이 세 가지 기하학적 구성의 상대적 결합 에너지는 쿼드폴/쿼드루폴과 런던 분산 힘의 균형으로 설명할 수 있다. 벤젠은 쌍극모멘트가 없는 반면 4극모멘트가 강하다.[5] 국부 C-H 쌍극자는 링의 원자에 양전하가 있고 링 위와 아래에 전자 구름을 나타내는 그에 상응하는 음전하가 있다는 것을 의미한다. 헥사플루오로벤젠의 경우 불소의 전기성으로 인해 쿼드폴 모멘트가 역전된다. 샌드위치 구성의 벤젠 조광기는 런던 분산력에 의해 안정화되지만 혐오스러운 쿼드러폴/쿼드러폴 상호작용에 의해 불안정화된다. 벤젠 링 중 하나를 상쇄함으로써 병렬로 이동된 구성은 이러한 혐오 상호작용을 감소시키고 안정화된다. 방향족 고리의 큰 편광성은 쌓는 효과에 대한 주요한 기여로서 분산적인 상호작용을 이끈다. 이것들은 DNA와 같은 뉴클레오바제의 상호작용을 위한 주요한 역할을 한다.[6] T자형 구성은 한 벤젠 고리의 양의 4중극이 다른 한 개의 음의 4중극과 상호작용을 하기 때문에 호의적인 4중극/4중극 상호작용을 즐긴다. 벤젠 링은 이 구성에서 가장 멀리 떨어져 있으므로, 바람직한 쿼드폴/쿼드루폴 상호작용이 감소된 분산력을 분명히 보상한다.
대체 효과
파이 쌓기 상호작용을 미세 조정하는 능력은 수많은 합성 노력에 유용할 것이다. 한 가지 예는 방향족 잔류물을 함유한 효소 포켓에 소분자 억제제의 결합 친화력을 높이는 것이다. 이성애자와 대체물이 파이 쌓기[3] 상호작용에 미치는 영향은 모델링하기 어렵고 논쟁의 사안이다.
정전기 모델
파이 쌓기 상호작용에서 대체자의 역할에 대한 초기 모델은 헌터와 샌더스에 의해 제안되었다.[7] 그들은 대체 효과에서 전기학이 우세하다는 것을 질적으로 판단하기 위해 시그마와 파이 원자 전하, 상대적 방향, 반 데르 발 상호작용을 기반으로 하는 간단한 수학 모델을 사용했다. 그들의 모델에 따르면, 전자 인출 그룹은 방향족 고리의 음의 4중극을 감소시켜 평행한 변위 및 샌드위치 순응을 선호한다. 대조적으로, 전자 기부 그룹은 음의 4중극을 증가시키며, 이것은 적절한 기하학적 구조와 함께 T자 모양의 구성에서 상호작용 강도를 증가시킬 수 있다. 이 모델에 기초하여, 저자들은 보다 정교한 계산이 적용되기 전까지 우세했던 파이 쌓기 상호작용을 지배하는 일련의 규칙들을 제안했다.
헌터-샌더스 모델에 대한 실험 증거는 시겔 외 연구진이 제공했다. 1,8-di-o-to-tolylnaphalenes의 대체된 [8]syn-di-di-o-tolylnaphalenes를 사용한다. 이들 화합물에서 아릴 그룹은 장막 혼잡으로 인해 누적된 기하학적 구조에서 "페이스오프"를 이루며, 경구화 방벽은 핵자기 공명 분광법에 의해 측정되었다. 저자들은 전자 대체물이 있는 아릴 링이 회전 장벽이 더 높다고 보고했다. 이 결과의 해석은 이들 집단이 방향족 고리의 전자 밀도를 감소시켜 샌드위치 파이 쌓기 상호작용을 보다 유리하게 하여 더 높은 장벽을 가능하게 한다는 것이었다. 즉, 전자 인출 집단은 접지 상태에서 "덜 불리한" 정전기적 상호작용을 초래했다.

헌터 외 연구진은 pi 쌓기 상호작용에서 대체 효과의 문제에 수소결합 "지퍼"로 보다 정교한 화학적 이중 돌연변이 사이클을 적용했다.[9] 이 기법은 다수의 비공용적 상호작용을 연구하기 위해 사용되어 왔다. 이 경우 단일 돌연변이는 방향족 고리의 대체물을 바꾸는 것으로, 수소 결합 강도의 변화와 같은 2차적 효과를 초래한다. 이중 돌연변이는 이러한 이차적 상호작용을 정량화하여 관심의 약한 상호작용도 배열에서 해부할 수 있다. 그들의 결과는 더 많은 전자-퇴출 대체물이 더 적은 파이 쌓기 상호작용을 가지고 있다는 것을 보여준다. 이에 상응하여, 이 경향은 벤젠과 4극 모멘트가 같지만 반대인 5극 모멘트를 갖는 펜타플루오로페닐벤젠과의 상호작용에서 정확히 반전되었다.[5] 이 연구 결과는 헌터-샌더스 모델에 대한 직접적인 증거를 제공한다. 그러나 이중 돌연변이 방법을 사용하여 측정한 적층 상호작용은 놀라울 정도로 작았고, 저자들은 그 값이 다른 시스템으로 전달되지 않을 수 있다는 점에 주목한다.
후속 연구에서 헌터 외 연구진. 이중 돌연변이 사이클에서 상호작용하는 방향족 링의 상호작용 에너지가 정전기 효과에 의해 지배된다는 것을 첫 번째 근사치로 검증했다.[10] 그러나 저자들은 아래에서 논의된 링 대체물과의 직접적인 상호작용도 중요한 기여를 한다는 점에 주목한다. 실제로 이 두 요인의 상호작용으로 인해 파이 쌓기 상호작용의 대체 및 기하학적 의존적 동작이 복잡해질 수 있다.
직접 상호작용 모형
헌터-샌더스 모델은 주로 정전기 효과에 의해 관리되지 않는 파이 쌓기 상호작용에 대한 모순된 실험 및 계산적 증거를 제공하는 수많은 연구 단체들로부터 비판을 받아왔다.
정전기 대체 효과에 대한 가장 명확한 실험 증거는 래쉬킨과 워터스로부터 보고되었다.[11] 그들은 pi 쌓기 상호작용을 위한 모델 시스템으로서 평행하게 변위된 순응에 쌓이는 메타 및 파라 대체 N-벤질-2-(2-fluorophenyl)-피리디늄 브로미드를 사용했다. 그들의 시스템에서, 메틸렌 링커는 유리한 T자 모양의 상호작용을 금지한다. 이전 모델에서와 같이, pi 쌓기 상호작용의 상대적 강도는 전환 상태에서 pi 쌓기 상호작용이 교란되기 때문에 biaryl 본드에 대한 회전 속도로 NMR에 의해 측정되었다. 파라 대체 링은 작은 회전 장벽을 가지고 있었는데, 이것은 점점 더 전자에서 빠져나오는 그룹과 함께 증가했고, 이전의 발견과 일치했다. 그러나 메타 대체 링은 방향족 링에서 전자 밀도가 거의 동일함에도 불구하고 회전 장벽이 훨씬 컸다. 저자들은 이러한 불일치를 한 고리의 수소 원자 가장자리와 다른 고리의 전기적 대체물의 직접적인 상호작용이라고 설명한다. 이 주장은 해당 양성자의 화학적 이동 데이터에 의해 뒷받침된다.
파이 쌓기에 대한 인자의 상대적 기여도에 대한 상세한 분석의 대부분은 계산에 의해 도출되었다. 셰릴과 신노크로트는 샌드위치 구성에서 모든 대체 벤젠 다이머가 벤젠 다이머보다 결합 상호작용이 더 유리하다는 높은 수준의 이론을 사용하여 놀라운 결과를 보고했다.[12] 나중에 Sherill 그룹의 계산 연구는 샌드위치 구성의 대체 효과가 첨가물이라는 것을 밝혀냈다. 이것은 산포력과 대체물들 사이의 직접적인 상호작용의 강한 영향을 지적한다.[13] T자형 구성에서 대체된 벤젠 간의 상호작용이 더 복잡하다는 점에 주목했다. 마지막으로 셰릴과 신노크로트는 리뷰 기사에서 전자 기부나 대체품 철수에 기초한 경향의 외형은 교환-거부 및 분산 용어로 설명될 수 있다고 주장한다.[14]
Houk와 Wheeler는 또한 파이 쌓기에서 직접적인 상호작용의 중요성에 대한 설득력 있는 계산 증거를 제공한다.[15] 샌드위치 순응에서 대체 벤젠 다이머를 분석하면서, 그들은 대체 벤젠인 Ph-X가 H-X로 대체되는 매우 단순한 모델을 사용하여 그들의 발견을 다시 요약할 수 있었다. 놀랍게도, 이 조잡한 모델은 상대 상호작용 에너지에서 동일한 추세를 초래했고 Ph-X에 대해 계산된 값과 강하게 상관되었다. 이 결과는 벤젠디머의 대체 효과가 방향족 링과 대체재의 직접적인 상호작용에 기인하며, 대체된 벤젠의 pi 시스템이 관여하지 않는다는 것을 시사한다. 이 후자의 지점은 아래에 확장되어 있다.
요약하면, pi 쌓기 상호작용에서 볼 수 있는 대체 효과에 대한 전기학, 분산 및 직접 상호작용의 상대적 기여는 기하학 및 실험 설계에 크게 의존하는 것처럼 보일 수 있다. 그 문제에 대한 의견의 불일치는 단순히 그 문제의 복잡성을 반영할 수도 있다.
방향성 요구 조건
pi 쌓기에 대한 전통적인 이해는 p-orbitals에서 delocalized electrones 사이의 4극 상호작용을 포함한다. 즉, 이러한 상호작용이 일어나려면 방향성이 요구되어야 한다. 그러나, 몇몇 집단은 파이 쌓기가 독특한 현상인지 아니면 그것이 다른 중립적이고 폐쇄적인 분자로 확장되는지 의문을 제기하며 반대 증거를 제시했다.
위에서 언급한 다른 것과 다르지 않은 실험에서, Paliwal과 공저자는 두 개의 일치 상태를 가진 아릴 에스테르로부터 분자 비틀림 균형을 구성했다.[16] 접힌 상태는 T자 형상과 pi 쌓기 상호작용이 잘 정의된 반면, 펼쳐진 상태는 아릴-아릴 상호작용이 없었다. 두 순응의 NMR 화학적 변화는 구별되었고 두 상태의 비율을 결정하는 데 사용될 수 있었는데, 이는 근내력에 대한 측정으로 해석되었다. 저자들은 접힌 상태에 대한 선호가 아릴 에스테르만의 독특한 것은 아니라고 보고한다. 예를 들어, 사이클로헥실 에스테르는 페닐 에스테르보다 접힌 상태를 더 선호했고, 테르트부틸 에스테르는 어떤 아릴 에스테르보다 더 큰 선호도로 접힌 상태를 선호했다. 이는 방향족과 방향족과의 상호작용을 위한 엄격한 요구사항이 아님을 시사한다.
비-자율적 pi 쌓기 상호작용 결과에 대한 다른 증거는 경험적 관찰의 근본적인 메커니즘을 설명하면서 이론 화학에서 비판적 연구를 포함한다. 그림미는 1개 또는 2개의 링으로 구성된 소형 조광기의 상호작용 에너지가 방향성 화합물과 포화성 화합물 모두에서 매우 유사하다고 보고했다.[17] 이 발견은 생물학과 특히 관련이 있으며, 쌓인 뉴클레오바제와 같은 현상에 대한 파이 시스템의 기여도를 과대평가할 수 있음을 시사한다. 그러나 대형 방향족 조광기의 안정화 교호작용이 증가하는 것으로 나타났다. 앞에서 언급한 바와 같이, 이 상호작용 에너지는 기하학에 크게 의존한다. 실제로 대형 방향족 조광기는 샌드위치 기하학에서 포화상태인 상대방에 비해 안정적일 뿐 에너지는 T자 모양의 상호작용에서 유사하다.
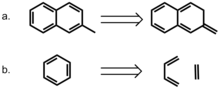
방향성의 역할을 모델링하기 위한 보다 직접적인 접근은 블룸과 휠러가 맡았다.[18] 저자들은 벤젠과 2-메틸나프탈렌 또는 2-메틸나프탈렌의 비-아름다운 이소머인 2-메틸렌-2,3-디히드로나프탈렌의 상호작용을 비교했다. 그러나 후자의 화합물은 p-electron자의 수를 보존하는 수단을 제공하는 동시에 delocalization의 효과를 제거한다. 놀랍게도, 비-아로마성 화합물의 경우 벤젠과의 상호작용 에너지가 더 높아서, 파이-본드 국산화 작용이 pi 쌓기 상호작용에 따르면 pi-bond localization은 pi 쌓기 상호작용에 유리하다. 저자들은 또 에틸렌과 1,3부타디엔으로 벤젠을 동음이의어로 분해하는 것을 고려했고, 샌드위치에서 벤젠과 이런 상호작용을 비교했다. 이들의 계산은 샌드위치와 병렬로 이동된 순응에서 벤젠 다이머보다 벤젠과 호모데모틱 벤젠 사이의 상호작용 에너지가 더 높다는 것을 나타내며, 국부적인 pi-bond 상호작용의 호감도를 다시 강조한다. 이러한 결과는 이 모델에서 파이 쌓기 상호작용에 방향성이 필요하지 않음을 강력히 시사한다.
이 증거에 비추어 보아도 그림미는 파이 쌓기가 실제로 존재한다고 결론짓는다.[17] 그러나 그는 특히 T자형 순응에 있는 작은 고리들은 포화상태의 고리들과 크게 다르게 행동하지 않으며, 이 용어는 협력적인 파이 전자 효과를 나타내는 것처럼 보이는 스택 순응에서 더 큰 고리에 대해 명시되어야 한다고 경고한다.
적용들
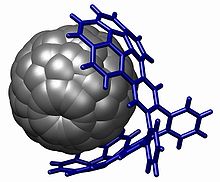
버키캐쳐에서 강력한 스택 시연이 발견된다.[19] 이 분자 핀셋은 두 개의 오목한 버키볼에 바탕을 두고 있으며 볼록한 풀렌 분자에 딱 들어맞는다. 복합화는 단순히 두 화합물이 모두 함유된 톨루엔 용액을 증발시킴으로써 일어난다. 용액에서 8600 M의−1 연관 상수는 NMR 화학적 변화의 변화에 기초하여 측정한다.
파이 쌓기는 단백질 결정 구조에서 만연하며, 또한 작은 분자와 단백질 사이의 상호작용에도 기여한다. 결과적으로, pi-pi와 cation-pi 상호작용은 합리적인 약물 설계에서 중요한 요소가 된다.[20] 알츠하이머병 치료에 사용되는 FDA 승인 아세틸콜린테라제(ACHE) 억제제 타크린이 대표적이다. 타크린은 트르프84의 인덜릭 링과 파이 쌓기 상호작용을 제안받았으며, 이러한 상호작용이 새로운 ACHE 억제제의 합리적 설계에 이용되었다.[21]
약리 활성 화합물 추가
여러 변종의 pi 조정 페닐은 심지어 벤젠 대신 사이클로펜타디엔닐과 트리카르보닐을 사용하여 η-페닐트로판체를6 쌓기 위한 전이 금속을 사용하여 시험되었다. 트리카르보닐의 경우 의도된 리간드 부지에 대한 화합물의 친화력을 배가시켰다(정전기적 영향으로 인해 대상에 더 도움이 되는 것으로 추정됨).[22]
초분자 조립체 내
π 시스템은 다양한 기능 그룹과의 다용도 비균형 상호작용 때문에 초분자 조립체에서 중요한 구성 요소다. 초분자 어셈블리에 π-π 교호작용을 적용하는 주목할 만한 예는 카테난의 합성이다. 카테난의 합성을 위한 주요 과제는 분자를 통제된 방식으로 연동시키는 것이다. 스토다트와 동료들은 전자에 풍부한 벤젠 유도체와 전자에 약한 피리디늄 고리 사이의 강한 π-– 상호작용을 활용하는 일련의 시스템을 개발했다.[23] [2]카타넨은 bis(피리디늄) (A), bisparaphenilen-34-크라운-10 (B), 1, 4-bis(브로메틸)벤젠 (C)을 반응시켜 합성되었다(그림 2). A와 B의 π–π 상호작용은 [2]카테난 제품을 생성하기 위해 복합체 C와의 대체 반응에 의해 추가로 사이클링된 연동형 템플릿 중간을 형성하도록 지시하였다.
참고 항목
참조
- ^ Martinez, Chelsea R.; Iverson, Brent L. (2012). "Rethinking the term "pi-stacking"". Chemical Science. 3 (7): 2191. doi:10.1039/c2sc20045g. hdl:2152/41033. ISSN 2041-6520.
- ^ a b c Sinnokrot, MO; Valeev, EF; Sherrill, CD (2002). "Estimates of the ab initio limit for pi–pi interactions: The benzene dimer". J. Am. Chem. Soc. 124 (36): 10887–10893. doi:10.1021/ja025896h. PMID 12207544.
- ^ a b Huber, Roland G.; Margreiter, Michael A.; Fuchs, Julian E.; von Grafenstein, Susanne; Tautermann, Christofer S.; Liedl, Klaus R.; Fox, Thomas (2014). "Heteroaromatic π-Stacking Energy Landscapes". Journal of Chemical Information and Modeling. 54 (5): 1371–1379. doi:10.1021/ci500183u. PMC 4037317. PMID 24773380.
- ^ McGaughey, GB; Gagné, M; Rappé, AK (1998). "Pi-Stacking interactions. Alive and well in proteins". J. Biol. Chem. 273 (25): 15458–15463. doi:10.1074/jbc.273.25.15458. PMID 9624131.
- ^ a b Battaglia, M.R.; Buckingham, A.D.; Williams, J.H. (1981). "The electric quadrupole moments of benzene and hexafluorobenzene". Chem. Phys. Lett. 78 (3): 421–423. Bibcode:1981CPL....78..421B. doi:10.1016/0009-2614(81)85228-1.
- ^ Riley, K. E.; Hobza, P. (2013). "On the Importance and Origin of Aromatic Interactions in Chemistry and Biodisciplines". Acc. Chem. Res. 46 (4): 927–936. doi:10.1021/ar300083h.
- ^ Hunter, Christopher A.; Sanders, Jeremy K. M. (1990). "The nature of π–π Interactions". J. Am. Chem. Soc. 112 (14): 5525–5534. doi:10.1021/ja00170a016.
- ^ Cozzi, Franco; Cinquini, Mauro; Annuziata, Rita; Siegel, Jay S. (1993). "Dominance of polar/.pi. Over charge-transfer effects in stacked phenyl interactions". J. Am. Chem. Soc. 115 (12): 5330–5331. doi:10.1021/ja00065a069.
- ^ a b Cockroft, SL; Hunter, CA; Lawson, KR; Perkins, J; Urch, CJ (2005). "Electrostatic control of aromatic stacking interactions". J. Am. Chem. Soc. 127 (24): 8594–8595. doi:10.1021/ja050880n. PMID 15954755.
- ^ Cockroft, SL; Perkins, J; Zonta, C; Adams, H; Spey, SE; Low, CM; Vinter, JG; Lawson, KR; Urch, CJ (2007). "Substituent effects on aromatic stacking interactions". Org. Biomol. Chem. 5 (7): 1062–1080. doi:10.1039/b617576g. PMID 17377660. S2CID 37409177.
- ^ Rashkin, MJ; Waters, ML (2002). "Unexpected substituent effects in offset pi–pi stacked interactions in water". J. Am. Chem. Soc. 124 (9): 1860–1861. doi:10.1021/ja016508z. PMID 11866592.
- ^ Sinnokrot, Mutasem Omar; Sherrill, C. David (2003). "Unexpected Substituent Effects in Face-to-Face π-Stacking Interactions". J. Phys. Chem. A. 107 (41): 8377–8379. Bibcode:2003JPCA..107.8377S. doi:10.1021/jp030880e.
- ^ Ringer, AL; Sinnokrot, MO; Lively, RP; Sherrill, CD (2006). "The effect of multiple substituents on sandwich and T-shaped pi–pi interactions". Chem. Eur. J. 12 (14): 3821–8. doi:10.1002/chem.200501316. PMID 16514687.
- ^ Sinnokrot, MO; Sherrill, CD (2006). "High-accuracy quantum mechanical studies of pi–pi interactions in benzene dimers". J. Phys. Chem. A. 110 (37): 10656–10668. Bibcode:2006JPCA..11010656S. doi:10.1021/jp0610416. PMID 16970354.
- ^ a b Wheeler, SE; Houk, KN (2008). "Substituent effects in the benzene dimer are due to direct interactions of the substituents with the unsubstituted benzene". J. Am. Chem. Soc. 130 (33): 10854–10855. doi:10.1021/ja802849j. PMC 2655233. PMID 18652453.
- ^ Paliwal, S.; Geib, S.; Wilcox, C. S. (1994). "Molecular Torsion Balance for Weak Molecular Recognition Forces. Effects of "Tilted-T" Edge-to-Face Aromatic Interactions on Conformational Selection and Solid-State Structure". J. Am. Chem. Soc. 116 (10): 4497–4498. doi:10.1021/ja00089a057.
- ^ a b Grimme, Stefan (2008). "Do Special Noncovalent π–π Stacking Interactions Really Exist?". Angew. Chem. Int. Ed. 47 (18): 3430–3434. doi:10.1002/anie.200705157.
- ^ a b Bloom, Jacob W. G.; Wheeler, Steven E. (2011). "Taking the Aromaticity out of Aromatic Interactions". Angew. Chem. 123 (34): 7993–7995. doi:10.1002/ange.201102982.
- ^ a b A. Sygula, F. R. Fronczek, R. Sygula, P. W. Rabideau and M. M. Olmstead (2007). "A Double Concave Hydrocarbon Buckycatcher". J. Am. Chem. Soc. 129 (13): 3842–3843. doi:10.1021/ja070616p. PMID 17348661.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Babine, RE; Bender, SL (1997). "Molecular Recognition of Proteinminus signLigand Complexes: Applications to Drug Design". Chem. Rev. 97 (5): 1359–1472. doi:10.1021/cr960370z. PMID 11851455.
- ^ Da Silva, CH; et al. (2006). "Molecular modeling, docking and ADMET studies applied to the design of a novel hybrid for treatment of Alzheimer's disease". J. Mol. Graphics Modell. 25 (2): 169–175. doi:10.1016/j.jmgm.2005.12.002. PMID 16413803.
- ^ Singh, Satendra; et al. (2000). "Chemistry, Design, and Structure-Activity Relationship of Cocaine Antagonists" (PDF). Chem. Rev. 100 (3): 925–1024. doi:10.1021/cr9700538. PMID 11749256.
- ^ Ashton, P. R.; Goodnow, T. T.; Kaifer, A. E.; et al. (1989). "A [2] Catenane Made to Order". J. Angew. Chem. Int. Ed. 28 (10): 1396–1399. doi:10.1002/anie.198913961.
외부 링크
- Luo, R; Gilson, HS; Potter, MJ; Gilson, MK (2001). "The physical basis of nucleic acid base stacking in water". Biophys J. 80 (1): 140–8. Bibcode:2001BpJ....80..140L. doi:10.1016/S0006-3495(01)76001-8. PMC 1301220. PMID 11159389.
- 래리 울프(2011년): --π (π-Stacking) 상호작용: 기원과 변조