저배리어 수소 결합
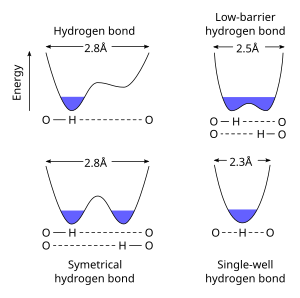
Low-barrier hydrogen bond저배리어 수소결합(LBHB)은 수소결합의 특수한 유형입니다.LBHB는 두 헤테로아톰의 pKa가 밀접하게 일치할 때 발생할 수 있으며, 이는 두 헤테로아톰 간에 수소를 더 동등하게 공유할 수 있게 해준다.이러한 수소 공유는 특히 짧고 강한 수소 [1]결합의 형성을 일으킨다.
묘사
표준 수소 결합은 더 길고(예를 들어 O··O h 결합의 경우 2.8Ω), 수소 이온은 분명히 헤테로아톰 중 하나에 속한다.헤테로아톰의 pKa가 근접하게 일치하면 보다 짧은 거리(~2.55Ω)에서 LBHB가 가능해진다.거리가 더 줄어들면(< 2.29Ω), 결합은 단일 웰 또는 짧은 강 수소 [3]결합으로 특징지어진다.
단백질
저 장벽 수소 결합은 단백질을 제외한 [4]물 환경에서 발생합니다.여러 잔류물이 전하 릴레이 시스템에서 함께 작용하여 관련된 잔류물의 pKa 값을 제어합니다.LBHB는 단백질 표면에서도 발생하지만, 벌크 워터에 가깝고 단백질-단백질 [4]계면에서 강한 염분 교량의 상반된 요구 사항 때문에 불안정하다.
효소 촉매 작용
저배리어 수소 결합은 두 가지 [5]유형의 환경에서 효소 촉매 작용과 관련이 있는 것으로 제안되었다.첫째, 활성 부위 내 전하 릴레이 네트워크의 저배리어 수소 결합은 촉매 잔류물(예: 촉매 삼합체 내 산과 염기 사이)을 활성화할 수 있습니다.둘째, LBHB의 형성은 촉매 작용 중에 형성되어 전이 상태를 안정시킬 수 있다(예를 들어 산소 음이온 구멍의 기질 전이 상태).이 두 메커니즘 모두 이론적인 근거와 실험적인 근거는 발생 [6][7]여부에 따라 나뉘며 논쟁의 여지가 있다.2000년대 이후, LBHB는 촉매 작용을 [7][8]돕기 위해 효소에 의해 사용되지 않는다는 것이 일반적인 의견이다.그러나 2012년에는 인산염 수송 [9]단백질의 인산염-아르센산 식별에 관여하는 저배리어 수소 결합이 제안되었다.이 발견은 매우 드문 경우에서 저배리어 수소 결합이 이온 크기 선택에 촉매 역할을 할 가능성을 나타낼 수 있다.
레퍼런스
- ^ Gilli, G.; Gilli, P. (2000-09-26). "Towards an unified hydrogen-bond theory". Journal of Molecular Structure. 552 (1–3): 1–15. Bibcode:2000JMoSt.552....1G. doi:10.1016/S0022-2860(00)00454-3.
- ^ Day, Victor W.; Hossain, Md. Alamgir; Kang, Sung Ok; Powell, Douglas; Lushington, Gerald; Bowman-James, Kristin (2007). "Encircled Proton". J. Am. Chem. Soc. 129 (28): 8692–3. doi:10.1021/ja0724745. PMID 17585768.
- ^ Schiøtt B, Iversen BB, Madsen GK, Larsen FK, Bruice TC (October 1998). "On the electronic nature of low-barrier hydrogen bonds in enzymatic reactions". Proc. Natl. Acad. Sci. U.S.A. 95 (22): 12799–802. Bibcode:1998PNAS...9512799S. doi:10.1073/pnas.95.22.12799. PMC 23598. PMID 9788994.
- ^ a b Ishikita, Hiroshi; Saito, Keisuke (2014-02-06). "Proton transfer reactions and hydrogen-bond networks in protein environments". Journal of the Royal Society Interface. 11 (91): 20130518. doi:10.1098/rsif.2013.0518. ISSN 1742-5689. PMC 3869154. PMID 24284891.
- ^ Cleland, W. W.; Frey, P. A.; Gerlt, J. A. (2 October 1998). "The Low Barrier Hydrogen Bond in Enzymatic Catalysis". Journal of Biological Chemistry. 273 (40): 25529–25532. doi:10.1074/jbc.273.40.25529. PMID 9748211.
- ^ Ash, E. L. (7 November 1997). "A Low-Barrier Hydrogen Bond in the Catalytic Triad of Serine Proteases? Theory Versus Experiment". Science. 278 (5340): 1128–1132. Bibcode:1997Sci...278.1128A. doi:10.1126/science.278.5340.1128. PMID 9353195.
- ^ a b Schutz, Claudia N.; Warshel, Arieh (1 April 2004). "The low barrier hydrogen bond (LBHB) proposal revisited: The case of the Asp ··· His pair in serine proteases". Proteins: Structure, Function, and Bioinformatics. 55 (3): 711–723. doi:10.1002/prot.20096. PMID 15103633. S2CID 34229297.
- ^ Warshel, Arieh; Sharma, Pankaz K.; Kato, Mitsunori; Xiang, Yun; Liu, Hanbin; Olsson, Mats H. M. (August 2006). "Electrostatic Basis for Enzyme Catalysis". Chemical Reviews. 106 (8): 3210–3235. doi:10.1021/cr0503106. PMID 16895325.
- ^ Elias, Mikael; Wellner, Alon; Goldin-Azulay, Korina; Chabriere, Eric; Vorholt, Julia A.; Erb, Tobias J.; Tawfik, Dan S. (2012-11-01). "The molecular basis of phosphate discrimination in arsenate-rich environments". Nature. 491 (7422): 134–137. Bibcode:2012Natur.491..134E. doi:10.1038/nature11517. ISSN 0028-0836. PMID 23034649. S2CID 205230854.