근육내력
Intramolecular force분자 내 힘(또는 일차 힘)은 분자 사이에 존재하는 힘인 분자간 힘과 혼동하지 않기 위해 분자나 화합물을 구성하면서 원자를 하나로 묶는 힘이다.[1] 이름의 미묘한 차이점은 영어의 라틴어적 뿌리에서 유래한 것으로, 내부적 의미와 내부적 의미 사이에 상호적 의미가 있다.[2] 예를 들어 화학적 결합은 근육 내 힘으로 간주된다. 이러한 힘은 결합되지 않은 원자나 분자 사이에 존재하는 분자간 힘보다 더 강한 경우가 많다.
종류들
고전적 모델은 이온, 공밸런트, 금속 등 세 가지 주요 화학 결합 유형을 식별하며, 이는 참여 원자 사이의 전하 분리 정도에 의해 구별된다.[3] 형성된 결합의 특성은 구성 원자의 특성, 즉 전기적 결합성으로 예측할 수 있다. 그들은 결합강도의 척도인 결합엔탈파이의 크기가 다르기 때문에 다른 방식으로 화합물의 물리적, 화학적 특성에 영향을 미친다. 이온성 성질의 %는 결합 원자의 전기성에 정비례한다.[clarification needed]
이온 결합
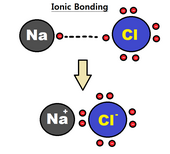
이온 결합은 결합 형성에 참여하는 원자의 하나 이상의 발란스 전자가 완전히 전달되어 정전기력에 의해 양이온과 음이온이 결합되는 것으로 대략 추정할 수 있다.[4] 이온 결합의 전자는 두 원자의 큰 전기적 결합성 차이 때문에 두 구성 원자의 하나 주변에서 주로 발견되는 경향이 있다(전기 결합도의 큰 차이는 더 강한 결합을 낳는다). 이것은 종종 다른 원자에게 전자를 주는 하나의 원자로 설명된다. 이러한 유형의 결합은 일반적으로 NaCl에서 나트륨과 염소와 같은 금속과 비금속 사이에 형성된다. 나트륨은 염소에 전자를 주어 양전하 나트륨 이온과 음전하 염화 이온을 형성한다.
공밸런트 결합
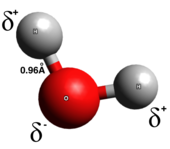
진정한 동반 결합에서 전자는 결합의 두 원자 사이에 고르게 공유된다; 전하 분리가 거의 또는 전혀 없다. 공밸런트 결합은 일반적으로 두 비금속 사이에 형성된다. 공밸런트 결합에는 여러 종류가 있다. 극성공밸런트 결합에서는 두 원자 중 하나 주변에서 전자가 발견될 가능성이 높은 반면, 비극공밸런스 결합에서는 전자가 고르게 공유된다. 동핵 이원자 분자는 순전히 공동의 가치가 있다. 공밸런트 결합의 극성은 각 원자의 전기적 중요도에 의해 결정되며, 따라서 극지의 공밸런트 결합은 부분적인 양의 끝에서 부분적인 음의 끝까지의 쌍극점 모멘트를 가진다.[5] 극성 공밸런트 결합은 전자가 한 원자에서 다른 원자로 완전히 전달되지 않거나 균등하게 공유되지 않는 중간 유형을 나타낸다.
공밸런트 화합물의 특성[2]
발란스 전자의 상호 공유에 의해 형성된 화합물을 공밸런트 화합물 또는 분자 화합물이라고 부른다. 공밸런트 화합물의 성질은 의존한다.
- 분자의 기하학적 형태.
- 분자 사이의 극성과 분자간 힘.
- 싱글, 더블, 트리플 중 어느 것이든 본드형.
공유 화합물의 몇 가지 중요한 특성은 다음과 같다.
- 공발화합물은 일반적으로 용해점과 비등점이 낮다.
- 공발화합물은 그 용액형태의 전해질이 아니므로 전기를 전도하지 않는다.
- 공발화합물은 고체, 액체, 기체 세 가지 물리적 상태에 모두 존재한다.
- 극성 공발효 화합물은 물 알코올 등과 같은 극성 용매에 용해되며, 비극성 공발효 화합물은 벤젠, 아세톤, 탄소 테트라-염소화물과 같은 비극성 용매에 용해된다.
- 공발화합물의 반응은 이온화합물보다 느리다.
- 공밸런트 화합물의 결합은 분자 결정을 형성할 수 있는 방향의 고체 공밸런트 화합물이다.
금속결합
금속 결합은 일반적으로 순수한 금속 또는 금속 합금 안에서 형성된다. 금속 전자는 일반적으로 소산된다; 그 결과는 전자 바다라고도 불리는 양의 핵 주위에 많은 수의 자유 전자가 있다.
금속 양극 이온과 전자의 주변 바다 사이의 끌어당김에서 생기는 화학적 결합을 금속 결합이라고 한다.
설명: - 금속 결합은 이온을 기준으로 설명할 수 없다. 공밸런트 본드 또는 바이더 월스 힘, 이것들은 금속 결합이 전자해나 전자 가스 이론에 기초하여 설명될 수 있는 금속 결합을 설명하는 다양한 이론들이다.
일렉트로닉
이 모델에 따르면 금속 원자의 발란스 전자는 큰 원자 크기와 금속 원자의 낮은 이온화 에너지로 인해 느슨하게 고정된다. 금속 원자는 발란스 전자를 잃고 양전하 이온이 된다. 외전자가 한 원자에 속하지 않고 음전하의 구름처럼 금속 이온 사이에서 자유롭게 움직인다는 뜻이다. 이 이동 전자는 금속 원자를 둘러싸고 전자의 바다를 형성하고, 금속 격자에서 함께 블러딩된다. 이 전자 바다는 금속 원자를 서로 결합하여 금속 결합을 형성한다.
금속성 화합물의 특성
금속의 원자는 금속 결합이라고 불리는 특수한 형태의 결합에 의해 결합되는데, 금속 화합물은 다음과 같은 성질을 보인다.
- 액체인 수성을 제외한 모든 금속은 상온에서 고체다.
- 그들은 높은 녹는점과 끓는점을 가지고 있다.
- 그들은 열과 전기를 잘 전도한다.
- 금속은 유연하기 때문에 시트에 박을 수 있다.
- 금속은 연성이므로 철사에 끌어 넣을 수 있다.
- 금속은 광택이 있고 표면이 반짝반짝 빛난다.
- 금속은 음성이고, 높은 밀도를 가지고 있을 때 특정한 울림 소리를 낸다.
채권형성
결합은 원자에 의해 형성되어 더 낮은 에너지 상태를 달성할 수 있다.[6] 자유 원자는 결합 원자보다 더 많은 에너지를 가질 것이다. 본드 형성 과정에서 일부 에너지가 방출돼 전체 시스템이 낮은 에너지 상태를 달성할 수 있기 때문이다. 결합 길이, 즉 결합 형성에 참여하는 두 원자의 최소 분리 거리는 핵 내부 방향을 따라 혐오스럽고 매력적인 힘에 의해 결정된다.[3] 두 원자가 점점 가까워질수록 양전하를 띤 핵이 반발하여 원자를 밀어내려고 하는 힘이 생긴다. 두 원자가 더 멀어질수록 매력적인 힘이 작용하여 원자를 다시 끌어당긴다. 따라서 평형 본드 길이가 달성되고 본드 안정성을 측정하는 좋은 척도가 된다.[7]
생화학
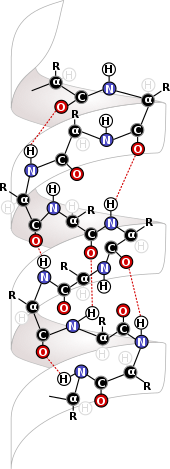
분자 내 힘은 생화학 분야에서 매우 중요한데, 생화학은 생물학적 구조의 가장 기본적인 수준에서 작용하게 된다. 이황화 결합과 같은 근육내 힘은 단백질과 DNA를 형성한다. 단백질은 그들을 형성하고 함께 지탱하는 근육 내의 힘으로부터 그들의 구조를 얻는다. 이들 분자의 주요 구조원은 단백질의 기초를 이루는 아미노산 잔류물들 사이의 상호작용이다.[8] 같은 단백질의 잔류물들 사이의 상호작용은 단백질의 2차 구조를 형성하여 단백질과 알파 헬리클의 경우 DNA에 중요한 구조인 베타 시트와 알파 헬리클의 형성을 가능하게 한다.
참고 항목
참조
- ^ Zumdahl, Steven S.; Zumdahl, Susan A. (2007). Chemistry (7th ed.). Boston: Houghton Mifflin. ISBN 978-0618713707. OCLC 85824942.
- ^ "Inter vs. Intra". www.grammar.com. Retrieved 2018-04-26.
- ^ a b Oxtoby, David W.; Gills, H. P.; Campion, Alan (2012). Principles of modern chemistry (7th ed.). Belmont, Calif.: Brooks/Cole Cengage Learning. ISBN 978-0-8400-4931-5.
- ^ Bader, R. F. W.; Henneker, W. H. (1965). "The Ionic Bond". Journal of the American Chemical Society. 87 (14): 3063–3068. doi:10.1021/ja01092a008.
- ^ Helmenstine, Anne Marie. "Understand What a Covalent Bond Is in Chemistry". ThoughtCo.
- ^ 원자력의 현미경 이미지에서 분자간 및 분자간 결합으로 해석되는 대비의 기원
- ^ 아시아 마리 S. 리엘, 리아논 K. 로위, 이단 N 호, 안나-캐린 C. 칼슨, 앤서니 K. 라페, 오리온 B. 베리맨*과 푸이싱호*
- ^ Nelson, David L.; Cox, Michael M.; Lehninger, Albert L. (2013). Lehninger principles of biochemistry (6th ed.). New York: W.H. Freeman and Company. ISBN 9781429234146. OCLC 824794893.