후크웜 감염
Hookworm infection| 후크웜 감염 | |
|---|---|
| 기타 이름 | 후크웜병 |
 | |
| 후크웜 | |
| 전문 | 전염병 |
| 증상 | 가려움증, 국소발진, 복통[1], 설사 |
| 합병증 | 빈혈, 단백질 결핍[2] |
| 원인들 | 십이지장충(구세계산 구렁이), 아메리카노네코토르(신세계산 [1]구렁이) |
| 위험요소 | 위생상태가 좋지[1] 않은 따뜻한 기후에서 맨발로 걷기 |
| 진단 방법 | 변 샘플[1] |
| 예방 | 맨발로 다니지 않고 야외 배변도[1] 멈춘다 |
| 약 | 알벤다졸, 메벤다졸, 철분[3] 보충제 |
| 빈도수. | 4억 2800만 (2015년)[4] |
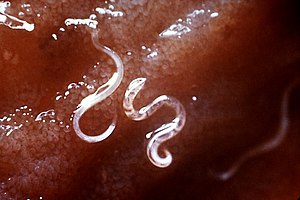
후크웜 감염은 [1][5]후크웜으로 알려진 장내 기생충에 의한 감염이다.처음에는 감염 부위에 가려움증이나 발진이 생길 수 있습니다.일부 웜의 영향을 받는 사람만 증상이 나타나지 않을 수 있습니다.많은 벌레들에 의해 감염된 사람들은 복통, 설사, 체중 감소, 그리고 피로를 경험할 수 있다.아이들의 정신적, 육체적 발달이 영향을 받을 수 있다.빈혈이 [1]생길 수 있습니다.
사람에게서 흔히 볼 수 있는 두 가지 구충 감염은 강낭충증과 네코토리아스이며, 각각 강낭충 십이지장충과 네코토리아스입니다.구충알은 감염된 사람의 변에 퇴적된다.만약 이것이 환경에 이르게 되면, 그들은 유충으로 부화할 수 있고, 그것은 피부를 관통할 수 있습니다.한 종류는 오염된 음식을 통해서도 전파될 수 있다.위험 요소로는 위생 상태가 좋지 않은 따뜻한 기후에서 맨발로 걷는 것이 포함됩니다.진단은 변 [1]샘플을 현미경으로 검사하는 것입니다.
이 병은 흔한 지역에서 맨발로 다니지 않음으로써 개인 차원에서 예방할 수 있다.인구 수준에서는 야외 배변을 줄이고, 생변을 비료로 사용하지 않으며, 대량 제충이 [1]효과적이다.치료는 보통 알벤다졸 또는 메벤다졸 약으로 1일에서 3일 동안 진행됩니다.빈혈이 [3]있는 사람에게는 철분 보충제가 필요할 수 있다.
구충은 2015년에 [4]약 4억 2,800만 명을 감염시켰다.심한 감염은 어린이와 성인 모두에게 발생할 수 있지만 성인에게는 [2]덜 흔하다.그들은 거의 [6]치명적이지 않다.후크웜 감염은 토양에서 전염되는 기생충으로 방치된 열대성 [7]질환으로 분류된다.
징후 및 증상
구충 감염에 특별한 증상이나 징후는 없지만, 그것들은 장염과 진행성 철 결핍성 빈혈과 단백질 결핍의 조합을 일으킨다.기침, 가슴 통증, 쌕쌕거림, 발열은 때때로 심각한 감염으로 인해 발생한다.위장의 증상은 시간이 지남에 따라 개선되는 경향이 있지만, 상복부 통증, 소화불량, 메스꺼움, 구토, 변비, 설사는 초기 또는 후기에 발생할 수 있습니다.진행성 중증 감염의 징후는 수척함, 심부전, [citation needed]복부팽창을 포함한 빈혈과 단백질 결핍의 징후이다.
유충의 피부 침입은 피부 유충 이동병이라고 불리는 피부 질환을 야기할 수 있습니다. 또한 포복성 발진으로도 알려져 있습니다.이 벌레들의 숙주는 사람이 아니며 애벌레는 피부의 위쪽 5개 층에만 침투할 수 있으며, 그곳에서 강한 국소적인 가려움을 유발하며, 보통 발이나 아랫다리로 알려져 있습니다.이 감염은 A. 브레이징 훅웜의 유충에 의한 것입니다.유충은 피부 밑바닥층과 각질층 사이의 굴곡진 터널을 통해 이동하며, 장딴지성 수포성 병변을 일으킨다.유충의 이동이 진행됨에 따라 병변의 뒷부분이 건조하고 딱딱해진다.병변은 전형적으로 심하게 [8]가렵다.
잠복기
잠복기는 수주에서 수개월까지 다양하며 개인이 감염된 [9]구충 기생충의 수에 크게 좌우된다.
원인
인간의 후크웜 감염에는 강낭충증과 네코토리아증이 포함된다.강직증은 중동, 북아프리카, 인도, 그리고 남유럽에서 발견되는 더 흔한 유형인 강직성 십이지장에 의해 발생합니다.네카토리아증은 아메리카 대륙, 사하라 사막 이남 아프리카, 동남아시아, 중국,[citation needed] 인도네시아에서 더 흔한 종류인 네카토르 아메리카누스에 의해 발생한다.
새, 개, 고양이와 같은 다른 동물들도 영향을 받을 수 있다.A. tubaeforme는 고양이를, A. caninum은 개를, A. brazilence와 Uncinaria stenocephala는 고양이와 개를 모두 감염시킨다.이 감염들 중 일부는 [10]사람에게 전염될 수 있다.
형태학
A. 십이지장벌레는 회백색 또는 분홍색을 띠며 머리는 몸의 다른 부분에 비해 약간 구부러져 있다.이 굴곡은 앞끝에 갈고리 모양을 형성하고 갈고리벌레의 이름을 붙입니다.그들은 두 쌍의 이빨이 있는 잘 발달된 입을 가지고 있다.수컷은 가로 1cm, 세로 0.5mm 정도 되는 반면 암컷은 종종 더 길고 뻣뻣하다.또한 수컷은 눈에 띄는 후방 교배낭의 [11]존재에 따라 암컷과 구별할 수 있다.
아메리카누스는 십이지장과 형태학적으로 매우 유사하다.아메리카누스는 일반적으로 수컷이 5~9mm, 암컷이 약 1cm 길이의 십이지장보다 작다.A. 십이지장이 두 쌍의 이빨을 가지고 있는 반면, N. Americanus는 구강 캡슐에 한 쌍의 절단판을 가지고 있다.또한 후크 모양은 Ancylostoma보다 [11]Necator에서 훨씬 더 정의됩니다.
라이프 사이클
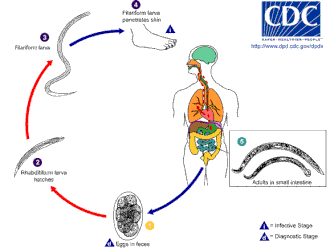
후크웜은 온도가 18°C 이상인 따뜻한 토양에서 잘 자랍니다.그들은 주로 모래나 황토 토양에 존재하며 점토나 진흙에서는 살 수 없습니다.강우량은 연평균 1000mm(40인치) 이상이어야 생존할 수 있다.이러한 조건이 존재해야만 알이 부화할 수 있다.북아메리카누스의 전염성 애벌레는 더 높은 온도에서 생존할 수 있는 반면, 십이지장충은 더 추운 기후에 더 잘 적응합니다.일반적으로, 그들은 자연 조건하에서 기껏해야 몇 주밖에 살지 못하고 직사광선이나 [citation needed]건조증에 노출되면 거의 즉시 죽는다.
숙주의 감염은 알이 아니라 유충에 의한 것입니다.A. 십이지장을 섭취할 수 있는 반면, 일반적인 감염 방법은 피부를 통해서이다; 이것은 보통 분변 물질로 오염된 지역을 맨발로 걸으면서 발생한다.유충은 발의 피부를 관통할 수 있고 몸 안에 들어가면 혈관계를 통해 폐로 이동하고 거기서 기관으로 이동해 삼켜집니다.그리고 나서 그들은 식도를 지나 소화기관으로 들어가 장에서 그들의 여행을 마칩니다. 그곳에서 유충은 [12][13]성충으로 성숙합니다.
일단 숙주의 내장에 들어가면, Necator는 장기간에 걸쳐 감염을 일으키는 경향이 있으며, 일부 성충은 15년 이상 사는 것으로 기록되고 있지만, 일반적으로 1~5년(많은 벌레들이 감염 후 1년 또는 2년 이내에 사망한다.)무신경상실종은 수명이 짧으며 평균 6개월 정도밖에 살지 못합니다.하지만, 휴면 유충은 만료된 성충을 대체하기 위해 수년 동안 조직 "저장소"에서 순차적으로 "재활용"될 수 있기 때문에 감염이 장기화될 수 있습니다.이는 감염 유병률과 강도의 계절적 변동을 야기할 수 있다(전염의 [citation needed]계절적 일반적인 변화와는 별개로).
그들은 숙주 안에서 짝짓기를 하며, 암컷은 하루에 최대 3만 개의 알을 낳고 일생 동안 약 1800만에서 5400만 개의 알을 낳으며, 이는 배설물로 사라집니다.성충이 성숙해 짝짓기, 알을 낳는 데는 5~7주가 걸리기 때문에 감염 초기에 환자의 대변에서 알이 검출되지 않고 급성 증상이 나타날 수 있다.이로 인해 진단이 매우 [citation needed]어려워질 수 있습니다.
아메리카누스와 십이지장알은 따뜻하고 습한 토양에서 발견될 수 있으며, 이들은 결국 1단계 유충으로 부화하거나, L1. 비감염성 횡문근형 유충인 L1. L1은 토양 미생물을 먹고, 최종적으로 2단계 유충인 L2로 탈모할 것이다.그것은 약 7일 동안 먹이를 먹고 나서 3단계 유충인 L3에 탈피할 것이다.이것은 기생충의 필라형 단계, 즉 먹이를 주지 않는 유충의 감염 형태입니다.L3 유충은 매우 활동성이 높으며 인간의 피부에 침투할 가능성을 높이기 위해 더 높은 지대를 찾습니다.L3 유충은 숙주를 찾지 않고도 2주까지 생존할 수 있습니다.N. Americanus 애벌레는 피부 침투만으로 감염되는 반면, A. 십이지장은 침투와 경구 모두를 통해 감염될 수 있습니다.L3 유충이 숙주에 성공적으로 들어간 후, 그들은 인간 숙주의 피하 정맥과 림프관을 통해 이동합니다.결국, L3 유충은 폐 모세혈관을 통해 폐로 들어가 폐포에 들어간다.그리고 나서 그들은 기침을 하고 숙주에 의해 삼키기 위해 기관 위로 이동한다.삼킨 후, L3 유충은 소장에서 발견되고, 거기서 L4 즉 성충 단계로 탈피합니다.피부 침투에서 성인의 발육까지의 전 과정은 약 5~9주가 소요됩니다.암컷 성충은 숙주의 배설물로 전달되는 알(북아메리카는 하루에 약 9,000~10,000개의 알과 십이지장 25,000~3,000개의 알)을 배출한다.이 알들은 며칠 안에 환경에서 부화하며 주기가 [12][14][15]다시 시작됩니다.
병태생리학
후크웜 감염은 일반적으로 증상이 없는 것으로 여겨지지만, 노먼 스톨이 1962년에 기술한 바와 같이, 그것은 "침묵하고 음흉하기"[16] 때문에 매우 위험한 감염이다.감염 직후에 일반 증상이 나타날 수 있다.기생충 침투 및 침입 부위의 알레르기 반응인 그라운드이치는 [11]북미 감염 환자에게서 흔히 볼 수 있다.또한, 유충이 폐포에 침입하여 기관으로 이동하기 시작하면서 기침과 폐렴이 발생할 수 있습니다.그리고 나서 유충이 숙주의 소장에 도달하고 성숙하기 시작하면, 감염된 개체는 설사와 다른 위장 불편함을 [11]겪을 것입니다.그러나 스톨이 언급한 "침묵하고 음흉한" 증상은 만성적이고 강한 구충 감염과 관련이 있다.구충 감염과 관련된 주요 질병은 장 출혈, 철분 결핍 빈혈, 그리고 단백질 [14]영양실조에 의해 야기된다.그것들은 주로 소장의 성충이 피를 섭취하고 적혈구를 파열시키고 [12]숙주의 헤모글로빈을 분해하는 것에서 발생한다.이 장기간의 출혈은 얼굴과 말초 부종을 통해 신체적으로 나타날 수 있다; 철분 결핍성 빈혈에 의해 야기되는 호산구균과 피카/지질도 구충에 감염된 일부 [11]환자들에 의해 경험된다.최근에는 공중 보건에 큰 역할을 하는 구충 감염의 다른 중요한 결과에 더 많은 관심이 쏠리고 있다.만성 후크웜 감염을 가진 아이들은 지적 및 인지적 [12][17]장애뿐만 아니라 성장 지체도 겪을 수 있다는 것이 현재 널리 받아들여지고 있다.또한, 최근의 연구는 임신 [citation needed]중 엄마가 후크웜에 감염되었을 때 모태에 악영향을 미칠 수 있는 가능성에 초점을 맞추고 있다.
이 질병은 주로 이집트의 테오도르 빌하르츠와 그리신저의 노력을 통해 장에서 1/3에서 0.5인치 길이의 선충과 관련이 있었다.[18]
증상들은 구토, 복통, 간헐적 설사와 같은 구충을 먹임으로써 자극되는 내장의 염증, 그리고 장기 질환의 진행성 빈혈과 관련이 있을 수 있습니다: 변덕스러운 식욕, 피지/지식성(또는 먼지를 먹는 것), 완고한 변비, 설사, 두근거림, 맥박, 피부 냉증, 창백 또는 창백함f 점막, 피로 및 약함, 호흡곤란, 치명적인 과정을 거치는 경우, 이질, 출혈 및 [18]부종.벌레들은 피를 빨아들여 점막을 손상시킨다.그러나 대변의 출혈은 눈에 잘 띄지 않는다.
초기 감염에서의 혈액 검사는 종종 조직의 웜 감염에 의해 우선적으로 자극되는 백혈구의 일종인 호산구 수의 증가를 보여준다. (많은 수의 호산구는 국소 염증 반응에도 존재한다.)장기간 빈혈에 감염되면 혈중 헤모글로빈 수치가 저하됩니다.
대부분의 장내 기생충은 어린이에게서 가장 무거운 기생충 부하가 발생하는 반면, 후크웜의 유병률과 강도는 성인 남성에게서 더 높을 수 있다.이에 대한 설명은 구충 감염이 직업적인 경향이 있기 때문에 직장 동료 등 가까운 그룹이 작업 환경을 오염시킴으로써 그들끼리 높은 감염률을 유지한다는 것이다.하지만, 대부분의 풍토 지역에서, 성인 여성들은 주로 철분(월경, 반복 임신)에 대한 생리적인 요구가 훨씬 높기 때문에 빈혈에 가장 심하게 영향을 받는다.무좀성 십이지장 감염의 경우 흥미로운 결과는 감염의 번역적 전염입니다. 이 종의 피부침습성 유충은 모두 즉시 폐를 통과하여 장으로 가는 것이 아니라 순환을 통해 체내로 퍼져나가 근육 섬유 내에서 휴면 상태가 됩니다.임산부에서는 출산 후 이들 유충의 일부 또는 전부를 자극하여 순환(아마도 갑작스런 호르몬 변화에 의해)으로 재진입한 후 유선으로 통과시켜 신생아가 모유를 통해 다량의 감염성 유충을 받을 수 있도록 한다.이것은 중국, 인도, 호주 북부와 같은 곳에서 생후 한 달 남짓 된 어린이에게서 매우 무겁고 심지어 치명적인 후크웜 감염의 다른 이유로는 설명할 수 없는 사례들을 설명해준다.동일한 현상은 개들의 Ancylostoma caninum 감염에서 훨씬 더 흔하게 볼 수 있는데, 이 감염에서 갓 태어난 아기들은 엄청난 수의 먹이로 인한 장출혈로 죽을 수도 있다.이것은 또한 인간과 개의 기생충 사이의 밀접한 진화적 관계를 반영하는데, 이것은 아마도 인간과 개가 처음 가까이 살기 시작한 시기로 거슬러 올라가는 공통의 조상을 가지고 있을 것이다.필라형 유충은 기생충의 감염 단계이다: 감염은 토양에 있는 유충이 피부에 침투하거나 피부 침투 후 오염된 음식과 물을 통해 섭취될 때 발생한다.
진단.
진단은 대변의 현미경 검사에서 특징적인 웜 알을 찾는 것에 달려 있지만, 초기 감염에서는 가능하지 않습니다.대부분의 개에서 감염의 초기 징후는 사지 절름거림과 항문 가려움증이다.알은 타원형 또는 타원형이며, 크기는 60x40µm이고, 무색이며 담즙이 묻지 않고 얇고 투명한 히알린 껍데기가 있다.지렁이에 의해 장에서 방출될 때, 알은 분할되지 않은 난자를 포함합니다.장으로 내려가는 동안, 난자가 발달하고, 따라서 대변으로 전달되는 난자는 보통 4개에서 8개의 배반체를 가진 분할된 난자를 가집니다.Ancylostoma와 Necator(그리고 대부분의 다른 갈고리벌레 종)의 알은 구분할 수 없기 때문에, 그 속을 식별하기 위해, 그들은 애벌레가 부화하도록 하기 위해 실험실에서 배양되어야 합니다.분뇨 샘플을 열대 기후에서 하루 이상 방치하면 애벌레가 부화해 알이 더 이상 드러나지 않을 수 있다.이 경우 구충과 스트롱일로이드 유충의 감염은 더 심각한 영향을 미치므로 구충과 스트롱일로이드 유충을 구별하는 것이 필수적이다.두 갈고리벌레 종의 유충은 현미경으로도 구별할 수 있지만, 이것은 일상적으로 행해지는 것이 아니라 보통 연구 목적으로 행해진다.성충은 (내시경, 수술 또는 부검을 제외하고) 거의 볼 수 없지만, 만약 발견된다면, 그 종을 확실히 식별할 수 있을 것이다.구강 길이, 구강 개구부와 식도 사이의 간격에 따라 분류할 수 있다: 구충성 횡문근 유충은 긴 구강성이고, 강문근성 횡문근 유충은 짧은 [11]구강성입니다.
최근의 연구는 감염의 진단, 후크웜의 특정 식별, 후크웜 [19]집단의 유전적 변이 분석을 위한 DNA 기반 도구의 개발에 초점을 맞추고 있다.구충 알은 종종 다른 기생 알과 구별되지 않기 때문에,[19][20] PCR 검사는 대변에 있는 구충의 정확한 진단을 위한 분자적 접근법 역할을 할 수 있다.
예방
전염성 유충은 습한 흙, 특히 모래와 침윤한 토양에서 자라고 생존한다.그들은 진흙이나 진흙 속에서 살아남을 수 없다.주의사항의 주요 라인은 양호한 위생행동에 의해 지시된 사항이다.
- 야외에서 배변하지 말고 화장실에서 배변하세요.
- 처리되지 않은 분뇨나 생하수를 농업에서 비료로 사용하지 마십시오.
- 감염된 것으로 알려진 지역에서는 맨발로 다니지 마십시오.
- 애완견과 고양이를 퇴치한다.개와 고양이 갈고리벌레는 인간에게서 성충으로 발전하는 경우가 거의 없다.흔히 볼 수 있는 개 갈고리벌레인 무낭종(Ancylostoma caninum)은 때때로 성충이 되어 사람에게 호산구 장염을 일으키기도 하지만, 그들의 침습적인 유충은 피부 유충 이동이라고 불리는 가려운 발진을 일으킬 수 있습니다.
묵시덱틴은 개와 고양이를 위한 (이미다클로프리드 + 묵시덱틴) 국소 용액으로 미국에서 이용 가능하다.회충, 후크지렁이, 심장충, 회충의 방제 및 예방에 묵시덱틴을 사용합니다.
아이들.
이러한 공중 보건에 대한 우려의 대부분은 구충에 감염된 아이들에게 집중되어 왔다.아이들에게 초점을 맞추는 것은 주로 구충 감염과 학습 장애, 학교 결석 증가, 그리고 미래의 경제적 [12]생산성 저하 사이의 강한 연관성을 보여주는 많은 증거들 때문이다.2001년 제54차 세계보건총회는 회원국에 [21]2010년까지 모든 위험에 처한 아동의 최소 75%를 정기적으로 구제할 것을 요구하는 결의안을 통과시켰다.2008년 세계보건기구(WHO) 간행물은 위험에 처한 학생들을 치료하기 위한 이러한 노력에 대해 보고했다.흥미로운 통계 중 일부는 다음과 같다. 1) 130개 지방 국가 중 9개 국가만이 목표의 75%를 달성할 수 있었고 2) 총 8억 7,800만 명 중 7700만 명 미만의 취학 연령 아동(위험한 총 8억 7,800만 명 중)이 달성되었으며, 이는 위험에 처한 아동의 8.78%만이 [22]후크웜 감염으로 치료받고 있음을 의미한다.
교내 대량 살충
학교에 기반을 둔 대량 살충 프로그램은 어린이 후크웜 감염 문제를 해결하기 위한 가장 인기 있는 전략이었다.학교 기반 프로그램은 매우 비용 효율적입니다.학교는 이미 [21]지역 사회와 밀접한 관계를 맺고 있는 숙련된 노동자와 함께 이용 가능하고 광범위하며 지속적인 인프라를 갖추고 있기 때문입니다.지역 의료 시스템의 교육을 거의 받지 않아도 교사는 어린이 1인당 연간 [23]미화 0.50달러 미만의 비용이 드는 약물을 쉽게 투여할 수 있습니다.
최근 많은 사람들이 학교에 기반을 둔 프로그램이 반드시 가장 효과적인 접근 방식인지에 대해 의문을 갖기 시작했다.학교에 기반을 둔 프로그램의 중요한 우려는 학교에 다니지 않는 아이들에게 종종 닿지 않고, 따라서 위험에 처한 많은 아이들을 무시한다는 것이다.Massa 등의 2008년 연구는 학교 기반 프로그램에 대한 논쟁을 계속했다.그들은 탄자니아의 탕가 지역에서 지역 사회 주도 치료와 학교 기반 치료의 효과를 조사했다.주요 결론은 후크웜의 평균 감염 강도가 학교 기반 접근법보다 지역사회 주도 치료 접근법을 사용하는 마을에서 유의하게 낮았다는 것이다.이 특정 연구에서 사용된 지역사회 주도 치료 모델은 마을 사람들이 항헬름제를 투여하기 위해 그들 자신의 지역사회 약품 유통업자를 선택함으로써 아이들의 치료를 통제할 수 있게 했다.게다가, 마을 사람들은 모든 [24]아이들에게 약을 분배하는 그들만의 방법을 조직하고 시행했다.이 새로운 모델과 관련된 긍정적인 결과는 웜 제거 [citation needed]캠페인에 대한 대규모 커뮤니티 참여의 필요성을 강조합니다.
공중 보건 교육
많은 대량 살충 프로그램들은 또한 그들의 노력과 공중 보건 교육을 결합한다.이러한 건강 교육 프로그램들은 종종 식사 전에 손을 씻는 것과 같은 중요한 예방 기술을 강조한다: 인간의 배설물에 오염된 물/지역을 멀리하는 것.이러한 프로그램들은 또한 신발을 신어야 한다는 것을 강조할 수도 있지만, 신발은 그들 자신의 건강상의 위험을 수반하며 [25]효과적이지 않을 수도 있다.전 세계 마을과 마을의 신발 착용 패턴은 문화적 신념과 그 사회 내의 교육 수준에 따라 결정됩니다.신발을 신으면 주변 토양에서 발가락 [26]사이와 같은 부드러운 피부 영역으로 구충 감염이 유입되는 것을 방지할 수 있습니다.
위생
1943년부터 1947년까지 미시시피와 플로리다에서 일어난 후크웜 캠페인과 같은 역사적 사례는 후크웜 감염의 주요 원인이 화장실을 짓고 유지함으로써 해결할 수 있는 열악한 위생 상태임을 보여주었다.하지만 이것들은 간단한 일처럼 보일지 모르지만, 중요한 공중 보건 문제를 제기한다.감염자 대부분은 위생상태가 좋지 않은 빈곤 지역 출신이다.따라서, 위험에 처한 어린이들은 손을 씻고 적절한 위생 인프라가 없는 환경에서 살기 위해 깨끗한 물에 접근할 수 없을 가능성이 높다.따라서 보건 교육은 자원이 제한된 환경에서 [citation needed]실현 가능하고 지속 가능한 방식으로 예방 조치를 다루어야 한다.
통합 어프로치
수많은 공중 보건 개입을 평가한 결과, 일반적으로 빈곤에 기인하는 각 개별 요소(예: 위생, 보건 교육 및 기초 영양 상태)의 개선이 전염에 미치는 영향은 거의 없는 것으로 나타났다.예를 들어, 한 연구는 자원이 제한된 지역사회에 변소를 도입하는 것이 후크웜 감염의 [27]유병률을 4%만 감소시켰다는 것을 발견했다.그러나 브라질 살바도르에 있는 또 다른 연구에 따르면 배수와 하수도가 개선되면서 후크웜 감염 유병률에는 큰 영향을 [28]미쳤지만 후크웜 감염 강도에는 전혀 영향을 미치지 않았다.이것은 환경 통제만으로는 구충의 전염에 제한적이지만 불완전한 영향을 미친다는 것을 암시하는 것으로 보인다.따라서 교육, 위생, 치료 등 수많은 예방 방법을 결합한 통합 프로그램의 효과와 지속가능성을 파악하기 위한 더 많은 연구가 필수적입니다.
치료
구충제
후크웜의 가장 일반적인 치료법은 벤즈이미다졸, 특히 알벤다졸과 메벤다졸이다.BZAs는 선충의 β-튜브린에 결합하여 기생충 내의 [14]미세관 중합을 억제함으로써 성충을 죽인다.경우에 따라서는 레바미솔과 피란텔 파모에이트를 사용할 [12]수 있습니다.2008년 리뷰에서는 구충 감염에 대한 단일 용량 치료제의 효과가 알벤다졸 72%, 메벤다졸 15%, 피란텔 파모에이트 [29]31%로 나타났다.이것은 알벤다졸이 후크웜 감염에 메벤다졸보다 훨씬 더 효과적이라는 이전의 주장을 입증한다.또한 세계보건기구는 임신 초기 [14]3개월 이후 임신부에게 구충제 치료를 권고하고 있다.또한 빈혈이 있는 경우 황산 제철(200mg)을 구충제 치료와 동시에 매일 3회 투여하는 것이 좋습니다. 헤모글로빈 수치가 정상으로 돌아올 때까지 지속되어야 하며 최대 [11]3개월까지 걸릴 수 있습니다.
구충 감염은 구충이 [30]아직 피부에 있을 때 국소 저온 요법으로 치료할 수 있다.
알벤다졸은 장기와 장기에 모두 효과가 있으며 기생충은 여전히 [30]피부 아래로 이동한다.
빈혈의 경우 철분을 보충하면 철분 결핍성 빈혈의 완화 증상이 나타날 수 있습니다.그러나 적혈구 수치가 회복됨에 따라 엽산이나 비타민 B12와 같은 다른 필수성분이 부족해질 수 있기 때문에 이것들도 보충될 수 있다.
1910년대에 후크웜에 대한 일반적인 치료법은 티몰, 2-나프톨, 클로로포름, 가솔린, 그리고 유칼립투스 오일을 [31]포함했다.1940년대에 이르러서는 공복 상태에서 3~4cc의 테트라클로로에틸렌을 사용한 [32]후 황산나트륨 30~45g을 사용하였다.테트라클로로에틸렌은 네케이터 감염의 경우 80%의 완치율을 보였지만 무혈종 감염의 경우 25%의 완치율을 보였으며 종종 환자에게 가벼운 중독을 유발했다.
재감염 및 약물 내성
구충의 치료와 관련된 다른 중요한 문제는 재감염과 약물 내성이다.치료 후 재감염률이 매우 높을 수 있는 것으로 나타났다.일부 연구에 따르면 치료 전 구충 감염률의 80%가 30-36개월 [14]내에 치료된 지역사회에서 나타날 수 있다.재감염이 발생할 수 있지만 만성적인 결과의 발생을 최소화하기 위해 정기적인 치료를 실시할 것을 권장합니다.약물 내성 문제에 대한 우려도 커지고 있다.가축 선충에 사용되는 최전선 구충제에 약물 내성이 나타났다.일반적으로 인간 선충은 더 긴 번식 시간, 덜 빈번한 치료 및 더 표적 치료로 인해 내성이 생길 가능성이 낮다.그럼에도 불구하고, 지구촌은 최신 [14]구충제 개발의 후기에 새로운 구충제가 없기 때문에 현재의 구충제의 효과를 유지하기 위해 주의해야 한다.
역학
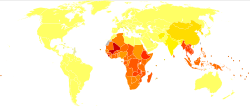
5억 7천 6백만에서 7억 4천만 명의 사람들이 [33][14]구충에 감염된 것으로 추정됩니다.이 감염자들 중 약 8천만 명이 심각한 [19]영향을 받고 있다.구충 감염의 주요 원인은 아메리카 대륙, 사하라 이남 아프리카,[12] 그리고 아시아에서 발견되는 북미 대륙입니다.A. 십이지장은 유럽과 지중해와 같은 더 산재된 초점 환경에서 발견됩니다.대부분의 감염자는 사하라 사막 이남의 아프리카와 동아시아/태평양 제도에 집중되어 있으며, 각 지역은 각각 1억9800만 명과 1억4900만 명으로 추산된다.기타 영향을 받는 지역은 다음과 같습니다.이어 남아시아(5000만 명), 중남미 카리브해(5000만 명), 남아시아(5900만 명), 중동/북아프리카(1000만 명)[14] 순이었다.이들 감염자의 대부분은 위생상태가 좋지 않은 빈곤 지역에 살고 있다.후크웜 감염은 [12]하루에 2달러 미만으로 생활하는 세계 최빈곤층에게 가장 많이 발생한다.
구충 감염이 사망률로 직접적으로 이어지지는 않지만, 질병률에 대한 영향은 즉각적인 주의를 요한다.DALY(Disability-adjusted life years)를 고려할 때, 개발도상국의 가장 중요한 건강 문제 중 하나로 구충 감염, 설사 질환의 순위, 허혈성 심장 질환, 말라리아 및 결핵을 포함한 무시된 열대성 질병이 있습니다.
구충 감염으로 인해 2,210만 개의 DALY가 손실된 것으로 추정되고 있다.최근 구충 감염과 관련된 공중 보건 문제에 대한 관심이 높아지고 있다.예를 들어, Bill & Melinda Gates Foundation은 최근 [34]구충 감염을 포함한 방치 열대성 질병 퇴치를 위해 미화 3400만 달러를 기부했습니다.클린턴 전 미국 대통령도 클린턴 글로벌 이니셔티브(CGI) 2008 연차총회에서 1000만 [35]명의 어린이를 구제하겠다는 대규모 약속을 발표했다.
구충 감염의 유병률과 관련된 많은 수치는 추정치이다. 왜냐하면 현재 유병률과 전지구적 [12]분포를 결정하는 국제적인 감시 메커니즘이 없기 때문이다.일부 유병률은 전 세계 풍토 지역의 조사 데이터를 통해 측정되었다.다음은 후크웜 풍토 지역의 유병률에 대한 가장 최근의 발견들이다.
인도 서벵골 후글리 구 다르질링 (Pal et al. 2007)[36]
- 일부 A. 십이지장 감염을 수반하지만 주로 N. Americanus 감염률 43%
- 구충 감염 부하와 경미한 빈혈 정도
- 주로 북 아메리카누스의 60% 감염률
- 주목할 만한 중요한 경향은 연령(약 41세)에 따라 유병률이 증가하고 여성이 남성보다 유병률이 높았다는 것이다.
베트남 북서부 호아빈(Verle et al. 2003)[38]
- 총 526가구 중 52%가 감염되었습니다.
- 종을 식별할 수는 없지만, 북베트남의 이전 연구에서는 구충 유충의 95% 이상에서 N. Americanus가 보고되었습니다.
미나스제라이스(브라질)(Fleming et al. 2006)[39]
- 주로 북 아메리카누스 감염률 63%
콰줄루나탈, 남아프리카공화국(마바소 외)2004년)[40]
- 내륙지역은 북미의 9% 유병률을 보였다.
- 해안 평야 지역은 북미의 63%의 유병률을 보였다.
- 주로 북 아메리카누스의 35% 감염률
구충 유행의 보다 정확한 매핑을 용이하게 할 수 있는 기술적 발전도 있었다.일부 연구자들은 기생충 생태학과 역학을 조사하기 위해 지리정보시스템(GIS)과 원격감지(RS)를 사용하기 시작했다.브루커 등이 기술을 활용해 사하라 사막 이남 아프리카의 헬미네이트 분포 지도를 작성했습니다.위성에서 도출된 환경 데이터와 학교 기반 조사의 유병률 데이터를 연관시킴으로써 상세한 유병률 지도를 작성할 수 있었다.이 연구는 광범위한 구충에 초점을 맞췄지만, 특히 구충에 대한 흥미로운 결론들이 발견되었다.다른 구충과 비교했을 때, 구충은 훨씬 더 뜨거운 환경에서도 생존할 수 있고 열 범위 [43]상단에서 매우 흔했습니다.
개선된 분자 진단 도구는 기존의 유병률 통계를 개선하는 데 도움이 될 수 있는 또 다른 기술적 진보입니다.최근 연구는 감염 진단, 후크웜의 특정 식별, 후크웜 집단의 유전적 변이 분석 등에 사용될 수 있는 DNA 기반 도구의 개발에 초점을 맞추고 있다.다시 한번 이것은 구충 감염에 대한 다양한 공중 보건 조치를 위한 주요 도구 역할을 할 수 있다.진단 도구에 관한 대부분의 연구는 현재 후크웜 감염의 특정 진단을 위한 신속하고 비용 효율적인 분석의 작성에 초점이 맞춰져 있다.많은 사람들은 그것의 발전이 향후 [when?][19]5년 안에 달성될 수 있을 것이라고 희망하고 있다.
역사
검출
현재 구충에 기인하는 증상은 빈혈로 특징지어지는 혼란으로 묘사된 c.고대 이집트 (기원전 1500년)의 파피루스 종이에 나타난다.11세기 페르시아의 의사였던 아비세나는 그의 환자들 중 몇 명에게서 이 지렁이를 발견하고 그들의 질병과 연관시켰다.이후 영국, 프랑스, 독일, 벨기에, 북퀸즐랜드 등의 [18]광산업에서 이 같은 현상이 두드러졌다.
이탈리아의 의사 안젤로 두비니는 1838년 한 농부의 부검 후 이 벌레를 발견한 현대인이었다.두비니는 1843년에 자세한 내용을 발표했고 그 종이 A. 십이지장이라고 밝혔다.1852년 독일의 의사 테오도르 빌하르츠는 동료인 빌헬름 그리신저의 연구를 바탕으로 부검 중에 이 벌레들을 발견했고 오늘날 철 결핍성 빈혈이라고 불릴 수 있는 지역 풍토병 발생과 연결시키는 데 한 걸음 더 나아갔다.
고타르트 철도 [18]터널에서 일하는 이탈리아 근로자들 사이에서 발생한 설사와 빈혈 유행 이후 25년 후에 돌파구가 마련되었습니다.1880년 논문에서, 의사 카밀로 보졸로, 에도아르도 페론치토, 그리고 루이지 팔리아니는 갈고리 벌레가 15킬로미터 터널 안에서 배변을 해야 하고 많은 사람들이 낡은 신발을 [44]신었다는 사실과 관련이 있다고 정확하게 가설을 세웠다.작업 환경에는 종종 고인 물이 있었고, 때로는 무릎까지 오는 유충들은 물에서 몇 주 동안 생존할 수 있었고, 이로 인해 많은 일개미들이 감염될 수 있었다.1897년, 피부가 감염의 주요 통로라는 것이 밝혀졌고 후크웜의 생물학적 라이프 사이클이 명확해졌다.
근절 프로그램
1899년, 미국의 동물학자 찰스 워델 스타일은 미국 남부에서 볼 수 있는 진행성 치명적인 빈혈이 후크웜 A. 십이지장에 의해 발생한다는 것을 확인했다.1900년대 실험 결과 학령기 아동에게 매우 심각한 감염이 있음이 밝혀졌다.푸에르토리코에서, 닥터 베일리 K.미군 의사인 Ashford는 1903-04년 동안 약 30만 명의 사람들을 치료하고 빈혈로 인한 사망률을 90% 줄인 기생충 치료 캠페인을 조직하고 실시했습니다.

1909년 10월 26일, 록펠러 후크웜 퇴치를 위한 위생 위원회는 존 D로부터 100만 달러의 기부금으로 조직되었다. 록펠러 시니어이 5개년 프로그램은 주목할 만한 성공이었고 미국의 공중 보건에 큰 기여를 했으며, 남부 11개 [45]주에 공교육, 의약품, 현장 연구 및 현대 정부 보건부를 설치했다.구충 전시회는 1910년 미시시피 주 박람회의 중요한 부분이었다.
위원회는 평균 취학 연령 아동의 40%가 구충에 감염되었다는 것을 발견했다.구제 프로그램 전에 후크웜 감염률이 높은 지역에서는 개입 후 학교 등록, 출석 및 문맹률이 크게 증가했습니다.계량경제학 연구에 따르면 이 효과는 지역 간 차이, 작물 가격 변화, 특정 교육 및 보건 정책의 변화, 말라리아 [46]박멸 효과 등 다양한 대안 요인으로는 설명할 수 없는 것으로 나타났다.상당히 낮은 (이전) 감염률 때문에 개입의 혜택을 덜 받았어야 하는 성인에 대해서는 유의한 동시 결과가 발견되지 않았다.이 프로그램은 구충을 거의 근절시켰으며 이후 록펠러 재단의 국제 보건 [47]부서로서 새로운 자금으로 번창할 것이다.
멕시코에서 RF의 구충 캠페인은 과학과 정치가 보건 정책을 개발하는 데 어떤 역할을 하는지 보여주었다.정부 관계자, 보건 공무원, 공중 보건 종사자, 록펠러 공무원 및 지역사회가 모였다.이 캠페인은 멕시코에서 구충 박멸을 위해 시작되었습니다.비록 이 캠페인은 장기적인 치료에 초점을 맞추지는 않았지만, 멕시코와 록펠러 재단 사이의 관계를 규정했다.이 캠페인의 이면에 있는 과학적 지식은 공중 보건 정책을 수립하고 공중 보건을 개선하며 미국과 멕시코 [48]간의 강력한 관계를 구축하는 데 도움을 주었다.
1920년대에 구충 박멸은 카리브해와 라틴 아메리카에 도달했고, 18세기 말 서인도 제도의 사람들 사이에서 엄청난 사망률이 보고되었으며, 브라질과 다른 다양한 열대 및 아열대 [18]지역에서 보내진 기술들을 통해서도 보고되었다.
치료법
20세기 초의 치료는 보호 점액을 줄이기 위해 Epsom 소금을 사용하고,[49][31] 그 다음에 벌레를 죽이기 위해 티몰을 사용하는 것에 의존했다.1940년대에는 테트라클로로에틸렌이 주요 [32]방법이었다.새로운 유기 약물 화합물이 개발된 [50]것은 20세기 중반이 되어서였다.
조사.
임신 중 빈혈
개발도상국 전체 임신부의 3분의 1이 후크웜에 감염되어 있고, 개발도상국 전체 임신부의 56%가 빈혈을 경험하고 있으며, 전체 산모 사망의 20%가 빈혈과 직간접적으로 관련되어 있는 것으로 추정된다.이와 같은 수치는 임신 [51]중 구충 관련 빈혈이라는 주제에 대한 관심을 증가시켰다.만성 후크웜 감염이 빈혈로 이어질 수 있다는 이해와 함께, 많은 사람들은 후크웜의 치료가 심각한 빈혈률의 변화에 영향을 미칠 수 있는지, 따라서 산모와 아이의 건강에도 영향을 미칠 수 있는지에 대해 의문을 제기하고 있다.대부분의 증거는 후크웜이 모성빈혈에 기여하는 것이 풍토 지역에 사는 모든 가임기 여성들에게 주기적인 구충제 치료의 대상이 된다는 것을 보여준다.세계보건기구(WHO)는 심지어 감염된 임신부들에게 첫 [14]3개월 후에 치료를 받도록 권고하고 있다.이러한 제안과 상관없이, 오직 마다가스카르, 네팔, 스리랑카만이 그들의 산전 [52]관리 프로그램에 벌레를 추가했다.
임산부의 이러한 제충 부족은 대부분의 사람들이 여전히 구충제 치료가 출산 결과에 악영향을 미칠 것을 두려워하고 있다는 사실로 설명된다.그러나 Gyorkos 등의 2006년 연구에 따르면 메벤다졸로 치료받은 임산부 그룹을 대조군 플라시보 그룹과 비교했을 때 두 그룹 모두 출산 결과가 좋지 않은 경우 다소 유사한 비율을 보였다.치료 그룹은 5.6%의 부정적인 출산 결과를 보인 반면 대조군은 6.25%의 부정적인 출산 [51]결과를 보였다.게다가, Larocque et al.는 후크웜 감염에 대한 치료가 실제로 유아에게 긍정적인 건강 결과를 가져다준다는 것을 보여주었다.이 연구는 산전 관리 중 메벤다졸과 철분 보충제를 사용한 치료가 플라시보 대조군에 [53]비해 매우 저체중 신생아의 비율을 유의하게 감소시켰다는 결론을 내렸다.지금까지의 연구들은 임신 중 구충 감염으로 감염된 임산부들을 치료하기 위한 권고 사항을 입증했다.
한 리뷰에 따르면 임신 2기에 투여된 항충제(항충제)의 1회 복용량은 "모성 구충증의 유병률이 높은 환경에서 사용될 경우 모성 빈혈과 구충 유병률을 낮출 수 있다"[54]고 한다.
임신 중 구충 관련 빈혈과 관련이 있기 때문에 구충 감염의 강도 및 구충의 종류는 아직 연구되지 않았다.또한 완료된 연구에서 지적된 추세가 지속되는지 확인하기 위해 세계의 다른 지역에서 더 많은 연구가 이루어져야 한다.[필요한 건]
말라리아 공동 감염
후크웜과 플라즈모듐 팔시파룸과의 공동 감염은 아프리카에서 [55]흔하다.정확한 숫자는 알려지지 않았지만 예비 분석에 따르면 아프리카 학생의 4분의 1(5-14세 어린이 1780-3210만 명)이 공교롭게도 P. falciparum과 [56]훅웜에 걸릴 수 있다.원래 가설은 여러 기생충과의 공동 감염이 단일 기생충에 대한 숙주의 면역 반응을 손상시키고 임상 질환에 대한 민감성을 증가시킨다고 언급했지만, 연구는 대조적인 결과를 낳았다.예를 들어, 세네갈의 한 연구는 기생충이 없는 어린이에 비해 기생충에 감염된 어린이에게서 임상 말라리아 감염의 위험이 증가하는 반면, 다른 연구는 그러한 [57]결과를 재현하지 못했고, 심지어 실험용 쥐 실험들 사이에서도 기생충이 말라리아에 미치는 영향은 [58]가변적이라는 것을 보여주었다.
일부 가설과 연구는 헬민스 감염이 소염 및 소염성 사이토카인 [59]반응의 가능한 조절로 인해 뇌 말라리아로부터 보호할 수 있다고 시사한다.게다가, 이러한 질병에 대한 감수성 증가의 기초가 되는 메커니즘은 알려져 있지 않다.예를 들어, 기생충 감염은 T형 2(T2h) 사이토카인과 면역글로불린 E(IgE) 생산을 증가시키는 것이 [60]특징인 강력하고 극성 면역 반응을 일으킨다.그러나 이러한 반응이 인간의 면역 반응에 미치는 영향은 알려지지 않았다.또한 말라리아와 기생충 감염 모두 빈혈의 원인이 될 수 있지만, 공감염의 영향과 빈혈의 가능한 강화는 [50]잘 알려져 있지 않다.
치료로서의 위생가설과 후크웜
위생가설은 감염원에 노출되지 않은 영유아는 면역체계 발달의 변조를 통해 알레르기 질환에 더 취약하다는 것이다.이 이론은 데이비드 P에 의해 처음 제안되었다.스트라찬은 건초열과 습진이 [61]대가족에 속하는 아이들에게서 덜 흔하다고 언급했다.그 이후로, 연구는 개발도상국에서 위장 벌레가 알레르기의 발달에 미치는 영향에 주목해 왔다.예를 들어, 감비아의 한 연구는 몇몇 마을에서 벌레를 박멸하는 것이 [62]어린이들 사이에서 알레르기에 대한 피부 반응을 증가시키는 것을 발견했다.
백신
매년 또는 반년마다 대량 항헬미네틱 투여는 공중 보건 개입의 중요한 측면이지만, 많은 사람들은 빈곤, 높은 재감염률, 반복 사용으로 인한 약물의 효과 감소와 같은 측면 때문에 이것이 얼마나 지속 가능하지 않은지를 깨닫기 시작했다.따라서 현재 연구는 기존 제어 프로그램에 통합될 수 있는 백신 개발에 초점을 맞추고 있다.백신 개발의 목표는 반드시 살균 면역력을 가진 백신을 만들거나 면역력을 완벽하게 보호하는 것은 아니다.백신 접종을 받은 사람들이 심각한 감염에 걸릴 가능성을 줄이고, 따라서 혈액과 영양 수치를 낮추는 백신은 여전히 전 세계적으로 높은 질병 부담에 큰 영향을 미칠 수 있다.
현재의 연구는 이 벌레의 발육의 두 단계를 목표로 하는 것에 초점을 맞추고 있다: 애벌레 단계와 성충 단계.애벌레 항원에 대한 연구는 병인과 관련된 단백질 슈퍼패밀리인 '무시로스토마 분비단백질'[63]의 구성원인 단백질에 초점을 맞추고 있다.그것들은 Anyclostoma에서 처음 설명되었지만, 이 단백질들은 또한 N. Americanus의 분비 생성물로부터 성공적으로 분리되었습니다.N. americanus ASP-2(Na-ASP-2)는 현재 유충 단계 후크웜 백신 후보군이다.무작위화된 이중맹검 위약 대조 연구는 이미 수행되었다. 후크웜 감염 전력이 없는 건강한 성인 36명에게 3가지 서로 다른 농도의 Na-ASP-2를 근육 내에 3회 주사하고 최종 백신 [64]접종 후 6개월 동안 관찰되었다.이 백신은 유의미한 항Na-ASP-2 IgG와 세포 면역 반응을 유도했다.게다가, 그것은 안전했고 쇠약하게 하는 부작용을 일으키지 않았다.백신은 현재 1단계 시험 단계에 있다. 브라질에서 이전 감염의 증거가 문서화된 건강한 성인 자원봉사자들에게 초기 [63]연구에서 사용된 것과 같은 일정으로 동일한 용량 농도를 투여하고 있다.만약 이 연구가 성공한다면, 다음 단계는 백신 접종자들 사이의 후크웜 감염의 속도와 강도를 평가하기 위한 2단계 시험을 실시하는 것이다.Na-ASP-2 백신은 유충 단계만을 대상으로 하기 때문에, 본 연구에 등록된 모든 피험자는 예방접종 전에 성충을 제거하기 위해 항Helmintic 약물로 치료하는 것이 중요하다.
성인 구충 항원 또한 백신의 잠재적 후보로 확인되었다.성충이 숙주의 장 점막에 부착하면 지렁이 소화관에서 적혈구가 파열돼 유리 헤모글로빈이 방출되고 이후 단백질 분해 캐스케이드에 의해 분해된다.이 단백질 분해 캐스케이드에 책임이 있는 이 단백질들 중 몇 가지는 또한 벌레의 영양과 [65]생존에 필수적이다.따라서, 이러한 항원에 대한 항체를 유도할 수 있는 백신은 갈고리벌레의 소화 경로를 방해하고 벌레의 생존을 방해할 수 있다.아스파라긴 단백질분해효소-헤모글로빈효소 APR-1, 시스테인 단백질분해효소-헤모글로빈효소 CP-2 및 글루타티온 S-전달효소 [66][67]등 세 가지 단백질이 확인되었다.[68] APR-1과 CP-2에 의한 백신 접종은 개의 [66][67]숙주 출혈과 분변 계란 수를 감소시켰다.APR-1에서는 예방접종을 통해 벌레의 [66]부담을 줄일 수 있었다.임상시험용 재조합단백질로서 이들 항원 중 적어도 1개의 개발에 관한 연구는 현재 차질을 빚고 있다.
용어.
후크웜이라는 용어는 후크웜 [12]감염을 가리키는 데 사용되기도 한다.후크웜은 기생충의 일종이다.
「 」를 참조해 주세요.
레퍼런스
- ^ a b c d e f g h i "CDC - Hookworm - General Information - Frequently Asked Questions (FAQs)". www.cdc.gov. 16 December 2014. Archived from the original on 22 April 2017. Retrieved 22 April 2017.
- ^ a b "CDC - Hookworm - Disease". www.cdc.gov. 10 January 2013. Archived from the original on 23 April 2017. Retrieved 22 April 2017.
- ^ a b "CDC - Hookworm - Treatment". www.cdc.gov. 10 January 2013. Archived from the original on 23 April 2017. Retrieved 22 April 2017.
- ^ a b GBD 2015 Disease and Injury Incidence and Prevalence, Collaborators. (8 October 2016). "Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1545–1602. doi:10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
{{cite journal}}:first1=범용명(도움말)이 있습니다. - ^ Prevention, CDC - Centers for Disease Control and. "CDC - Hookworm - Biology". www.cdc.gov. Archived from the original on 21 June 2017. Retrieved 21 June 2017.
- ^ GBD 2015 Mortality and Causes of Death, Collaborators. (8 October 2016). "Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1459–1544. doi:10.1016/s0140-6736(16)31012-1. PMC 5388903. PMID 27733281.
{{cite journal}}:first1=범용명(도움말)이 있습니다. - ^ "Neglected Tropical Diseases". cdc.gov. June 6, 2011. Archived from the original on 4 December 2014. Retrieved 28 November 2014.
- ^ James, William D.; Berger, Timothy G.; et al. (2006). Andrews' Diseases of the Skin: clinical Dermatology. Saunders Elsevier. pp. 435. ISBN 978-0-7216-2921-6.
- ^ "갈고리벌레"식품안전보장 및 공중위생센터.2005년 5월아이오와 주립 대학교
- ^ "CDC - Zoonotic Hookworm - General Information". www.cdc.gov. 25 April 2019. Retrieved 27 December 2019.
- ^ a b c d e f g Markell, Edward K.; John, David C.; Petri, William H. (2006). Markell and Voge's medical parasitology (9th ed.). St. Louis, Mo: Elsevier Saunders. ISBN 978-0-7216-4793-7.
- ^ a b c d e f g h i j Hotez PJ, Bethony J, Bottazzi ME, Brooker S, Buss P (March 2005). "Hookworm: "The Great Infection of Mankind"". PLOS Med. 2 (3): e67. doi:10.1371/journal.pmed.0020067. PMC 1069663. PMID 15783256.
- ^ "CDC 팩트시트: Hookworm" 2010-09-04년 Wayback Machine에서 아카이브, 2008년9월 29일 액세스
- ^ a b c d e f g h i Bethony J, Brooker S, Albonico M, Geiger SM, Loukas A, Diemert D, Hotez PJ (May 2006). "Soil-transmitted helminth infections: ascariasis, trichuriasis, and hookworm". Lancet. 367 (9521): 1521–32. doi:10.1016/S0140-6736(06)68653-4. PMID 16679166. S2CID 8425278.
- ^ Hawdon JM, Hotez PJ (October 1996). "Hookworm: developmental biology of the infectious process". Curr. Opin. Genet. Dev. 6 (5): 618–23. doi:10.1016/S0959-437X(96)80092-X. PMID 8939719.
- ^ Stoll NR (August 1962). "On endemic hookworm, where do we stand today?". Exp. Parasitol. 12 (4): 241–52. doi:10.1016/0014-4894(62)90072-3. PMID 13917420.
- ^ Hotez PJ, Pritchard DI (1995). "Hookworm infection". Scientific American. Vol. 272, no. 6. pp. 68–74. doi:10.1038/scientificamerican0695-68. PMID 7761817.
- ^ a b c d e 앞의 문장 중 하나 이상에는 현재 퍼블릭 도메인에 있는 출판물의 텍스트가 포함되어 있습니다.
- ^ a b c d Gasser RB, Cantacessi C, Campbell BE (January 2009). "Improved molecular diagnostic tools for human hookworms". Expert Rev. Mol. Diagn. 9 (1): 17–21. doi:10.1586/14737159.9.1.17. PMID 19099345. S2CID 32970805.
- ^ Yong TS, Lee JH, Sim S, Lee J, Min DY, Chai JY, Eom KS, Sohn WM, Lee SH, Rim HJ (March 2007). "Differential diagnosis of Trichostrongylus and hookworm eggs via PCR using ITS-1 sequence". Korean J. Parasitol. 45 (1): 69–74. doi:10.3347/kjp.2007.45.1.69. PMC 2526333. PMID 17374982.
- ^ a b "School Deworming". Public Health at a Glance. World Bank. 2003.
- ^ "Soil-transmitted helminthiasis". Wkly. Epidemiol. Rec. 83 (27/28): 237–252. 4 July 2008. Archived from the original on August 5, 2012.
- ^ "벌레는 어떻게 작동합니까?"월드를 제거하세요.<dewormtheworld.org Wayback Machine에서 2009-02-08 아카이브 완료>
- ^ Massa K, Magnussen P, Sheshe A, Ntakamulenga R, Ndawi B, Olsen A (2009). "The effect of the community-directed treatment approach versus the school-based treatment approach on the prevalence and intensity of schistosomiasis and soil-transmitted helminthiasis among schoolchildren in Tanzania". Trans. R. Soc. Trop. Med. Hyg. 103 (1): 31–37. doi:10.1016/j.trstmh.2008.07.009. PMID 18771789.
- ^ Howell, Daniel (2010). The Barefoot Book: 50 Great Reasons to Kick Off Your Shoes. Hunter House. ISBN 978-0897935548.
- ^ Birn & Solorzano 1999, 페이지 1200, 1205
- ^ Huttly SR (1990). "The impact of inadequate sanitary conditions on health in developing countries". World Health Stat. Q. 43 (3): 118–26. PMID 2146815.
- ^ Moraes LR, Cancio JA, Cairncross S (April 2004). "Impact of drainage and sewerage on intestinal nematode infections in poor urban areas in Salvador, Brazil". Trans. R. Soc. Trop. Med. Hyg. 98 (4): 197–204. doi:10.1016/S0035-9203(03)00043-9. PMID 15049458.
- ^ Keiser J, Utzinger J (April 2008). "Efficacy of current drugs against soil-transmitted helminth infections: systematic review and meta-analysis". J. Am. Med. Assoc. 299 (16): 1937–48. doi:10.1001/jama.299.16.1937. PMID 18430913.
- ^ a b Albanese G, Venturi C, Galbiati G (2001). "Treatment of larva migrans cutanea (creeping eruption): A comparison between albendazole and traditional therapy". Int. J. Dermatol. 40 (1): 67–71. doi:10.1046/j.1365-4362.2001.01103.x. PMID 11277961. S2CID 40314184.
- ^ a b Milton, Joseph Rosenau (1913). Preventive Medicine and Hygiene. D. Appleton. p. 119.
- ^ a b "Clinical Aspects and Treatment of the More Common Intestinal Parasites of Man (TB-33)". Veterans Administration Technical Bulletin 1946 & 1947. 10: 1–14. 1948.
- ^ Fenwick A (March 2012). "The global burden of neglected tropical diseases". Public Health. 126 (3): 233–36. doi:10.1016/j.puhe.2011.11.015. PMID 22325616.
- ^ "게이츠 재단으로부터 방치된 열대질환에 대한 전세계 네트워크는 3,400만 달러를 받습니다. IDB는 라틴 아메리카와 카리브해에서 2020년까지 대부분의 방치된 질병들의 부담을 크게 줄이기 위한 캠페인을 주도합니다."Release 를 누릅니다.방치된 열대 질환을 위한 글로벌 네트워크.2009년 1월 30일
- ^ Clinton Global Initiative 2008 연차총회에서 세계를 구제하라: 최대 1000만 명의 어린이가 구제 혜택을 받는다!Release 를 누릅니다.Deworm the World, 2008.
- ^ Pal D, Chattopadhyay UK, Sengupta G (April 2007). "A study on the prevalence of hookworm infection in four districts of West Bengal and its linkage with anemia". Indian J. Pathol. Microbiol. 50 (2): 449–52. PMID 17883107.
- ^ Gandhi NS, Jizhang C, Khoshnood K, Fuying X, Shanwen L, Yaoruo L, Bin Z, Haechou X, Chongjin T, Yan W, Wensen W, Dungxing H, Chong C, Shuhua X, Hawdon JM, Hotez PJ (August 2001). "Epidemiology of Necator americanus hookworm infections in Xiulongkan Village, Hainan Province, China: high prevalence and intensity among middle-aged and elderly residents". J. Parasitol. 87 (4): 739–43. doi:10.1645/0022-3395(2001)087[0739:EONAHI]2.0.CO;2. PMID 11534635. S2CID 28630527.
- ^ Verle P, Kongs A, De NV, Thieu NQ, Depraetere K, Kim HT, Dorny P (October 2003). "Prevalence of intestinal parasitic infections in northern Vietnam". Trop. Med. Int. Health. 8 (10): 961–64. doi:10.1046/j.1365-3156.2003.01123.x. PMID 14516309.
- ^ Fleming FM, Brooker S, Geiger SM, Caldas IR, Correa-Oliveira R, Hotez PJ, Bethony JM (January 2006). "Synergistic associations between hookworm and other helminth species in a rural community in Brazil". Trop. Med. Int. Health. 11 (1): 56–64. doi:10.1111/j.1365-3156.2005.01541.x. PMID 16398756. S2CID 20407618.
- ^ Mabaso ML, Appleton CC, Hughes JC, Gouws E (April 2004). "Hookworm (Necator americanus) transmission in inland areas of sandy soils in KwaZulu-Natal, South Africa". Trop. Med. Int. Health. 9 (4): 471–76. doi:10.1111/j.1365-3156.2004.01216.x. PMID 15078265.
- ^ McKenna, Megan L.; McAtee, Shannon; Hotez, Peter J.; Bryan, Patricia E.; Jeun, Rebecca; Bottazzi, Maria E.; Flowers, Catherine C.; Ward, Tabitha; Kraus, Jacob; Mejia, Rojelio (8 November 2017). "Human Intestinal Parasite Burden and Poor Sanitation in Rural Alabama". The American Journal of Tropical Medicine and Hygiene. 97 (5): 1623–28. doi:10.4269/ajtmh.17-0396. PMC 5817782. PMID 29016326.
- ^ Pilkington, Ed (5 September 2017). "Hookworm, a disease of extreme poverty, is thriving in the US south. Why?". The Guardian. Retrieved 4 December 2017 – via www.TheGuardian.com.
- ^ Brooker S, Clements AC, Bundy DA (2006). "Global epidemiology, ecology and control of soil-transmitted helminth infections". Global Mapping of Infectious Diseases: Methods, Examples and Emerging Applications. Adv. Parasitol. Advances in Parasitology. Vol. 62. pp. 221–61. doi:10.1016/S0065-308X(05)62007-6. ISBN 978-0120317622. PMC 1976253. PMID 16647972.
- ^ Peduzzi R, Piffaretti JC (1983). "Ancylostoma duodenale and the Saint Gothard anaemia". Br. Med. J. (Clin. Res. Ed.). 287 (6409): 1942–45. doi:10.1136/bmj.287.6409.1942. PMC 1550193. PMID 6418279.
- ^ Page, Walter H. (September 1912). "The Hookworm And Civilization: The Work Of The Rockefeller Sanitary Commission In The Souther States". The World's Work: A History of Our Time. Vol. XXIV. pp. 504–18. Retrieved 2009-07-10.
- ^ Bleakley H (2007). "Disease and Development: Evidence from Hookworm Eradication in the American South". Q. J. Econ. 122 (1): 73–117. doi:10.1162/qjec.121.1.73. PMC 3800113. PMID 24146438.
- ^ Wallace, Barbara; Kirkley, James; McGuire, Thomas; Austin, Diane; Goldfield, David (April 2001). Assessment of Historical, Social, and Economic Impacts of OCS Development on Gulf Coast Communities (PDF) (Report). New Orleans: U .S. Department of the Interior. Bureau of Ocean Energy Management (BOEM), Minerals Management Service, Gulf of Mexico OCS Region. pp. 35–36. Retrieved December 11, 2017.
Inadequate public health services and a general lack of basic citizen knowledge of health and hygiene reflected the weak public education system. Health problems, especially in the Gulf Coast States where frost came late, if at all, abounded in an era when active public health departments in other parts of the country were eradicating nutritional and bacterial diseases. The hookworm, an intestinal parasite, infected and chronically debilitated a great many southerners, perhaps as many as 2 million. In the 1930s, a cooperative study by the Florida State Board of Health, the Rockefeller Foundation, and Vanderbilt University found the State's adolescents aged 15 to 18 the most affected group (44.7 percent), and the Panhandle the most severely affected area with nearly half of its teenagers (49 .2 percent) infested with hookworm (Eberson, 1980; and Link, 1988). John D. Rockefeller found the situation so appalling in the early twentieth century that he established and funded the Rockefeller Sanitary Commission for the Eradication of Hookworm Disease.
- ^ Birn, Anne-Emanuelle; Solórzano, Armando (November 1999). "Public health policy paradoxes: science and politics in the Rockefeller Foundation's hookworm campaign in Mexico in the 1920s". Soc. Sci. Med. 49 (9): 1197–1213. doi:10.1016/S0277-9536(99)00160-4. PMID 10501641.
- ^ Ferrell, John A. (1914). The Rural School and Hookworm Disease. U.S. Government Printing Office.
- ^ a b Brooker, Simon; Bethony, Jeffrey; Hotez, Peter J. (2004-01-01). Human Hookworm Infection in the 21st Century. Adv. Parasitol. Advances in Parasitology. Vol. 58. pp. 197–288. doi:10.1016/S0065-308X(04)58004-1. ISBN 978-0120317585. ISSN 0065-308X. PMC 2268732. PMID 15603764.
- ^ a b Gyorkos TW, Larocque R, Casapia M, Gotuzzo E (September 2006). "Lack of risk of adverse birth outcomes after deworming in pregnant women". Pediatr. Infect. Dis. J. 25 (9): 791–4. doi:10.1097/01.inf.0000234068.25760.97. PMID 16940835. S2CID 8637824.
- ^ Brooker S, Hotez PJ, Bundy DA (2008). Raso G (ed.). "Hookworm-Related Anaemia among Pregnant Women: A Systematic Review". PLOS Negl. Trop. Dis. 2 (9): e291. doi:10.1371/journal.pntd.0000291. PMC 2553481. PMID 18820740.
- ^ Larocque R, Casapia M, Gotuzzo E, MacLean JD, Soto JC, Rahme E, Gyorkos TW (October 2006). "A double-blind randomized controlled trial of antenatal mebendazole to reduce low birthweight in a hookworm-endemic area of Peru". Trop. Med. Int. Health. 11 (10): 1485–95. doi:10.1111/j.1365-3156.2006.01706.x. PMID 17002722. S2CID 46261382.
- ^ Salam, Rehana A.; Das, Jai K.; Bhutta, Zulfiqar A. (2021-05-17). "Effect of mass deworming with antihelminthics for soil-transmitted helminths during pregnancy". The Cochrane Database of Systematic Reviews. 2021 (5): CD005547. doi:10.1002/14651858.CD005547.pub4. ISSN 1469-493X. PMC 8127571. PMID 33998661.
- ^ Brooker S, Akhwale W, Pullan R, Estambale B, Clarke SE, Snow RW, Hotez PJ (December 2007). "Epidemiology of Plasmodium-Helminth co-infection in Africa: Populations at risk, potential impact on anemia and prospects for combining control". Am. J. Trop. Med. Hyg. 77 (6 Suppl): 88–98. doi:10.4269/ajtmh.2007.77.88. PMC 2637949. PMID 18165479.
- ^ Brooker S, Clements AC, Hotez PJ, Hay SI, Tatem AJ, Bundy DA, Snow RW (2006). "The co-distribution of Plasmodium falciparum and hookworm among African schoolchildren". Malar. J. 5: 99. doi:10.1186/1475-2875-5-99. PMC 1635726. PMID 17083720.
- ^ Spiegel A, Tall A, Raphenon G, Trape JF, Druilhe P (2003). "Increased frequency of malaria attacks in subjects co-infected by intestinal worms and Plasmodium falciparum malaria". Trans. R. Soc. Trop. Med. Hyg. 97 (2): 198–9. doi:10.1016/S0035-9203(03)90117-9. PMID 14584377.
- ^ Knowles SC (August 2011). "The effect of helminth co-infection on malaria in mice". Int. J. Parasitol. 41 (10): 1041–51. doi:10.1016/j.ijpara.2011.05.009. PMID 21777589.
- ^ Mwangi TW, Bethony JM, Brooker S (October 2006). "Malaria and helminth interactions in humans: an epidemiological viewpoint". Ann. Trop. Med. Parasitol. 100 (7): 551–70. doi:10.1179/136485906X118468. PMC 1858631. PMID 16989681.
- ^ Hartgers FC, Yazdanbakhsh M (October 2006). "Co-infection of helminths and malaria: modulation of the immune responses to malaria". Parasite Immunol. 28 (10): 497–506. doi:10.1111/j.1365-3024.2006.00901.x. PMID 16965285. S2CID 20956686.
- ^ Strachan DP (November 1989). "Hay fever, hygiene, and household size". BMJ. 299 (6710): 1259–60. doi:10.1136/bmj.299.6710.1259. PMC 1838109. PMID 2513902.
- ^ Cooper PJ (2004). "Intestinal worms and human allergy". Parasite Immunol. 26 (11–12): 455–67. doi:10.1111/j.0141-9838.2004.00728.x. PMID 15771681. S2CID 23348293.
- ^ a b Diemert, David J.; Bethony, Jeffrey M.; Hotez, Peter J. (15 January 2008). "Hookworm Vaccines". Clin. Infect. Dis. 46 (2): 282–8. doi:10.1086/524070. ISSN 1058-4838. JSTOR 40306890. PMID 18171264.
- ^ Bethony JM, Simon G, Diemert DJ, Parenti D, Desrosiers A, Schuck S, Fujiwara R, Santiago H, Hotez PJ (May 2008). "Randomized, placebo-controlled, double-blind trial of the Na-ASP-2 hookworm vaccine in unexposed adults". Vaccine. 26 (19): 2408–17. doi:10.1016/j.vaccine.2008.02.049. PMID 18396361.
- ^ Williamson AL, Lecchi P, Turk BE, Choe Y, Hotez PJ, McKerrow JH, Cantley LC, Sajid M, Craik CS, Loukas A (August 2004). "A multi-enzyme cascade of hemoglobin proteolysis in the intestine of blood-feeding hookworms". J. Biol. Chem. 279 (34): 35950–7. doi:10.1074/jbc.M405842200. PMID 15199048.
- ^ a b c Loukas A, Bethony JM, Mendez S, Fujiwara RT, Goud GN, Ranjit N, Zhan B, Jones K, Bottazzi ME, Hotez PJ (October 2005). "Vaccination with Recombinant Aspartic Hemoglobinase Reduces Parasite Load and Blood Loss after Hookworm Infection in Dogs". PLOS Med. 2 (10): e295. doi:10.1371/journal.pmed.0020295. PMC 1240050. PMID 16231975.
- ^ a b Loukas, Alex; Bethony, Jeffrey M.; Williamson, Angela L.; Goud, Gaddam N.; Mendez, Susana; Zhan, Bin; Hawdon, John M.; Bottazzi, Maria Elena; Brindley, Paul J.; Hotez, Peter J. (15 May 2004). "Vaccination of Dogs with a Recombinant Cysteine Protease from the Intestine of Canine Hookworms Diminishes the Fecundity and Growth of Worms". J. Infect. Dis. 189 (10): 1952–61. doi:10.1086/386346. ISSN 0022-1899. JSTOR 30077095. PMID 15122534.
- ^ Zhan B, Liu S, Perally S, Xue J, Fujiwara R, Brophy P, Xiao S, Liu Y, Feng J, Williamson A, Wang Y, Bueno LL, Mendez S, Goud G, Bethony JM, Hawdon JM, Loukas A, Jones K, Hotez PJ (October 2005). "Biochemical Characterization and Vaccine Potential of a Heme-Binding Glutathione Transferase from the Adult Hookworm Ancylostoma caninum". Infect. Immun. 73 (10): 6903–11. doi:10.1128/IAI.73.10.6903-6911.2005. PMC 1230892. PMID 16177370.