카복시펩티다아제 A
Carboxypeptidase A| 카복시펩티다아제 A | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 카르복시펩티다아제 A, 소 췌장에서 추출 | |||||||||
| 식별자 | |||||||||
| EC 번호 | 3.4.17.1 | ||||||||
| CAS 번호. | 9031-98-5 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 입력 | ||||||||
| 엑스퍼시 | 나이스자이메 뷰 | ||||||||
| 케그 | KEG 입력 | ||||||||
| 메타사이크 | 대사통로 | ||||||||
| 프리암 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBsum | ||||||||
| 진 온톨로지 | 아미고 / 퀵고 | ||||||||
| |||||||||
카르복시펩티다아제 A는 보통 C-단자 잔류물의 펩타이드 결합을 방향족 또는 탈색성 측면 체인으로 가수분해하는 췌장 엑소펩타이드제를 말한다.현재 이 분야의 대부분의 과학자들은 이 효소를 CPA1로, 관련된 췌장 카복시펩티드를 CPA2로 언급하고 있다.
종류들
또 CPA-3에서 CPA-6까지라는 이름의 다른 포유류 효소 4개가 있는데, 이 중 췌장에 발현된 것은 없다.대신에, 이러한 다른 CPA와 같은 효소들은 다양한 기능을 가지고 있다.
- CPA3(마스트 세포 CPA라고도 한다)는 마스트 세포에 의한 단백질의 소화에 관여한다.
- CPA4(기존에는 CPA-3으로 알려졌으나, 마스트-세포 CPA가 CPA-3로 지정되었을 때 번호를 다시 매긴 것)는 종양 진행에 관여할 수 있지만, 이 효소는 잘 연구되지 않았다.
- CPA5는 잘 연구되지 않았다.
- CPA6는 생쥐가 발달하는 동안 많은 조직에서 발현되며, 성인의 경우 뇌와 몇 개의 다른 조직에서 분배가 더 제한적이다.CPA6는 효소 활성인 세포외 매트릭스에 존재한다.CPA-6의 인간 돌연변이는 듀안의 증후군(비정상적인 눈 움직임)과 연관되어 있다.최근 CPA6의 돌연변이는 간질과 관련이 있는 것으로 밝혀졌다.
함수
CPA-1과 CPA-2(그리고 다른 모든 CPA)는 아미노산 잔류물의 C-단자 끝에서 펩타이드 결합을 가수 분해하기 위해 단백질 내에 아연 이온을 사용한다.아연의 상실은 활동성 상실로 이어지며, 이는 아연으로 쉽게 대체될 수 있으며, 또한 일부 다른 이분 금속(코발트, 니켈)으로도 쉽게 대체될 수 있다.카르복시펩티다아제 A는 췌장에서 생성되며 소화, 단백질의 변환 후 변형, 혈액 응고, 번식을 포함한 인체의 많은 과정에 중요하다.
적용들
단일 단백질에 대한 이 광범위한 기능성은 알려지지 않은 구조의 다른 아연 보호제에 관한 연구를 위한 이상적인 모델이다.최근 콜라겐아제, 엔케플리니아제, 안지오텐신전환효소에 대한 바이오의학 연구는 억제제 합성과 운동 테스트에 카르복시펩티다아제 A를 사용했다.예를 들어 고혈압을 치료하는 약인 캡토프릴은 카복시펩타이드제 A 억제제를 기반으로 설계됐다.카르복시펩티다아제 A와 안지오텐신전환효소인 캡토프릴의 표적 효소는 모두 활성 부위 내에 아연 이온을 함유하고 있어 구조가 매우 유사하다.이를 통해 강력한 카복시펩타이드제 A 억제제를 사용하여 효소를 억제함으로써 레닌-안지오텐신-알도스테론 시스템을 통해 혈압을 낮출 수 있었다.[1]
구조
카르복시펩티다아제 A(CPA)는 4면 기하학 내에 아미노산 잔류물이 있는 아연(Zn2+) 금속 중심을 함유해 촉매와 결합을 용이하게 한다.펩타이드 체인에 접합된 307개의 아미노산 중 다음과 같은 아미노산 잔류물은 촉매와 결합에 중요하다. Glu-270, Arg-71, Arg-127, Asn-144, Arg-145, Tyr-248.그림 1은 복합체를 둘러싸고 있는 중요한 아미노산 잔류물이 있는 사면 아연 복합체 활성 부지를 나타낸다.[2]
아연 금속은 강력한 전기생성 루이스 산 촉매로, 조정된 물 분자를 안정화시킬 뿐만 아니라 수력 반응 전체에서 발생하는 음의 매개체를 안정화시킨다.조정된 물 분자와 음극 중간자 모두의 안정화는 수소 결합을 용이하게 하기 위해 가까이 있는 활성 현장의 극지 잔류물에 의해 지원된다.[2]
활성 사이트는 S1'와 S로1 표시된 두 개의 하위 사이트로 특성화할 수 있다.S1' 하위 부위는 효소의 소수성 주머니로, Tyr-248은 기질이나 억제제가 결합한 후 소수성 주머니를 '캡'하는 작용을 한다(SITE).[2]Tyr-248의 히드록실 그룹에서 수소 본딩은 결합되는 기판의 단자 카복실산염과의 상호작용 때문에 이러한 준수를 촉진한다.이 효소에는 상당한 움직임이 필요하며 유도 적합 모델은 이러한 상호작용이 어떻게 발생하는지를 설명한다.
3개의 잔류물이 수소 본딩을 통해 C-단자 카복시산염과 상호 작용한다.
- 양전하 Arg-145를 사용한 소금 연결
- Tyr-248의 수소 결합
- Asn-144 아미드 질소로부터의 수소 결합
메커니즘
메탈로엑소펩티다아제로 분류되는 카복시펩티다아제 A는 아연 이온에 묶인 단일 폴리펩타이드 체인으로 구성된다.이 특징적인 금속 이온은 기질 결합에 관여하는 5개의 아미노산 잔류물(Arg-71, Arg-127, Asn-144, Arg-145, Tyr-248, Glu-270)과 함께 효소의 활성 부위 내에 위치한다. X선 결정학 연구 결과 단백질에 5개의 서브사이트가 발견되었다.이러한 알로스테릭 부위는 대부분의 생체활성 효소에서 볼 수 있는 리간드-엔자임 특이성을 생성하는 데 관여한다.이 중 하나는 1차 활성 부위에서 기질 분자를 결합할 때 Tyr-248에서 순응적 변화를 유도한다.티로신의 페놀 하이드록실(penolic hydroxyl)은 리간드의 단자 카복시산(carboxylate)과 수소 결합을 형성한다.또한, 긴 펩타이드 기판의 티로신과 펩타이드 연결 사이에 두 번째 수소 결합이 형성된다.이러한 변화는 기질이든 억제제가든 효소와 리간드 사이의 유대를 훨씬 더 강하게 만든다.카복시펩티다아제 A의 이러한 성질은 다니엘 E의 제1절까지 이어졌다. 코슈랜드 주니어의 '유인적 적합성' 가설
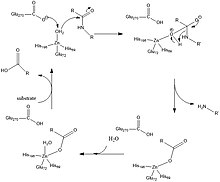
S1 하위 부위는 CPA에서 촉매제가 발생하는 곳으로 아연 이온은 글루-72, 히스-69, 히스-196 효소 잔류물로 조정된다.아연-물 결합 복합체의 반대편에 잔여물 Glu-270과 Arg-127이 있는 활성 사이트 홈을 이등분하는 평면이 존재한다.아연은 글루타민 리간드가 아연을 조정하기 때문에 전자적으로 풍부하다. 왜냐하면 기질이 결합되기 전에는 글루-72가 바이덴테이트를 좌표화하지만 기질이 결합한 후에는 모노덴테이트로 이동하기 때문이다.결과적으로, 아연 금속은 조정된 물 분자를 감압하여 히드록실 핵분자를 만들 수 없다.[2]
Glu-270과 Arg-127은 그림 2와 같은 촉매제에 중요한 역할을 한다.아르그-127은 페닐알라닌의 아미노 그룹에 묶인 기질의 카보닐을 안정시키는 작용을 한다.동시에 아연에 조화된 물 분자는 글루-270에 의해 감압되고 아르그-127에 의해 안정화된 카보닐과 상호작용한다.이것은 그림 2에 나타낸 것과 같이 음전하 산소가 아연으로 조정되고, Glu-270과 이온화 제품 사이의 불리한 정전기적 상호작용을 통해 촉매변환 끝에서 제품의 출시를 용이하게 한다.[2]
최근의 컴퓨터 연구들에서, 카탈루션의 메커니즘은 유사하지만 메커니즘의 차이는 탈염수 분자가 카보닐의 탄소에 결합하는 반면, 그림 2는 히드록실 그룹이 아연으로 조정된 상태를 유지한다는 것을 보여준다.그 후 단백질 분해가 발생하고 물 분자가 다시 활성 부위로 유입되어 아연에 맞춰 조정된다.[3]
카복시펩타이드효소 A와 기질 사이의 결합의 세부 사항과 이것이 가수분해율에 어떤 영향을 미치는지 여러 연구가 수행되었다.1934년 운동 실험을 통해 기질이 결합되기 위해서는 가수 분해할 펩타이드가 단자 프리 하이드록실 그룹에 인접해야 한다는 것이 처음 발견되었다.또한 C-단자 잔류물을 갈아서 알립화시키거나 방향성을 부여하면 가수분해 속도를 높일 수 있다.그러나 기질이 자유아미노군을 가진 디펩타이드일 경우 서서히 가수분해를 겪지만, 이는 아미노군이 N-아세일레이션에[4] 의해 차단되면 피할 수 있다.
효소의 구조가, 즉 활성 부위가 구체적으로 말하면, 반응의 메커니즘을 이해하는 데 매우 중요하다는 것은 꽤 분명하다.이 때문에 리즈와 동료들은 아연 이온의 역할에 대한 명확한 답을 얻기 위해 효소 리간드 콤플렉스를 연구했다.이러한 연구 결과, 자유 효소에서 아연 조정 번호는 5로 밝혀졌다; 금속 중심은 이미다졸 Δ1 니트로겐 2개, 글루탐산염 72의 카르복실산 옥시겐 2개, 물 분자로 조정되어 왜곡된 사면체를 형성한다.그러나 일단 리간드가 카복시펩티다아제 A의 활성 부위에서 결합되면 이 조정 번호는 5에서 6까지 다양할 수 있다.디펩타이드 글리실-L-티로신(dipptide glycyl-L-tyrosine)에 묶여 있을 때 디펩타이드와 카보닐 산소의 아미노 질소가 물 리간드를 대체했다.이렇게 하면 카복시펩티다아제 A-디펩타이드 글리실-L-티로신 콤플렉스의 아연에 대해 조정 번호가 6이 된다.전자 밀도 지도는 아미노 질소가 글루탐산염-270 근처에서 두 번째 위치를 차지하고 있다는 증거를 제공했다.이 두 잔류물의 폐쇄성은 물 리간드가 아연과 조응하는 것을 방해하는 강직한 방해물을 초래할 것이다.이렇게 되면 조정 번호는 5가 된다.두 가지 모두에 대한 데이터는 두 가지 상황이 모두[5] 자연적으로 발생한다는 것을 나타냄
카복시펩타이드제 A의 촉매 기능을 위한 두 가지 메커니즘이 제안된다.첫 번째는 활성 사이트 베이스 Glu-270을 포함하는 공발효소 아킬 효소 중간을 포함하는 핵포질 경로다.이 무수중간에 대한 증거는 혼합되어 있다; Suh와 동료들은 아킬중간에 의해 가정된 것을 분리했다.그러나 아킬 효소의 확인은 실험에 함몰하지 않고 이뤄져 결론은 약해졌다.[1]
두 번째로 제안된 메커니즘은 촉진된 물길이다.이 메커니즘은 기질의 가위 펩타이드 연결에서 물 분자의 공격을 포함한다.이 과정은 아연 이온에 의해 촉진되고 잔류물 Glu-270에 의해 보조된다.[1]
참고 항목
참조
- ^ a b c Christianson DW, Lipscomb WN (February 1989). "Carboxypeptidase A". Accounts of Chemical Research. 22 (2): 62–9. doi:10.1021/ar00158a003.
- ^ a b c d e 크리스천슨, D, W, 립스콤 (1989) 카복시펩티다아제 A.미국 화학 협회, Vol (22): 62-69.
- ^ Valdez CE, Morgenstern A, Eberhart ME, Alexandrova AN (November 2016). "Predictive methods for computational metalloenzyme redesign - a test case with carboxypeptidase A". Physical Chemistry Chemical Physics. 18 (46): 31744–31756. Bibcode:2016PCCP...1831744V. doi:10.1039/c6cp02247b. PMID 27841396.
- ^ Lipscomb WN (March 1970). "Structure and mechanism in the enzymic activity of carboxypeptidase A and relations to chemical sequence". Accounts of Chemical Research. 3 (3): 81–9. doi:10.1021/ar50027a001.
- ^ Rees DC, Lewis M, Honzatko RB, Lipscomb WN, Hardman KD (June 1981). "Zinc environment and cis peptide bonds in carboxypeptidase A at 1.75-A resolution". Proceedings of the National Academy of Sciences of the United States of America. 78 (6): 3408–12. Bibcode:1981PNAS...78.3408R. doi:10.1073/pnas.78.6.3408. PMC 319577. PMID 6943549.