디펩티드
Dipeptide디펩타이드란 두 개의 아미노산에서 파생된 유기 화합물이다.구성성 아미노산은 같거나 다를 수 있다.차이가 나면 순서에 따라 디펩타이드의 등가 2개가 가능하다.몇몇 디펩타이드들은 생리학적으로 중요하며, 어떤 것들은 생리학적으로나 상업적으로 중요하다.딥피드는 인공 감미료인 아스파탐이다.[1]null
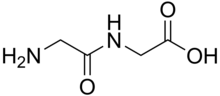
디펩티드는 흰색 고체다.많은 것들이 모성 아미노산보다 훨씬 더 수용성이 높다.[1]예를 들어, 디펩타이드 알라-글렌은 586 g/L의 용해도가 Gln(35 g/L)의 10배 이상이다.디펩타이드도 예를 들어 가수분해와 관련하여 다른 안정성을 보일 수 있다.Gln은 불임 시술에 견디지 못하지만, 이 디펩타이드에는 견디지 못한다.디펩타이드들은 가수분해되기 쉽기 때문에 높은 용해성은 주입, 즉 영양 공급에 이용된다.[2]null
예

상업가치
약 6개의 디펩타이드들이 상업적인 흥미가 있다.[1]null
- 아스파탐(N-L-α-aspartyL-L-페닐알라닌 1-메틸에스테르)은 인공 감미료다.
- 카르노신(Beta-Alanyl-L-histidine)과 안세린(Beta-Alanyl-N-methyl histidine)은 근육과 뇌 조직에 고도로 집중되어 있다.그것들은 스포츠 의약품에 사용된다.
- 아세틸카르노신, 백내장 예방
- 알라-글렌과 글리-티르, 주입[2]
- 발티르, 고혈압 치료 반대
기타디펩타이드
- 호모안세린(Homoanserine, 4-aminobutyryl)-L-histidine)은 포유류의 뇌와 근육에서 확인된 또 다른 디펩타이드다.
- 디페닐알라닌은 펩타이드 나노기술에서 가장 많이 연구된 빌딩 블록이다.
- 쿄토핀(L-tyrosyl-L-arginine)은 신경 활성 디펩타이드로 뇌의 통증 조절에 역할을 한다.
- 발레닌 (또는 ophidine) (베타-알라닐-N 타우-메틸 히스티딘)은 여러 종의 포유류(인간 포함)와 닭의 근육에서 확인되었다.
- Mrigin(N-propionyl-l-glutamyl-L-ornithine-Δ-lac ethyl ester)은 슬라임 몰드 Polysphondylum violaceum의 화학 디펩타이드다.
- 바레틴(Syclo-[6-브로모-8엔트립토판)-아르기닌]은 해양스펀지 지오디아 바레티에서 나오는 순환 디펩타이드다.
- 유사포도선
- Dialanine은 Molecular Dynamics에서 일반적으로 모델로 사용된다.
생산
합성디펩티드
디펩티드는 아미노산을 결합하여 생성된다.1개의 아미노산에 있는 아미노 그룹은 비핵성(P in eq)으로 렌더링되고, 2번째 아미노산에 있는 카복실산 그룹은 메틸 에스테르로 비활성화된다.그런 다음 두 개의 수정된 아미노산이 결합되어 아미드 결합의 형성을 용이하게 하는 결합제가 있다.
- RCH(NHP)COH2 + R'CH(NH2)COCH23 → RCH(NHP)C(O)NH(CHR')COCH23 + HO2
이러한 결합 반응에 따라 아민 보호 그룹 P와 에스테르는 각각 아민 및 카르복실산으로 변환된다.[3]null
많은 아미노산의 경우 보조 기능 그룹은 보호된다.아민과 카복실산의 응축으로 펩타이드 결합을 형성하는 것은 일반적으로 카복실산을 활성화하기 위한 결합제를 사용한다.[4]null
베르그만 아즐락톤 펩타이드 합성은 디펩타이드의 조제를 위한 고전적인 유기합성물이다.[1]null
생합성
디펩티드는 히드로라제 효소 디펩티딜 펩티다아제의 작용에 의해 폴리펩티드에서 생성된다.[5]식이성 단백질은 디셉티드와 아미노산으로 소화되고 디셉티드는 아미노산보다 더 빠르게 흡수되는데, 이는 이들의 섭취가 별도의 메커니즘을 수반하기 때문이다.디펩티드는 위장에서 발견된 G세포들을 활성화시켜 미로를 분비한다.null
디케토피페라진(순환 디펩타이드)
디케토피페라진(diketopiperazines)은 주기적인 디펩타이드의 특별한 종류다.그것들은 펩타이드 합성에서 사이드 제품으로 형성된다.많은 것들이 비수상 아미노산으로부터 생산되었다.[7]null
참조
- ^ a b c d Yagasaki M, Hashimoto S (November 2008). "Synthesis and application of dipeptides; current status and perspectives". Applied Microbiology and Biotechnology. 81 (1): 13–22. doi:10.1007/s00253-008-1590-3. PMID 18795289.
- ^ a b Fürst P, Pogan K, Stehle P (1997). "Glutamine dipeptides in clinical nutrition". Nutrition. 13 (7–8): 731–7. doi:10.1016/S0899-9007(97)83035-3. PMID 9263278.
- ^ Subirós-Funosas AE, Albericio F (2013). "Low-epimerization Peptide Bond Formation with Oxyma Pure: Preparation of Z-L-Phg-Val-OMe". Organic Syntheses. 90: 306. doi:10.15227/orgsyn.090.0306.
- ^ Suppo JS, de Figueiredo RM, Campagne JM (2015). "Dipeptide Syntheses via Activated α-Aminoesters". Organic Syntheses. 92: 296–308. doi:10.15227/orgsyn.092.0296.
- ^ Steane R. "Hydrolysis of a dipeptide". BioTopics. Retrieved 28 July 2014.
- ^ Borthwick AD, Liddle J (January 2013). "Retosiban and Epelsiban: Potent and Selective Orally available Oxytocin Antagonists". In Domling A (ed.). Methods and Principles in Medicinal Chemistry: Protein-Protein Interactions in Drug Discovery. Weinheim: Wiley-VCH. pp. 225–256. ISBN 978-3-527-33107-9.
- ^ Borthwick AD (July 2012). "2,5-Diketopiperazines: synthesis, reactions, medicinal chemistry, and bioactive natural products". Chemical Reviews. 112 (7): 3641–716. doi:10.1021/cr200398y. PMID 22575049.
외부 링크
- PeptideGuide에서 디펩타이드에 대한 소개.


