요인 X
Factor X| F10 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| 식별자 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| 에일리어스 | F10, FX, FXA, 응고 인자 X | ||||||||||||||||||||||||||||||||||||||||||||||||||
| 외부 ID | OMIM: 613872 MGI: 103107 HomoloGene: 30976 GeneCard: F10 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| 위키데이터 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Stuart-Prower 인자로도 알려진 인자 X는 응고 캐스케이드의 효소(EC 3.4.21.6)이다.세린엔도펩티드가수분해효소(프로테아제 S1, PA클랜)이다.X인자는 간에서 합성되며 합성을 위해 비타민 K를 필요로 한다.
인자 X는 가수분해에 의해 인자 IX(그 보조인자와 함께 내인성 테나아제라고 알려진 복합체에서의 인자 VII)와 그 보조인자, 조직인자(외인성 테나아제라고 알려진 복합체) 모두에 의해 인자 Xa로 활성화된다.따라서 최종 공통 경로 또는 트롬빈 경로의 첫 번째 구성원이다.
프로트롬빈을 두 곳(아르그-스르 결합과 아르그-일 결합)에서 분해하여 활성 트롬빈을 생성합니다.이 과정은 Xa 인자가 프로트롬비나아제 복합체에서 활성화된 보조인자 V와 복합될 때 최적화된다.
Xa 인자는 세린단백질가수분해효소억제제(serpin)인 단백질Z의존성단백질가수분해효소억제제(ZPI)에 의해 불활성화된다.Xa 인자에 대한 이 단백질의 친화력은 단백질 Z의 존재에 의해 1000배 증가하지만, XI 인자의 불활성화를 위해 단백질 Z를 필요로 하지 않는다.단백질 Z의 결함은 Xa 인자의 활성을 증가시키고 혈전증의 경향을 유발한다.
인자 X의 반감기는 40~45시간입니다.
구조.
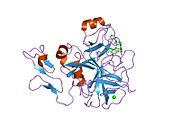
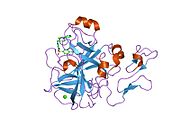
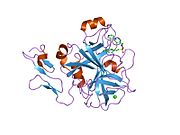
인간 요인 Xa의 첫 결정 구조는 1993년 5월에 퇴적되었다.현재까지 단백질 데이터 뱅크에는 다양한 억제제를 가진 Xa 인자의 191개의 결정 구조가 축적되어 있다.인자 Xa의 활성 부위는 S1, S2, S3, S4의 4개의 서브 포켓으로 나뉜다.S1 서브포켓은 선택성과 바인딩의 주요 컴포넌트를 결정합니다.S2 서브 포켓은 작고 얕으며 잘 정의되지 않습니다.S4 서브 포켓과 결합됩니다.S3 서브 포켓은 S1 포켓의 가장자리에 위치하며 용매에 상당히 노출되어 있습니다.S4 서브 포켓은 "소수성 상자", "카티온 구멍" 및 물 부위라는 세 가지 리간드 결합 도메인을 가지고 있다.Xa인자억제제는 일반적으로 L자 형태로 결합하며, 리간드의 한 그룹은 잔류물 Asp189, Ser195 및 Tyr228로 배열한 음이온성 S1 포켓을 차지하고, 다른 리간드의 다른 그룹은 잔류물 Tyr99, Phe174 및 Trp215로 배열한 방향족 S4 포켓을 점유한다.일반적으로 상당히 견고한 링커 그룹은 이들 2개의 상호작용 [5]사이트를 브리지합니다.
유전학
인간 인자 X 유전자는 13번 염색체(13q34)에 위치한다.
질병에서의 역할
X 인자의 선천적 결핍은 매우 드물고(1:1,000,000), 서신증(코피), 헤마스로시스(관절로 출혈) 및 위장 출혈과 함께 나타날 수 있다.선천성 결핍과는 별도로, 낮은 인자 X 수치는 여러 질병 상태에서 가끔 발생할 수 있다.예를 들어, 인자 X 결핍은 혈관 구조의 아밀로이드 섬유에 인자 X가 흡착되는 아밀로이드증에서 볼 수 있다.
비타민 K의 결핍이나 와파린(또는 유사한 약물)에 의한 길항작용은 비활성인자 X의 생성을 이끈다.와파린 요법은 혈전 예방에 바람직하다.2007년 말 현재, 새롭게 등장한 항응고 치료제 5개 중 4개가 이 [6]효소를 목표로 하고 있다.
인자 Xa를 억제하면 항응고제를 위한 대체 방법을 제공할 수 있습니다.직접 Xa 억제제는 인기 있는 항응고제이다.
인자 X의 다형성은 세균 감염의 유병률 증가와 관련이 있으며, 이는 [7]세균 병원체에 대한 면역 반응을 직접적으로 조절하는 역할을 암시한다.
치료용 사용
인자 X는 신선한 냉동 혈장과 프로트롬비나아제 복합체의 일부입니다.시판되는 X인자 농축액에는 CSL [8]Behring이 제조한 "Factor X P Behring"과 바이오 제품 연구소가 생산하여 2015년 10월 FDA에 의해 미국 사용을 승인받은 고순도 X Cogadex가 있으며, 2016년 3월,[9][10][11][12] CHMP 및 CF가 이를 승인한 후 EU에서 사용할 수 있다.
CSL Behring에 의해 제조된 Kcentra는 응고 인자 II, VII, IX 및 X와 항혈전 단백질 C 및 [13]S를 포함하는 농축액이다.
생화학에 사용
Xa단백질가수분해효소는 생화학에서 관심 단백질의 발현 또는 정화를 개선하는 단백질 태그를 분리하는 데 사용될 수 있습니다.바람직한 절단 부위(일-글루/Asp-Gly-Arg, IEGR 또는 IDGR 배열의 아르기닌 이후)는 태그 배열과 관심 단백질 사이에서 쉽게 설계할 수 있다.발현 및 정제 후 인자 Xa에 의해 태그가 단백질 분해 제거된다.
계수 Xa
Xa 인자는 응고 인자 X의 활성화된 형태이며, 트롬보키나아제라고도 하며, 익명으로 스튜어트-프로워 인자로 알려져 있다.인자 X는 효소인 세린 엔도펩티다아제이며, 응고 시스템의 여러 단계에서 중요한 역할을 합니다.X인자는 간에서 합성된다.임상 실무에서 가장 일반적으로 사용되는 항응고제인 와파린과 항응고제와 폰다파리눅스 헤파린 시리즈는 다양한 차원에서 Xa 인자의 작용을 억제하는 작용을 한다.
1960년대에 개발된 전통적인 응고 모델은 외인자(조직인자(TF) 경로와 내인 경로라는 두 개의 분리된 캐스케이드를 예상하였다.이러한 경로는 공통점인 Xa/Va 인자의 복합체로 수렴되며, 칼슘과 함께 인지질 표면에 결합되어 프로트롬빈(인자 II)으로부터 트롬빈(인자 IIa)을 생성한다.
새로운 모델인 항응고 세포 기반 모델은 응고 단계를 보다 완벽하게 설명하는 것으로 보입니다.이 모델은 1) TF 담당 세포에 대한 응고 개시 2) TF 담당 세포에서 생성된 트롬빈에 의한 프로응고제 신호의 증폭 3) 혈소판 표면에서의 트롬빈 생성의 전파의 3단계로 구성되어 있다.Xa 요인은 이 세 [14]가지 단계에서 모두 중요한 역할을 합니다.
제1단계에서는 제7인자가 세포표면의 막간단백질 TF에 결합되어 제7인자로 변환된다.그 결과 인자 VIIa/TF 복합체가 생성되어 인자 X와 인자 IX의 활성화를 촉매합니다.TF 담당 셀 표면에 형성되는 인자 Xa는 인자 Va와 상호작용하여 소량의 트롬빈을 TF 담당 셀 표면에 생성하는 프로트롬비나아제 복합체를 형성한다.
2단계인 증폭단계에서 충분한 트롬빈이 생성되면 혈소판 및 혈소판 관련 보조인자가 활성화된다.
3단계 트롬빈 생성에서 인자 XIa는 활성화된 혈소판의 표면에서 유리 인자 IX를 활성화한다.인자 VIIIa와 함께 활성화된 인자 IXa는 "테나아제" 복합체를 형성합니다.이 "테나아제" 복합체는 인자 X를 더 활성화하여 인자 Va와 새로운 프로트롬비나아제 복합체를 형성합니다.Xa 인자는 다량의 프로트롬빈을 변환하는 프로트롬비나아제 복합체의 주요 성분이다.Xa 인자의 각 분자는 1000개의 트롬빈 분자를 생성할 수 있습니다.이 큰 트롬빈의 폭발은 혈전을 형성하기 위해 섬유소 중합에 책임이 있다.
Xa 인자는 또한 상처 치유, 조직 재모듈링, 염증, 혈관신생 및 아테롬성 동맥경화와 같이 응고와 직접적으로 관련이 없는 다른 생물학적 과정에서도 역할을 합니다.
인자 X의 합성 또는 활성의 억제는 오늘날 사용되는 많은 항응고제의 작용 메커니즘이다.쿠마린의 합성 유도체인 와파린은 미국에서 가장 널리 사용되는 경구 항응고제이다.일부 유럽 국가에서는 다른 쿠마린 유도체(펜프로코몬 및 아세노코마롤)가 사용된다.비타민 K 길항제(VKA)로 알려진 이러한 약물은 간세포에서 인자 II(프로트롬빈), VII, IX, X의 비타민 K 의존성 카르복실화를 억제합니다.번역 후의 이 카르복실화는 생리 [15]활동에 필수적이다.
헤파린(미분자 헤파린) 및 그 유도체 저분자량 헤파린(LMWH)은 혈장 보조인자 안티트롬빈(AT)에 결합하여 여러 응고인자 IIa, Xa, XIa 및 XIa를 비활성화한다.계수 Xa에 대한 비분할 헤파린과 다양한 LMWH의 친화력은 상당히 다르다.헤파린계 항응고제의 효과는 인자 Xa의 선택성이 증가함에 따라 증가한다.LMWH는 미분열 헤파린에 비해 인자 Xa의 불활성화가 증가하였으며, 헤파린의 임계 펜타사카리드 배열에 기초한 약물인 폰다파리눅스는 LMWH보다 선택성이 더 높다.헤파린에 의한 이러한 인자 Xa의 불활성화는 인자 Xa와의 직접적인 상호작용이 아닌 AT의 존재에 의존하기 때문에 "간접"이라고 불린다.
최근 Xa 인자의 새로운 특정 직접 작용 억제제가 개발되었습니다.여기에는 리바로사반, 아픽사반, 베트릭사반, LY517717, 데렉사반(YM150), 에독사반 및 813893의 약물이 포함된다.이러한 약제는 현재 치료법에 비해 몇 가지 이론적인 이점이 있습니다.그것들은 경구 투여될 수 있다.그들은 행동이 빠르게 시작된다.또한 프로트롬비나아제 [16]복합체에서 유리인자 Xa와 인자 Xa를 모두 억제한다는 점에서 인자 Xa에 대해 더 효과적일 수 있다.
역사
미국과 영국의 과학자들은 각각 1953년과 1956년에 X 인자의 결핍을 독립적으로 설명했습니다.다른 응고 인자와 마찬가지로, 이 인자는 처음에 이 환자들, 미스터 루퍼스 스튜어트(1921년)와 미스 오드리 프로워(1934년)의 이름을 따서 명명되었다.그 당시, 그 연구자들은 그들이 밝혀낸 인간의 유전적 결함이 트롬보키나아제라고 불리는 이전에 특징지어졌던 효소에서 발견된다는 것을 알 수 없었다.
트롬보키나제는 1904년 폴 모라위츠가 프로트롬빈을 트롬빈으로 바꾸고 혈액을 [17]응고시키는 물질을 설명하기 위해 만든 이름이다.이 이름은 혈액 응고를 이해하는 데 있어 중요한 새로운 개념을 구체화했다. 즉, 효소는 프로트롬빈의 활성화에 매우 중요했다.Morawitz는 그의 효소가 혈소판 같은 세포에서 나왔다고 믿었지만, 그 당시 효소에 대한 지식 상태와 함께, 그는 그의 트롬보키나제의 화학적 성질이나 그것의 작용 메커니즘에 대해 명확한 생각을 가지고 있지 않았다.이러한 불확실성으로 인해 트롬보키나아제와 트롬보플라스틴이라는 용어는 프로트롬빈의 활성제를 설명하기 위해 수십 년 동안 사용되었고, 프로트롬빈의 화학적 성질과 [18]기원에 대한 논란으로 이어졌다.
1947년, J Haskell Milstone은 소 혈장에서 프로트롬빈을 트롬빈으로 바꾸는 프로엔자임을 분리했다.Morawitz의 명칭에 따라, 그는 그것을 프로트롬보키나아제라고 불렀고 1951년까지 활성 효소인 트롬보키나제를 정제했다.다음 몇 년 동안 그는 트롬보키나제가 프로트롬빈을 활성화시킬 수 있는 단백질 분해 효소라는 것을 보여주었다.트롬보키나아제와의 상호작용으로 프로트롬빈에서 트롬빈으로의 전환을 촉진하는 트롬보플라스틴을 나타내는 칼슘, 기타 혈청인자 및 조직추출물을 [20]첨가하여 활성이 크게 향상되었다.1964년 밀스톤은 그의 연구와 다른 사람들의 것을 요약했다: "너무 느린 화학 반응들이 많아서 효소에 의해 가속되지 않으면 생리적으로 쓸모가 없을 것이다.우리는 이제 보조 인자의 도움을 받지 않는 한 여전히 너무 느린 효소에 의해 촉매되는 반응에 직면해 있습니다."[21]
상호 작용
인자 X는 조직 인자 경로 [22]억제제와 상호작용하는 것으로 나타났다.
레퍼런스
- ^ a b c GRCh38: 앙상블 릴리즈 89: ENSG00000126218 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리즈 89: ENSMUSG000031444 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Presentation on Direct Factor Xa Inhibitors". Archived from the original on 2016-03-03. Retrieved 2010-04-08.
- ^ Ron Winslow; Avery Johnson (2007-12-10). "Race Is on for the Next Blood Thinner". The Wall Street Journal. p. A12. Archived from the original on 2016-03-10. Retrieved 2008-01-06.
The flurry of interest reflects increasing understanding of what doctors call the coagulation cascade... Four new blood thinners target an enzyme called factor Xa, one of several enzymes that play an important role in the cascade.
- ^ Skaar, Eric P.; Pulley, Jill; Jerome, Rebecca N.; Pruijssers, Andrea; Shirey-Rice, Jana K.; Margaritis, Paris; Himmel, Lauren E.; Monteith, Andrew J.; Choby, Jacob E. (2019-02-19). "PheWAS uncovers a pathological role of coagulation Factor X during Acinetobacter baumannii infection". Infection and Immunity. 87 (5): IAI.00031–19. doi:10.1128/IAI.00031-19. ISSN 0019-9567. PMC 6479028. PMID 30782860.
- ^ Mark Brooker (2008) : "응고인자 농축물 등록"세계혈우병연맹 제8판, 2008년
- ^ "FDA approves first Factor X concentrate to treat patients with rare hereditary bleeding disorder" (Press release). US FDA. October 20, 2015. Archived from the original on October 21, 2015. Retrieved October 21, 2015.
Until today's orphan drug approval, no specific coagulation factor replacement therapy was available for patients with hereditary Factor X deficiency.
- ^ "Coagadex". U.S. Food and Drug Administration. 28 June 2017. Archived from the original on 22 July 2017. Retrieved 2 April 2020.
{{cite web}}: CS1 유지보수: 부적합한 URL(링크) - ^ "Coagadex". U.S. Food and Drug Administration. 21 September 2018. Archived from the original on 17 December 2019. Retrieved 2 April 2020.
- ^ "Coagadex EPAR". European Medicines Agency (EMA). Retrieved 21 April 2020.
- ^ "Kcentra- prothrombin, coagulation factor vii human, coagulation factor ix human, coagulation factor x human, protein c, protein s human, and water kit". DailyMed. 22 October 2018. Retrieved 21 April 2020.
- ^ Hoffman M, Monroe DM (February 2007). "Coagulation 2006: a modern view of hemostasis". Hematology/Oncology Clinics of North America. 21 (1): 1–11. doi:10.1016/j.hoc.2006.11.004. PMID 17258114.
- ^ Golan, D. E. (2012). Principles of Pharmacology The Pathophysiologic Basis of Drug Therapy. Philadelphia: Lippincott Williams & Wilkins. p. 387. ISBN 978-1-4511-1805-6.
- ^ Turpie AG (June 2007). "Oral, direct factor Xa inhibitors in development for the prevention and treatment of thromboembolic diseases". Arteriosclerosis, Thrombosis, and Vascular Biology. 27 (6): 1238–47. CiteSeerX 10.1.1.536.872. doi:10.1161/ATVBAHA.107.139402. PMID 17379841. S2CID 2998452.
- ^ Morawitz, Paul. "Beitrage zur Kenntnis der Blutgerinnung". Deutsches Archiv für Klinische Medizin. 79: 432–442.
- ^ Milstone, J H. "On the evolution of blood clotting theory". Medicine. 31: 411–447. doi:10.1097/00005792-195212000-00004. PMID 13012730.
- ^ Milstone, J H. "Prothrombokinase and the three stages of blood coagulation". Science. 106: 546–547. PMID 17741228.
- ^ Milstone, Leonard (2021). "Factor Xa: Thrombokinase from Paul Morawitz to J Haskell Milstone". Journal Thrombosis and Thrombolysis. 52: 364–370. doi:10.1007/s11239-021-02387-6. PMID 33484373.
- ^ Milstone, J H (1964). "Thrombokinase as prime activator of prothrombin: historical perspectives and present status". Federation Proceedings. 23: 742–748. doi:10.1085/jgp.47.2.315. PMID 14080818.
- ^ Broze GJ, Warren LA, Novotny WF, Higuchi DA, Girard JJ, Miletich JP (February 1988). "The lipoprotein-associated coagulation inhibitor that inhibits the factor VII-tissue factor complex also inhibits factor Xa: insight into its possible mechanism of action". Blood. 71 (2): 335–43. doi:10.1182/blood.V71.2.335.335. PMID 3422166.
외부 링크
추가 정보
- Cooper DN, Millar DS, Wacey A, Pemberton S, Tuddenham EG (July 1997). "Inherited factor X deficiency: molecular genetics and pathophysiology". Thrombosis and Haemostasis. 78 (1): 161–72. doi:10.1055/s-0038-1657520. PMID 9198147.
- Hassan HJ, Leonardi A, Chelucci C, Mattia G, Macioce G, Guerriero R, Russo G, Mannucci PM, Peschle C (September 1990). "Blood coagulation factors in human embryonic-fetal development: preferential expression of the FVII/tissue factor pathway". Blood. 76 (6): 1158–64. doi:10.1182/blood.V76.6.1158.1158. PMID 1698100.
- Messier TL, Pittman DD, Long GL, Kaufman RJ, Church WR (March 1991). "Cloning and expression in COS-1 cells of a full-length cDNA encoding human coagulation factor X". Gene. 99 (2): 291–4. doi:10.1016/0378-1119(91)90141-W. PMID 1902434.
- Krishnaswamy S (March 1990). "Prothrombinase complex assembly. Contributions of protein-protein and protein-membrane interactions toward complex formation". The Journal of Biological Chemistry. 265 (7): 3708–18. doi:10.1016/S0021-9258(19)39652-8. PMID 2303476.
- España F, Berrettini M, Griffin JH (August 1989). "Purification and characterization of plasma protein C inhibitor". Thrombosis Research. 55 (3): 369–84. doi:10.1016/0049-3848(89)90069-8. PMID 2551064.
- Fung MR, Hay CW, MacGillivray RT (June 1985). "Characterization of an almost full-length cDNA coding for human blood coagulation factor X". Proceedings of the National Academy of Sciences of the United States of America. 82 (11): 3591–5. Bibcode:1985PNAS...82.3591F. doi:10.1073/pnas.82.11.3591. PMC 397831. PMID 2582420.
- Jagadeeswaran P, Reddy SV, Rao KJ, Hamsabhushanam K, Lyman G (December 1989). "Cloning and characterization of the 5' end (exon 1) of the gene encoding human factor X". Gene. 84 (2): 517–9. doi:10.1016/0378-1119(89)90529-5. PMID 2612918.
- Reddy SV, Zhou ZQ, Rao KJ, Scott JP, Watzke H, High KA, Jagadeeswaran P (October 1989). "Molecular characterization of human factor XSan Antonio". Blood. 74 (5): 1486–90. doi:10.1182/blood.V74.5.1486.1486. PMID 2790181.
- Kaul RK, Hildebrand B, Roberts S, Jagadeeswaran P (1986). "Isolation and characterization of human blood-coagulation factor X cDNA". Gene. 41 (2–3): 311–4. doi:10.1016/0378-1119(86)90112-5. PMID 3011603.
- Broze GJ, Warren LA, Novotny WF, Higuchi DA, Girard JJ, Miletich JP (February 1988). "The lipoprotein-associated coagulation inhibitor that inhibits the factor VII-tissue factor complex also inhibits factor Xa: insight into its possible mechanism of action". Blood. 71 (2): 335–43. doi:10.1182/blood.V71.2.335.335. PMID 3422166.
- Gilgenkrantz S, Briquel ME, André E, Alexandre P, Jalbert P, Le Marec B, Pouzol P, Pommereuil M (1986). "Structural genes of coagulation factors VII and X located on 13q34". Annales de Génétique. 29 (1): 32–5. PMID 3487272.
- Leytus SP, Foster DC, Kurachi K, Davie EW (September 1986). "Gene for human factor X: a blood coagulation factor whose gene organization is essentially identical with that of factor IX and protein C". Biochemistry. 25 (18): 5098–102. doi:10.1021/bi00366a018. PMID 3768336.
- Leytus SP, Chung DW, Kisiel W, Kurachi K, Davie EW (June 1984). "Characterization of a cDNA coding for human factor X". Proceedings of the National Academy of Sciences of the United States of America. 81 (12): 3699–702. Bibcode:1984PNAS...81.3699L. doi:10.1073/pnas.81.12.3699. PMC 345286. PMID 6587384.
- McMullen BA, Fujikawa K, Kisiel W, Sasagawa T, Howald WN, Kwa EY, Weinstein B (June 1983). "Complete amino acid sequence of the light chain of human blood coagulation factor X: evidence for identification of residue 63 as beta-hydroxyaspartic acid". Biochemistry. 22 (12): 2875–84. doi:10.1021/bi00281a016. PMID 6871167.
- Marchetti G, Castaman G, Pinotti M, Lunghi B, Di Iasio MG, Ruggieri M, Rodeghiero F, Bernardi F (August 1995). "Molecular bases of CRM+ factor X deficiency: a frequent mutation (Ser334Pro) in the catalytic domain and a substitution (Glu102Lys) in the second EGF-like domain". British Journal of Haematology. 90 (4): 910–5. doi:10.1111/j.1365-2141.1995.tb05214.x. PMID 7669671. S2CID 29324903.
- Morgenstern KA, Sprecher C, Holth L, Foster D, Grant FJ, Ching A, Kisiel W (March 1994). "Complementary DNA cloning and kinetic characterization of a novel intracellular serine proteinase inhibitor: mechanism of action with trypsin and factor Xa as model proteinases". Biochemistry. 33 (11): 3432–41. doi:10.1021/bi00177a037. PMID 8136380.
- Heeb MJ, Rosing J, Bakker HM, Fernandez JA, Tans G, Griffin JH (March 1994). "Protein S binds to and inhibits factor Xa". Proceedings of the National Academy of Sciences of the United States of America. 91 (7): 2728–32. Bibcode:1994PNAS...91.2728H. doi:10.1073/pnas.91.7.2728. PMC 43443. PMID 8146182.
- Inoue K, Morita T (November 1993). "Identification of O-linked oligosaccharide chains in the activation peptides of blood coagulation factor X. The role of the carbohydrate moieties in the activation of factor X". European Journal of Biochemistry. 218 (1): 153–63. doi:10.1111/j.1432-1033.1993.tb18361.x. PMID 8243461.
- Padmanabhan K, Padmanabhan KP, Tulinsky A, Park CH, Bode W, Huber R, Blankenship DT, Cardin AD, Kisiel W (August 1993). "Structure of human des(1-45) factor Xa at 2.2 A resolution". Journal of Molecular Biology. 232 (3): 947–66. doi:10.1006/jmbi.1993.1441. PMID 8355279.
- Sinha U, Wolf DL (February 1993). "Carbohydrate residues modulate the activation of coagulation factor X". The Journal of Biological Chemistry. 268 (5): 3048–51. doi:10.1016/S0021-9258(18)53657-7. PMID 8428982.









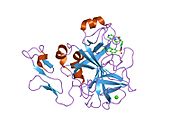







![1mq5: Crystal Structure of 3-chloro-N-[4-chloro-2-[[(4-chlorophenyl)amino]carbonyl]phenyl]-4-[(4-methyl-1-piperazinyl)methyl]-2-thiophenecarboxamide Complexed with Human Factor Xa](http://upload.wikimedia.org/wikipedia/commons/thumb/6/68/PDB_1mq5_EBI.jpg/180px-PDB_1mq5_EBI.jpg)
![1mq6: Crystal Structure of 3-chloro-N-[4-chloro-2-[[(5-chloro-2-pyridinyl)amino]carbonyl]-6-methoxyphenyl]-4-[[(4,5-dihydro-2-oxazolyl)methylamino]methyl]-2-thiophenecarboxamide Complexed with Human Factor Xa](http://upload.wikimedia.org/wikipedia/commons/thumb/a/a4/PDB_1mq6_EBI.jpg/180px-PDB_1mq6_EBI.jpg)




![1v3x: Factor Xa in complex with the inhibitor 1-[6-methyl-4,5,6,7-tetrahydrothiazolo(5,4-c)pyridin-2-yl] carbonyl-2-carbamoyl-4-(6-chloronaphth-2-ylsulphonyl)piperazine](http://upload.wikimedia.org/wikipedia/commons/thumb/7/70/PDB_1v3x_EBI.jpg/180px-PDB_1v3x_EBI.jpg)
![1wu1: Factor Xa in complex with the inhibitor 4-[(5-chloroindol-2-yl)sulfonyl]-2-(2-methylpropyl)-1-[[5-(pyridin-4-yl) pyrimidin-2-yl]carbonyl]piperazine](http://upload.wikimedia.org/wikipedia/commons/thumb/1/17/PDB_1wu1_EBI.jpg/180px-PDB_1wu1_EBI.jpg)







![2d1j: Factor Xa in complex with the inhibitor 2-[[4-[(5-chloroindol-2-yl)sulfonyl]piperazin-1-yl] carbonyl]thieno[3,2-b]pyridine n-oxide](http://upload.wikimedia.org/wikipedia/commons/thumb/a/ae/PDB_2d1j_EBI.jpg/180px-PDB_2d1j_EBI.jpg)
![2fzz: Factor Xa in complex with the inhibitor 1-(3-amino-1,2-benzisoxazol-5-yl)-6-(2'-(((3r)-3-hydroxy-1-pyrrolidinyl)methyl)-4-biphenylyl)-3-(trifluoromethyl)-1,4,5,6-tetrahydro-7h-pyrazolo[3,4-c]pyridin-7-one](http://upload.wikimedia.org/wikipedia/commons/thumb/e/e1/PDB_2fzz_EBI.jpg/180px-PDB_2fzz_EBI.jpg)
![2g00: Factor Xa in complex with the inhibitor 3-(6-(2'-((dimethylamino)methyl)-4-biphenylyl)-7-oxo-3-(trifluoromethyl)-4,5,6,7-tetrahydro-1H-pyrazolo[3,4-c]pyridin-1-yl)benzamide](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b8/PDB_2g00_EBI.jpg/180px-PDB_2g00_EBI.jpg)