클로스트리디오이드 디피실리균 감염
Clostridioides difficile infection| 클로스트리디오이드 디피실리균 감염 | |
|---|---|
| 기타 이름 | C. difficile 관련 설사(CDAD), Clostridium difficile 감염, C. difficile colitis |
 | |
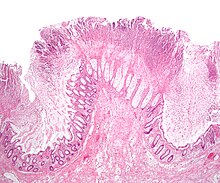
| 유사염색성대장염을 보이는 병리학적 시료 | |
| 전문 | 전염병 |
| 증상 | 설사, 발열, 메스꺼움, 복통[1] |
| 합병증 | 유사염, 독성 메가콜론, 대장 천공, 패혈증[1] |
| 원인들 | 분변-도덕 경로에[2] 의해 퍼진 클로스트리디오이드 디피실리케이트 |
| 위험요소 | 항생제, 양성자 펌프 억제제, 입원, 기타 건강 문제, 노령[1] |
| 진단법 | 대변 배양, 박테리아의 DNA 또는 독소[1] 검사 |
| 예방 | 손빨래, 말기실 병원[2] 청소 |
| 치료 | 메트로니다졸, 반코마이신, 피닥소미신, 분변 미생물 이식[1][3] |
| 빈도 | 45만3000명(2011년 미국)[2][4] |
| 죽음 | 29,000(미국)[2][4] |
클로스트리디움 디피실리균 감염이라고도 알려진 클로스트리디오이드 디피실리균 감염(CDI 또는 C-diff)은 포자 형성 박테리아 클로스트리디오이드 디피실리드로 인한 증상 감염이다.[2][6]증상은 묽은 설사, 발열, 메스꺼움, 복통 등이 있다.[1]항생제 관련 설사의 약 20%를 차지한다.[1]항생제는 장내 미세 생물체의 해로운 변화에 기여할 수 있다; 특히, 그것들은 삼투성 또는 물 설사를 유발하는 단사슬 지방산 흡수를 감소시킨다.[7]합병증은 유사성 대장염, 독성 메가콜론, 대장 천공, 패혈증을 포함할 수 있다.[1]null
Clostridioides difficile 감염은 대변에서 발견되는 박테리아 포자에 의해 퍼진다.[1]표면이 포자에 오염되어 의료 종사자의 손을 통해 추가적으로 확산될 수 있다.[1]감염의 위험요인으로는 항생제나 양성자 펌프 억제제 사용, 입원, 기타 건강 문제, 노령 등이 있다.[1]진단은 대변 배양이나 박테리아의 DNA나 독소에 대한 검사로 이루어진다.[1]만약 어떤 사람이 양성반응을 보였지만 아무런 증상이 없다면, 그 상태는 감염이라기 보다는 C. difficile collation으로 알려져 있다.[1]null
예방 활동으로는 병원 내 말기 방 청소, 항생제 사용 제한, 병원 내 손 씻기 운동 등이 있다.[2]알코올 기반 손 소독제는 효과가 없는 것 같다.[2]항생제가 중단되면 감염자의 약 20%에 3일 이내에 증상이 해소될 수 있다.[1]항생제 메트로니다졸, 반코마이신 또는 피닥소미신은 감염을 치료할 것이다.[1][3]증상이 해소된 이상 치료 후 재검사를 하지 않는 것이 좋으며, 이는 종종 식민지 상태로 남아 있을 수 있기 때문이다.[1]재발은 25%까지 보고되었다.[8]일부 잠정적인 증거는 분변 마이크로바이오타 이식과 프로바이오틱스가 재발 위험을 감소시킬 수 있다는 것을 보여준다.[2]null
C. 확산성 감염은 세계 모든 지역에서 발생한다.[9]2011년 미국에서 약 45만3000건이 발생해 2만9000명이 사망했다.[2][4]2001년과 2016년 사이에 전세계 질병 발생률이 증가했다.[2][9]C. 확산성 감염은 남성보다 여성에게 더 자주 발생한다.[2]이 박테리아는 1935년에 발견되었고 1978년에 질병을 일으키는 것으로 밝혀졌다.[9]미국에서 의료 관련 감염은 매년 15억 달러의 진료비를 증가시킨다.[10]C. difficile은 일반적인 건강관리 관련 감염이지만, 감염의 30%는 병원 내에서 전염된다.[11]대부분의 감염은 병원 밖에서 취득되는데, 여기서 약물과 최근의 설사병 이력(예: 살모넬라균에 의한 설사약 남용이나 식중독)이 식민지화의 위험을 몰고 온 것으로 생각된다.[12]null
징후 및 증상
CDI의 징후와 증상은 가벼운 설사에서부터 심각한 생명을 위협하는 대장 염증까지 다양하다.[13]null
성인의 경우 임상 예측 규칙에서 가장 좋은 징후는 상당한 설사("24시간 동안 부분적으로 형성된 3개 이상의 변이 새로 발생"), 최근의 항생제 노출, 복통, 발열(최대 40.5°C 또는 105°F) 및 말 거름을 닮은 변에 대한 독특한 악취가 있다는 것을 발견했다.[14]병원 인구에서, 이전 항생제 치료와 설사 또는 복통 등은 민감도가 86%, 특이도는 45%[15]로 나타났다.양성 세포독소 분석의 유병률이 14%인 본 연구에서 양성 예측 값은 18%, 음성 예측 값은 94%로 나타났다.null
소아에서 CDI의 가장 흔한 증상은 하루에 최소 3번 이상 배변을 하는 묽은 설사인데, 이는 발열, 식욕 저하, 메스꺼움 및/또는 복통을 동반할 수 있다.[16]감염이 심한 사람도 대장에 심각한 염증이 생기고 설사가 거의 또는 전혀 없을 수 있다.null
원인
C. difficile 박테리아에 감염되면 C. difficile disling의 원인이 된다.null
C. difficile

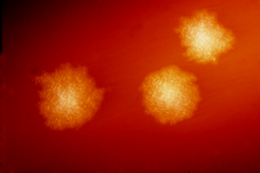
클로스트리디아는 혐기성 운동성 박테리아로, 자연에서는 어디서나 볼 수 있으며, 특히 토양에서 널리 퍼져 있다.현미경 아래, 그것들은 단자 끝에 불룩하게 생긴 길고 불규칙한 (흔히 드럼스틱이나 스핀들 모양의) 세포로 나타난다.그람 스테인 아래에서 C. difficile 세포는 그람 양성이며 산소가 없을 때 인체 온도에서 혈중 한천에서 최적의 성장을 보인다.스트레스를 받으면 활성세균이 견딜 수 없는 극한의 상태를 견딜 수 있는 포자를 만들어낸다.[17]null
C. difficile은 증상 없이 인간 대장을 식민지화할 수 있다. 인구 통계에 따라 상당히 다르지만 성인 인구의 약 2 - 5 퍼센트가 운송업자다.[17]식민지화의 위험은 관련 없는 설사 질환의 역사(예: 살모넬로증이나 비브리오 콜레라 감염에 의한 설사 남용과 식중독)와 연관되어 있다.[12]null
병원성 C. 확산성 변종은 여러 개의 독소를 생성한다.[18]가장 잘 특징지어지는 것은 엔토톡신(Clostridium difficile toxin A)과 세포톡신(Clostridium difficile toxin B)으로, 비록 상대적인 기여가 논란이 되었지만 감염자에게 설사와 염증을 일으킬 수 있다.[17]독소 A와 B는 GTPases의 Rho 계열을 대상으로 하여 불활성화하는 글루코실전달물질이다.독소 B(사이토톡신)는 낮은 분자질량 GTP 결합 Rho 단백질의 ADP-리보실레이션 감소와 상관관계가 있는 메커니즘에 의해 액틴 고결화를 유도한다.[19]또 다른 독소인 바이너리 독소도 설명됐지만 질병에서 그 역할을 제대로 파악하지 못하고 있다.[20]null
CDI의 항생제 처리는 항생제 내성과 박테리아의 생리학적 요인(포자 형성, 유사암브레인의 보호 효과)으로 인해 어려울 수 있다.[17]북아메리카에서 지리적으로 분산된 발병을 유발하고 있다고 알려진 시프로플록사신, 레보플록사신 등 플루오로퀴놀론 항생제에 내성이 있는 C. difficile의 새롭고 독성이 강한 변종이 2005년에 나타났다고 보고되었다.[21]애틀랜타에 있는 미국 질병통제예방센터는 독성, 항생제 내성, 또는 둘 다 증가된 전염병 변종의 출현을 경고했다.[22]null
C. difficile은 분변-도덕 경로에 의해 사람에서 사람으로 전달된다.이 유기체는 알코올을 이용한 손 세정제나 일반적인 표면 세정제에 의해 죽지 않는 내열성 포자를 형성한다.따라서 이러한 포자는 임상 환경에서 장기간 생존한다.이 때문에 이 박테리아는 거의 모든 표면에서 배양될 수 있다.일단 포자를 섭취하면, 그들의 내산성은 그들이 상처받지 않고 위를 통과할 수 있게 한다.담즙산에 노출되면 발아하여 대장의 식물성 세포로 증식한다.항생제 사용이나 설사 질환으로 인한 위장 장애 이력이 없는 사람은 C. difficile에 의해 식민지가 될 가능성이 적다.[12]null
2005년, 분자 분석은 제한 내분비 분석을 통해 그룹 BI로 특징지어지는 C. difficile 변형 유형을 식별하고, 펄스장 겔 전기영동증에 의한 북미 펄스장형 NAP1과 리보타입 027로 구분하였으며, 서로 다른 용어는 역학타입에 사용되는 주요 기법을 반영하였다.이 변형을 C. difficile BI/NAP1/027이라고 한다.[23]null
위험요소
항생제
C. difficile colitis는 이러한 항생제인 플루오로퀴놀론, 세팔로스포린, 그리고 클린다마이신의 사용과 가장 강하게 연관되어 있다.[24]null
일부 연구는 가축 사육에 항생제를 일상적으로 사용하는 것이 C. difficile과 같은 박테리아 감염의 발생에 기여하고 있다고 제안한다.[25]null
헬스케어 환경
의료 환경 밖의 감염은 증가하고 있지만 병원, 요양원 또는 [26]기타 의료기관에서 가장 자주 감염된다.개인이 대변에 오염된 물체나 표면을 만진 뒤 입이나 점막을 만지면 감염이 발생할 수 있다.의료 종사자들은 손 접촉을 통해 박테리아를 퍼뜨리거나 표면을 오염시킬 수 있다.[27]C. difficile 취득률은 최대 2주간 입원한 사람의 경우 13%, 4주 이상 입원한 사람의 경우 50%로 추정된다.[28]null
전년도 내 요양병원 장기입원이나 거주가 식민지화 증가에 따른 독립적인 위험요인이다.[29]null
산 억제 약품
지역사회에서 획득한 CDI의 증가율은 위산 생산을 억제하기 위한 의약품의 사용과 관련이 있다: H2 수용체 길항제는 위험을 1.5배 증가시켰고, 양성자 펌프 억제제는 1일 1회 사용 시 1.7배, 1회 이상 사용 시 2.4배 증가했다.[30][31]null
설사병
최근 설사병 이력이 있는 사람들은 이완제 남용과 위장병균을 포함한 포자에 노출되면 C. difficile에 의해 식민지가 될 위험이 높아진다.[12]장내 운동성을 증가시키는 장애는 일시적으로 이용 가능한 식이당의 농도를 상승시켜 C. 디피카일이 증식하여 내장에 발판을 마련할 수 있게 하는 것으로 생각된다.[32]비록 모든 식민지화 사건이 질병으로 이어지는 것은 아니지만, 무증상 운송업자들은 한 번에 몇 년씩 식민지를 유지한다.[12]이 기간 동안, C. difficile의 풍부함은 매일 상당히 다양하며, 지역사회에서 획득한 감염률에 실질적으로 기여할 수 있는 탈출을 증가시키는 기간을 야기한다.[12]null
기타
건강한 박테리아를 억제한 결과, 박테리아 식품 공급원의 상실을 통해, 원소 식단의 장기적 사용은 C. difficile 감염의 발생 위험을 증가시킨다.[33]혈청 알부민 수치가 낮으면 C. difficile 감염의 발병과 중증 질환에 감염될 때 위험인자가 된다.[34][35]혈청 알부민의 보호 효과는 C. difficile 독소 A와 독소 B를 결합하여 장내세포로의 진입을 방해하는 이 단백질의 능력과 관련이 있을 수 있다.[35]null
병리학
광폭 페니실린/세팔로스포린, 플루오로퀴놀론, 클린다마이신 등 전신 항생제를 사용하면 장의 정상적인 마이크로바이오타(microbiota)가 변하게 된다.특히, 항생제가 장에서 경쟁하는 다른 박테리아들을 죽일 때, 남아있는 박테리아는 공간과 영양소의 경쟁을 덜 하게 될 것이다.순효과는 특정 박테리아의 정상적 성장보다 더 광범위한 성장을 허용하는 것이다.C. difficile은 그런 종류의 박테리아 중 하나이다.C. difficile은 장에서 증식하는 것 외에 독소를 생성하기도 한다.독소 A나 독소 B가 없다면 C. 디피실리는 내장을 식민지화할 수 있지만 유사성 대장염을 일으킬 가능성은 낮다.[36]심한 감염과 연관된 대장염은 염증반응의 일부로서 염증세포, 피브린, 괴사세포의 점성 집합에 의해 형성되는 "사두샘브레인"이다.[17]null
진단
C. difficile 독소를 검출하기 위한 테스트가 등장하기 전, 대장내시경이나 s자형내시경으로 진단이 이루어지는 경우가 가장 많았다.결장이나 직장의 점막에 '시사체'가 나타나는 것은 시사하는 바가 크지만 상태를 진단하는 것은 아니다.[37]가성비는 염증성 파편인 백혈구로 만들어진 분출물로 구성되어 있다.대장내시경과 S자형내시경 검사를 여전히 채택하고 있지만, 이제는 C. difficile 독소의 유무를 위한 대변 검사가 종종 1차 진단 접근법이다.보통 두 개의 독소(독소 A와 독소 B)만 검사되지만 이 유기체는 다른 여러 개의 독소를 생산한다.이 테스트는 100% 정확하지 않으며 반복 테스트에도 상당한 거짓 음성 비율이 있다.null
세포독성 검사
C. difficile 독소는 세포 배양에서 세포질 효과를 가지고 있으며, 특정 항균제로 관찰된 효과의 중성화는 새로운 CDI 진단 기법을 연구하는 연구에 대한 실질적인 금 표준이다.[17]유기체가 선택적 매체에서 배양되어 독소 생성 검사를 받는 독성유전성 배양균은 느리고 노동집약적이긴 하지만 금본위제로 남아 가장 민감하고 구체적인 검사다.[38]null
독소 ELISA
독소 A 또는 B(또는 둘 다)에 대한 효소연계 면역항암제(ELISA)에 의한 A 및 B 독소의 평가는 민감도가 63~99%, 특이도는 93~100%이다.null
앞서 전문가들은 초기 검사에서 음성일 경우 질병을 배제하기 위해 대변 검체를 3개까지 보낼 것을 권고했지만, 같은 설사 기간 중 반복 검사를 하는 것은 가치가 제한적이므로 금기시해야 한다는 증거가 제시됐다.[39]C. difficile 독소는 치료가 효과적이라면 이전에 감염된 사람의 대변에서 제거되어야 한다.많은 병원들은 널리 퍼진 독소 A에 대해서만 검사를 한다.그러나 현재 많은 병원에는 B독소만을 나타내는 균주가 존재하기 때문에 두 독소에 대한 검사가 이루어져야 한다.[40][41]두 가지 모두에 대한 시험을 하지 않으면 실험실 결과의 획득이 지연될 수 있으며, 이는 종종 장기간의 질병과 나쁜 결과의 원인이 된다.null
기타 대변 테스트
대변 백혈구 측정과 대변 락토페린 수치도 진단 테스트로 제안되었지만 진단 정확도가 제한적일 수 있다.[42]null
PCR
실시간 중합효소 연쇄반응에 의한 대변 검체 시험은 C. diffile의 약 93%를 검출할 수 있으며, 양성이 약 3%의 시간 동안 잘못 양성일 경우 검출할 수 있다.[43]이것은 세포독성유전자 배양이나 세포독성 검사보다 더 정확하다.[43]또 다른 장점은 3시간 이내에 결과를 얻을 수 있다는 것이다.[43]단점으로는 비용이 더 많이 들고 검사에서 독소 자체가 아닌 독소의 유전자만을 찾는다는 점이 있다.[43]후자는 확인 없이 검사를 사용할 경우 과진단이 발생할 수 있다는 뜻이다.[43]반복 검사는 오해의 소지가 있을 수 있으며 새로운 증상이 없는 사람에게 7일에 한 번 이상 검체를 검사하면 유용한 정보를 얻을 가능성이 매우 낮다.[44]null
예방
C. difficile의 확산을 막기 위해서는 개인 방에 사람들을 수용하는 자가 격납이 중요하다.[45]접촉 예방조치는 C. difficile의 확산을 막는 중요한 부분이다.C. difficile은 항생제를 복용하지 않는 사람들에게서 자주 발생하지 않기 때문에 항생제의 사용을 제한하는 것은 위험을 감소시킨다.[46]null
항생제
CDI를 예방하는 가장 효과적인 방법은 적절한 항생제 처방이다.CDI가 가장 흔한 병원 환경에서는 CDI를 개발하는 대부분의 사람들이 항생제에 노출되어 있다.적절한 항생제 처방이 적극 권장되지만 약 50%는 부적절하다고 판단된다.이것은 병원, 클리닉, 커뮤니티, 또는 학문적 환경 중 어느 곳에서든 일관된다.항생제를 제한하거나 일반적으로 불필요한 처방을 제한함으로써 CDI의 감소는 CDI 감소와 가장 큰 관련이 있는 것으로 입증되었다.게다가, 의약품에 대한 반응은 심각할 수 있다: CDI 감염은 2011년 미국 병원에서 볼 수 있는 의약품 부작용의 가장 흔한 원인이었다.[47]영국의 일부 지역에서는, 플루오로퀴놀론 항생제의 사용이 줄면 CDI의 감소로 이어질 것으로 보인다.[48]
프로바이오틱스
일부 증거는 프로바이오틱스가 감염과 재발을 예방하는 데 유용할 수 있다는 것을 보여준다.[49][50]C. difficile로 면역항암제를 투여하지 않은 경우 사카로마이오스 불라르디균을 이용한 치료도 유용할 수 있다.[51][52]당초 2010년 미국감염병학회는 합병증의 위험성을 이유로 사용을 금지할 것을 권고했다.[49][51]그러나 그 후의 검토에서는 치료로 인한 부작용의 증가를 발견하지 못했으며,[50] 전반적인 치료는 안전하고 적당하게 클로스트리디움 디피실리튬 관련 설사를 예방하는 데 효과가 있는 것으로 보인다.[53]null
특히 한 연구에서는 3,631명의 외래환자에서 항생제 관련 설사(AAD)의 위험을 51% 감소시켜 프로바이오틱스의 '보호효과'가 있는 것으로 나타나지만, 대상자의 감염 유형을 특정하지 않은 것이 중요하다.[54]요거트, 알약, 건강보조식품은 사람들이 이용할 수 있는 프로바이오틱스의 몇 가지 예에 불과하다.null
감염관리
이러한 전염 위험을 최소화하기 위해서는 엄격한 감염 프로토콜이 필요하다.[55]CDI를 가진 1인용 장갑과 비중요 의료기기를 착용하는 등 감염관리 조치가 예방에 효과적이다.[56]이것은 병원 환경에서 C. difficile의 확산을 제한함으로써 작용한다.또 비누와 물로 씻으면 오염된 손의 포자가 씻겨 나가지만 알코올에 의한 손 문지르는 효과가 없다.[57]이러한 주의사항은 설사가 멈춘 후 최소 2일 동안 병원에 있는 사람들 사이에서 유지되어야 한다.[58]null
차아염소산나트륨 0.55%가 함유된 표백제 물티슈는 포자를 죽이고 전염을 막는 것으로 나타났다.[59]뚜껑이 있는 화장실을 설치하고 플러싱에 앞서 뚜껑을 닫는 것도 오염 위험을 줄여준다.[60]null
CDI를 가지고 있는 사람들은 CDI가 있는 다른 사람들과 함께 방에 있거나 병원에 있을 때 혼자 있어야 한다.[56]null
일반적인 병원 소독제는 C. difficile 포자에 효과가 없어 포자 형성을 촉진할 수 있지만, 다양한 산화제(예: 차아염소산나트륨용액)는 포자를 빠르게 파괴한다.[61]치료 완료 후 실내 소독에 사용되는 과산화수소 증기(HPV) 시스템은 감염률을 낮추고 타인에 대한 감염 위험을 줄이는 것으로 나타났다.CDI 발생률은 HPV의 사용을 통해 53%[62] 또는 42%[63] 감소하였다.퇴원 후 C. difficile이 있는 사람들의 방을 소독하는 데 특히 전념하는 자외선 청소 장치 및 하우스키핑 직원이 효과적일 수 있다.[64]null
치료
증상 없이 C. diffile을 운반하는 것은 흔한 일이다.증상이 없는 사람의 치료는 논란의 여지가 있다.일반적으로 경미한 경우는 구체적인 치료가 필요하지 않다.[3][17]구강 수분 보충 요법은 설사와 관련된 탈수증을 치료하는데 유용하다.null
약물
C. difficile에는 여러 가지 다른 항생제가 사용되는데, 사용 가능한 약제는 어느 정도 균등하게 효과적이다.[65]null
반코마이신 또는 구강별 피닥소미신은 보통 경증, 보통, 심각한 감염에 권장된다.[66]특히 메트로니다졸이 선천성 결함을 유발할 수 있기 때문에 임산부에게는 또한 첫 번째 치료법이다.[67]전형적인 밴코마이신은 하루에 4번 입으로 10일간 복용한다.[67]그것은 또한 일레우스를 발달시킨다면 정직하게 주어질 수 있다.[66]null
피닥소미신은 밴코마이신뿐만 아니라 용인되며 재발 위험이 낮을 수 있다.[68][65]피닥소미신은 경증에서 중증인 경우 반코마이신만큼 효과가 있는 것으로 나타났으며, 중증인 경우 반코마이신보다 효과가 좋을 수 있다.[3][69]피닥소미신은 재발성 감염이 있고 다른 항생제에 반응하지 않은 사람에게 사용될 수 있다.[69]구강별 메트로니다졸은 대상자가 1차 치료제에 알레르기가 있거나, 참을 수 없거나, 재정적인 어려움이 있을 때에만 C. 디피실 감염에 대한 대체 치료법으로 추천된다.[66][70]완치성 질환에서는 입으로 하는 반코마이신과 정맥주사로 쓰이는 메트로니다졸이 흔히 함께 사용된다.[66]null
로페라마이드와 같이 설사를 늦추거나 멈추기 위해 사용되는 약들은 C. difficile 질환을 악화시킬 가능성이 있다고 생각되어 왔으며, 일반적으로 권장되지는 않는다.[71]그러나 사용과 함께 더 나쁜 결과를 뒷받침할 증거는 불충분하다.[72]이온교환수지인 콜레슈티라민은 독소 A와 B 모두를 결합시켜 장운동성을 늦추고 탈수 예방에 효과가 있다.[73]반코마이신에는 콜레스토레라민이 권장된다.면역억제를 받은 사람들의 마지막 치료법은 정맥주사 면역글로불린이다.[73]C. difficile 독소 A와 C. difficile 독소 B에 대한 단핵항체는 belzlotoxumab을 포함한 C. difficile 감염의 재발을 방지하기 위해 승인되었다.[74]null
프로바이오틱스
활성 질환 치료에 프로바이오틱스의 사용을 뒷받침할 증거가 불충분하다.[51][75][76][77]연구원들은 최근에 분변에서 유래된 제품에 대한 기계적 접근법을 취하기 시작했다.7α-데히드록실라아제 활동을 하는 특정 미생물은 1차 담즙산부터 2차 담즙산까지 대사작용을 할 수 있어 C. 디피실리를 억제할 수 있다고 알려져 있다.따라서 이러한 미생물을 프로바이오틱스와 같은 치료용 제품에 통합하는 것은 더 많은 임상 전 조사가 필요하지만 보호적일 수 있다.[78]null
대변 이식
대변 이식이라고도 알려진 배설물 마이크로바이오타 이식은 항생제가 효과가 없는 사람에게 약 85%에서 90% 효과적이다.[79][80]건강한 기증자의 대변에서 얻은 미생물 미생물(microbiota)을 주입해 반복적인 감염의 원인이 되는 세균 불균형을 반전시키는 것이다.[81]이 절차는 항생제로 소실되었던 정상적인 대장균 마이크로바이오타를 보충하고, 클로스트리디오이드 디피실리에 의한 식민지화에 대한 저항력을 다시 확립한다.[82]적어도 초기에는 부작용이 거의 없다.[80]null
일부 증거는 대변 이식이 알약 형태로 전달될 수 있다는 희망을 갖고 있다.[83]이 제품들은 미국에서 구입할 수 있지만 2015년 현재 FDA 승인을 받지 못했다.[84]null
수술
심한 C. difficile colitis를 가진 사람들의 경우, 결장 절제술은 결과를 향상시킬 수 있다.[85]수술에서 누가 가장 많은 혜택을 받을지 결정하기 위해 구체적인 기준을 사용할 수 있다.[86]null
재발 감염
재발성 CDI는 환자의 20~30%에서 발생하며, 이후 에피소드마다 재발률이 높아진다.[87]임상 환경에서는 새로운 변종의 결과인 C. difficile 대 재감염의 동일한 변종을 가진 CDI의 재발로 발전하는 재발을 사실상 구별할 수 없다.null
재발 C 확산성 감염에 대한 몇 가지 치료 방법이 있다.2017 IDSA 가이드라인은 재발 C 디피실리 감염의 첫 번째 에피소드에 메트로니다졸을 초기 에피소드에 사용했다면 매일 4회 125mg의 용량으로 경구용 밴코마이신을 10일간 권장하고 있다.초기 에피소드에 구강 반코마이신을 사용한 경우, 10-14일 동안 매일 4회 125mg의 구강 반코마이신 맥박 장기 투여 후 테이퍼(1주일간 매일 2회, 2-8주 동안 2~3일마다 2회) 또는 피닥소미신 200mg을 10일 동안 매일 2회 복용한다.IDSA는 앞서 언급한 경구 반코마이신 맥박 선량에 이어 경구 반코마이신 맥박선량, 경구 반코마이신 125mg, 경구 반코마이신 125mg, 경구 반코마이신 400mg, 매일 3회씩 20일간 3회, 피닥소미신 200mg, 대변 마이크로바이오타 이식 등의 옵션을 권고하고 있다.[70]null
전통적인 항생제 요법으로 해결하지 못하는 C. diff 감염 환자들의 경우 분변 마이크로바이옴 이식은 평균 90% 이상의 [88]치료율을 자랑한다.317명의 환자를 대상으로 한 심사에서 92%의 지속적·재발성 질환 사례에서 해결로 이어지는 것으로 나타났다.[89]반복적인 CDI에 대항하는 투쟁에서 장내 동식물 복원이 가장 중요하다는 것은 분명하다.효과적인 항생제 치료를 통해 자연 미생물 집단이 회복됨에 따라 C. diffile을 줄일 수 있고 시간이 지남에 따라 자연적 식민지화 저항력이 발달할 수 있다.이 과정이 완료되기 전에 재감염 또는 재발이 발생할 수 있다.분변 미생물 이식은 실종된 미생물 공동체 구성원을 직접 교체함으로써 이러한 회복을 촉진할 수 있다.[90]그러나 인간이 낳은 배설물은 표준화가 어렵고 감염물질의 이전, 장에 이물질을 접종하는 장기적 결과 등 여러 가지 잠재적 위험이 있다.그 결과, FMT의 장기적인 유효성과를 연구하기 위해서는 추가 연구가 필요하다.
예후
메트로니다졸이나 반코마이신 으로 첫 치료를 받은 후 C. difficile은 약 20%의 사람들에게 재발한다.이는 이후 재발과 함께 40%, 60%로 증가한다.[91]null
역학
C. difficile 설사는 매년 10만 명 중 8명에게서 발생하는 것으로 추정된다.[92]입원 환자 중에서는 1000명당 4~8명꼴로 발생한다.[92]2011년, 미국에서 약 50만 명의 감염과 29,000명의 사망자를 낳았다.[4]null
부분적으로 플루오로퀴놀론 내성 변종의 출현으로 C. difficile 관련 사망자는 미국에서 2000년부터 2007년 사이에 400% 증가했다.[93]CDC에 따르면 "C. difficile은 미국 병원에서 의료 관련 감염의 가장 흔한 미생물 원인이 되었고 급성 치료 시설에만 매년 48억달러의 초과 의료비가 든다"[94]고 한다.
역사
이반 C. 홀과 엘리자베스 오툴은 이 박테리아를 1935년에 처음으로 박테리아 이름을 바실러스 디피실리스라고 지었는데, 이 박테리아는 초기 고립 시도에 저항력이 있었고 문화적으로 매우 느리게 성장했기 때문에 이 박테리아를 특정한 별칭으로 선택했다.[91][95]안드레 로맹 프레보트는 이후 그것을 클로스트리디움속(Clostridium)으로 옮겼고, 그로 인해 이너멘성 클로스트리디움(Clostridium)이 확산되었다.[96][97]그 조합은 후에 새로운 속 클로스트리디오이드로 옮겨진 후 클로스트리디오데스 디피실레로 변경되었다.[98]null
가성 대장염은 1978년 가성 대장염을 앓는 사람들과 독소가 격리되고 코흐의 체질이 충족되면서 C. difficile 감염의 합병증으로 처음 설명되었다.[99]null
주목할 만한 발병
- 2003년 6월 4일, 퀘벡 주 몬트리올과 알버타 주 캘거리에서 이 박테리아의 매우 치명적인 변종이 두 번 발생했다고 보고되었다.소식통들은 사망자 수를 2003년과 2004년 처음 몇 달 이내에 약 1,400명 정도로 집계하여 사망자 수를 36명, 89명으로 줄였다.CDI는 2004년 말 퀘벡 의료 시스템에서 계속 문제가 되었다.2005년 3월 현재 토론토 지역으로 퍼져 10명이 입원했다.한 명은 다른 사람들이 퇴원하는 동안 죽었다.
- 2003년과 2005년 사이에 영국의 스토크 맨데빌 병원에서도 비슷한 발병 사례가 발생했다.C. difficile의 국소 역학 연구는 환자가 병원 및/또는 재활 센터에서 보내는 시간과 그 확산이 어떻게 관련될 수 있는지에 대한 단서를 제공할 수 있다.또한 증가된 비율을 탐지할 수 있는 기관의 능력, 그리고 그들의 대응 능력을 보다 공격적인 손 씻기 운동, 검역 방법, 그리고 감염의 위험에 처한 환자에게 살아있는 문화를 함유한 요구르트의 사용 가능성으로 샘플링한다.
- 캐나다인과 영국인 모두 이 박테리아의 더 치명적인 변종 NAP1/027과 관련이 있을 수 있다.퀘벡 변종으로 알려진 이 바이러스는 네덜란드 병원 두 곳에서 전염병에 연루되었다(하더바이크와 아머스포트, 두 곳 모두 2005년).027의 증가된 독성을 설명하기 위한 이론은 독소 A와 B의 초생산자이며 특정 항생제가 박테리아를 자극하여 과잉생산을 할 수 있다는 것이다.
- 국립보건원 조사에 따르면 2006년 10월 1일 영국 레스터의 병원에서 8개월 이상 C. difficile이 최소 49명의 목숨을 앗아간 것으로 알려졌다.또 다른 29건의 유사한 사건들은 검시관들에 의해 조사되었다.[100]영국 보건부 메모가 그 직후에 유출된 한 메모는 "보건서비스 전반에 걸쳐서 풍토병"[101]이라고 묘사되는 이 박테리아에 대한 정부 내 상당한 우려를 드러냈다.
- 2006년 10월 27일, 9명의 사망자가 퀘벡의 박테리아에 기인했다.[102]
- 2006년 11월 18일, 이 박테리아는 퀘벡에서 12명의 사망자를 낸 것으로 보고되었다.이번 12번째 보고된 사망은 세인트루이스가 죽은 지 이틀밖에 되지 않았다.히아신테의 호노레 메르시어는 발병이 통제되고 있다고 발표했다.31명이 CDI 진단을 받았다.청소부들은 발병을 막기 위해 조치를 취했다.[103]
- C. difficile은 2006년 영국에서 6,480건의 사망진단서에 언급되었다.[104]
- 2007년 2월 27일, 온타리오주 미시소가의 트릴리움 보건소에서 새로운 발병 사례가 확인되어 14명이 CDI 진단을 받았다.그 박테리아는 퀘벡에 있는 박테리아와 같은 종류의 박테리아였다.관계자들은 지난 두 달 동안 4명의 사망에 C. difficile이 책임이 있는지 여부를 확인할 수 없었다.[105]
- 2007년 2월부터 6월 사이에 아일랜드 더블린의 로플린스타운 병원에서 3명이 C. difficile 감염의 결과로 검시관에 의해 사망한 것이 발견되었다.검시 결과, 검시소는 병원에 지정된 감염관리팀이나 컨설턴트 미생물학자가 없는 것으로 밝혀졌다.[106]
- 2007년 6월부터 2008년 8월까지 북아일랜드, 앤트림 지역, 브레이드 밸리, 미드 울스터 병원 등이 조사 대상이었다.조사 중에, 전문가 검토자들은 C. diffile이 이러한 사망 중 31명, 15명의 근본적인 원인, 16명의 원인이 되는 원인으로 연루되었다고 결론지었다.그 기간 동안, 검토는 또한 병원에서 치료 중인 CDI의 375개 사례에 주목했다.[107]
- 2007년 10월, 메이드스톤과 툰브리지 웰스 NHS 트러스트는 2004년 4월부터 2006년 9월까지 켄트에 있는 병원에서 발생한 C. 디피실리의 주요 발생을 처리한 것에 대해 보건 위원회로부터 심한 비난을 받았다.위원회는 보고서에서 약 90명의 사람들이 감염의 결과로 "확실히 또는 아마도" 사망했다고 추정했다.[108][109]
- 2007년 11월, 027 변종은 핀란드 남부 여러 병원에 퍼졌고, 2007-12-14년 115명의 감염자 중 10명이 사망했다고 보고되었다.[110]
- 2009년 11월 아일랜드 루르드 병원의 우리 성모병원에서 4명의 사망자가 CDI와 연관될 가능성이 있다. 추가적으로 12명의 사람들이 감염 양성반응을 보였으며, 또 다른 20명의 사람들이 감염의 징후를 보였다.[111]
- 2009년 2월부터 2010년 2월까지 덴마크의 헤르레브 병원에서 199명이 027종 바이러스에 감염된 것으로 의심되었다.2009년 상반기에 코펜하겐의 병원에서 29명이 박테리아에 감염된 후 사망했다.[112]
- 2010년 5월 덴마크의 4개 병원에서 총 138명이 027종양에 감염되었고 다른 병원에서도 일부 격리된 경우가 있었다.[114]
- 2010년 5월, 14명의 사망자가 호주 빅토리아주의 박테리아와 관련되어 있었다.2년 후 뉴질랜드에서도 같은 종류의 박테리아가 검출되었다.[115]
- 2011년 5월 28일, 온타리오에서 발생한 발병이 보고되었으며, 2011년 7월 24일 현재 26명이 사망하였다.[116]
- 2012/2013년 스웨덴 남부(Ystad)의 한 병원에서 총 27명이 사망해 10명이 사망했다.5명은 변종 017로 사망했다.[117]
어원과 발음
속명은 그리스 클로스스트르(κλωωτ), '스핀들([118]spindle)'에서 따왔으며, 구체적인 명칭은 교양에 대한 까다로움과 관련하여 선택한 라틴어 difficile, 중성적인 difficilis의 단수형 '어렵고 완고함'[119]에서 따왔다.null
현재 및 이전 속배정의 발음과 관련하여 클로스트리디오이데스는 /klɒstrdidiɪdis/이고 클로스트리디움(Clostridium)은 /klɒstrdidiəm/이다.두 제네랄은 여전히 그들에게 할당된 종을 가지고 있지만, 이 종은 현재 전자에 분류되어 있다.이항명칭의 규범을 통해 이종의 옛 이항명칭이 지금은 가명으로 이해된다.null
특정 이름에 대해 /dɪˈfɪsɪli[120]의 전통 규범, 비록 /dɪˈfɪkɪleɪ/의 복원된 발음 역시 때때로(고전 라틴어 발음reconstructe된다 어떻게 의료 영어 보통(는 교대로 주로 라틴어의 전통적인 영어 발음을 반영하는 것), 귀화한 근세 라틴어 단어 발음을 반영한다.d로[kloːsˈtrɪdd.ũː dɪfˈfɪkɪlɛ])).마치 프랑스어, 시효에 의해 취득한 관점의" 틀린 발음"[120]지만 너무 광범위하게 의료 전문가들 사이에 사용되는 언어학적으로 기술적 관점에서 잘못된 것으로 설명될 수 없는 특정 이름 또한 흔히 /ˌdiːfiˈsiːl/, 지키고,"그non-preferred 변형"로 묘사될 수 있게 발음된다.그새로운 라틴어 고유 명칭에는 라틴어 이외의 발음이 개입될 정도로 광범위한 Extra Latin 뿌리(성명과 기수적 참조 포함)가 포함되어 있지만(예를 들어, 바 험부기, 스펀지폼파탕티시 등)는 이항식 명칭에서 뉴 라틴어를 가장 규칙적으로 고수하는 관점 또한 유효하다., 그리고 수백 개의 다른 것.null
리서치
- 2019년 현재 C. difficile toxin A, C. difficile toxin B에 대한 면역력을 제공하는 백신 후보군이 임상 연구에서 가장 많이 진보했지만 세균의 군집을 막지는 못하고 있다.[121]화이저의 백신 후보는 2021년 9월 완료로 추정되는 임상 3상, 글락소스미스클라인의 백신 후보는 2021년 7월 완료로 추정되는 임상 1상이다.[122][123]
- CDA-1 and CDB-1 (also known as MDX-066/MDX-1388 and MBL-CDA1/MBL-CDB1) is an investigational, monoclonal antibody combination co-developed by Medarex and Massachusetts Biologic Laboratories (MBL) to target and neutralize C. difficile toxins A and B, for the treatment of CDI.Merck & Co.는 2009년 4월에 체결된 독점 라이선스 계약을 통해 CDA-1과 CDB-1을 개발하고 상용화할 수 있는 전세계적인 권리를 획득했다.CDI를 치료하기 위해 기존 항생제 중 하나에 대한 추가요법으로 고안된 것이다.[124][125][126]
- 니타즈옥사니드는 항정신병 약물(Cryptosporidium parvum과 Giardia 람블리아에 의한 전염성 설사 치료를 위해 FDA가 승인함)으로 표시된 합성 니트로시아졸릴 살리실아미드 파생물질로 현재 C. diffile 감염 대 반코마이신에서도 연구되고 있다.[127]
- 리팍스민([127]Rifaxmin)은 CDI를 위한 임상 단계 반시스테틱, 리파마이신 기반의 비시스템 항생제다.감염성 설사 치료를 위해 FDA 승인을 받았으며, 현재 살릭스제약이 개발하고 있다.
- CDI 치료를 위한 다른 약으로는 리팔라질,[127] 티게시클린,[127] 라모플라닌,[127] 리디닐라졸, SQ641 등이 개발 중에 있다.[128]
- 연구는 부록이 C. difficile에 어떤 중요성이 있는지 연구해왔다.부록은 좋은 내장을 수용하는 기능을 가지고 있다고 생각된다.2011년 실시된 연구에서 C. difficile 박테리아가 내장에 유입되었을 때, 맹장에는 신체의 항체 반응을 증가시키는 세포가 수용된 것으로 나타났다.부록의 B 세포는 독소 A 특이 IgA 및 IgG 항체를 이동, 성숙 및 증산하여 C. difficile 박테리아에 대항하여 좋은 장내 식물체가 생존할 확률을 증가시킨다.[129]
- 감염 후 독성이 없는 종류의 C. difficile을 복용하는 것은 향후 감염 예방과 관련하여 유망한 결과를 가지고 있다.[130]
- 특정 독소를 생성하는 C difficile 변종에 대해 지시된 박테리오파지를 이용한 치료도 또한 시험되고 있다.[70]
- 2017년의 한 연구는 식단에서 중증 질병과 트레할로스를 연관시켰다.[131]
다른동물
- 대장염-X(말 속)
참조
- ^ a b c d e f g h i j k l m n o p "Frequently Asked Questions about Clostridium difficile for Healthcare Providers". CDC. 6 March 2012. Archived from the original on 2 September 2016. Retrieved 5 September 2016.
- ^ a b c d e f g h i j k Butler M, Olson A, Drekonja D, Shaukat A, Schwehr N, Shippee N, Wilt TJ (March 2016). "Early Diagnosis, Prevention, and Treatment of Clostridium difficile: Update". AHRQ Comparative Effectiveness Reviews.: vi, 1. PMID 27148613.
- ^ a b c d Nelson RL, Suda KJ, Evans CT (March 2017). "Antibiotic treatment for Clostridium difficile-associated diarrhoea in adults". The Cochrane Database of Systematic Reviews. 3: CD004610. doi:10.1002/14651858.CD004610.pub5. PMC 6464548. PMID 28257555.
- ^ a b c d Lessa FC, Mu Y, Bamberg WM, Beldavs ZG, Dumyati GK, Dunn JR, et al. (February 2015). "Burden of Clostridium difficile infection in the United States". The New England Journal of Medicine. 372 (9): 825–34. doi:10.1056/NEJMoa1408913. PMID 25714160.
- ^ 분류학로슨 외 연구진(2016년).NCBI. https://www.ncbi.nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi?mode=Info&id=1496&lvl=3&lin=f&keep=1&srchmode=1&unlock
- ^ Guh AY, Kutty PK (October 2018). "Clostridioides difficile Infection". Annals of Internal Medicine. 169 (7): ITC49–ITC64. doi:10.7326/AITC201810020. PMC 6524133. PMID 30285209.
- ^ Mullish BH, Williams HR (June 2018). "Clostridium difficile infection and antibiotic-associated diarrhoea". Clinical Medicine. 18 (3): 237–241. doi:10.7861/clinmedicine.18-3-237. PMC 6334067. PMID 29858434.
- ^ Long SS, Pickering LK, Prober CG (2012). Principles and Practice of Pediatric Infectious Diseases (4th ed.). Elsevier Health Sciences. p. 979. ISBN 978-1455739851. Archived from the original on 14 September 2016.
- ^ a b c Lessa FC, Gould CV, McDonald LC (August 2012). "Current status of Clostridium difficile infection epidemiology". Clinical Infectious Diseases. 55 Suppl 2: S65-70. doi:10.1093/cid/cis319. PMC 3388017. PMID 22752867.
- ^ Leffler DA, Lamont JT (April 2015). "Clostridium difficile infection". The New England Journal of Medicine. 372 (16): 1539–48. doi:10.1056/NEJMra1403772. PMID 25875259. S2CID 2536693.
- ^ Eyre DW, Cule ML, Wilson DJ, Griffiths D, Vaughan A, O'Connor L, et al. (September 2013). "Diverse sources of C. difficile infection identified on whole-genome sequencing". The New England Journal of Medicine. 369 (13): 1195–205. doi:10.1056/NEJMoa1216064. PMC 3868928. PMID 24066741.
- ^ a b c d e f VanInsberghe D, Elsherbini JA, Varian B, Poutahidis T, Erdman S, Polz MF (April 2020). "Diarrhoeal events can trigger long-term Clostridium difficile colonization with recurrent blooms". Nature Microbiology. 5 (4): 642–650. doi:10.1038/s41564-020-0668-2. PMID 32042128. S2CID 211074075.
- ^ Joshi NM, Macken L, Rampton DS (December 2012). "Inpatient diarrhoea and Clostridium difficile infection". Clinical Medicine. 12 (6): 583–8. doi:10.7861/clinmedicine.12-6-583. PMC 5922602. PMID 23342416.
- ^ Bomers MK, Menke FP, Savage RS, Vandenbroucke-Grauls CM, van Agtmael MA, Covington JA, Smulders YM (April 2015). "Rapid, accurate, and on-site detection of C. difficile in stool samples". The American Journal of Gastroenterology. 110 (4): 588–94. doi:10.1038/ajg.2015.90. PMID 25823766. S2CID 3051623.
- ^ Katz DA, Lynch ME, Littenberg B (May 1996). "Clinical prediction rules to optimize cytotoxin testing for Clostridium difficile in hospitalized patients with diarrhea". The American Journal of Medicine. 100 (5): 487–95. doi:10.1016/S0002-9343(95)00016-X. PMID 8644759.
- ^ Moreno MA, Furtner F, Rivara FP (June 2013). "Clostridium difficile: a cause of diarrhea in children". JAMA Pediatrics. 167 (6): 592. doi:10.1001/jamapediatrics.2013.2551. PMID 23733223.
- ^ a b c d e f g Ryan KJ, Ray CG, eds. (2004). Sherris Medical Microbiology (4th ed.). McGraw Hill. pp. 322–4. ISBN 978-0-8385-8529-0.
- ^ Di Bella S, Ascenzi P, Siarakas S, Petrosillo N, di Masi A (May 2016). "Clostridium difficile Toxins A and B: Insights into Pathogenic Properties and Extraintestinal Effects". Toxins. 8 (5): 134. doi:10.3390/toxins8050134. PMC 4885049. PMID 27153087.
- ^ Just I, Selzer J, von Eichel-Streiber C, Aktories K (March 1995). "The low molecular mass GTP-binding protein Rho is affected by toxin A from Clostridium difficile". The Journal of Clinical Investigation. 95 (3): 1026–31. doi:10.1172/JCI117747. PMC 441436. PMID 7883950.
- ^ Barth H, Aktories K, Popoff MR, Stiles BG (September 2004). "Binary bacterial toxins: biochemistry, biology, and applications of common Clostridium and Bacillus proteins". Microbiology and Molecular Biology Reviews. 68 (3): 373–402, table of contents. doi:10.1128/MMBR.68.3.373-402.2004. PMC 515256. PMID 15353562.
- ^ Loo VG, Poirier L, Miller MA, Oughton M, Libman MD, Michaud S, et al. (December 2005). "A predominantly clonal multi-institutional outbreak of Clostridium difficile-associated diarrhea with high morbidity and mortality". The New England Journal of Medicine. 353 (23): 2442–9. doi:10.1056/NEJMoa051639. PMID 16322602. S2CID 14818750.
- ^ McDonald LC (August 2005). "Clostridium difficile: responding to a new threat from an old enemy" (PDF). Infection Control and Hospital Epidemiology. 26 (8): 672–5. doi:10.1086/502600. PMID 16156321. S2CID 44919184. Archived (PDF) from the original on 4 June 2011.
- ^ Rupnik M, Wilcox MH, Gerding DN (July 2009). "Clostridium difficile infection: new developments in epidemiology and pathogenesis". Nature Reviews. Microbiology. 7 (7): 526–36. doi:10.1038/nrmicro2164. PMID 19528959. S2CID 23376891.
- ^ Luciano JA, Zuckerbraun BS (December 2014). "Clostridium difficile infection: prevention, treatment, and surgical management". The Surgical Clinics of North America. 94 (6): 1335–49. doi:10.1016/j.suc.2014.08.006. PMID 25440127.
- ^ "Scientists probe whether C. difficile is linked to eating meat". CBC News. 4 October 2006. Archived from the original on 24 October 2006.
- ^ Dumyati G, Stone ND, Nace DA, Crnich CJ, Jump RL (April 2017). "Challenges and Strategies for Prevention of Multidrug-Resistant Organism Transmission in Nursing Homes". Current Infectious Disease Reports. 19 (4): 18. doi:10.1007/s11908-017-0576-7. PMC 5382184. PMID 28382547.
- ^ "Clostridium difficile Infection Information for Patients HAI CDC". www.cdc.gov. Archived from the original on 30 March 2017. Retrieved 19 April 2017.
- ^ Clabots CR, Johnson S, Olson MM, Peterson LR, Gerding DN (September 1992). "Acquisition of Clostridium difficile by hospitalized patients: evidence for colonized new admissions as a source of infection". The Journal of Infectious Diseases. 166 (3): 561–7. doi:10.1093/infdis/166.3.561. PMID 1323621.
- ^ Halsey J (April 2008). "Current and future treatment modalities for Clostridium difficile-associated disease". American Journal of Health-System Pharmacy. 65 (8): 705–15. doi:10.2146/ajhp070077. PMID 18387898.
- ^ Howell MD, Novack V, Grgurich P, Soulliard D, Novack L, Pencina M, Talmor D (May 2010). "Iatrogenic gastric acid suppression and the risk of nosocomial Clostridium difficile infection". Archives of Internal Medicine. 170 (9): 784–90. doi:10.1001/archinternmed.2010.89. PMID 20458086.
- ^ Deshpande A, Pant C, Pasupuleti V, Rolston DD, Jain A, Deshpande N, et al. (March 2012). "Association between proton pump inhibitor therapy and Clostridium difficile infection in a meta-analysis". Clinical Gastroenterology and Hepatology. 10 (3): 225–33. doi:10.1016/j.cgh.2011.09.030. PMID 22019794.
- ^ Ferreyra JA, Wu KJ, Hryckowian AJ, Bouley DM, Weimer BC, Sonnenburg JL (December 2014). "Gut microbiota-produced succinate promotes C. difficile infection after antibiotic treatment or motility disturbance". Cell Host & Microbe. 16 (6): 770–7. doi:10.1016/j.chom.2014.11.003. PMC 4859344. PMID 25498344.
- ^ O'Keefe SJ (January 2010). "Tube feeding, the microbiota, and Clostridium difficile infection". World Journal of Gastroenterology. 16 (2): 139–42. doi:10.3748/wjg.v16.i2.139. PMC 2806551. PMID 20066732.
- ^ Crook DW, Walker AS, Kean Y, Weiss K, Cornely OA, Miller MA, et al. (August 2012). "Fidaxomicin versus vancomycin for Clostridium difficile infection: meta-analysis of pivotal randomized controlled trials". Clinical Infectious Diseases. 55 Suppl 2: S93-103. doi:10.1093/cid/cis499. PMC 3388031. PMID 22752871.
- ^ a b Sartelli M, Di Bella S, McFarland LV, Khanna S, Furuya-Kanamori L, Abuzeid N, et al. (2019). "difficile infection in surgical patients". World Journal of Emergency Surgery. 14: 8. doi:10.1186/s13017-019-0228-3. PMC 6394026. PMID 30858872.
- ^ Kuehne SA, Cartman ST, Heap JT, Kelly ML, Cockayne A, Minton NP (October 2010). "The role of toxin A and toxin B in Clostridium difficile infection" (PDF). Nature. 467 (7316): 711–3. Bibcode:2010Natur.467..711K. doi:10.1038/nature09397. hdl:10044/1/15560. PMID 20844489. S2CID 4417414.
- ^ "Surgical Pathology Criteria: Pseudomembranous Colitis". Stanford School of Medicine. Archived from the original on 3 September 2014.
- ^ Murray PR, Baron EJ, Pfaller EA, Tenover F, Yolken RH, eds. (2003). Manual of Clinical Microbiology (8th ed.). Washington DC: ASM Press. ISBN 978-1-55581-255-3.[페이지 필요]
- ^ Deshpande A, Pasupuleti V, Patel P, Ajani G, Hall G, Hu B, et al. (August 2011). "Repeat stool testing to diagnose Clostridium difficile infection using enzyme immunoassay does not increase diagnostic yield". Clinical Gastroenterology and Hepatology. 9 (8): 665–669.e1. doi:10.1016/j.cgh.2011.04.030. PMID 21635969.
- ^ Salleh A (2 March 2009). "Researchers knock down gastro bug myths". ABC Science Online. Archived from the original on 3 March 2009. Retrieved 2 March 2009.
- ^ Lyras D, O'Connor JR, Howarth PM, Sambol SP, Carter GP, Phumoonna T, et al. (April 2009). "Toxin B is essential for virulence of Clostridium difficile". Nature. 458 (7242): 1176–9. Bibcode:2009Natur.458.1176L. doi:10.1038/nature07822. PMC 2679968. PMID 19252482.
- ^ a b c d e Chen S, Gu H, Sun C, Wang H, Wang J (June 2017). "Rapid detection of Clostridium difficile toxins and laboratory diagnosis of Clostridium difficile infections". Infection. 45 (3): 255–262. doi:10.1007/s15010-016-0940-9. PMID 27601055. S2CID 30286964.
- ^ 임상용 마이크로비 저널IOLOY, 2010년 10월 페이지 3738–3741
- ^ "FAQs (frequently asked questions) "Clostridium Difficile"" (PDF). Archived (PDF) from the original on 7 December 2016.
- ^ "Clostridium difficile Infection Information for Patients HAI CDC". www.cdc.gov. Archived from the original on 16 December 2016. Retrieved 18 December 2016.
- ^ Weiss AJ, Elixhauser A.미국 병원의 약물 부작용의 기원, 2011.HCUP 통계 개요 #158.2013년 7월, 록빌의 의료 연구 및 품질 기관"Origin of Adverse Drug Events in U.S. Hospitals, 2011 - Statistical Brief #158". Archived from the original on 7 April 2016. Retrieved 9 February 2016.
- ^ 항생제 억제 영국의 C. diff 강하와 결부된 항생제. 2017년 1월 6일 웨이백머신에 보관
- ^ a b Heineman J, Bubenik S, McClave S, Martindale R (August 2012). "Fighting fire with fire: is it time to use probiotics to manage pathogenic bacterial diseases?". Current Gastroenterology Reports. 14 (4): 343–8. doi:10.1007/s11894-012-0274-4. PMID 22763792. S2CID 22813174.
- ^ a b Johnston BC, Ma SS, Goldenberg JZ, Thorlund K, Vandvik PO, Loeb M, Guyatt GH (December 2012). "Probiotics for the prevention of Clostridium difficile-associated diarrhea: a systematic review and meta-analysis". Annals of Internal Medicine. 157 (12): 878–88. doi:10.7326/0003-4819-157-12-201212180-00563. PMID 23362517. S2CID 72364505.
- ^ a b c Na X, Kelly C (November 2011). "Probiotics in clostridium difficile Infection". Journal of Clinical Gastroenterology. 45 Suppl (Suppl): S154-8. doi:10.1097/MCG.0b013e31822ec787. PMC 5322762. PMID 21992956.
- ^ McFarland LV (April 2006). "Meta-analysis of probiotics for the prevention of antibiotic associated diarrhea and the treatment of Clostridium difficile disease". The American Journal of Gastroenterology (Submitted manuscript). 101 (4): 812–22. PMID 16635227.
- ^ Goldenberg JZ, Yap C, Lytvyn L, Lo CK, Beardsley J, Mertz D, Johnston BC (December 2017). "Probiotics for the prevention of Clostridium difficile-associated diarrhea in adults and children". The Cochrane Database of Systematic Reviews. 12: CD006095. doi:10.1002/14651858.CD006095.pub4. PMC 6486212. PMID 29257353.
- ^ Blaabjerg S, Artzi DM, Aabenhus R (October 2017). "Probiotics for the Prevention of Antibiotic-Associated Diarrhea in Outpatients-A Systematic Review and Meta-Analysis". Antibiotics. 6 (4): 21. doi:10.3390/antibiotics6040021. PMC 5745464. PMID 29023420.
- ^ Mayo Clinic C. diff prevention 2013년 10월 8일 웨이백머신에 보관
- ^ a b Dubberke ER, Carling P, Carrico R, Donskey CJ, Loo VG, McDonald LC, et al. (June 2014). "Strategies to prevent Clostridium difficile infections in acute care hospitals: 2014 Update". Infection Control and Hospital Epidemiology (Submitted manuscript). 35 (6): 628–45. doi:10.1086/676023. PMID 24799639. S2CID 32258582.
- ^ Roehr B (21 September 2007). "Alcohol Rub, Antiseptic Wipes Inferior at Removing Clostridium difficile". Medscape. Archived from the original on 30 October 2013.
- ^ Banach DB, Bearman G, Barnden M, Hanrahan JA, Leekha S, Morgan DJ, et al. (February 2018). "Duration of Contact Precautions for Acute-Care Settings". Infection Control and Hospital Epidemiology. 39 (2): 127–144. doi:10.1017/ice.2017.245. PMID 29321078.
- ^ Savidge TC, Urvil P, Oezguen N, Ali K, Choudhury A, Acharya V, et al. (August 2011). "Host S-nitrosylation inhibits clostridial small molecule-activated glucosylating toxins". Nature Medicine. 17 (9): 1136–41. doi:10.1038/nm.2405. PMC 3277400. PMID 21857653. Lay summary – ScienceDaily (21 August 2011).
{{cite journal}}:Cite는 사용되지 않는 매개 변수를 사용한다.lay-source=(도움말) - ^ Laidman J (29 December 2011). "Flush With Germs: Lidless Toilets Spread C. difficile". Medscape. Archived from the original on 20 April 2016.
- ^ "Cleaning agents 'make bug strong'". BBC News Online. 3 April 2006. Archived from the original on 8 November 2006. Retrieved 17 November 2008.
- ^ 보이시 외 2008년
- ^ 마니안 외 2010
- ^ "Performance Feedback, Ultraviolet Cleaning Device, and Dedicated Housekeeping Team Significantly Improve Room Cleaning, Reduce Potential for Spread of Common, Dangerous Infection". Agency for Healthcare Research and Quality. 15 January 2014. Retrieved 20 January 2014.
- ^ a b Drekonja DM, Butler M, MacDonald R, Bliss D, Filice GA, Rector TS, Wilt TJ (December 2011). "Comparative effectiveness of Clostridium difficile treatments: a systematic review". Annals of Internal Medicine. 155 (12): 839–47. doi:10.7326/0003-4819-155-12-201112200-00007. PMID 22184691.
- ^ a b c d McDonald LC, Gerding DN, Johnson S, Bakken JS, Carroll KC, Coffin SE, et al. (March 2018). "Clinical Practice Guidelines for Clostridium difficile Infection in Adults and Children: 2017 Update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA)". Clinical Infectious Diseases. 66 (7): 987–994. doi:10.1093/cid/ciy149. PMID 29562266.
- ^ a b Surawicz CM, Brandt LJ, Binion DG, Ananthakrishnan AN, Curry SR, Gilligan PH, et al. (April 2013). "Guidelines for diagnosis, treatment, and prevention of Clostridium difficile infections". The American Journal of Gastroenterology. 108 (4): 478–98, quiz 499. doi:10.1038/ajg.2013.4. PMID 23439232. S2CID 54629762.
- ^ Cornely OA (December 2012). "Current and emerging management options for Clostridium difficile infection: what is the role of fidaxomicin?". Clinical Microbiology and Infection. 18 Suppl 6: 28–35. doi:10.1111/1469-0691.12012. PMID 23121552.
- ^ a b Crawford T, Huesgen E, Danziger L (June 2012). "Fidaxomicin: a novel macrocyclic antibiotic for the treatment of Clostridium difficile infection". American Journal of Health-System Pharmacy. 69 (11): 933–43. doi:10.2146/ajhp110371. PMID 22610025.
- ^ a b c Rao K, Malani PN (March 2020). "Diagnosis and Treatment of Clostridioides (Clostridium) difficile Infection in Adults in 2020". JAMA. 323 (14): 1403–1404. doi:10.1001/jama.2019.3849. PMID 32150234.
- ^ Cunha BA (2013). Antibiotic Essentials 2013 (12th ed.). p. 133. ISBN 978-1-284-03678-7. Archived from the original on 8 September 2017.
- ^ Koo HL, Koo DC, Musher DM, DuPont HL (March 2009). "Antimotility agents for the treatment of Clostridium difficile diarrhea and colitis". Clinical Infectious Diseases. 48 (5): 598–605. doi:10.1086/596711. PMID 19191646.
- ^ a b Stroehlein JR (June 2004). "Treatment of Clostridium difficile Infection". Current Treatment Options in Gastroenterology. 7 (3): 235–239. doi:10.1007/s11938-004-0044-y. PMID 15149585. S2CID 25356792.
- ^ "Merck Newsroom Home". Archived from the original on 3 November 2016. Retrieved 1 November 2016., FDA, CDI 재발 위험이 높은 CDI를 위한 항균제 치료를 받는 성인 환자의 클로스트리디움 디피실리 감염(CDI) 재발을 줄이기 위해 Merck의 ZINPLAVA™(bezlotoxumab) 승인
- ^ Bauer MP, van Dissel JT, Kuijper EJ (December 2009). "Clostridium difficile: controversies and approaches to management". Current Opinion in Infectious Diseases. 22 (6): 517–24. doi:10.1097/QCO.0b013e32833229ce. PMID 19738464. S2CID 24040330.
- ^ Pillai A, Nelson R (January 2008). Pillai A (ed.). "Probiotics for treatment of Clostridium difficile-associated colitis in adults". The Cochrane Database of Systematic Reviews (1): CD004611. doi:10.1002/14651858.CD004611.pub2. PMID 18254055.
- ^ Wilkins T, Sequoia J (August 2017). "Probiotics for Gastrointestinal Conditions: A Summary of the Evidence". American Family Physician. 96 (3): 170–178. PMID 28762696.
however, there are conflicting results for C. difficile infection.
- ^ Rao K, Young VB, Malani PN (November 2017). "Capsules for Fecal Microbiota Transplantation in Recurrent Clostridium difficile Infection: The New Way Forward or a Tough Pill to Swallow?". JAMA. 318 (20): 1979–1980. doi:10.1001/jama.2017.17969. PMC 6561340. PMID 29183052.
- ^ Burke KE, Lamont JT (August 2013). "Fecal transplantation for recurrent Clostridium difficile infection in older adults: a review". Journal of the American Geriatrics Society. 61 (8): 1394–8. doi:10.1111/jgs.12378. PMID 23869970. S2CID 34998497.
- ^ a b Drekonja D, Reich J, Gezahegn S, Greer N, Shaukat A, MacDonald R, et al. (May 2015). "Fecal Microbiota Transplantation for Clostridium difficile Infection: A Systematic Review". Annals of Internal Medicine. 162 (9): 630–8. doi:10.7326/m14-2693. PMID 25938992. S2CID 1307726.
- ^ van Nood E, Vrieze A, Nieuwdorp M, Fuentes S, Zoetendal EG, de Vos WM, et al. (January 2013). "Duodenal infusion of donor feces for recurrent Clostridium difficile". The New England Journal of Medicine. 368 (5): 407–15. doi:10.1056/NEJMoa1205037. PMID 23323867. S2CID 25879411.
- ^ de Vrieze J (August 2013). "Medical research. The promise of poop". Science. 341 (6149): 954–7. doi:10.1126/science.341.6149.954. PMID 23990540.
- ^ Keller JJ, Kuijper EJ (2015). "Treatment of recurrent and severe Clostridium difficile infection". Annual Review of Medicine. 66: 373–86. doi:10.1146/annurev-med-070813-114317. PMID 25587656.
- ^ Smith PA (10 November 2015). "Fecal Transplants Made (Somewhat) More Palatable". The New York Times. pp. D5. Archived from the original on 13 November 2015. Retrieved 13 November 2015.
- ^ Bhangu A, Nepogodiev D, Gupta A, Torrance A, Singh P (November 2012). "Systematic review and meta-analysis of outcomes following emergency surgery for Clostridium difficile colitis". The British Journal of Surgery. 99 (11): 1501–13. doi:10.1002/bjs.8868. PMID 22972525. S2CID 42729589.
- ^ Osman KA, Ahmed MH, Hamad MA, Mathur D (October 2011). "Emergency colectomy for fulminant Clostridium difficile colitis: Striking the right balance". Scandinavian Journal of Gastroenterology. 46 (10): 1222–7. doi:10.3109/00365521.2011.605469. PMID 21843039. S2CID 27187695.
- ^ Kelly C P, LaMont J T. Clostridium difficile—그 어느 때보다 어렵다.N Engl J Med. 2008;359(18):1932–1940.
- ^ 로울케, F, & 스톨만, N. (2012)Clostridium difficile 감염을 재발견하기 위한 대변 마이크로바이오타 이식.위내과 치료의 진보, 5(6), 403–420.https://doi.org/10.1177/1756283X12453637
- ^ 콜, S. A. & Stahl, T. J. (2015)지속적이고 반복적인 클로스트리디움 디피시틸 콜리시스.대장 및 직장 수술 클리닉, 28(2), 65–69.https://doi.org/10.1055/s-0035-1547333
- ^ 디테를레, 엠지, 라오, 케이, 앤 영, 브이비(2019)1차 및 재발 Clostridium difficile 감염에 대한 새로운 치료 및 예방 전략.뉴욕 과학 아카데미 연보, 1435(1), 110–138.https://doi.org/10.1111/nyas.13958
- ^ a b Kelly CP, LaMont JT (October 2008). "Clostridium difficile--more difficult than ever". The New England Journal of Medicine. 359 (18): 1932–40. doi:10.1056/NEJMra0707500. PMID 18971494.
- ^ a b Domino FJ, Baldor RA, eds. (2014). The 5-minute clinical consult 2014 (22nd ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. p. 258. ISBN 978-1-4511-8850-9. Archived from the original on 8 September 2017.
- ^ "Antibiotic resistance threats in the United States, 2013" (PDF). US Centers for Disease Control and Prevention. 2013. Archived (PDF) from the original on 17 November 2014. Retrieved 3 November 2014.
- ^ "Hospital Acquired Infections Are a Serious Risk - Consumer Reports". www.consumerreports.org. Archived from the original on 10 December 2016. Retrieved 18 December 2016.
- ^ Hall IC, O'Toole E (1935). "Intestinal flora in newborn infants with a description of a new pathogenic anaerobe, Bacillus difficilis". American Journal of Diseases of Children. 49 (2): 390–402. doi:10.1001/archpedi.1935.01970020105010.
- ^ Prévot AR (1938). "Études de systématique bactérienne. IV. Critique de la conception actuelle du genre Clostridium". Annales de l'Institut Pasteur. 61 (1): 84.
- ^ De Vos P, Garrity GM, Jones D, Krieg NR, Ludwig W, Rainey FA, Schleifer K, Whitman WB, eds. (2009). "Family I. Clostridiaceae". The Firmicutes. Bergey's Manual of Systematic Bacteriology. Vol. 3 (2nd ed.). Dordrecht: Springer. p. 771. ISBN 978-0-387-68489-5.
- ^ Lawson PA, Citron DM, Tyrrell KL, Finegold SM (August 2016). "Reclassification of Clostridium difficile as Clostridioides difficile (Hall and O'Toole 1935) Prévot 1938". Anaerobe. 40: 95–9. doi:10.1016/j.anaerobe.2016.06.008. PMID 27370902.
- ^ Larson HE, Price AB, Honour P, Borriello SP (May 1978). "Clostridium difficile and the aetiology of pseudomembranous colitis". Lancet. 1 (8073): 1063–6. doi:10.1016/S0140-6736(78)90912-1. PMID 77366. S2CID 2502330.
- ^ "Trust confirms 49 superbug deaths". BBC News Online. 1 October 2006. Archived from the original on 22 March 2007.
- ^ Hawkes N (11 January 2007). "Leaked memo reveals that targets to beat MRSA will not be met" (snippet). The Times. London. Retrieved 11 January 2007.(필요한 경우)
- ^ "C. difficile blamed for 9 death in hospital near Montreal". Canoe.ca. 27 October 2006. Archived from the original on 8 July 2012. Retrieved 11 January 2007.
- ^ "12th person dies of C. difficile at Quebec hospital". CBC News. 18 November 2006. Archived from the original on 21 October 2007.
- ^ 새로운 킬러 버그가 강타한 병원 2008년 5월 20일 웨이백 머신에서 보관된 맨체스터 무료 신문 '메트로'의 기사, 2008년 5월 7일
- ^ "치명 변종과 연관된 C. difficile 발생" 2007년 3월 3일 웨이백 기계에 보관.CTV 뉴스. 2007년 2월 28일.
- ^ "Superbug in hospitals linked to four deaths". Irish Independent. 10 October 2007.
- ^ "북방신탁병원 클로스트리디움 디피실리튬 발생 공개질문" 2016년 3월 4일 웨이백머신에 보관
- ^ Healthcare watchdog finds significant failings in infection control at Maidstone and Tunbridge Wells NHS Trust (press release), United Kingdom: Healthcare Commission, 11 October 2007, archived from the original on 21 December 2007
- ^ Smith R, Rayner G, Adams S (11 October 2007). "Health Secretary intervenes in superbug row". Daily Telegraph. London. Archived from the original on 20 April 2008.
- ^ Tappanut Jo Kymmen potilasta – HS.fi – Kotimaa Archived 2007년 12월 15일 웨이백 머신에 보관된 Tappanut Jo Kymmen potilasta – HS.fi
- ^ "Possible C Diff link to Drogheda deaths". RTÉ News. 10 November 2009. Archived from the original on 23 October 2012.
- ^ 199 Herlev 병원 살인설사 사망, 2016년 1월 6일 Wayback Machine, BT 3월 3일 보관
- ^ (Herlev, Amager, Gentofte 및 Hvidovre)
- ^ 위험한 박테리아에 감염된 병원 4곳 2013년 7월 5일 웨이백머신, TV2 뉴스7 2010년 5월 7일 보관
- ^ "Deadly superbug reaches NZ". 3 News NZ. 30 October 2012. Archived from the original on 15 April 2014. Retrieved 29 October 2012.
- ^ "C. difficile linked to 26th death in Ontario". CBC News. 25 July 2011. Archived from the original on 24 July 2011. Retrieved 24 July 2011.
- ^ "10 punkter för att förhindra smittspridning i Region Skåne" [10 points to prevent the spread of infection in Region Skåne] (in Swedish). Archived from the original on 5 March 2015.
- ^ Liddell-Scott. "κλωστήρ". Greek-English Lexicon{{inconsistent citations}}
{{cite journal}}: CS1 maint : 포스트스크립트(링크) - ^ Cawley K. "Difficilis". Latin Dictionary and Grammar Aid. Retrieved 16 March 2013{{inconsistent citations}}
{{cite journal}}: CS1 maint : 포스트스크립트(링크) - ^ a b Stedman's Medical Dictionary, Wolters-Kluwer, retrieved 11 April 2019.
- ^ Broecker F, Wegner E, Seco BM, Kaplonek P, Bräutigam M, Ensser A, et al. (December 2019). "Clostridioides difficile Infections". ACS Chemical Biology. 14 (12): 2720–2728. doi:10.1021/acschembio.9b00642. PMC 6929054. PMID 31692324.
- ^ "Clostridium Difficile Vaccine Efficacy Trial (Clover)". clinicaltrials.gov. 21 February 2020. Retrieved 28 April 2020.
- ^ "Study of GlaxoSmithKline's (GSK) Clostridium Difficile Vaccine to Investigate the Safety and Ability to Provoke an Immune Response in the Body When Administered in Healthy Adults Aged 18-45 Years and 50-70 Years". clinicaltrials.gov. 13 April 2020. Retrieved 28 April 2020.
- ^ "op-line data from randomized, double-blind, placebo controlled Phase 2 clinical trial indicate statistically significant reduction in recurrences of CDAD". University of Massachusetts Worcester Campus. Archived from the original on 27 December 2010. Retrieved 16 August 2011.
- ^ CenterWatch. "Clostridium Difficile-Associated Diarrhea". Archived from the original on 29 September 2011. Retrieved 16 August 2011.
- ^ Business, Highbeam. "MDX 066, MDX 1388 Medarex, University of Massachusetts Medical School clinical data (phase II)(diarrhea)". Archived from the original on 14 October 2012. Retrieved 16 August 2011.
- ^ a b c d e Shah D, Dang MD, Hasbun R, Koo HL, Jiang ZD, DuPont HL, Garey KW (May 2010). "Clostridium difficile infection: update on emerging antibiotic treatment options and antibiotic resistance". Expert Review of Anti-Infective Therapy. 8 (5): 555–64. doi:10.1586/eri.10.28. PMC 3138198. PMID 20455684.
- ^ Moore JH, van Opstal E, Kolling GL, Shin JH, Bogatcheva E, Nikonenko B, et al. (May 2016). "Treatment of Clostridium difficile infection using SQ641, a capuramycin analogue, increases post-treatment survival and improves clinical measures of disease in a murine model". The Journal of Antimicrobial Chemotherapy. 71 (5): 1300–6. doi:10.1093/jac/dkv479. PMC 4830414. PMID 26832756.
- ^ Barlow A, Muhleman M, Gielecki J, Matusz P, Tubbs RS, Loukas M (October 2013). "The vermiform appendix: a review". Clinical Anatomy. 26 (7): 833–42. doi:10.1002/ca.22269. PMID 23716128. S2CID 30463711.
- ^ Gerding DN, Meyer T, Lee C, Cohen SH, Murthy UK, Poirier A, et al. (May 2015). "Administration of spores of nontoxigenic Clostridium difficile strain M3 for prevention of recurrent C. difficile infection: a randomized clinical trial". JAMA. 313 (17): 1719–27. doi:10.1001/jama.2015.3725. PMID 25942722.
- ^ Collins J, Robinson C, Danhof H, Knetsch CW, van Leeuwen HC, Lawley TD, et al. (January 2018). "Dietary trehalose enhances virulence of epidemic Clostridium difficile". Nature. 553 (7688): 291–294. Bibcode:2018Natur.553..291C. doi:10.1038/nature25178. PMC 5984069. PMID 29310122.