황산리튬
Lithium sulfate | |
 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 황산리튬 | |
| 기타 이름 황산 리튬 | |
| 식별자 | |
| |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.030.734 |
펍켐 CID | |
| RTECS 번호 |
|
| 유니 |
|
CompTox 대시보드 (EPA) | |
| |
| |
| 속성[1] | |
| 리소24 | |
| 어금질량 | 109.94 g/190 |
| 외관 | 백색 결정체 고체, 저광학 |
| 밀도 | 2.190 g/cm3(무수) 2.06 g/cm3(수화물) |
| 녹는점 | 859°C(1,578°F, 1,132K) |
| 비등점 | 1,377 °C(2,511 °F, 1,650 K) |
| 단수화물: 34.9 g/100 mL(25 °C) 29.2 g/100 mL (100 °C) | |
| 용해성 | 절대 에탄올, 아세톤, 피리딘에서 불용성인 |
자기 감수성(magnetic susibility) | --40.0·10cm−63/190cm |
굴절률(nD) | 1.465(β-형식) |
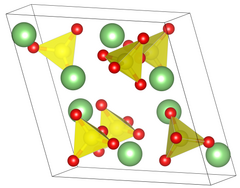
| 구조[2] | |
| 원시단백질 | |
| P 21/a, 14번 | |
a = 8.239 å, b = 4.954 å, c = 8.474 å α = 90°, β = 107.98°, γ = 90°[2] | |
격자 부피(V) | 328.9 Å3 |
공식 단위(Z) | 4 |
| 유황 4면체 | |
| 열화학 | |
열 용량 (C) | 1.07 J/g K |
성 어금니 엔트로피 (S | 113 J/mol K |
의 성 엔탈피 대형화 (ΔfH⦵298) | −1436.37 kJ/mol |
기브스 자유 에너지 (ΔfG˚) | -1324.7 kJ/mol |
| 위험 | |
| NFPA 704(화재 다이아몬드) | |
| 치사량 또는 농도(LD, LC): | |
LD50(중간 선량) | 613mg/kg(랫드, 구강)[3] |
| 관련 화합물 | |
기타 음이온 | 염화 리튬 |
기타 양이온 | 황산나트륨 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
황산리튬은 LiSO라는24 공식을 가진 흰색 무기염이다. 황산의 리튬염이다.
특성.
물리적 성질
황산리튬은 대부분의 염류가 온도로 용해도를 높이는 일반적인 추세를 따르지는 않지만 물에 녹는다. 반대로, 용해성은 발열 작용이기 때문에 온도가 상승함에 따라 용해도는 감소한다. 역행성 용해성이라고도 불리는 이 비교적 특이한 성질은 수산화칼슘(포틀랜드라이트, 수화 시멘트 페이스트의 중요한 무기상), 황산칼슘(흡수체, 바사나이트, 무수체)과 같은 몇 가지 무기 화합물들과 공유되며, 용해 반응 또한 발열성이 있는 란타노이드 황산염은 수산화칼슘과 같은 무기 화합물과도 거의 공유되지 않는다. 역행 용해도는 물에서 가스가 용해될 경우 흔히 나타나지만 고형물이 용해될 경우에는 덜 자주 접하게 된다. 탄산칼슘도 역행성 용해성을 나타내지만, 그것은 또한 칼코-탄소 평형도에서 CO 해체의2 행동에 달려 있다.
압전인 황산리튬 결정체는 매우 효율적인 음향수신기여서 초음파형 비파괴시험에도 사용된다. 그러나, 그들은 그들의 용해성 때문에 이 응용에서 고통을 받는다.
황산리튬은 저광학 특성을 갖고 있기 때문에 황산리튬의 가장 흔한 형태는 황산리튬 일수화물이다. 무수 황산리튬은 밀도가 2.22g/cm이지만3 무수 리튬은 대기가 부족한 물에서 해야 하므로 무게가 번거로워질 수 있다.
황산 리튬은 열전 성질을 가지고 있다. 황산 리튬 수분이 가열되면 전기전도율도 높아진다. 황산리튬의 어금니도 전기전도도에 영향을 미친다; 최적의 전도성은 2M에서 달성된 다음 감소한다.[4]
고체 리튬 황산염이 물에 녹으면 내열성 분열을 일으킨다. 이것은 발열성 분열을 가지고 있는 황산나트륨과 다르다. 그러나 물에 첨가된 소금의 양(몰의 수)에도 따라 달라지는 것 같아 정확한 연관성의 에너지는 정량화하기가 어렵다. 소량의 용해된 황산리튬은 다량의 용해보다 몰 당 훨씬 큰 온도 변화를 유발한다.[5]
크리스털 특성
황산 리튬은 두 가지 다른 결정 단계를 가지고 있다. 공통상 II 형태에서 황산리튬은 가장자리 길이가 a = 8.2323 b = 4.95å c = 8.47å β = 107.98°인 스테노이드 단원결정 시스템을 가지고 있다. 황산리튬은 130℃를 지나면 무수 상태로 변하지만 결정구조를 유지한다. 2단계에서 1단계로 변형이 있는 경우는 575℃가 되어야 한다. 수정 구조는 면 중심 큐빅 크리스털 시스템으로 변경되며, 가장자리 길이는 7.07å이다.[6] 이 위상 변화 동안에 황산리튬의 밀도는 2.22에서 2.07 g/cm로3 변화한다.[7]
사용하다
황산리튬은 양극성 질환 치료에 사용된다(리튬 약리학 참조).
황산리튬은 이온 전도유리의 잠재적 성분으로 연구되고 있다. 투명 전도 필름은 태양 전지판과 같은 응용 분야와 새로운 종류의 배터리의 잠재력에 사용되기 때문에 매우 조사된 주제다. 이러한 용도에서는 높은 리튬 함량을 갖는 것이 중요하다. 더 일반적으로 알려진 2진 리튬 붕산염(LioO·BoO₃)은 높은 리튬 농도로 얻기가 어렵고, 저광학이기 때문에 유지하기 어렵다. 시스템에 황산리튬이 추가되면서 쉽게 생산되고 안정적이며 높은 리튬 농도 유리가 형성될 수 있다. 현재 투명 이온 전도 필름의 대부분은 유기 플라스틱으로 만들어졌으며, 저렴한 안정성의 무기유리가 개발될 수 있다면 이상적일 것이다.[8]
포틀랜드 시멘트의 첨가제로 황산리튬을 테스트해 양성반응으로 경화를 가속화했다. 황산리튬은 양생시간을 단축시키는 수화반응(시멘트 참조)을 촉진하는 역할을 한다. 경화 시간 단축에 대한 우려는 최종 제품의 강도지만, 테스트했을 때 황산 리튬 도핑 포틀랜드 시멘트는 관측할 수 있는 강도 감소가 없었다.[9]
리튬이온전지
리튬이 80% 이상 함유된 1차 리튬황산염(PLS·[10]LiSO
2
4·HO
2)은 리튬이온배터리 소재 공급망에서 수산화리튬 생산에 유용한 화학물질이다. 그것은 LiOH보다 반응성이 덜한 물질이기 때문에 더 쉽게 저장하고 운반할 수 있다.[10][11]
경질암스포두메네 농축액 공급원료는 산성 로스팅으로 처리되며, 이어 물이 새어 리튬 회수율이 84-88%에 이른다. 그런 다음 정제된 침출액에 증발 작용하여 황산 리튬 일수화물(LiSO
2
4 · HO
2)으로 구성된 1차 황산 리튬 고형물이 생성된다.
약물
리튬이온(Li+)은 정신의학에서 조증, 내인성 우울증, 정신분열증 치료 등에 쓰이며 정신분열증 치료에도 쓰인다. 보통 탄산리튬(LiCO
2
3)을 적용하지만 대안으로 리튬 구연산(LiCHO
3
6
5
7), 황산리튬 또는 옥시부티레이트를 사용하는 경우도 있다.[12] Li는+ 대사되지 않는다. 나트륨+(Na+)과 칼륨(K+) 양이온과의 화학적 유사성 때문에 이러한 물질의 생화학적 경로를 상호작용하거나 방해할 수 있으며, 체내 또는 세포외 구획에서 이러한 양이온을 대체할 수 있다. 리는+ 비록 덜 효율적이긴 하지만, 활성 나트륨 펌프에 의해 신경과 근육 세포로부터 옮겨지는 것 같다.
황산리튬은 위장관 흡수 속도가 빠르고(몇 분 이내) 정제의 경구 투여나 액체 형태에 따라 완성된다.[12] 그것은 간과 신장으로 빠르게 확산되지만 신체 평형에 도달하는 데는 8-10일이 필요하다. Li는+ 많은 신진대사 및 신경내분비 변화를 일으키지만, 어떤 결정적인 증거도 특정 행동 방식을 선호하지 않는다.[12] 예를+ 들어, Li는 신경호르몬, 특히 생물 유발 아민, 세로토닌(5-hydroxy tryptamine) 및 노레피네프린과 상호작용을 하며, 이는 정신질환(예: 마니아)에서 유익한 효과를 위한 가능한 메커니즘을 제공한다. 중추신경계(CNS)에서 Li는+ 신경 흥분, 시냅스 전달, 뉴런메타볼리즘에 영향을 미친다.[13] 리는+ 세로토닌 신경 전달을 안정시킨다.
유기화학합성
황산리튬은 320~370℃ 범위에서 100%에 가까운 수율에서 n-부틸브로미드를 1-부틴으로 변환하기 위한 제거반응의 촉매로 사용되고 있다. 이 반응의 수율은 2-부틴의 높은 수율이 형성됨에 따라 이 범위를 넘어서 가열하면 극적으로 변화한다.[14]
참조
- ^ Patnaik, Pradyot (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 0-07-049439-8.
- ^ a b doi:10.1107/S0567740876004433
- ^ Chambers, Michael. "ChemIDplus - 10377-48-7 - INHCSSUBVCNVSK-UHFFFAOYSA-L - Lithium sulfate - Similar structures search, synonyms, formulas, resource links, and other chemical information". chem.sis.nlm.nih.gov. Retrieved 12 October 2018.
- ^ 엔젤 C; 소브론 F.; 호세 1세(1995) 황산 리튬 수용액의 밀도, 점도 및 전기 전도도. J. 켐. 영국, 40, 987–991.
- ^ 톰슨 T. P.; 스미스 D. E.; 우드 R. H. (1974) 수용성 NaaS24 및 LiSO24 J. 화학 희석 엔탈피. 영국, 19, 386–388.
- ^ 라오 C. N. R.; 프라카시 B. 결정 구조: 무기 황산염, 인산염, 과염소산염, 색소산염의 변화 NSRDS. 1975, 56, 2-12
- ^ Fordland, T.; Keogh, M. J. 황산 리튬의 고온 개조 구조. 1957, 565-567
- ^ E. I. 화학자; M. A. 카라카시데스; G. D. 크리시코스. 황산리튬을 이용한 고속 이온 전도성 붕산안경의 진동해석 J. 체육 화학. 1986, 90 4528-4533
- ^ 유하이 D.; 갈아타는 Z.샤오성 W. 포틀랜드 시멘트 페이스트의 특성에 미치는 황산 리튬 첨가 영향 건설 및 건물 2014, 50, 457-462
- ^ a b "Metallurgical test work confirms Manono Primary Lithium Sulphate suitable for battery production feedstock" (PDF). AVZ Minerals Limited. 13 January 2021. Retrieved 25 March 2021.
{{cite web}}: 외부 링크 위치author-link= - ^ "AVZ Minerals Limited". AVZ Minerals. Retrieved 25 March 2021.
{{cite web}}: CS1 maint : url-status (링크) - ^ a b c Haddaddad, L.M., Winchester, J.F.의 임상 관리 중독 및 약물 과다복용. 1990년 2차 개정판, 656-665
- ^ Poisindex, Thomson Micromedex 2005
- ^ Noller, H, Rosa-Brusin, M. and Andréu, P. (1967), 1-Butene의 입체적 합성과 황산 리튬을 제거 촉매로 한다. 안젤라, 화학. 에드 장로 영어, 6: 170–171. 도이:10.1002/anie.196701702




