비황산칼륨
Potassium bisulfate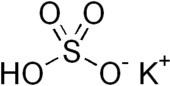 | |
 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 황산칼륨 | |
| 기타 이름 황산칼륨 | |
| 식별자 | |
| |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.028.722 |
| EC 번호 |
|
| E 넘버 | E515(ii) (acidity 규제 기관, ...) |
펍켐 CID | |
| RTECS 번호 |
|
| 유니 | |
| UN 번호 | 2509 |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| KHSO4 | |
| 어금질량 | 136.1987 g/mb |
| 외관 | 무색의 고체 |
| 냄새 | 무취의 |
| 밀도 | 2.196 g/cm3 |
| 녹는점 | 197°C(387°F, 470K) |
| 비등점 | 300 °C(572 °F; 573 K) (손상) |
| 36.6 g/100 mL(0°C) 49 g/100 mL(20°C) 121.6 g/100 mL (100 °C) | |
| 용해성 | 아세톤, 에탄올에 녹는다. |
자기 감수성(magnetic susibility) | -49.8·10cm−63/190cm |
| 열화학 | |
의 성 엔탈피 대형화 (ΔfH⦵298) | -1163.3 kJ/mol |
| 위험 | |
| GHS 라벨 표시: | |
  | |
| 위험 | |
| H314, H335 | |
| P260, P261, P264, P271, P280, P301+P330+P331, P303+P361+P353, P304+P340, P305+P351+P338, P310, P312, P321, P363, P403+P233, P405, P501 | |
| 치사량 또는 농도(LD, LC): | |
LD50(중간 선량) | 2340mg*kg−1 |
| 안전 데이터 시트(SDS) | 외부 MSDS |
| 관련 화합물 | |
관련 화합물 | 황산칼륨 비황산나트륨 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
비황산칼륨은 화학식 KHSO를4 함유한 무기 화합물로 황산의 칼륨산염이다. 그것은 흰색, 수용성 고체다.
준비
황산칼륨을 생산하는 만하임 공정의 초기 단계로서 1985년에 100만톤 이상이 생산되었다. 관련 변환은 염화칼륨과 황산의 발열 반응이다.[1][2]
- KCl + HSO24 → HCl + KHSO4
비황산칼륨(bisulfate)은 질산칼륨과 황산칼륨에서 질산을 생산하는 부산물이다.[3]
- KNO3 + H2SO4 → KHSO4 + HNO3
화학적 특성
- 2 KHSO4 → K2S2O7 + H2O
600 °C 이상의 피로황산칼륨은 황산칼륨과 삼산화황으로 변환된다.[4]
- K2S2O7 → K2SO4 + SO3
사용하다
비황산칼륨은 일반적으로 와이너마킹을 위한 비타르트레이트 칼륨을 준비하는데 사용된다.[5] 비황산칼륨은 분석화학에서 분해제로도 쓰이거나 강력한 산화제인 페르황산칼륨을 준비하기 위한 전구체로도 쓰인다.[6]
발생
비황산칼륨의 광물학적 형태인 메르칼라이트는 매우 드물게 발생한다.[7] 미세나이트(Misenite)는 비황산칼륨의 또 다른 복잡한 형태로서 KH86(SO4)라는 공식을 가지고 있다.7
참조
- ^ a b Washington Wiley, Harvey (1895). Principles and Practice of Agricultural Analysis: Fertilizers. Easton, PA.: Chemical Publishing Co. p. 218. Retrieved 31 December 2015.
Potassium disulfate.
- ^ H. Schultz, G. Bauer, E. Schachl, F. Hagedorn, P. Schmittinger (2005). "Potassium Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a22_039. ISBN 978-3527306732.CS1 maint: 작성자 매개변수 사용(링크)
- ^ Pradyot, Patnaik (2003). Handbook of Inorganic Chemicals. New York: McGraw-Hill. p. 636. ISBN 978-0070494398.
- ^ Iredelle Dillard Hinds, John (1908). Inorganic Chemistry: With the Elements of Physical and Theoretical Chemistry. New York: John Wiley & Sons. p. 547. Retrieved 31 December 2015.
Potassium disulfate.
- ^ Weisblatt, Jayne; Montney, Charles B. (2006). Chemical Compounds. ISBN 978-1-4144-0453-0.
- ^ Brauer, Georg (1963). Handbook of Preparative Inorganic Chemistry Vol. 1, 2nd Ed. New York: Academic Press. p. 392. ISBN 978-0121266011.
- ^ "Mercallite: Mineral information, data and localities". mindat.org. Retrieved 2019-05-08.