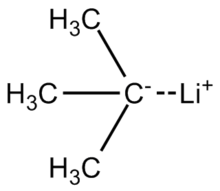
테르트-부틸리튬
tert-Butyllithium | |
 | |
 | |
| 이름 | |
|---|---|
| 우선 IUPAC 이름 테르트-부틸리튬[citation needed] | |
| 식별자 | |
3D 모델(JSmol) | |
| 3587204 | |
| 켐스파이더 | |
| ECHA 정보 카드 | 100.008.939 |
| EC 번호 |
|
PubChem CID | |
| UN 번호 | 3394 |
CompTox 대시보드 (EPA ) | |
| |
| |
| 특성. | |
| LiC 4H 9 | |
| 몰 질량 | 64.055 gmol−1 |
| 외모 | 무색 고체 |
| 밀도 | 660 mg cm−3 |
| 비등점 | 36 ~ 40 °C (97 ~104 °F, 309 ~313 K) |
| 반응 | |
| 산도(pKa) | 45–53 |
| 위험 요소 | |
| GHS 라벨링: | |
     | |
| 위험. | |
| H225, H250, H260, H300, H304, H310, H314, H330, H336, H411 | |
| P210, , , , , , | |
| NFPA 704(파이어 다이아몬드) | |
| 플래시 포인트 | -6.6 °C (20.1 °F, 266.5 K) |
| 관련 화합물 | |
관련 화합물 | n-부틸리튬 |
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |
Tert-Butylithium은 3(CH3)CLi라는 공식의 화합물이다.유기 리시움 화합물로서 벤젠을 포함한 많은 탄소 분자를 탈양성할 수 있는 강력한 염기이기 때문에 유기 합성에 응용된다.Tert-Butylithium은 탄화수소 용액으로 시판되고 있으며, 일반적으로 실험실에서 제조되지 않습니다.그것의 합성은 1941년 [1]R. B. 우드워드에 의해 처음 보고되었다.
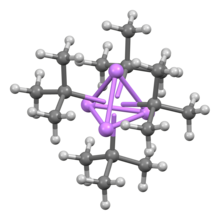
구조 및 본딩
다른 유기석소 화합물들처럼, 터트-부틸리튬은 클러스터이다.n-부틸리튬은 헥사머와 테트라머로 존재하는 반면, tert-부틸리튬은 큐반 구조의 테트라머로 존재한다.유기석소 클러스터에서의 결합은 시그마 탈국소화와 상당한 Li-Li [2]결합을 포함한다.
Tert-Butylithium의 리튬-탄소 결합은 약 40%의 이온 특성을 가지며 매우 편광되어 있습니다.는 카르 바니 온 같은 분자인 반응을 보이고 두 공명 구조로 표시됩니다.[3](두 공명 기여자들, 그 불은, 그 안에 중심 탄소 원자는 ~50%부분 부정적인 담당하고 있제시된, t-butyllithium의 단일 분자의"진짜"구조될 가능성이 큰 near-average은 C−Li 채권에 극성 계산이다.~50%의 부분 양전하를 가진다.)
화학적 성질
n-부틸리튬과 마찬가지로 tert-부틸리튬은 할로겐과의 리튬 교환 및 아민과 활성화된 C-H 화합물의 탈양성자화에 사용될 수 있다.
이 화합물 및 기타 알킬리튬 화합물은 에테르 용제와 반응하는 것으로 알려져 있다. Tert-부틸리튬의 반감기는 디에틸 에테르 0°C에서 60분, 테트라히드로프랑(THF)[4] -20°C에서 40분, 디메톡시에탄 [5]-70°C에서 약 11분이다.이 예에서는 Tert-Butylithium과 (THF)의 반응을 나타내고 있습니다.
이러한 용매에 의한 열화를 최소화하기 위해 Tert-Butylithium과 관련된 반응은 Trapp 용매 혼합물과 같은 특수 용매에서 매우 낮은 온도에서 종종 수행됩니다.
안전.
Tert-Butylithium은 발화성 물질로 공기에 노출되면 자연 발화한다.이 화합물이 산소 및 습기와 격렬하게 반응하지 않도록 하려면 에어프리 기법이 중요합니다.
- t-BuLi + O2 → t-BuOOLi
- t-BuLi + HO2 → t-BuH + LiOH
일반적인 시판 준비에 사용되는 용제 자체는 인화성이 있습니다.카뉴레 전이를 사용하여 이 화합물을 다루는 것은 가능하지만, 바늘 끝이나 카뉴레 끝에 있는 Tert-Butylithium의 흔적은 불이 붙고 카뉴레를 리튬 소금으로 막히게 할 수 있습니다.일부 연구자들은 이러한 "파일럿 라이트" 효과를 제품이 "신선"하고 시간이나 부적절한 보관/취급으로 인해 변질되지 않았다는 신호로 받아들이는 반면, 다른 연구자들은 바늘 끝이나 캐뉼러를 짧은 유리 튜브에 감싸고, 불활성 가스로 플러싱되고 양 끝은 [6]중격막으로 밀봉하는 것을 선호합니다.Tert-Butylithium과 관련된 심각한 실험실 사고가 발생했다.예를 들어 2008년 LA 캘리포니아 대학 패트릭 하란의[7] 연구실에서 직원 연구 보조인 쉐하르바노 상지는 터르트부틸리튬에 [8][9][10]의해 발화된 화재로 심하게 화상을 입고 사망했다.
대규모 반응은 Tert-Butylithium이 디에틸에테르, 테트라히드로프랑 등의 에테르와 혼합될 때 폭주 반응, 화재, 폭발로 이어질 수 있다.탄화수소 용제의 사용이 선호될 수 있다.
레퍼런스
- ^ Bartlett, Paul D.; C. Gardner Swain; Robert B. Woodward (1941). "t-Butyllithium". J. Am. Chem. Soc. 63 (11): 3229–3230. doi:10.1021/ja01856a501.
- ^ Elscenbroich, C. "Organmetallics" (2006) Wiley-VCH: 와인하임.ISBN 978-3-527-29390-2
- ^ 유기 금속 시약: 알코올 합성을 위한 친핵성 탄소 공급원.K. P. C. Vollhardt, N. E. Schore: 유기화학: 구조와 기능.1999년 제3판, 8.7파운드
- ^ Stanetty, P; Koller, H.; Mihovilovic, M. (1992). "Directed ortho lithiation of phenylcarbamic acid 1,1-dimethylethyl ester (N-BOC-aniline). Revision and improvements". Journal of Organic Chemistry. 57 (25): 6833–6837. doi:10.1021/jo00051a030.
- ^ Fitt, J. J.; Gschwend, H. E. (1984). "Reaction of n-, sec-, and tert-butyllithium with dimethoxyethane (DME): a correction". Journal of Organic Chemistry. 49: 209–210. doi:10.1021/jo00175a056.
- ^ Errington, R. M. (1997). Advanced practical inorganic and metalorganic chemistry (Google Books excerpt). London: Blackie Academic & Professional. pp. 47–48. ISBN 978-0-7514-0225-4.
- ^ "Harran Lab: UCLA".
- ^ Jyllian Kemsley (2009-01-22). "Researcher Dies After Lab Fire". Chemical & Engineering News.
- ^ Jyllian Kemsley (2009-04-03). "Learning From UCLA: Details of the experiment that led to a researcher's death prompt evaluations of academic safety practices". Chemical & Engineering News.
- ^ 로스앤젤레스 타임스, 2009-03-01






