리튬 비스(트리메틸실릴)아미드
Lithium bis(trimethylsilyl)amide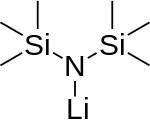 모노머(존재하지 않음) | |
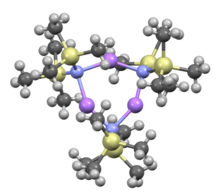
 순환 트리머 | |
 | |
| 이름 | |
|---|---|
| 선호 IUPAC 이름 리튬 1,1,1-트리메틸-N-(트리메틸실릴)실라노아민화 리튬 | |
| 기타 이름 헥사메틸디실라자이드 리튬 헥사메틸디실라잔 리튬염 | |
| 식별자 | |
| |
3D 모델(JSmol) | |
| 켐스파이더 | |
| ECHA InfoCard | 100.021.569 |
펍켐 CID | |
| 유니 | |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| 슐리엔시6182 | |
| 어금질량 | 167.326 g/167 |
| 외관 | 화이트솔리드 |
| 밀도 | 25°C에서 0.86g/cm3 |
| 녹는점 | 71~72°C(160~162°F, 344~345K) |
| 비등점 | 80 ~ 84 °C(176 ~ 183 °F, 353 ~ 357 K)(0.001 mm Hg) |
| 부패하다 | |
| 용해성 | 가장 무첨가 용제 THF, 헥산, 톨루엔 |
| 산도(pKa) | 26 |
| 위험 | |
| 주요 위험 | 인화성 부식성 |
| 관련 화합물 | |
관련 화합물 | 나트륨 비스(트리메틸실릴)아미드 비스(트리메틸실릴)아미드 칼륨 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
리튬 bis(트리메틸실릴)amide는 LiN(SiMe3)이라는 공식을 가진 석판 오르가노실리콘 화합물이다.2 일반적으로 LiHmDS(리튬 헥사메틸디실라자이드 - 그것의 결합산 HMDS를 가리키는 말)로 약칭되며, 주로 강력한 비핵세포 염기 및 리간드로 사용된다. 많은 리튬 시약과 마찬가지로 응집하는 경향이 있으며, 조정종이 없을 경우 주기적인 트리머를 형성하게 된다.
준비
LiHMDS는 상업적으로 구할 수 있지만, 또한 n-butyllithium으로 bis(트리메틸실릴)amine을 디프로토닝하여 준비할 수 있다.[1] 이 반응은 현장에서 수행할 수 있다.[2]
- HN(SiMe3)2 + C4H9Li → LiN(SiMe3)2 + C4H10
일단 형성되면, 그 화합물은 승화 또는 증류에 의해 정화될 수 있다.
반응 및 응용 프로그램
베이스로
LiHMDS는 강력한 비핵세포 기반으로서 유기화학에 자주 사용된다.[3] 그것의 결합산은 pKa ~26으로 [4]LDA(결합산 ~36의 pKa)와 같은 다른 리튬 베이스에 비해 기초가 약하지만, 강직적으로 방해를 받아 핵소독성이 떨어진다. 아세틸라이드나[3] 리튬 에놀레이트 등 다양한 유기석 화합물을 형성하는 데 사용할 수 있다.[2]
이와 같이, 그것은 다양한 결합 반응, 특히 Frater-Seebach 알킬레이션과 혼합된 Claisen 응축과 같은 반응을 형성하는 탄소-탄소 결합에서 사용을 발견한다.
테트라술푸르 사트라니트라이드의 대체합성은 사전 형성된 S-N 결합을 가진 전구체로 [(MeSi3)2N]2S를 사용하는 것을 수반한다. [(MeSi3)2N]2S는 리튬 bis(트리메틸실릴)아미드와 황 디클로로이드(SCL2)의 반응에 의해 준비된다.
- 2 [(CH3)3Si]2NLi + SCl2 → [(CH3)3Si]22S + 2 LiCl
[((CH3)32Si)2N]S는 SCl과2 SOCl22(Sulfuryl Socl)의 조합에 반응하여 SN44, Trimethylsilyl 염화물 및 이산화황:[5]
- 2[(CH3)32Si)2N + 2SCL2 + 2SOCl22 → SN44 + 8 (CH3)3SiCl + 2SO2
리간드로
LiHMDS는 금속 bis(트리메틸실릴) 아미드를 주기 위해 염기 계량 반응에 의해 광범위한 금속 할로겐화물과 반응할 수 있다.
- MXx + x Li(hmds) → M(hmds)x + x LiX
- (X = Cl, Br, I 및 때로는 F)
금속 bis(트리메틸실릴)아미드 복합체는 리간드로 인해 지방질이 많아 비극성 유기용제 범위에 용해되기 때문에 해당 금속 할리드보다 반응성이 높아 용해되기 어려운 경우가 많다. 리간드의 단단한 덩어리는 그들의 콤플렉스가 별개의 단조로움을 유발하고 그들의 반응성을 더욱 증가시킨다. 이러한 화합물은 기본이 내장되어 있어 다른 금속 콤플렉스를 주기 위해 원생 리간드 전구체와 편리하게 반응하므로 더욱 복잡한 조정 화합물의 중요한 전구체다.[6]
틈새 용도
LiHmDS는 휘발성이 있으며 리튬 화합물의 원자층 증착에 사용하기 위해 논의되어 왔다.[7]
구조
다른 유기석 시약들처럼 리튬 비스(트리메틸실릴)아미드는 용액에서 골재를 형성할 수 있다. 집계의 정도는 용매에 달려 있다. 에테르나[8] 아민과 같은 용제를 조정하는데 있어서,[9] 모노머와 조광기가 널리 퍼져 있다. 단조롭고 희미한 상태에서는 한두 개의 용제 분자가 리튬 중심부에 결합한다. 암모니아를 도너 베이스로 하여 리튬 비스(트리메틸실릴)아미드가 분자간 수소 결합에 의해 안정되는 삼이소화 단량체를 형성한다.[10][11] 아로마틱스나 펜탄과 같이 조정되지 않는 용매에서는 트리머를 포함한 복잡한 과점자가 우세하다.[9] 솔리드 스테이트 구조는 트리머릭하다.[12]
 | ||||
 TMEDA 포함 LiHMDS 유도 |  THF 용융 조광기: (LiHMDS)•2THF2 |  트리머, 용제 미포함: (LiHMDS)3 | ||
참고 항목
참조
- ^ Amonoo-Neizer, E. H.; Shaw, R. A.; Skovlin, D. O.; Smith, B. C. (1966). "Lithium Bis(Trimethylsilyl)Amide and Tris(Trimethylsilyl)Amine". Inorg. Synth. Inorganic Syntheses. 8: 19–22. doi:10.1002/9780470132395.ch6. ISBN 978-0-470-13239-5.
- ^ a b Danheiser, R. L.; Miller, R. F.; Brisbois, R. G. (1990). "Detrifluoroacetylative Diazo Group Transfer: (E)-1-Diazo-4-phenyl-3-buten-2-one". Organic Syntheses. 73: 134.; Collective Volume, 9, p. 197
- ^ a b Wu, George; Huang, Mingsheng (July 2006). "Organolithium Reagents in Pharmaceutical Asymmetric Processes". Chemical Reviews. 106 (7): 2596–2616. doi:10.1021/cr040694k. PMID 16836294.
- ^ Fraser, Robert R.; Mansour, Tarek S.; Savard, Sylvain (August 1985). "Acidity measurements on pyridines in tetrahydrofuran using lithiated silylamines". The Journal of Organic Chemistry. 50 (17): 3232–3234. doi:10.1021/jo00217a050.
- ^ Maaninen, A.; Shvari, J.; Laitinen, R. S.; Chivers, T (2002). Coucouvanis, Dimitri (ed.). "Compounds of General Interest". Inorganic Syntheses. New York: John Wiley & Sons, Inc. 33: 196–199. doi:10.1002/0471224502.ch4.
- ^ Michael Lappert, Andrey Protchenko, Philip Power, Alexandra Seeber (2009). Metal Amide Chemistry. Weinheim: Wiley-VCH. doi:10.1002/9780470740385. ISBN 0-470-72184-7.CS1 maint: 여러 이름: 작성자 목록(링크)
- ^ Hämäläinen, Jani; Holopainen, Jani; Munnik, Frans; Hatanpää, Timo; Heikkilä, Mikko; Ritala, Mikko; Leskelä, Markku (2012). "Lithium Phosphate Thin Films Grown by Atomic Layer Deposition". Journal of the Electrochemical Society. 159 (3): A259–A263. doi:10.1149/2.052203jes.
- ^ Lucht, Brett L.; Collum, David B. (1995). "Ethereal Solvation of Lithium Hexamethyldisilazide: Unexpected Relationships of Solvation Number, Solvation Energy, and Aggregation State". Journal of the American Chemical Society. 117 (39): 9863–9874. doi:10.1021/ja00144a012.
- ^ a b Lucht, Brett L.; Collum, David B. (1996). "Lithium Ion Solvation: Amine and Unsaturated Hydrocarbon Solvates of Lithium Hexamethyldisilazide (LiHMDS)". Journal of the American Chemical Society. 118 (9): 2217–2225. doi:10.1021/ja953029p.
- ^ Neufeld, R.; Michel, R.; Herbst-Irmer, R.; Schöne, R.; Stalke, D. (2016). "Introducing a Hydrogen-Bond Donor into a Weakly Nucleophilic Brønsted Base: Alkali Metal Hexamethyldisilazides (MHMDS, M = Li, Na, K, Rb and Cs) with Ammonia". Chem. Eur. J. 22: 12340–12346. doi:10.1002/chem.201600833. PMID 27457218.
- ^ Neufeld, R.: DOSY 외부 교정 곡선 분자량 측정 방법론 솔루션에서 반응성 매개체의 특성화에 있어 중요한 방법론으로서의 분자량 측정. 인: eDiss, Georg-Augustitette Göttingen. 2016.
- ^ Rogers, Robin D.; Atwood, Jerry L.; Grüning, Rainer (1978). "The crystal structure of N-lithiohexamethyldisilazane, [LiN(SiMe3)2]3". J. Organomet. Chem. 157 (2): 229–237. doi:10.1016/S0022-328X(00)92291-5.



