발포세포
Foam cell| 발포세포 | |
|---|---|
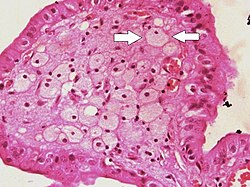 콜레스테롤 증상의 경우 담낭 루멘에 대한 손가락 모양의 투영에서 볼 수 있는 발포 세포(화살표로 표시된 세포) | |
| 세부 사항 | |
| 전구체 | 모노키테를 함유한 대식세포 |
| 식별자 | |
| 메슈 | D005487 |
| FMA | 83586 |
| 미세조영술의 해부학적 용어 | |
지질이 많은 대식세포라고도 불리는 거품세포는 콜레스테롤이 함유된 세포의 일종이다. 이것들은 아테롬성 경화증을 유발할 수 있고 심장마비와 뇌졸중을 유발할 수 있는 명판을 형성할 수 있다.[1][2][3]
폼 셀은 저밀도 리포단백질(LDL)을 함유한 지방이 많은 M2 대식세포다. 그것들은 몸에서 제거된 후에 현미경으로 지방 플라그를 조사해야만 진정으로 검출될 수 있다.[4] 그것들은 지단백질이 세포에 거품을 일으키기 때문에 붙여진 이름이다.[5]
심혈관 질환과의 연관성에도 불구하고 그것들은 본질적으로 위험한 것은 아니다.[6]
포메이션
폼 셀 형성은 변형된 저밀도 지단백질(LDL)의 통제되지 않은 섭취, 콜레스테롤 에스테르화의 상향 조절 및 콜레스테롤 배출과 관련된 메커니즘의 손상 등 여러 요인에 의해 유발된다.[2] 거품세포는 순환하는 단세포에서 유래된 세포가 무신경화성 병변 부위에 포집되거나 혈관벽에 지방 퇴적물이 있을 때 형성된다. 모집은 분자 P-selectin과 E-selectin, 세포간 접착 분자 1(ICAM-1) 및 혈관 세포 접착 분자 1(VCAM-1)에 의해 촉진된다.[7] 그리고 나서 단세포는 투과성을 증가시키는 내피성 건전성 저하로 인해 동맥벽을 투과할 수 있다. 일단 소내피질 공간에 들어가면 염증 과정은 단세포의 분화를 성숙한 대식세포로 유도한다.[7] Macrophages are then able to internalize modified lipoproteins like βVLDL (beta very low density lipoprotein), AcLDL (acetylated low density lipoprotein) and OxLDL (oxidized low density lipoprotein) through their binding to the scavenger receptors (SRs) such as CD36 and SR-A on the macrophage surface.[2] 이러한 스캐빈저 수용체들은 대식세포에서 '패턴인식 수용체'(PRR) 역할을 하며, oxLDL에 대한 인식과 결합을 담당하며, 이는 다시 이들 지단백질의 내장을 통해 폼세포 형성을 촉진한다.[8] 코팅된 피트의 내포증, 포자낭증, 피노시토증도 지단백질 내복의 원인이다.[9] 일단 체내화되면, 분해된 리포단백질을 분해하기 위해 엔도솜이나 리소솜으로 운반하고, 여기서 처스테릴 에스테르(CE)에 의해 리소솜산 리파아제(LPL)에 의해 무증정 자유콜레스테롤(FC)으로 가수 분해된다. 자유콜레스테롤은 내포체성 망막으로 운반되어 ACAT1(ACyl-CoA:콜레스테롤 아킬전달효소 1)에 의해 재상쇄되고 이후 세포질 액체 방울로 저장된다. 이 물방울들은 대식세포의 거품이 많이 생겨 거품세포의 명칭에 영향을 미친다.[2] 이 때, 폼 세포는 콜레스테롤의 탈절제와 분비를 통해 분해되거나, 자유 콜레스테롤과 에스테르화 콜레스테롤의 균형에 의존하는 과정인 폼 세포의 발달과 플라그 형성을 더욱 촉진시킬 수 있다.[2]
구성
저밀도 지단백질(LDL-C) 콜레스테롤과 특히 산화, 당화 또는 아세틸화 LDL과 같은 LDL 콜레스테롤의 변형된 형태는 거품 세포에 의해 포함되어 있다. - 아테롬성 경화증의 표시.[3] LDL-C만 흡수해도 폼 셀 형성이 발생하지는 않지만, 대식세포에서 LDL이 변형된 LDL과 LDL-C의 공동 내부가 형성되면 폼 셀 형성이 발생할 수 있다. 수정된 LDL은 고유 LDL의 세포내 인신매매와 신진대사에 영향을 미치므로 LDL 수치가 높을 때 폼 셀 형성을 위해 모든 LDL을 수정할 필요는 없다.[9]
거품 세포의 유지와 그에 따른 플라그 증식의 진행은 대식세포와 폼세포에서 케모카인과 사이토카인이 분비되어 발생한다. 거품 세포는 인터루킨: IL-1, IL-6; 종양 괴사 인자(TNF), 케모킨: 케모킨 리간드 2, CCL5, CXC-케모킨 리간드 1 (CXCL1)과 같은 프로염증 시토카인을 분비한다.[8] 무신경화 군단 내 대식세포는 이동 능력이 감소해 사이토카인, 화학적 산소종(ROS)과 변형된 지단백질 흡수와 혈관 평활근세포(VSMC) 증식을 자극하는 성장인자를 분비할 수 있어 플라그 형성을 더욱 촉진한다.[7][6][10] VSMC는 또한 처마돌 에스테르를 축적할 수 있다.[6]
만성 고지혈증에서는 지단백질이 혈관의 인티마 내에서 응집되며 대식세포나 내피세포에 의해 생성되는 산소 유리기의 작용에 의해 산화된다. 대식세포는 LDL 수용체와 구별되는 스캐빈저 수용체를 통한 내분비증에 의해 산화된 저밀도 지질단백질(LDLs)을 집어삼킨다. 산화된 LDL은 대식세포와 다른 파그모세포에 축적되는데, 이를 거품세포라고 한다.[11] 거품 세포는 동맥의 튜니카 인티마에서 무테로마 판의 지방 줄기를 형성한다.
거품 세포는 그렇게 위험하지는 않지만, 특정한 집중에 축적되면 문제가 될 수 있고, 따라서 괴사성 동맥경화증의 중심이 된다. 괴사성 중심이 혈관 파열부의 루멘으로 흘러 들어가는 것을 막는 섬유성 캡이 형성되면 혈전( form戰)이 형성되어 작은 혈관을 방부시킬 수 있다. 작은 혈관을 폐쇄하면 허혈이 발생하며 심혈관계 사망의 주요 원인 중 하나인 뇌졸중과 심근경색에 기여한다.[6]
거품 세포는 크기가 매우 작으며, 체내에서 제거된 후, 또는 더 구체적으로 심장에서 지방 플라그를 현미경으로 조사해야만 진정으로 검출할 수 있다. 검출은 보통 대동맥동맥동맥동맥동맥동맥동맥동맥동맥동맥의 얼룩에 이어 컴퓨터 이미징과 분석이 뒤따른다. 또한 OxLDL에 1,1′-dioctadecyl-3,3′-3′-tetra-Methylindocyanide 과콜로이드(DiI-OxLDL) 라벨을 붙였을 때 형광 현미경이나 흐름 시토메트리를 사용하여 OxL의 흡수를 검출할 수 있다.[4]
자기 면역성은 몸이 자신을 공격하기 시작할 때 발생한다. 아테롬성 동맥경화와 자가면역성의 연결고리는 플라스마시토이드 덴드리트 세포(pDC)이다. PDC는 제1형 인터페론(INF)을 대량으로 방출함으로써 혈관에 무신경화성 병변이 형성되는 초기 단계에 기여한다. pDC의 자극은 플라크로 존재하는 대식세포의 증가로 이어진다. 그러나 병변 진행의 후기 단계에서 pDC는 T세포와 Treg 기능을 활성화하여 질병 억제를 유도함으로써 보호 효과를 갖는 것으로 나타났다.[12]
분해
거품 세포의 저하 또는 보다 구체적으로는 에스테르화 콜레스테롤의 분해는 다수의 유출 수용체와 경로에 의해 촉진된다. 세포질 액체 방울에서 나온 에스테르화 콜레스테롤은 산성 콜레스테롤 에스테라아제에 의해 콜레스테롤을 자유롭게 하기 위해 다시 한번 가수분해된다. 그런 다음 ABCA1 수용체를 통해 아포A1과 아포E 디스크로 유출되어 대식세포로부터 자유 콜레스테롤을 분비할 수 있다. 이 경로는 AcLDL, OxLDL, βVLDL과 같은 변형되거나 병적인 지질단백질에 의해 주로 사용된다. FC는 또한 HDLs(고밀도 지질단백질)를 함유한 ApoA1로 유출되거나 SR-B1 수용체 또는 ABCG1 수용체를 통한 수송을 통해 재활용 구획으로 운송될 수 있다. 이 통로는 변형된 지단백질에 의해서도 사용될 수 있지만, LDL에서 파생된 콜레스테롤은 FC를 배설하는 데만 이 통로를 사용할 수 있다. 지단백질 유형들 간의 배설 경로의 차이는 주로 콜레스테롤이 다른 영역으로 분리되는 결과물이다.[2][6][13]
전염병
거품성 대식세포는 클라미디아, 톡소플라즈마, 미코박테리움 결핵 등 몸에 지속되는 병원균에 의해 생기는 병에서도 발견된다. 결핵(TB)에서는 박테리아 지질들이 과도한 LDL을 뿜어내는 대식세포들을 무력화시켜 폐에 있는 결핵 그래룰로마 주변에서 거품세포로 변하게 한다. 콜레스테롤은 박테리아에게 풍부한 음식 공급원을 형성한다. 대식세포가 죽으면서 과립종 중앙의 콜레스테롤 질량은 카세움이라는 오글쪼글한 물질이 된다.[14]
기타조건
가슴 성형수술로 유출된 실리콘 주위에 폼 셀이 형성될 수 있다.[15] 폐포말세포라고도 알려진 지방성 치핵 대식세포는 일부 호흡기 질환의 뇌척수막 세척 시료에서 볼 수 있다.[16]
참조
- ^ Hotamisligil GS (April 2010). "Endoplasmic reticulum stress and atherosclerosis". Nature Medicine. 16 (4): 396–9. doi:10.1038/nm0410-396. PMC 2897068. PMID 20376052.
- ^ a b c d e f Yu XH, Fu YC, Zhang DW, Yin K, Tang CK (September 2013). "Foam cells in atherosclerosis". Clinica Chimica Acta. 424: 245–52. doi:10.1016/j.cca.2013.06.006. PMID 23782937.
- ^ a b Oh J, Riek AE, Weng S, Petty M, Kim D, Colonna M, Cella M, Bernal-Mizrachi C (April 2012). "Endoplasmic reticulum stress controls M2 macrophage differentiation and foam cell formation". The Journal of Biological Chemistry. 287 (15): 11629–41. doi:10.1074/jbc.M111.338673. PMC 3320912. PMID 22356914.
- ^ a b Xu S, Huang Y, Xie Y, Lan T, Le K, Chen J, Chen S, Gao S, Xu X, Shen X, Huang H, Liu P (October 2010). "Evaluation of foam cell formation in cultured macrophages: an improved method with Oil Red O staining and DiI-oxLDL uptake". Cytotechnology. 62 (5): 473–81. doi:10.1007/s10616-010-9290-0. PMC 2993859. PMID 21076992.
- ^ "Foam cells - Latest research and news Nature".
- ^ a b c d e 린튼 MF, 옌시 PG, 데이비스 SS 등. 아테롬성 동맥경화에서 지질 및 지질단백질의 역할. [2015년 12월 24일 업데이트됨] In: De Groot LJ, Chruos G, Dungan K, 등, 편집자. Endotext [인터넷]. 사우스다트머스 (MA): MDText.com, Inc.; 2000- https://www.ncbi.nlm.nih.gov/books/NBK343489에서 이용 가능:
- ^ a b c Bobryshev YV, Ivanova EA, Chistiakov DA, Nikiforov NG, Orekhov AN (2016). "Macrophages and Their Role in Atherosclerosis: Pathophysiology and Transcriptome Analysis". BioMed Research International. 2016: 9582430. doi:10.1155/2016/9582430. PMC 4967433. PMID 27493969.
- ^ a b Moore KJ, Sheedy FJ, Fisher EA (October 2013). "Macrophages in atherosclerosis: a dynamic balance". Nature Reviews. Immunology. 13 (10): 709–21. doi:10.1038/nri3520. PMC 4357520. PMID 23995626.
- ^ a b Jones NL, Reagan JW, Willingham MC (March 2000). "The pathogenesis of foam cell formation: modified LDL stimulates uptake of co-incubated LDL via macropinocytosis". Arteriosclerosis, Thrombosis, and Vascular Biology. 20 (3): 773–81. doi:10.1161/01.atv.20.3.773. PMID 10712403.
- ^ Shen CM, Mao SJ, Huang GS, Yang PC, Chu RM (December 2001). "Stimulation of smooth muscle cell proliferation by ox-LDL- and acetyl LDL-induced macrophage-derived foam cells". Life Sciences. 70 (4): 443–52. doi:10.1016/s0024-3205(01)01428-x. PMID 11798013.
- ^ 쿠마르, 압바스, 파우스토, 아스테르(2010년) "11". 로빈스와 코트란: 병리학적 질병 기반 (Eight Edition International Edd.) 필라델피아: Sunders Exvier. 페이지 500–501. ISBN 978-1-4160-3121-5
- ^ Döring Y, Zernecke A (2012). "Plasmacytoid dendritic cells in atherosclerosis". Frontiers in Physiology. 3: 230. doi:10.3389/fphys.2012.00230. PMC 3385355. PMID 22754539.
- ^ Wang MD, Kiss RS, Franklin V, McBride HM, Whitman SC, Marcel YL (March 2007). "Different cellular traffic of LDL-cholesterol and acetylated LDL-cholesterol leads to distinct reverse cholesterol transport pathways". Journal of Lipid Research. 48 (3): 633–45. doi:10.1194/jlr.M600470-JLR200. PMID 17148552.
- ^ Russell DG, Cardona PJ, Kim MJ, Allain S, Altare F (September 2009). "Foamy macrophages and the progression of the human tuberculosis granuloma". Nature Immunology. 10 (9): 943–8. doi:10.1038/ni.1781. PMC 2759071. PMID 19692995.
- ^ van Diest, P J; Beekman, W H; Hage, J J (1998). "Pathology of silicone leakage from breast implants". Journal of Clinical Pathology. 51 (7): 493–497. doi:10.1136/jcp.51.7.493. PMC 500799. PMID 9797723.
- ^ Fessler, Michael B. (2017). "A New Frontier in Immunometabolism. Cholesterol in Lung Health and Disease". Annals of the American Thoracic Society. 14 (Supplement_5): S399–S405. doi:10.1513/AnnalsATS.201702-136AW. ISSN 2329-6933. PMC 5711269. PMID 29161079.


