리간드
Ligand
배위 화학에서 리간드는[a] 중심 금속 원자와 결합하여 배위 복합체를 형성하는 작용기를 가진 이온 또는 분자입니다. 금속과의 결합은 일반적으로 Lewis 염기를 통해 리간드의 전자 쌍 중 하나 이상을 공식적으로 기증하는 것을 포함합니다.[1] 금속-리간드 결합의 성질은 공유에서 이온에 이르기까지 다양합니다. 또한 금속-리간드 결합 순서는 1에서 3까지 가능합니다. 리간드는 루이스 염기로 간주되지만 드물게는 루이스 산성 "리간드"를 포함하는 것으로 알려져 있습니다.[2][3]
금속과 메탈로이드는 거의 모든 환경에서 리간드에 결합되어 있지만, 기체 상태의 "네이키드" 금속 이온은 높은 진공에서 생성될 수 있습니다. 복합체 내의 리간드는 리간드 치환율, 리간드 자체의 반응성, 산화 환원을 포함한 중심 원자의 반응성을 지시합니다. 리간드 선택은 생체 무기 및 의약 화학, 균질 촉매 및 환경 화학을 포함한 많은 실용적인 분야에서 비판적인 고려를 필요로 합니다.
리간드는 전하, 크기(벌크), 배위 원자의 정체, 금속에 기증된 전자의 수(덴티티 또는 햅틱) 등 여러 가지로 분류됩니다. 리간드의 크기는 원뿔 각도로 표시됩니다.
역사
프러시안 블루와 구리 바이탈과 같은 배위 복합체의 구성은 1800년대 초부터 알려져 왔습니다. 핵심적인 돌파구는 알프레드 베르너가 공식과 이성질체를 화해시켰을 때 일어났습니다. 그는 무엇보다도 금속이 팔면체 기하학에서 6개의 리간드를 가지면 많은 코발트(III)와 크롬(III) 화합물의 공식을 이해할 수 있다는 것을 보여주었습니다. 리간드라는 용어를 처음 사용한 사람은 실리콘 화학과 관련하여 알프레드 베르너와 칼 소미에스키입니다. 이 이론을 통해 염화코발트암민염화물의 배위 염화물과 이온 염화물의 차이를 이해하고 이전에 설명할 수 없는 많은 이성질체를 설명할 수 있습니다. 그는 헥솔이라고 불리는 최초의 배위 복합체를 광학 이성질체로 분해하여 키랄성이 탄소 화합물과 반드시 연관되어 있다는 이론을 뒤집었습니다.[4][5]
강한 필드 및 약한 필드 리간드
일반적으로 리간드는 전자 공여체, 금속은 전자 수용체, 즉 각각 루이스 염기 및 루이스 산으로 간주됩니다. 이 설명은 ECW 모델과 같은 여러 가지 방법으로 반 정량화되었습니다. 결합은 종종 분자 궤도 이론의 형식론을 사용하여 설명됩니다.[6][7]
리간드와 금속 이온은 여러 가지 방법으로 정렬될 수 있습니다. 하나의 순위 시스템은 리간드 '경도'에 초점을 맞춥니다(경도/연산/염기 이론 참조). 금속 이온은 특정 리간드에 우선적으로 결합합니다. 일반적으로 '경질' 금속 이온은 약한 필드 리간드를 선호하는 반면, '연질' 금속 이온은 강한 필드 리간드를 선호합니다. 분자 궤도 이론에 따르면 리간드의 HOMO(최고 점유 분자 궤도)는 금속 우선의 LUMO(최저 점유 분자 궤도)와 겹치는 에너지를 가져야 합니다. 강장 리간드에 결합된 금속 이온은 Aufbau 원리를 따르는 반면, 약장 리간드에 결합된 복합체는 Hund의 규칙을 따릅니다.
금속과 리간드의 결합은 분자 오비탈의 집합을 생성하며, 여기서 금속은 새로운 HOMO 및 LUMO(생성된 복합체의 특성 및 반응성을 정의하는 오비탈) 및 5d 오비탈의 특정 순서(전자로 채워지거나 부분적으로 채워질 수 있음)로 식별될 수 있습니다. 팔면체 환경에서 축퇴된 5개의 궤도는 3개와 2개의 궤도로 분할됩니다(자세한 설명은 결정장 이론 참조).
- 낮은 에너지의 세 궤도: dxy, d, d 그리고xzyz
- 높은 에너지의 두 궤도: d와z2x2−y2 d.
이 두 개의 d-궤도 사이의 에너지 차이를 분할 파라미터, δ라고 합니다. δ의 크기는 리간드의 필드 강도에 의해 결정됩니다: 강한 필드 리간드는 정의에 따라 약한 필드 리간드보다 δ를 더 증가시킵니다. 이제 리간드를 δ의 크기에 따라 정렬할 수 있습니다(아래 표 참조). 이러한 리간드의 순서는 모든 금속 이온에 대해 거의 변하지 않으며 분광화학 계열이라고 불립니다.
사면체로 둘러싸인 복합체의 경우, d-궤도는 다시 두 집합으로 나뉘지만, 이번에는 역순으로 다음과 같습니다.
- 낮은 에너지의 두 궤도: d와z2 d 그리고x2−y2
- 높은 에너지의 세 궤도: dxyxz, dyz, d.
이 두 개의 d-궤도 사이의 에너지 차이를 이제 δ라고 합니다. δ의 크기는 δ보다 작습니다. 왜냐하면 사면체 복합체에서는 4개의 리간드만이 d-궤도에 영향을 미치는 반면, 팔면체 복합체에서는 d-궤도가 6개의 리간드에 의해 영향을 받기 때문입니다. 배위수가 팔면체도 사면체도 아닌 경우 분할은 그만큼 더 복잡해집니다. 그러나 리간드의 순위를 매기는 목적을 위해 팔면체 복합체의 특성과 결과적인 δ이 주요 관심사였습니다.
리간드의 '강도'에 의해 결정되는 중심 원자에 대한 d-궤도의 배열은 결과 복합체의 거의 모든 특성에 강력한 영향을 미칩니다. 예를 들어, d-궤도의 에너지 차이는 금속 복합체의 광학 흡수 스펙트럼에 강한 영향을 미칩니다. 상당한 3 d-궤도 특성을 가진 궤도를 차지하는 원자가 전자는 스펙트럼의 400-800 nm 영역(UV-가시 범위)에서 흡수하는 것으로 나타났습니다. 이러한 전자에 의한 빛의 흡수(즉, 빛의 영향을 받아 한 궤도에서 다른 궤도로 전자가 여기됨)는 리간드의 결합 특성을 반영하는 금속 복합체의 바닥 상태와 상관될 수 있습니다. 리간드의 전계 강도 함수로서 d-궤도의 상대적인 에너지 변화는 타나베-스가노 도표에 설명되어 있습니다.
리간드가 낮은 에너지 LUMO를 갖는 경우, 이러한 오비탈도 결합에 참여합니다. 금속-리간드 결합은 리간드에 전자 밀도를 다시 공식적으로 공여함으로써 백-결합으로 알려진 과정에 의해 더욱 안정화될 수 있습니다. 이 경우 채워진 중앙 원자 기반 궤도는 밀도를 (배열된) 리간드의 LUMO에 제공합니다. 일산화탄소는 역기증을 통해 금속과 결합하는 리간드가 대표적인 예입니다. 보완적으로, 파이 대칭의 낮은 에너지가 채워진 궤도를 가진 리간드는 파이 공여체 역할을 할 수 있습니다.


리간드를 L과 X로 분류
특히 유기금속 화학 분야에서는 리간드를 L과 X(또는 이 둘의 조합)로 분류합니다. 공유 결합 분류를 위한 "CBC 방법"이라는 분류 체계는 M.L.H. Green에 의해 대중화되었으며 "[리간드의] 세 가지 기본 유형이 있다는 개념에 기반을 두고 있습니다. 각각 2-전자, 1-전자 및 0-전자 중성 리간드에 해당하는 기호 L, X 및 Z로 표시됩니다."[8][9] 고려할 만한 또 다른 리간드 유형은 사용된 기존 표현에서 예상되는 대로 NVE(원자가 전자의 수)가 필요한 경우 3개의 전자를 제공하는 LX 리간드입니다. 알콕시 리간드(일반적으로 X 리간드라고도 함)가 그 예입니다. 리간드는 전하 중성 전구체에서 유래하며 아민, 포스핀, CO, N 및2 알켄으로 표시됩니다. X 리간드는 일반적으로 염화물과 같은 음이온 전구체에서 유래하지만 수소화물 및 알킬과 같이 음이온의 염이 실제로 존재하지 않는 리간드를 포함합니다. 따라서 CO와 두 PPh3 리간드가 Ls로 분류되기 때문에 복합체 IrCl(CO)(PPh3)2은 MXL3 복합체로 분류됩니다. IrCl(CO)(PPH3)2에 H를2 산화적으로 첨가하면 18e− MLX33 제품인 IrClH2(CO)(PPH3)가 생성됩니다.2 EDTA는4− 4개의 음이온과 2개의 중성 공여 부위를 특징으로 하기 때문에 LX24 리간드로 분류됩니다. Cp는 LX2 리간드로 분류됩니다.[10]
리간드 유형에 따른 전자 계수
리간드 유형에 기초한 유기금속 화학에서 전자 계수는 전자 공여 능력에 기초하여 리간드에 특정 수의 전자를 할당하는 것을 포함합니다. 서로 다른 리간드(L, X 또는 Z)는 유기금속 복합체의 전체 전자 수에 다양한 수의 전자를 제공합니다.[11]
- 주 그룹 리간드(X형 리간드):
- 알킬(예: CH ₃, C ₂H ₅): 각각의 알킬기는 일반적으로 하나의 전자 공여체로 간주됩니다.
- 아릴(예: Ph, C ₆H ₅): 알킬과 유사하게, 각 아릴기는 전형적으로 하나의 전자 공여체로 간주됩니다.
- 수소화물(H ⁻): 각각의 수소화물 이온은 하나의 전자를 기여합니다.
- π-기증자 리간드(L형 리간드):
- 올레핀(예: 에틸렌, C ₂H ₄): 각각의 π 결합 전자 쌍은 일반적으로 하나의 전자 공여체로 계산됩니다.
- 디엔(예: 부타디엔, C ₄H ₆): 각각의 π 결합 전자 쌍이 계산됩니다.
- π-수용 리간드(Z형 리간드):
- 일산화탄소(CO): 각 CO 리간드는 π 결합이 존재하기 때문에 2전자 공여체로 간주됩니다.
- 이소시아나이드(예: RNC): CO와 유사하게 이소시아나이드는 2전자 공여체로 간주됩니다.
- 중성 리간드(예2: H, N2, O2):
- 중성 리간드는 결합 특성에 따라 전자 수에 기여할 수도 있고 그렇지 않을 수도 있습니다.[12]
폴리덴테이트 및 폴리합토 리간드 모티프 및 명명법
치열
덴티시티(denticity)는 리간드가 비연속적인 공여 부위를 통해 금속에 결합하는 횟수를 말합니다. 많은 리간드는 여러 부위를 통해 금속 이온을 결합할 수 있는데, 보통 리간드는 하나 이상의 원자에 단독 쌍을 가지고 있기 때문입니다. 하나 이상의 원자를 통해 결합하는 리간드를 종종 킬레이트라고 합니다. 두 개의 부위를 통해 결합하는 리간드는 이좌, 세 개의 부위는 삼좌로 분류됩니다. "물기 각도"는 이축 킬레이트의 두 결합 사이의 각도를 말합니다. 킬레이트화 리간드는 일반적으로 유기 링커를 통해 공여체 그룹을 연결함으로써 형성됩니다. 에틸렌디아민은 두 개의 암모니아 그룹이 에틸렌(-CHCH-22) 링커와 연결되어 유도되는 전형적인 2중 리간드입니다. 폴리덴테이트 리간드의 전형적인 예는 6개의 부위를 통해 결합할 수 있고, 일부 금속을 완전히 둘러싸고 있는 6개의 부위를 통해 결합할 수 있는 6개의 킬레이트제 EDTA입니다. 금속 중심에 다치환 리간드가 결합하는 횟수는 "κ"로 표시되며, 여기서 n은 리간드가 금속에 결합하는 부위의 수를 나타냅니다. EDTA는 6중성일 때 κ 리간드로 결합하고 아민과 카르복실레이트 산소 원자는 연속적이지 않습니다. 실제로 리간드의 n 값은 명시적으로 표시되지 않고 가정됩니다. 킬레이트 시스템의 결합 친화도는 킬레이트 각도 또는 바이트 각도에 따라 달라집니다.
다치환 리간드의 복합체를 킬레이트 복합체라고 합니다. 그들은 단일체 리간드에서 파생된 복합체보다 더 안정적인 경향이 있습니다. 킬레이트 효과라고 불리는 이러한 향상된 안정성은 일반적으로 엔트로피의 효과에 기인하며, 이는 하나의 다치 리간드에 의한 많은 리간드의 변위를 선호합니다.
킬레이트 효과와 관련된 것은 거대고리 효과입니다. 거대고리 리간드(macrocyclic ligand)는 적어도 부분적으로 중심 원자를 둘러싸고 그에 결합하여 중심 원자가 큰 고리의 중심에 있게 하는 모든 큰 리간드입니다. 단단하고 그 동일성이 높을수록, 거대고리 복합체는 더 불활성일 것입니다. 헴은 철 원자가 테트라피롤 거대고리의 4개의 질소 원자에 결합된 포르피린 거대고리의 중심에 있는 예입니다. 니켈의 매우 안정적인 디메틸글리옥시메이트 복합체는 디메틸글리옥심으로부터 유래된 합성 매크로사이클입니다.
햅틱
Hapticity(그리스 문자 η로 표시)는 공여 부위를 구성하고 금속 중심에 부착되는 연속적인 원자의 수를 나타냅니다. η 표기법은 여러 개의 원자가 배위되어 있을 때 적용됩니다. 예를 들어, η는 연속된 두 개의 원자를 통해 배위를 하는 리간드입니다. 부타디엔은 금속에 결합하는 탄소 원자의 수에 따라 η과 η 복합체를 형성한다는 점에 주목합니다.
리간드 모티프
이 섹션은 검증을 위해 추가 인용이 필요합니다. (2021년 1월)(본 및 안내 |
트랜스스패닝 리간드
트랜스 스패닝 리간드는 배위 복합체의 반대쪽의 배위 위치에 걸쳐 있을 수 있는 이변 리간드입니다.[16]
양변 리간드
다치 리간드와 달리, 양변 리간드는 두 곳 중 한 곳에 중심 원자에 부착할 수 있지만, 두 곳 모두에 부착할 수는 없습니다. 황 원자 또는 질소 원자에 부착할 수 있는 티오시아네이트, SCN이− 그 예입니다. 이러한 화합물은 연결 이성질화를 일으킵니다.
따라서 폴리덴테이트와 양변형은 서로 다른 리간드 원자를 통해 금속 중심에 결합하여 다양한 이성질체를 형성할 수 있는 두 가지 다른 유형의 다관능 리간드(기능성 그룹이 둘 이상인 리간드)입니다. 다치환 리간드는 한 원자와 다른 원자(또는 여러 다른 원자)를 동시에 통해 결합할 수 있는 반면, 양변 리간드는 한 원자 또는 다른 원자를 통해 결합합니다. 단백질은 다관능 리간드, 일반적으로 다관능 리간드의 복잡한 예입니다.
브리징 리간드
브리징 리간드는 두 개 이상의 금속 중심을 연결합니다. 사실상 단순한 공식을 가진 모든 무기 고체는 가교 리간드에 의해 연결된 금속 이온 중심으로 구성된 배위 폴리머입니다. 이 물질 그룹에는 무수 이성질체 금속 이온 할라이드 및 유사 할라이드가 모두 포함됩니다. 가교 리간드는 용액에서도 지속됩니다. 탄산염과 같은 다원자 리간드는 양쪽성이므로 종종 두 개 또는 세 개의 금속에 동시에 결합하는 것으로 밝혀집니다. 금속을 연결하는 원자는 접두사 "μ"로 표시되기도 합니다. 대부분의 무기 고체는 다수의 가교 리간드가 존재하기 때문에 고분자입니다. 복수의 금속 이온을 조정할 수 있는 브리징 리간드는 기능성 다중 금속 접합체의 제조를 위한 빌딩 블록으로서 잠재적인 사용으로 인해 상당한 관심을 받아 왔습니다.[17]
이핵 리간드
이핵 리간드는 두 개의 금속 이온을 결합합니다.[18] 일반적으로 이핵 리간드는 페녹사이드, 피라졸레이트, 피라진과 같은 가교 리간드와 두 금속 이온 중 하나에만 결합하는 다른 공여체 그룹을 특징으로 합니다.
금속-리간드 다중 결합
일부 리간드는 같은 원자를 통해 금속 중심에 결합할 수 있지만 다른 수의 단독 쌍과 결합할 수 있습니다. 금속 리간드 결합 각도(M-X-R)를 통해 금속 리간드 결합의 결합 순서를 부분적으로 구분할 수 있습니다. 이 결합 각도는 종종 각도가 구부러지는 정도에 대한 추가 논의와 함께 선형 또는 구부러진 것으로 언급됩니다. 예를 들어 이온 형태의 이미도 리간드는 3개의 단독 쌍을 가지고 있습니다. 하나의 단독 쌍은 시그마 X 공여체로 사용되며, 다른 두 개의 단독 쌍은 L형 파이 공여체로 사용할 수 있습니다. 두 개의 단독 쌍이 모두 파이 결합에 사용되는 경우 M-N-R 기하학은 선형입니다. 그러나 이 둘 중 하나 또는 둘 다 단독 쌍이 비결합일 경우 M-N-R 결합이 구부러지고 구부러진 정도가 얼마나 많은 파이 결합이 있을 수 있는지를 나타냅니다. η-산화질소는 선형 또는 구부러진 방식으로 금속 중심에 배위할 수 있습니다.
관중 리간드
구경 리간드는 화학 반응에는 참여하지 않지만 금속의 활성 부위를 제거하는 촘촘하게 배위된 다치 리간드입니다. 관중 리간드는 결합된 금속 중심의 반응성에 영향을 미칩니다.
부피가 큰 리간드
부피가 큰 리간드는 금속 중심부의 입체적 특성을 제어하는 데 사용됩니다. 실용적이고 학문적인 많은 이유로 사용됩니다. 실용적인 측면에서, 이들은 예를 들어 하이드로포밀화에서 금속 촉매의 선택성에 영향을 미칩니다. 학술적으로 흥미로운 점은 부피가 큰 리간드는 반응성 콜리간드 또는 낮은 배위 수와 같은 특이한 배위 부위를 안정화합니다. 종종 부피가 큰 리간드는 단백질이 금속 함유 활성 부위에 제공하는 입체 보호를 시뮬레이션하기 위해 사용됩니다. 물론 과도한 입체 벌크는 특정 리간드의 배위를 방지할 수 있습니다.

카이랄 리간드
카이랄 리간드는 배위 영역 내에서 비대칭을 유도하는 데 유용합니다. 종종 리간드는 광학적으로 순수한 그룹으로 사용됩니다. 2차 아민과 같은 경우에는 조정 시 비대칭이 발생합니다. 카이랄 리간드는 비대칭 수소화와 같은 균질한 촉매 작용에 사용됩니다.
헤미라빌 리간드
헤밀라빌 리간드는 적어도 두 개의 전자적으로 다른 배위 그룹을 포함하고 이들 중 하나는 금속 중심에서 쉽게 변위되고 다른 하나는 단단히 결합된 상태로 남아 있는 복합체를 형성하며, 이는 보다 전통적인 리간드의 사용과 비교할 때 촉매의 반응성을 증가시키는 것으로 밝혀졌습니다.
무결점 리간드
금속 중심부와 리간드 사이의 전자 밀도 분포가 불분명한 방식으로 무결점 리간드는 금속과 결합합니다. 무고한 리간드의 결합을 설명하는 것은 종종 전체 상태에 부분적으로 기여하는 여러 공명 형태를 작성하는 것을 포함합니다.
커먼 리간드
이 섹션은 검증을 위해 추가 인용이 필요합니다. (2021년 1월)(본 및 안내 |
사실상 모든 분자와 모든 이온은 금속의 리간드 역할을 할 수 있습니다. 단일체 리간드는 사실상 모든 음이온과 모든 단순한 루이스 염기를 포함합니다. 따라서 할로겐화물과 가성할라이드는 중요한 음이온 리간드인 반면 암모니아, 일산화탄소 및 물은 특히 일반적인 전하 중성 리간드입니다. 음이온성(RO− 및 RCO−
2) 또는 중성(RO2, RS2, RNH3−xx 및 RP3)인 단순 유기종도 매우 일반적입니다. 일부 리간드의 입체 특성은 원뿔 각도로 평가됩니다.
고전적인 루이스 염기와 음이온을 넘어 모든 불포화 분자도 리간드이며, 이들의 파이 전자를 이용하여 좌표 결합을 형성합니다. 또한 금속은 실란, 탄화수소, 디하이드로겐과 같은 σ 결합에 결합할 수 있습니다. 상호 작용(aggostic interaction).
무고한 리간드의 복합체에서 리간드는 기존의 결합을 통해 금속과 결합하지만 리간드는 산화환원 활성도 가지고 있습니다.
일반적인 리간드의 예(필드 강도별)
다음 표에서 리간드는 필드 강도[citation needed](약한 필드 리간드 먼저)에 따라 정렬됩니다.
| 리간드 | 공식(bonding 원자를 굵은 글씨로 표시) | 외상으로 하겠습니다. | 가장 흔한 아이덴티티 | 비고 |
|---|---|---|---|---|
| 요오드화물 (iodo) | I− | 단음이온성의 | 단일의 | |
| 브로마이드(브로미도) | 브르− | 단음이온성의 | 단일의 | |
| 황화물(티오 또는 그 이하 일반적으로 "하이브리드 티올레이트") | S2− | 다이오닉의 | 모노덴테이트(M=S) 또는 이좌표 브리징(M-S-M') | |
| 티오시아네이트(S-티오시아나토) | S−CN− | 단음이온성의 | 단일의 | 양쪽 방향(아래 이소티오시아네이트 참조) |
| 염화물(chlorido) | 클− | 단음이온성의 | 단일의 | 브리지도 발견했습니다. |
| 질산염(니트라토) | O−NO− 2 | 단음이온성의 | 단일의 | |
| 아지드 (아지도) | 엔엔− 2 | 단음이온성의 | 단일의 | 매우 독성이 있음 |
| 불소(플루오로) | F− | 단음이온성의 | 단일의 | |
| 수산화물(hydroxido) | 오에이치− | 단음이온성의 | 단일의 | 종종 가교 리간드로 발견되는 |
| 옥살레이트(옥살라토) | [O−CO−CO−O]2− | 다이오닉의 | 양면의 | |
| 물(아쿠아) | 오에이치2 | 중립의 | 단일의 | |
| 아질산염(질산염) | O−N−O− | 단음이온성의 | 단일의 | 양면성(니트로 참조) |
| 이소티오시아네이트(이소티오시아나토) | N=C=S | 단음이온성의 | 단일의 | 양쪽 방향(위의 티오시아네이트 참조) |
| 아세토니트릴(아세토니트릴로) | CH3CN | 중립의 | 단일의 | |
| 피리딘(py) | C5H5N | 중립의 | 단일의 | |
| 암모니아(암민 또는 덜 일반적으로 "암미노") | NH3 | 중립의 | 단일의 | |
| 에틸렌디아민(en) | NH2−CH2−CH2−NH2 | 중립의 | 양면의 | |
| 2,2'-Bipyridine (bipy) | NC5H4−C5H4N | 중립의 | 양면의 | 그것의 (radical) 음이온 또는 심지어 디안이온으로 쉽게 환원되는. |
| 1,10-페난트롤린(펜) | C12H8N2 | 중립의 | 양면의 | |
| 아질산염(질산염) | N−O− 2 | 단음이온성의 | 단일의 | 양면성(니트리토 참조) |
| 트리페닐포스핀 | P−(C6H5)3 | 중립의 | 단일의 | |
| 시안화물(시아노) | C ≡N N ≡C | 단음이온성의 | 단일의 | 금속(C에 결합된 두 금속, 또는 C에 결합된 금속과 N에 결합된 금속) 사이를 연결할 수 있습니다. |
| 일산화탄소(카보닐) | –CO, 기타 | 중립의 | 단일의 | can bridge in metals (두 금속 모두 C에 결합됨) |
표의 항목은 필드 강도에 따라 분류되며, 지정된 원자를 통해 결합됩니다(즉, 말단 리간드로서). 리간드의 '강도'는 리간드가 대체 결합 모드로 결합할 때(예를 들어, 금속 사이를 가교할 때) 또는 리간드의 형태가 왜곡될 때(예를 들어, 입체 상호작용을 통해 비선형 방식으로 결합하도록 강제되는 선형 리간드) 변화합니다.
다른 일반적으로 접하는 리간드(알파벳)
이 표에는 다른 일반적인 리간드가 알파벳 순서로 나열되어 있습니다.
| 리간드 | 공식(볼드체로 표시된 결합 원자) | 외상으로 하겠습니다. | 가장 흔한 아이덴티티 | 비고 |
|---|---|---|---|---|
| 아세틸아세토네이트(acac) | CH3−CO−CH2−CO−CH3 | 단음이온성의 | 양면의 | 일반적으로 양쪽 산소를 통해 결합되어 있지만 때로는 중앙 탄소만을 통해 결합되어 있습니다. 유사한 케티민 유사체도 참조 |
| 알케네스 | RC=CR | 중립의 | C-C 이중 결합을 가진 화합물 | |
| 아미노폴리카르복실산(APCAs) | ||||
| BAPTA (1,2-bis(o-aminophenoxy)ethane-N,N,N',N'-tetraacetic acid) | ||||
| 벤젠 | C6H6 | 중립의 | 그리고 다른 지역들 | |
| 1,2-비스(디페닐포스피노)에탄(dppe) | (C6H5)2P−C2H4−P(C6H5)2 | 중립의 | 양면의 | |
| 1,1-비스(디페닐포스피노)메탄(dppm) | (C6H5)2P−CH2−P(C6H5)2 | 중립의 | 두 개의 금속 원자에 동시에 결합하여 이량체를 형성할 수 있습니다. | |
| 부식 | 테트라덴테이트 | |||
| 크라운 에테르 | 중립의 | 주로 알칼리 및 알칼리 토금속 양이온의 경우 | ||
| 2,2,2-cryptand | 육분의 | 주로 알칼리 및 알칼리 토금속 양이온의 경우 | ||
| 암호학 | 중립의 | |||
| 사이클로펜타디엔일(Cp) | C 5H− 5 | 단음이온성의 | 비록 모노 음이온성이지만, 점유된 분자 궤도의 특성상, 그것은 삼차원 리간드 역할을 할 수 있습니다. | |
| 디에틸렌트리아민(디엔) | C4H13N3 | 중립의 | 삼지창의 | TACN과 관련이 있지만 얼굴 표정에 국한되지는 않습니다. |
| 디메틸글리옥시메이트(dmgH−) | 단음이온성의 | |||
| 1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid (DOTA) | ||||
| 디에틸렌트리아민펜타아세트산(DTPA)(펜타산) | ||||
| 에틸렌디아민테트라아세트산(EDTA)(edta4−) | (−OOC−CH2)2N−C2H4−N(CH2-COO−)2 | 테트라 음이온의 | 육분의 | |
| 에틸렌디아민트리아세테이트 | −OOC−CH2NH−C2H4−N(CH2-COO−)2 | 트리아노닉의 | 오순절의 | |
| 에틸렌글리콜비스(옥시에틸렌니트릴로)테트라아세테이트(예타4−) | (−OOC−CH2)2N−C2H4−O−C2H4−O−C2H4−N(CH2−COO−)2 | 테트라 음이온의 | 팔분의 일 | |
| 후라-2 | ||||
| 글리시네이트(글리시나토) | NH2CH2COO− | 단음이온성의 | 양면의 | 다른 α-amino산 음이온은 유사합니다(그러나 키랄). |
| 헴 | 다이오닉의 | 테트라덴테이트 | 거대고리 리간드 | |
| 이미노다이아세트산(IDA) | 삼지창의 | 준안정 방사성 핵종 테크네튬-99m을 복합화하여 신티그래피용 방사성 추적기를 만드는 데 광범위하게 사용됩니다. 예를 들어, 촐레신트그래피에서는 HIDA, BrIDA, PIPIDA, DISIDA가 사용됩니다. | ||
| 니코티아나민 | 고등 식물에 편재함 | |||
| 니트로실 | NO+ | 양이온의 | 굽힘(1e−) 및 선형(3e−) 접합 모드 | |
| 니트릴로트리아세트산(NTA) | ||||
| 옥소 | O2− | 디오니온 | 단일의 | 때때로 브리징 |
| 피라진 | N2C4H4 | 중립의 | 토픽의 | 때때로 브리징 |
| 전갈자리 리간드 | 삼지창의 | |||
| 아황산염 | O−SO2− 2 S−O2− 3 | 단음이온성의 | 단일의 | 양면성이 있는 |
| 2,2';6',2″-Terpyridine (terpy) | NC5H4−C5H3N−C5H4N | 중립의 | 삼지창의 | 경락 접합만 |
| Triazacyclononane (tacn) | (C2H4)3(NR)3 | 중립의 | 삼지창의 | 거대고리 리간드 참고 항목: N,N',N ″-트리메틸화 유사체 |
| 트리사이클로헥실포스핀 | P(C6H11)3 or PCy3 | 중립의 | 단일의 | |
| 트리에틸렌테트라민(트리엔) | C6H18N4 | 중립의 | 테트라덴테이트 | |
| 트리메틸포스핀 | P(CH3)3 | 중립의 | 단일의 | |
| Tris(o-tolyl)phosphine | P(o-toolyl)3 | 중립의 | 단일의 | |
| 트리스(2-아미노에틸)아민(트렌) | (NH2CH2CH2)3N | 중립의 | 테트라덴테이트 | |
| 트리스(2-디페닐포스핀에틸)아민(np3) | 중립의 | 테트라덴테이트 | ||
| 트로피움 | C 7H+ 7 | 양이온의 | ||
| 이산화탄소 | –CO2, 기타 | 중립의 | 금속 이산화탄소 복합체를 보다 | |
| 삼불화인 | –PF3 | 중립의 |
리간드 교환
리간드 교환(ligand exchange, 리간드 치환이라고도 함)은 화합물의 리간드가 다른 것으로 대체되는 화학 반응의 한 종류입니다. 치환 경로의 한 가지 유형은 리간드 의존 경로입니다. 유기금속 화학에서 이것은 결합 치환 또는 해리 치환에 의해 일어날 수 있으며, 이는 교차 결합 및 올레핀 메타시스와 같은 상호 교환 메커니즘에 비해 순수한 경로입니다.[19][20]
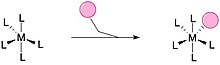
결합 치환은 리간드가 과소 배위된 금속 복합체를 포화시키는 일반적인 방법입니다. 이 경로는 유기화학의 S2N 메커니즘과 매우 유사합니다. 일반적으로 더 작은 리간드는 배위되지 않은 금속 복합체에 부착되어 복합체를 완전히 포화시키고 금속의 18개 전자 수를 완료하고 금속 복합체에서 또 다른 리간드를 잃을 수 있습니다. 정사각형 평면 복합체에 대한 일반적인 방법과 과도하게 조정된 중간체가 안정화되는 경우.[19][21]

반면에, 해리 치환은 배위 포화 금속 복합체의 리간드에 대해 일반적입니다. 이 경로는 유기화학의 S1N 메커니즘과 매우 유사합니다. 저배위 중간체가 안정화되면, 전형적으로 벌크화된 리간드는 배위 포화 금속 복합체로부터 해리될 수 있습니다. 이것은 팔면체 복합체에 대한 일반적인 방법입니다.[19][21]
많은 교차 결합 반응은 일반적으로 한 금속에서 다른 금속으로 리간드를 전달하는 과정인 트랜스메탈화를 통해 리간드를 교환합니다.[22]
리간드 교환 전이에 대한 일반적인 설명:
- 리간드(L1)에 배위된 금속(M1)을 포함하는 하나의 유기금속 복합체(Complex 1)로 시작합니다. Complex 1: M1(L1)n
- 다른 금속(M2)이 다른 리간드(L2)에 배위된 또 다른 유기금속 복합체(Complex 2)가 있습니다. Complex 2: M2(L2)m
- 리간드 교환 금속화 반응: 리간드 교환 금속화는 두 복합체 사이에서 금속과 리간드가 모두 교환되어 새로운 유기금속 복합체인 M1(L1) + M2(L2) ⟶ M1(L2) + M2(L1)가 생성됩니다. 두 복합체 사이에서 금속 M1과 M2가 교환되고 리간드 L1과 L2도 교환됩니다.
- 리간드 교환 금속화의 결과는 금속과 리간드가 모두 복합체 1과 복합체 2 사이에서 전환된 두 개의 새로운 유기금속 복합체입니다.

스즈키 교차 결합 반응은 유기 팔라듐 복합체와 유기 보라노 종 사이의 리간드 교환을 촉진합니다.[24] 또 다른 예는 유기 팔라듐 복합체와 유기 주석 종 사이에 리간드 교환이 일어나는 스틸 반응입니다.[25]
올레핀 메타시스는 유기 반응에서 올레핀으로 알려진 알켄의 조각을 탄소-탄소 이중 결합을 끊은 다음 재생함으로써 재배열하는 것입니다. N-헤테로사이클릭 카벤 계열의 일부인 Grubbs 촉매와 같은 촉매는 초기 탄소-탄소 이중 결합을 깨기 위해 이 반응을 유도하고 또한 고리 개구를 유도하여 순환 화합물에 대한 올레핀 메타테시스를 가능하게 합니다.[26][27]
리간드-단백질 결합 데이터베이스
BioLiP는[28] 단백질 데이터 뱅크에서 가져온 리간드-단백질 상호작용의 3D 구조를 가진 포괄적인 리간드-단백질 상호작용 데이터베이스입니다. MANORAA는 단백질 데이터 뱅크(Protein Data Bank)의 단백질 구조 상동체와 복합체를 이루는 리간드의 보존 및 차등 분자 상호작용을 분석하기 위한 웹 서버입니다. 생화학적 경로에서의 위치, SNP 및 표적 기관에서의 단백질/RNA 기준선 발현과 같은 단백질 표적에 대한 연결을 제공합니다.[29]
참고 항목
해설주
참고문헌
- ^ 버지, J., & Overby, J. (2020) 화학 – 원자가 먼저(4번째). 뉴욕: 맥그로 힐. ISBN 978-1260571349
- ^ Cotton, Frank Albert; Geoffrey Wilkinson; Carlos A. Murillo (1999). Advanced Inorganic Chemistry. Wiley-Interscience. p. 1355. ISBN 978-0471199571.
- ^ Miessler, Gary L.; Paul J. Fischer; Donald Arthur Tarr (2013). Inorganic Chemistry. Prentice Hall. p. 696. ISBN 978-0321811059.
- ^ Jackson, W. Gregory; Josephine A. McKeon; Silvia Cortez (1 October 2004). "Alfred Werner's Inorganic Counterparts of Racemic and Mesomeric Tartaric Acid: A Milestone Revisited". Inorganic Chemistry. 43 (20): 6249–6254. doi:10.1021/ic040042e. PMID 15446870.
- ^ Bowman-James, Kristin (2005). "Alfred Werner Revisited: The Coordination Chemistry of Anions". Accounts of Chemical Research. 38 (8): 671–678. doi:10.1021/ar040071t. PMID 16104690.
- ^ Hans Ludwig Schläfer and Günter Gliemann (1969). Basic Principles of Ligand Field Theory. London: Wiley-Interscience. ISBN 0471761001.
- ^ Miessler, Gary; Fischer, Paul J.; Tarr, Donald A. (2014). Inorganic Chemistry (5 ed.). Pearson. ISBN 978-0321811059.
- ^ Green, M. L. H. (20 September 1995). "A new approach to the formal classification of covalent compounds of the elements". Journal of Organometallic Chemistry. 500 (1–2): 127–148. doi:10.1016/0022-328X(95)00508-N. ISSN 0022-328X.
- ^ "mlxz plots – Columbia University", Columbia University, 뉴욕.
- ^ Hartwig, J. F. Organotransition Metal Chemistry, Bonding to Catalysis; University Science Books: New York, 2010. ISBN 1-891389-53-X
- ^ Rasmussen, Seth C. (5 March 2015). "The 18-electron rule and electron counting in transition metal compounds: theory and application". ChemTexts. 1 (1): 10. doi:10.1007/s40828-015-0010-4. ISSN 2199-3793.
- ^ "1.19: Electron Counting and the 18 Electron Rule". LibreTexts Chemistry. Retrieved 6 December 2023.
{{cite web}}: CS1 maint: url-status (링크) - ^ Chemistry (IUPAC), The International Union of Pure and Applied. "IUPAC - η (eta or hapto) (H01881)". goldbook.iupac.org. doi:10.1351/goldbook.h01881. Retrieved 8 November 2023.
- ^ Chemistry (IUPAC), The International Union of Pure and Applied. "IUPAC - denticity (D01594)". goldbook.iupac.org. doi:10.1351/goldbook.d01594. Retrieved 8 November 2023.
- ^ Hartwig, John Frederick (2010). Organotransition metal chemistry: from bonding to catalysis. Sausalito (Calif.): University science books. ISBN 978-1-891389-53-5.
- ^ 폰 젤류스키, A. "배위 화합물의 입체화학" 존 와일리: 치체스터, 1995. ISBN 047195599X.
- ^ 소바게, J.-P., 콜린, J.-P., 참브론, J.-C., 기예레즈, S., C., C., 발자니, V., 바리겔레티, F., 드 콜라, L., 플라미니, L. 켐. ReV. 1994, 94, 993-1019
- ^ Gavrilova, A. L., Bosnich, "단핵화 및 이핵화 리간드 디자인의 원리", Chem. Rev. 2004, Volume 104, 349–383. doi:10.1021/cr020604g
- ^ a b c Tian, W. D.; Sage, J. T.; Champion, P. M. (1 September 1993). "Investigations of Ligand Association and Dissociation Rates in the "Open" and "Closed" States of Myoglobin". Journal of Molecular Biology. 233 (1): 155–166. doi:10.1006/jmbi.1993.1491. ISSN 0022-2836.
- ^ Singh, Balwant; Yeasmin, Sabina; Sparks, Donald L. (2023), "Mineral-organic-microbial interactions", Encyclopedia of Soils in the Environment, Elsevier, pp. 387–406, doi:10.1016/b978-0-12-822974-3.00128-2, ISBN 978-0-323-95133-3, retrieved 6 December 2023
- ^ a b Wilkins, Ralph G. (1991). Kinetics and mechanism of reactions of transition metal complexes (2. thoroughly rev. ed.). Weinheim: VCH. ISBN 978-1-56081-125-1.
- ^ a b Rasmussen, Seth C. (18 November 2020). "Transmetalation: a fundamental organometallic reaction critical to synthesis and catalysis". ChemTexts. 7 (1): 1. doi:10.1007/s40828-020-00124-9. ISSN 2199-3793.
- ^ "Suzuki-Miyaura Coupling". LibreTexts Chemistry. Retrieved 6 December 2023.
{{cite web}}: CS1 maint: url-status (링크) - ^ Barder, Timothy E.; Walker, Shawn D.; Martinelli, Joseph R.; Buchwald, Stephen L. (1 April 2005). "Catalysts for Suzuki−Miyaura Coupling Processes: Scope and Studies of the Effect of Ligand Structure". Journal of the American Chemical Society. 127 (13): 4685–4696. doi:10.1021/ja042491j. ISSN 0002-7863.
- ^ Stille, John K. (June 1986). "The Palladium‐Catalyzed Cross‐Coupling Reactions of Organotin Reagents with Organic Electrophiles [New Synthetic Methods (58)]". Angewandte Chemie International Edition in English. 25 (6): 508–524. doi:10.1002/anie.198605081. ISSN 0570-0833.
- ^ Kirk-Othmer, ed. (26 January 2001). Kirk-Othmer Encyclopedia of Chemical Technology (1 ed.). Wiley. doi:10.1002/0471238961.metanoel.a01. ISBN 978-0-471-48494-3.
- ^ Astruc, Didier (7 January 2005). "The metathesis reactions: from a historical perspective to recent developments". New Journal of Chemistry. 29 (1): 42–56. doi:10.1039/B412198H. ISSN 1369-9261.
- ^ 바이오LiP
- ^ Tanramluk D, Naripiyakul L, Akavipat R, Gong S, Charoensawan V (2016). "MANORAA (Mapping Analogous Nuclei Onto Residue And Affinity) for identifying protein-ligand fragment interaction, pathways and SNPs". Nucleic Acids Research. 44 (W1): W514-21. doi:10.1093/nar/gkw314. PMC 4987895. PMID 27131358.
외부 링크
- Vu-Quoc, L., 구성 적분(통계역학), 2008의 리간드-수용체-리간드 결합 모델링을 참조하십시오. 이 위키 사이트는 다운되었습니다. 2012년 4월 28일 인터넷 아카이브에서 이 기사를 참조하십시오.


