비인내성 리간드
Non-innocent ligand화학에서 (redox) nonnocent 리간드는 산화 상태가 명확하지 않은 금속단지의 리간드다.전형적으로 비침습성 리간드를 포함하는 복합체들은 가벼운 전위에서 리독스가 활성화된다.이 개념은 금속 복합체에서 리독스 반응이 금속이나 리간드 국산화라고 가정하는데, 이는 유용하기는 하지만 단순화된다.[1]
C.K. Jörgensen은 처음에 리간드를 "무결함"과 "무심함"으로 묘사했다: "리간드는 중심 원자의 산화 상태를 정의할 수 있을 때 결백하다.용의자 리간드의 가장 간단한 경우는 NO..."[2]
무해한 복합체 대 무해한 리간드의 리독스 반응
일반적으로 조정 콤플렉스의 redox 반응은 금속 중심이라고 가정한다.망간의4− 산화 상태가 7+에서42− 6+로 변화함에 따라 MnO에서 MnO로의 감소는 설명된다.산화물 리간드는 산화상태에서 변하지 않으며, 2-.[3] 산화물이란 무고한 리간드를 말한다.기존의 금속 중심 리독스 커플의 또 다른 예는 [Co(NH3)]/[63+Co(NH3)]62+이다.암모니아는 이 변형에 결백하다.
리간드의 Redox 비침습성 거동은 니켈 bis(stilbenedithiolate) ([Ni(SCPh222)]2z로 설명된다.nd8 금속 이온의 모든 bis(1,2-디티올렌) 복합체로서 z = 2-, 1-, 0의 세 가지 산화 상태를 확인할 수 있다.리간드가 항상 다이오니컬(정형 산화 상태 카운팅에서 수행되는 것처럼)으로 간주되는 경우, z = 0은 니켈이 +IV의 형식 산화 상태를 갖도록 요구한다.따라서 중앙 니켈 원자의 공식 산화 상태는 +부터이다.위의 변환에서 II에서 +IV까지(그림 참조).그러나 형식 산화 상태는 (스펙트로스코프) 금속 d-전자 구성에 기초한 실제(스펙트로스코프) 산화 상태와는 다르다.stilbene-1,2-dithiolate는 nonocent가 아닌 리독스 리간드로 작용하며, 산화 과정은 실제로 금속이 아닌 리간드에서 일어난다.이로 인해 리간드 급진 복합체가 형성된다.따라서 부분적인 싱글릿 일람표 특성을 보이는 전하중립 복합체(z =0)[4]는 급진 음이온 SCPh의222•− Ni2+ 파생물로 더 잘 설명된다.이 콤플렉스의 직경은 두 리간드 활성산소의 손상된 전자들 사이의 반발광성 결합에서 발생한다.또 다른 예로는 분자 내 다중 중심 수소[5] 결합에 의해 안정화된 직경 페닐 리간드의 구리 복합체의 높은 산화 상태가 있다.
대표적인 비침습성 리간즈
- 니트로실(NO)은 두 가지 극한 기하학 중 하나로 금속과 결합한다. 즉, NO는 가성(NO−)으로 처리되는 곳에서 구부러지고, NO는 NO로+ 처리되는 곳에서 선형이다.
- 다이옥시겐은 과산화질소(O2−)와 과산화질소22−(O)의 두 가지 산화 상태로 존재하기 때문에 비인산화질소일 수 있다.[6]
포르피린, 프탈로시아닌, 그리고 일반화된 공식[D-CR=CR-D]n−을 가진 부식[7] 및 리간드(D = O, S, NR, R'과 R' = 알킬 또는 아릴)와 같이 확장된 pi-질소화를 가진 리간드는 흔히 비인포텐트가 아니다.반대로 NacNac이나 acacac과 같은 [D-CR=CR-CR=D]−는 결백하다.
- 카테콜라테스와 관련된 1,2-다이옥살렌.[8]
- 말레오니트릴리디톨레이트(위 [Ni(SCPh222)]2n−의 예 참조)와 같은 디티올렌.
- 1,2-diamidobenzene, 2,2'-bipyridine, dimethylglyoxime 등의 1,2-다이미닌.복합 Cr(2,2'-비피리딘)3은 3개의 비피리딘1− 리간드에 묶인 Cr(III)의 파생물이다.한편, [Ru(2,2'-비피리딘)]32+의 일렉트로닉 산화는 루에 국부화되며, 이 경우 비피리딘은 정상적이고 순수한 리간드로 작용하고 있다.
- 페로센을 함유한 리간드는 촉매 활성 금속 중심보다는 페로센 철 중심에서 산화 이벤트를 가질 수 있다.[9]
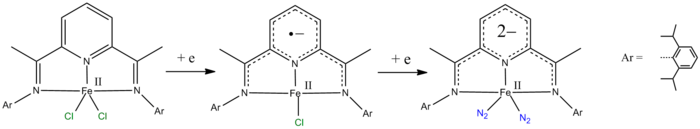
- 피리딘-2,6-다이미닌 리간드는 1 전자와 2 전자만큼 줄일 수 있다.[10][11]
생물학 및 균질 촉매에서 비침습성 리간드(redox
특정 효소 공정에서 redox 비-innocent 공동 인자(redox non-inocent coactor)는 야금류의 redox 특성을 보완하기 위해 redox 동등 물질을 제공한다.물론 자연에서 대부분의 redox 반응은 [4Fe-4S] 클러스터와 같은 무고한 시스템을 포함한다.리독스 비인후성 리간드가 제공하는 추가 리독스 등가물은 동질 촉매제 조종을 위한 제어 계수로도 사용된다.[12][13][14]
헤메스

포르피린 리간드는 결백할 수 있다(2-) 또는 비침묵적일 수 있다(1-).효소 클로로페록시디아제와 시토크롬 P450에서 포르피린 리간드는 촉매 사이클 동안, 특히 화합물 I의 형성에 있어 산화를 지속한다.미오글로빈과 같은 다른 헤메 단백질에서는 리간드 중심의 레독스가 발생하지 않고 포르피린도 결백하다.
갈락토오스산화효소
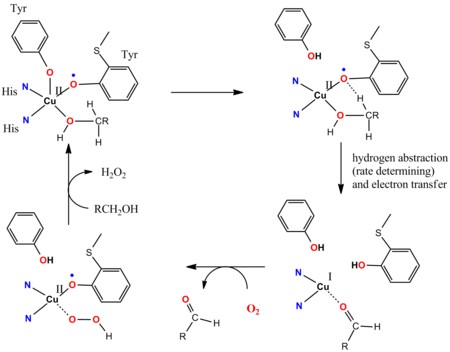
갈락토오스 산화효소(GOASE)의 촉매 주기는 비인내성 리간드의 관여를 나타낸다.[15][16]GOase는 O를2 사용하여 알데히드로 1차 알코올을 산화시키고 HO를22 방출한다.GOase 효소의 활성 부위는 CuII 이온에 조화된 tyrosyl을 특징으로 한다.촉매 사이클의 주요 단계에서, 협력 브뢰네스트-기초 리간드-사이트가 알코올을 분해하고, 그 후 티로시닐 라디칼의 산소 원자는 조정된 알카산화기질의 알파-CH 기능에서 수소 원자를 추상화한다.티로시닐 라디칼은 촉매 사이클에 참여한다: 1e-산소는 Cu(II/I) 커플에 의해, 1e 산화물은 티로실 라디칼에 의해 영향을 받아 전체적으로 2e의 변화를 준다.급진적 추상화는 빠르다.티로신 래디컬 리간드의 손상되지9 않은II 스핀과 d Cu 중심 사이의 반강자성 결합은 합성 모델과 일치하는 직자성 지반 상태를 발생시킨다.[17]
참고 항목
참조
- ^ Ganguly, Sumit; Ghosh, Abhik (2019-07-16). "Seven Clues to Ligand Noninnocence: The Metallocorrole Paradigm". Accounts of Chemical Research. 52 (7): 2003–2014. doi:10.1021/acs.accounts.9b00115. ISSN 0001-4842. PMID 31243969.
- ^ Jørgensen CK (1966). "Differences between the four halide ligands, and discussion remarks on trigonal-bipyramidal complexes, on oxidation states, and on diagonal elements of one-electron energy". Coordination Chemistry Reviews. 1 (1–2): 164–178. doi:10.1016/S0010-8545(00)80170-8.
- ^ 그러나 redox 파트너의 전자 구조를 보다 세심하게 조사하면 산화 리간드가 redox 변화에 의해 영향을 받는다는 것이 밝혀지지만, 이 효과는 미미하고 산소의 공식 산화 상태는 그대로 유지된다.
- ^ Aragoni, M. Carla; Caltagirone, Claudia; Lippolis, Vito; Podda, Enrico; Slawin, Alexandra M. Z.; Woollins, J. Derek; Pintus, Anna; Arca, Massimiliano (2020-12-07). "Diradical Character of Neutral Heteroleptic Bis(1,2-dithiolene) Metal Complexes: Case Study of [Pd(Me2timdt)(mnt)] (Me2timdt = 1,3-Dimethyl-2,4,5-trithioxoimidazolidine; mnt2– = 1,2-Dicyano-1,2-ethylenedithiolate)". Inorganic Chemistry. 59 (23): 17385–17401. doi:10.1021/acs.inorgchem.0c02696. ISSN 0020-1669. PMC 7735710. PMID 33185438.
- ^ Rajabimoghadam, Khashayar; Darwish, Yousef; Bashir, Umyeena; Pitman, Dylan; Eichelberger, Sidney; Siegler, Maxime A.; Swart, Marcel; Garcia-Bosch, Isaac (2018). "Catalytic Aerobic Oxidation of Alcohols by Copper Complexes Bearing Redox-Active Ligands with Tunable H-Bonding Groups". Journal of the American Chemical Society. 140 (48): 16625–16634. doi:10.1021/jacs.8b08748. PMC 6645702. PMID 30400740.
- ^ Kaim W, Schwederski B (2010). "Non-innocent ligands in bioinorganic chemistry—An overview". Coordination Chemistry Reviews. 254. (13-14) (13–14): 1580–1588. doi:10.1016/j.ccr.2010.01.009.
- ^ Ghosh, Abhik (2017-02-22). "Electronic Structure of Corrole Derivatives: Insights from Molecular Structures, Spectroscopy, Electrochemistry, and Quantum Chemical Calculations". Chemical Reviews. 117 (4): 3798–3881. doi:10.1021/acs.chemrev.6b00590. ISSN 0009-2665.
- ^ Zanello P, Corsini M (2006). "Homoleptic, mononuclear transition metal complexes of 1,2-dioxolenes: Updating their electrochemical-to-structural (X-ray) properties". Coordination Chemistry Reviews. 250 (15–16): 2000–2022. doi:10.1016/j.ccr.2005.12.017.
- ^ Wang X, Thevenon A, Brosmer JL, Yu I, Khan SI, Mehrkhodavandi P, Diaconescu PL (August 2014). "Redox control of group 4 metal ring-opening polymerization activity toward L-lactide and ε-caprolactone". J. Am. Chem. Soc. 136 (32): 11264–7. doi:10.1021/ja505883u. PMID 25062499.
- ^ de Bruin B, Bill E, Bothe E, Weyhermüller T, Wieghardt K (June 2000). "Molecular and electronic structures of bis(pyridine-2,6-diimine)metal complexes [ML2](PF6)n (n = 0, 1, 2, 3; M = Mn, Fe, Co, Ni, Cu, Zn)". Inorg Chem. 39 (13): 2936–47. doi:10.1021/ic000113j. PMID 11232835.
- ^ Chirik PJ, Wieghardt K (February 2010). "Chemistry. Radical ligands confer nobility on base-metal catalysts". Science. 327 (5967): 794–5. doi:10.1126/science.1183281. PMID 20150476.
- ^ Lyaskovskyy V, de Bruin B (2012). "Redox Non-Innocent Ligands: Versatile New Tools to Control Catalytic Reactions". ACS Catalysis. 2 (2): 270–279. doi:10.1021/cs200660v.
- ^ Luca OR, Crabtree RH (February 2013). "Redox-active ligands in catalysis". Chem Soc Rev. 42 (4): 1440–59. doi:10.1039/c2cs35228a. PMID 22975722.
- ^ Chirila, Andrei; Das, Braja Gopal; Kuijpers, Petrus F.; Sinha, Vivek; Bruin, Bas de (2018), "Application of Stimuli-Responsive and "Non-innocent" Ligands in Base Metal Catalysis", Non-Noble Metal Catalysis, John Wiley & Sons, Ltd, pp. 1–31, doi:10.1002/9783527699087.ch1, ISBN 9783527699087
- ^ Whittaker MM, Whittaker JW (March 1993). "Ligand interactions with galactose oxidase: mechanistic insights". Biophys. J. 64 (3): 762–72. Bibcode:1993BpJ....64..762W. doi:10.1016/S0006-3495(93)81437-1. PMC 1262390. PMID 8386015.
- ^ Wang Y, DuBois JL, Hedman B, Hodgson KO, Stack TD (January 1998). "Catalytic galactose oxidase models: biomimetic Cu(II)-phenoxyl-radical reactivity". Science. 279 (5350): 537–40. Bibcode:1998Sci...279..537W. doi:10.1126/science.279.5350.537. PMID 9438841.
- ^ Müller J, Weyhermüller T, Bill E, Hildebrandt P, Ould-Moussa L, Glaser T, Wieghardt K (March 1998). "Why Does the Active Form of Galactose Oxidase Possess a Diamagnetic Ground State?". Angew. Chem. Int. Ed. Engl. 37 (5): 616–619. doi:10.1002/(SICI)1521-3773(19980316)37:5<616::AID-ANIE616>3.0.CO;2-4. PMID 29711069.
추가 읽기
- Dzik, W. I..; Zhang, X. P.; de Bruin, B. (2011). "Redox Noninnocence of Carbene Ligands: Carbene Radicals in (Catalytic) C-C Bond Formation". Inorganic Chemistry. 50 (20): 9896–9903. doi:10.1021/ic200043a. PMID 21520926.
- Büttner, T.; Geier, J.; Frison, G.; Harmer, J.; Calle, C.; Schweiger, A.; Schönberg, H.; Grützmacher, H. (2005). "A Stable Aminyl Radical Metal Complex". Science. 307. 307 (5707): 235–238. Bibcode:2005Sci...307..235B. doi:10.1126/science.1106070. PMID 15653498.
- Hetterscheid, D.G.H.; Kaiser, J.; Reijerse, E.; Peters, T.P.J.; Thewissen, S.; Blok, A.N.J.; Smits, J.M.M.; de Gelder, R.; de Bruin, B. (2005). "IrII(ethene): Metal or Carbon Radical?". Journal of the American Chemical Society. 127 (6): 1895–1905. doi:10.1021/ja0439470. PMID 15701024.
- Blanchard, S.; Derat, E.; Desage-El Murr, M.; Fensterbank, L.; Malacria, M; Mouriès-Mansuy, V. (2012). "Non-Innocent Ligands: New Opportunities in Iron Catalysis". European Journal of Inorganic Chemistry. 2012 (3): 376–389. doi:10.1002/ejic.201100985.
- Kaim, W. (2012). "The Shrinking World of Innocent Ligands: Conventional and Non-Conventional Redox-Active Ligands". European Journal of Inorganic Chemistry. 2012 (3): 343–348. doi:10.1002/ejic.201101359.