순환종양세포
Circulating tumor cell순환종양세포(CTC)는 1차 종양에서 혈관조직이나 림프계로[1] 빠져 나온 세포로 혈액순환에서 몸 주위로 운반된다.CTC는 암 관련 사망의 대부분을 담당하는 메커니즘인 먼 장기에 추가 종양(메타지스)의 후속 성장을 위한 씨앗이 될 수 있다.[2]CTC의 검출과 분석을 통해 초기 환자 예보를 지원하고 적절한 맞춤형 치료법을 결정할 수 있다.[3]현재 CTC 검출을 위한 FDA 승인 방법인 CellSearch는 유방암, 대장암, 전립선암 진단에 사용된다.[4]null
CTCs, 즉 액체 생검의 검출은 전통적인 조직 생체검사보다 몇 가지 장점을 제시한다.그것들은 비침습적이고 반복적으로 사용될 수 있으며 전이 위험, 질병 진행 및 치료 효과에 대한 더 유용한 정보를 제공한다.[5][6]예를 들어 암환자의 혈액샘플 분석 결과 질병이 진행됨에 따라 CTC 검출량이 증가하는 경향을 발견했다.[7]혈액 검사는 쉽고 안전하게 수행되며 시간이 지남에 따라 여러 개의 샘플을 채취할 수 있다.이와는 대조적으로 고형 종양의 분석에는 환자 준수를 제한할 수 있는 침습적 절차가 필요하다.시간 경과에 따른 질병 진행을 감시하는 능력은 환자의 치료에 적절한 수정을 촉진하여 잠재적으로 환자의 예후와 삶의 질을 개선할 수 있다.질병의 향후 진행을 예측하는 능력의 중요한 측면은 반복적인 CTC 수치가 낮을 때 수술의 필요성을 제거(적어도 일시적으로)하는 것이다; 수술을 피하는 것의 분명한 이점은 암 수술의 선천적인 종양-유전성과 관련된 위험을 피하는 것이다.이를 위해 전이성 질환 환자의 CTC를 검출할 수 있는 필수 민감성과 재현성을 갖춘 기술이 최근 개발됐다.[8][9][10][11][12][13][14][15]반면 CTC는 매우 희귀하며, 종종 혈액 1밀리리터당 몇 개의 세포만 존재하기 때문에, CTC의 검출이 어려워진다.또한 환자마다 다양한 마커를 표현하기 때문에 민감도와 특수성이 높은 기법을 개발하기 어려운 경우가 많다.null
종류들
발암에서 유래한 CTC(상피에서 유래된 캔서스, 가장 널리 퍼져 있는 것)는 상피 표지의 표현에 따라 분류할 수 있으며, 그 크기와 사멸 여부도 알 수 있다.일반적으로 CTC는 아노이키스에 내성이 있어 기질에 부착하지 않고도 혈류에서 생존할 수 있다는 의미다.[16]null
- 전통적인 CTC는 온전하고 실행 가능한 핵으로 특징지어진다; 상피 기원을 보여주는 EpCAM과 사이토케라틴의 표현; 세포가 조혈성 기원이 아님을 나타내는 CD45의 부재; 그리고 더 큰 크기, 불규칙한 모양 또는 세포하 형태학.[17]
- 사이토케라틴 음성 CTCs는 EpCAM이나 사이토케라틴의 부족에 의해 특징지어지는데, 이는 미분화 표현형(순환 암 줄기 세포)이나 중상피 표현형(상피-망상피 전이 또는 EMT로 알려져 있음)의 획득을 나타낼 수 있다.이러한 CTC 모집단은 가장 저항성이 높고 전이가 발생하기 쉽다.또한 사이토케라틴도 CD45도 표현하지 않기 때문에 분리하기가 더 어렵다.그렇지 않으면 이들의 형태학, 유전자 표현, 유전체학은 다른 암세포와 비슷하다.[18]
- 세포사멸 프로그램(programed cell death)은 세포사멸을 겪고 있는 전통적인 CTC이다.이것들은 세포사멸과 관련된 핵분열 또는 세포질 표백법을 식별하는 에픽사이언스 방법에 의해 실험적으로 수행된 것처럼 치료 반응을 감시하는 데 사용될 수 있다.기초부터 치료까지 기존의 CTC 대 사복구 CTC의 비율을 측정하는 것은 암세포를 표적화하고 죽이는 데 있어 치료 효과의 실마리를 제공한다.[18]
- 소형 CTC는 사이토케라틴 양성, CD45 음성이지만 크기와 모양이 백혈구와 비슷하다.중요한 것은 소규모 CTC에는 이들을 CTC로 식별하는 암 특이 바이오마커가 있다는 점이다.소규모 CTC는 진행성 질병과 작은 세포암으로 분화하는데, 이것은 종종 다른 치료 과정을 필요로 한다.[19]
CTC 클러스터
CTC 클러스터는 둘 이상의 개별 CTC를 결합한 것이다.CTC 클러스터는 전통적인, 작은 또는 CK- CTC를 포함할 수 있다.이들 군집은 이들을 CTC로 식별하는 암 특이 바이오마커를 가지고 있다.여러 연구에서 이러한 군집의 존재는 전이 위험의 증가와 좋지 않은 예후와 관련이 있다고 보고되었다.예를 들어, 전립선암과 관련된 한 연구는 CTC 클러스터가 있는 환자에 비해 CTC가 단일한 환자의 평균 생존율이 8배 더 길다는 것을 보여주었고, 다른 연구들은 대장암과 유사한 상관관계를 보여주었다.[20][21]또한 CTC 클러스터를 열거하면 이미 CTC 수준이 높아진 환자에게 유용한 예측 정보를 제공할 수 있다.[22]null
그러나, 한 연구는 기존의 합의와는 달리, 적어도 이들 성단의 이산적인 개체군은 상처가 없고, 대신 종양 내피에서 나온다고 보고했다.[23]이렇게 순환하는 종양 내피 성단은 상피-망막 표지를 보여주기도 하지만 1차 종양의 유전학을 반영하지는 않는다.null
이전에는 CTC 클러스터가 전체 크기 때문에 모세혈관과 같은 좁은 혈관을 통과할 수 없다고 가정했다.그러나 CTC 클러스터는 이러한 제약사항을 단일 파일로 통과시키기 위해 "셀간 접착의 선택적 분할"을 통해 "해제"할 수 있으며, 한 번 클리어하면 프로세스를 역전시킬 수 있는 것으로 나타났다.이러한 행동은 CTC 클러스터가 왜 그렇게 중요한 전이적 잠재력을 가지고 있는가에 대한 요인이 될 수 있다.[24]null
빈도
CTCs의 검출은 중요한 예측 및 치료적 함의를 가질 수 있지만 그 수가 매우 작을 수 있기 때문에 이러한 세포들은 쉽게 검출되지 않는다.[25]1차 종양에서 분리한 세포 중 전이가 가능한 세포는 0.01%에 불과한 것으로 추정된다.[26]null
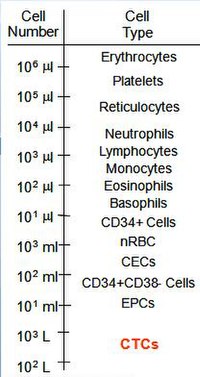
순환종양세포는 전이성 질환 환자에서 전혈 mL당 1-10 CTC의 순서로 빈도에서 발견된다.[27]비교를 위해 mL의 혈액은 몇 백만 개의 백혈구와 10억 개의 적혈구를 포함하고 있다.이 낮은 빈도는 암세포의 식별의 어려움과 관련된 것으로, CTCs의 생물학적 특성을 이해하는 핵심 구성요소가 충분히 높은 정의에서 모든 CTC 하위 유형을 식별하는 농축 무농축 검사를 통해 mL당 1 CTC를 분리할 수 있는 기술과 접근방식을 필요로 함을 의미한다.다양한 암 유형을 가진 환자의 진단 병리학 이미지 분석 요구 사항을 충족하기 위한 아이디어.[18]현재까지 CTC는 여러 상피암(양상, 전립선, 폐, 대장)[28][29][30][31]에서 검출되었으며 임상 증거는 전이성 병변을 가진 환자가 CTC를 분리할 가능성이 더 높다는 것을 보여준다.null
CTCs는 대개 특정 종양 마커(일반적으로 EpCAM)를 인식할 수 있는 특정 항체를 사용하여 혈관 구조에서 캡처된다. 그러나 이 접근법은 농축 단계에 필요한 이벤트인 세포 표면에서 선택된 단백질의 충분한 표현 필요성에 의해 편향된다.게다가, EpCAM과 다른 단백질들(예: 사이토케라틴)은 일부 종양에서 발현되지 않고 상피에서 중피 전이(EMT) 동안 하향 조절될 수 있기 때문에, 새로운 농축 전략이 필요하다.[32]null
첫 번째 증거는 인간의 의술에 적용된 CTC 표지가 다른 종에 보존되어 있다는 것을 나타낸다.CK19를 포함한 더 흔한 5개의 표지는 또한 악성 유방 종양을 가진 개의 혈액에서 CTC를 검출하는데 유용하다.[33][34]새로운 접근법은 IsofFux나 Maintrac과 같이 7.5ml의 혈액 중에서 더 많은 세포를 식별할 수 있다.[35][36]매우 드문 경우지만, CTC는 일상적인 혈액 얼룩 검사에서 볼 수 있을 만큼 충분히 많은 양이 존재한다.이것은 암세포 백혈병 또는 암세포 백혈병으로 불리며, 좋지 않은 예후와 관련이 있다.[37]null
탐지 방법

현재까지 CTC를 분리하고 열거할 수 있는 다양한 연구 방법이 개발되었다.[38]미국 식품의약국(FDA)이 전혈 CTC를 열거할 수 있는 유일한 방법론은 셀서치 시스템이다.[39]이 방법을 사용하여 수행된 광범위한 임상실험을 통해 전이성 유방, 대장암 또는 전립선암 환자의 전반적인 생존을 위한 CTC의 존재는 강력한 예후 요인임을 알 수 있다.[7][40][41][42][43][44][45]null
CTC는 전이 생물학을 이해하는 데 중추적인 역할을 하며, 종양 진행과 치료에 대한 반응을 비침습적으로 평가할 수 있는 바이오마커로서 잠재력을 약속한다.그러나 CTCs의 격리 및 특성화는 중요한 기술적 난제를 나타낸다. CTCs는 순환혈액에서 전체 혈액의 mL당 1-10 CTCs의 총 세포의 분수를 구성하기 때문이다. 수백만의 백혈구와 10억개의 적혈구에 비해, CTCs는 전체 혈액의 mL당 1~10 CTCs를 구성하기 때문이다.[46]따라서 CTC 연구자들의 주요 과제는 CTCs의 분자 특성화를 가능하게 하는 CTC 정화의 난이도가 지배적이라는 점이다.말초혈에 있는 CTC를 격리시키고 본질적으로 생물학적 방법과 물리적 방법의 두 가지 범주에 속하게 하는 방법, 그리고 두 가지 전략을 결합하는 혼합적 방법이 개발되었다.기법은 또한 격리(양성 선택)를 위해 CTC를 선택하는지 또는 모든 혈구(음성 선택)를 제외하는지(음성 선택)에 따라 분류할 수 있다.null
생물학적 방법
생물학적 방법은 매우 구체적인 항원 결합에 근거하여 세포를 격리하는데, 가장 일반적으로 양성 선택을 위한 단핵항체에 의해 이루어진다.EpCAM, HER2, PSA를 포함한 종양별 바이오마커에 대한 항체가 사용되었다.가장 일반적인 기법은 CellSearch 또는 MACS에서 사용되는 자기 나노입자 기반 분리(면역 자기분석)이다.연구 중인 다른 기법으로는 미세유체 분리[47] 및 면역자기 분석과 미세유체 분리의 조합이 있다.[48][49][50][51]미세조립기술의 발달에 따라 마이크로스케일 자기장의 제어능력을 향상시키고 CTCs 검출에 도움을 주기 위해 마이크로스케일 자기구조가 구현된다.[52][53][54]예방접종[55] 바이러스 등 온콜리틱 바이러스가 개발돼 CTC를 검출하고 식별한다.CTCs 표면의 온코페탈 콘드로이틴 황산염에 결합하는 말라리아 VAR2CSA 단백질과 같이 항체 대신 공학적 단백질을 사용하는 대체 방법이 존재한다.[56] 또한 CTCs는 GILUPI GmbH에 의해 개발된 변형된 셀딩거 기법에 의해 혈액에서 직접 회수될 수도 있다.[57][58]항체 코팅 금속 와이어는 말초 정맥에 삽입되어 정해진 기간(30분) 동안 그 곳에 머무른다.이 기간 동안 혈액에서 나온 CTCs가 항체에 결합할 수 있다(현재 안티EpCAM). 잠복기가 끝나면 와이어를 제거하고 세척하며 환자의 혈액에서 격리된 네이티브 CTCs를 추가로 분석할 수 있다.분자 유전학뿐만 아니라 면역 형광 염색과 몇 가지 다른 방법이 가능하다.[59][60]이 방법의 장점은 CTCs에 대해 분석할 수 있는 혈액량이 더 많다는 것이다(뽑힌 혈액 샘플의 7.5ml에 비해 30분 동안 약 750ml).null
CellSearch 방법
CTC 격리를 위한 FDA 승인 플랫폼은 셀서치가 유일하다.이 방법은 바이오틴 아날로그를 운반하는 폴리머 레이어로 코팅된 철 나노입자를 사용하고, CTCs 포획을 위해 EpCAM에 대한 항체를 결합한 것이다.격리는 분석기와 결합되어 특정 형광 항체 결합체로 얼룩진 고립된 세포의 이미지를 촬영한다.EDTA 튜브에 보존제가 첨가된 혈액을 채취한다.실험실에 도착하면 7.5 mL의 혈액을 원심분리하여 준비 시스템에 넣는다.이 시스템은 우선 강유체 나노입자와 자석을 이용하여 종양세포를 면역적으로 풍부하게 한다.그 후 회수된 세포가 스며들어 핵 얼룩으로 얼룩지고, 형광 항체가 CD45(레우코세포 표식기)와 사이토케라틴 8, 18, 19(에피테리아 표식기)에 대항하여 결합된다.그리고 나서 샘플은 핵, 사이토케라틴, CD45 얼룩의 이미지를 찍는 분석기로 스캔된다.[61]CTC로 간주되려면 세포가 핵을 포함하고 CD45 마커의 표현에 대해 음극일 뿐 아니라 사이토케라틴의 세포질 발현에 대해서도 양성이어야 하며 직경은 5µm 이상이어야 한다.위에서 인용한 기준에 맞는 종양세포가 총 5개 이상이면 혈액샘플이 양성이다.전립선암, 유방암, 대장암 환자를 대상으로 한 연구에서 양성 검체를 가진 전이성 환자의 중위 생존은 음성 검체를 가진 전이성 환자의 중위 생존의 약 절반이다.이 시스템은 전혈 7.5 mL당 93%의 회복능력과 1 CTC의 검출한도가 특징이다.특정 암 유형의 경우 IsoFlux와 같은 대체 방법이 더 큰 민감도를 보였다.[62]null
파소르틱스 방법
이 자동화된 방법은 크기 여과법을 사용하여 다른 혈액 구성 요소에서 더 크고 덜 압축 가능한 순환 종양 세포를 풍부하게 한다.Parsortix 시스템은 1 mL ~ 40 mL 범위의 혈액 샘플을 채취할 수 있다.6.5미크론의 높은 간격을 가진 일회용 미세유체 카세트는 적혈구와 백혈구의 대부분을 통과하게 하고, 순환 종양 세포와 태아 세포를 포함한 더 큰 희귀 세포는 잡힌다.갇힌 세포는 식별을 위해 자동으로 항체로 얼룩지거나 카세트 밖으로 배출될 수 있다.이러한 방출/수확된 세포는 살아있으며 배양뿐만 아니라 하류 세포와 분자 기법으로 분석할 수 있다.그 여과 카세트는 다양한 암세포 타입의 군살을 포착한다.null
에픽 사이언스 방식
이 방법은 핵이 부족한 적혈구로부터 핵세포를 분리하는 기술을 포함한다.정상 백혈구와 CTC를 포함한 모든 핵세포는 암 바이오마커 전용 형광 태그 항체에 노출된다.또 에픽의 영상시스템은 슬라이드에 있는 모든 세포의 사진(약 300만 개)을 캡처해 각 세포의 정밀한 좌표를 기록하고 각 세포의 형광 강도 4개, 형태학적 파라미터 86개 등 90여 개의 다른 파라미터를 분석한다.에픽은 또한 중복, 삭제, 재배열과 같은 이상을 찾기 위해 FICH와 다른 얼룩 기술을 사용할 수 있다.영상·분석 기술도 슬라이드에 있는 모든 셀의 좌표를 알 수 있게 해 차세대 시퀀싱을 이용해 하나의 셀을 슬라이드로부터 검색해 분석할 수 있게 한다.혈액병리학에서 훈련된 알고리즘은 사이토케라틴과 CD45의 표현뿐만 아니라 수많은 형태학 측정을 통합한다.그런 다음 알고리즘은 훈련된 판독기가 확인하는 후보 CTC를 제안한다.관심 세포는 관련 표현형 및 유전자형 표지에 대해 분석되며, 국소 백혈구가 음성 대조군으로 포함된다.[63]에픽의 분자 측정은 단백질 발현을 측정하고 또한 20개 이상의 다른 암 종류에 대한 CTC의 유전학적 이상을 조사한다.null
마트라크
Maintrac은 미세한 체외 진단법을 적용해 체액 속 희귀 세포와 분자 특성을 파악하는 진단혈액 검사 플랫폼이다.EpCAM 특이 항체를 이용한 양성 선정에 기초한다.[64]Maintrac은 순환 종양 세포의 현미경 식별에 기초한 접근법을 사용한다.이 과정에서 세포의 손상과 상실을 방지하기 위해 Maintrac은 식별을 위한 두 단계만 사용한다.다른 많은 방법들과 대조적으로, maintrac은 세포를 정화하거나 풍부하게 하는 것이 아니라, 다른 혈액 화합물의 맥락 안에서 세포를 식별한다.중요한 세포를 얻고 그 세포들의 스트레스를 줄이기 위해, 혈구는 원심분리 단계와 적혈구 용해로 준비된다.Maintrac은 CellSearch와 마찬가지로 EpCAM 항체를 사용한다.그러나 그것은 농축을 위해 사용되지 않고 오히려 그러한 세포들을 식별하기 위한 형광 표시기로 사용된다.요오드화 프로피듐이 함유된 핵 얼룩과 함께 maintrac 방법은 죽은 세포와 살아있는 세포를 구별할 수 있다.EpCAM 양성세포를 제외한 활력, 프로피듐만이 잠재적 종양세포로 계산된다.살아있는 세포만이 종양으로 자랄 수 있기 때문에, 죽어가는 EpCAM 양세포는 해를 끼칠 수 없다.현수막은 형광 현미경 검사에 의해 분석되며, 이 현미경은 사건을 자동으로 계산한다.동시 이벤트 갤러리는 소프트웨어가 실제 살아있는 세포를 발견했는지 여부를 확인하고 피부 상피 세포를 구분하는 방식으로 기록된다.이 방법을 정밀하게 검증한 결과 사이토케라틴이나 CD45의 추가 항체가 아무런 이점도 얻지 못했다.[36][65]null
다른 방법들과 달리, Maintrac은 단일 셀 카운트를 예측 표시기로 사용하지 않는다. 오히려 Maintrac은 셀 카운트의 역학을 이용한다.종양 세포 수가 증가하는 것은 종양 활동이 지속되고 있는 중요한 요인이다.[66]세포 수를 줄이는 것은 성공적인 치료를 위한 신호다.따라서 마트락은 항암화학요법의[36][67] 성공 여부를 검증하고 호르몬이나 유지요법[68][69] 중 치료를 감독하는 데 사용될 수 있으며, 마트락은 암 재발 감시를 위해 실험적으로 사용되어 왔다.[70][71]Maintrac을 이용한 연구는 암이 없는 환자의 혈액에서 EpCAM 양세포가 발견될 수 있다는 것을 보여주었다.[72]크론병과 같은 염증성 질환은 또한 EpCAM 양성 세포의 수치가 증가했음을 보여준다.피부화상이 심한 환자는 혈액 속에 EpCAM 양세포도 옮길 수 있다.따라서 조기진단의 도구로 EpCAM 양성전지를 사용하는 것이 최적이 아니다.null
물리적 방법
물리적인 방법은 종종 필터에 기반을 두고 있어 특정 비문이 아닌 크기별로 CTC를 포착할 수 있다.[15]스크린셀(ScreenCell)은 CTC를 사람의 전혈로부터 몇 분 안에 민감하고 구체적인 분리할 수 있는 여과 기반 장치다.[73]주변 혈액은 ScreenCell 격리 장치로 4시간 이내에 채취하여 CTCs를 캡처한다.캡처된 셀은 셀 배양 또는 뷰를 사용하여 직접 특성화할 준비가 됨상황 잡종 측정에서 RNA.Parsortix 방법은 크기와 변형성에 따라 CTC를 구분한다.[74]null
혼성법
하이브리드 방법은 물리적인 분리(경사, 자기장 등)와 항체 매개 세포 회수법을 결합한다.그 예로는 민감한 이중 구배 원심분리 및 자기세포 선별검출 및 열거 방법이 있는데, 이는 암환자의 순환 상피암을 음성으로 검출하는 데 사용되어 왔다.[75]음극선택의 원리는 피콜과 함께 기존의 구배원심분리뿐만 아니라 항체 패널을 사용해 모든 혈구를 회수하는 것에 기초한다.순환하는 전립선암 세포를[76][77][78] 검출하기 위해 ISET Test라고 알려진 유사한 방법이 채택되었고, 로제트스텝이라고 알려진 또 다른 기술은 소세포 폐암 환자들로부터 CTCs를 격리시키기 위해 사용되었다.[79]마찬가지로, 매사추세츠 종합병원의 연구원들은 미세유체 장치에 초점을 맞춘 관성체를 사용하는 음성 선택 방법을 개발했다.CTC-ichip이라고 불리는 이 기술은 먼저 적혈구처럼 CTC가 되기에는 너무 작은 세포를 제거한 뒤 자분을 이용해 백혈구를 제거한다.[80]null
CTC 특성화
어떤 약은 특정 요건에 맞는 암에 특히 효과적이다.예를 들어, Herceptin은 Her2 양성 환자에게는 매우 효과적이지만 Her2 음성 환자에게는 훨씬 덜 효과적이다.일단 1차 종양이 제거되면 기존 조직 타입을 통한 암의 현재 상태를 조직적으로 파악할 수 없게 된다.[81]종종 몇 년 전에 제거된 1차 종양의 조직 부분이 타이핑을 하는데 사용된다.CTC의 추가적인 특성화는 현재의 종양 표현형을 결정하는 데 도움이 될 수 있다.FICH 검사는 면역항암을 이용한 IGF-1R, Her2, Bcl-2, ERG, PTEN, AR 상태 결정뿐만 아니라 CTC에서 수행되었다.[6][82][83][84][85]단일 세포 수준 QPCR은 혈액으로부터 격리된 CTC로도 수행될 수 있다.[citation needed]null
환자 발생 CTC의 장기 열도는 마우스 모델에서 조사되었다.[86]유방암 환자와 격리되어 체외가 확장된 CTCs는 쥐에게 뼈, 폐, 난소, 뇌 전이체를 발생시킬 수 있다는 것을 보여주었는데, 이는 해당 환자에서 발견된 2차 병변을 부분적으로 반영한다.놀랍게도, 환자의 뇌 전이가 나타나기 훨씬 전에 격리된 한 CTC 라인은 쥐에게 뇌 전이를 발생시킬 수 있는 능력이 뛰어났다.이것은 뇌 전이에 대한 최초의 예측 사례였고 CTC들 사이에서 전이의 전구체의 본질적인 분자 특성이 전이의 메커니즘에 대한 새로운 통찰력을 제공할 수 있다는 개념의 증명이었다.null
세포 형태학
형태학적 외형은 인간 운영자에 의해 판단되므로 운영자 간 큰 변동을 겪게 된다.[87]형태학적 외관을 사용하여 CTC를 식별하는 몇 가지 CTC 열거 방법이 존재하며, 이는 다른 형태학적 기준을 적용할 수도 있다.전립선암에 대한 최근의 연구는 환자와 정상적인 기증자에서 발견되는 절대적 수의 세포가 서로 다른 형태학적 정의 사이에서 10년 이상 변화했음에도 불구하고 순환 종양 세포의 많은 다른 형태학적 정의는 유사한 예후 값을 가지고 있다는 것을 보여주었다.[88]null
역사
1869년 토머스 애슈워스가 전이암에 걸린 사람의 혈액에서 CTC가 처음으로 관찰되었는데, 그는 "혈액에서 볼 수 있는 암 그 자체와 동일한 세포가 동일한 사람에게 존재하는 여러 종양의 발생원인에 대해 어느 정도 빛을 던질 수 있다"고 가정했다.순환하는 세포의 형태학을 서로 다른 병변의 종양세포에 대한 철저한 비교를 통해 아스호르트는 "한 가지 확실한 것은 그것들이 기존 암구조에서 왔다면 순환계의 더 큰 부분을 통과해서 음차의 내부 사페나 정맥에 도착했음이 틀림없다는 결론을 내렸다.g"[89]
현대 암 연구에서 CTC의 중요성은 1990년대 중반 질병의 진행 과정에서 CTC가 일찍부터 존재한다는 것을 입증하면서 시작되었다.[90]이러한 결과는 폴 리베르티가 발명한 페로플루이드(협착 자기 나노입자)와 고경사 자기 분리기를 이용한 정교하게 민감한 자기 분리 기술로 가능했으며, 리베르티와 레온 테르스타펜의 이론적 계산에 의해 동기 부여가 되어 매우 작은 종양이 1.0%p 이하로 세포를 방출한다는 것을 보여주었다.낮이 되면 혈액에 감지 가능한 세포가 생기게 된다.[91]그 이후 CTC 열거 및 식별에 다양한 다른 기술이 적용되었다.null
현대의 암 연구는 CTC가 1차 종양의 클론에서 나온다는 것을 증명했고, 아스호르트의 발언을 검증했다.[92]CTCs의 생물학적 특성을 이해하는데 투입된 중요한 노력은 순환 종양 세포가 암의 전이적 확산에서 중요한 역할을 한다는 것을 보여주었다.[93]또한, 매우 민감한 단일 세포 분석은 단백질 발현과 단백질 국산화[94] 모두에 대해 단일 세포 수준에서 볼 수 있는 높은 수준의 이질성을 보여주었고 CTCs는 일차 생검과 전이 현장에서 볼 수 있는 변화를 모두 반영했다.[95]null
참조
- ^ Riquet, M; Rivera, C; Gibault, L; Pricopi, C; Mordant, P; Badia, A; Arame, A; Le Pimpec Barthes, F (2014). "[Lymphatic spread of lung cancer: anatomical lymph node chains unchained in zones]". Revue de Pneumologie Clinique. 70 (1–2): 16–25. doi:10.1016/j.pneumo.2013.07.001. PMID 24566031.
- ^ Gupta, GP; Massagué, J (Nov 17, 2006). "Cancer metastasis: building a framework". Cell. 127 (4): 679–95. doi:10.1016/j.cell.2006.11.001. PMID 17110329. S2CID 7362869.
- ^ Rack B, Schindlbeck C, Jückstock J, Andergassen U, Hepp P, Zwingers T, Friedl T, Lorenz R, Tesch H, Fasching P, Fehm T, Schneeweiss A, Lichtenegger W, Beckmann M, Friese K, Pantel K, Janni W (2014). "Circulating Tumor Cells Predict Survival in Early Average-to-High Risk Breast Cancer Patients". Journal of the National Cancer Institute. 106 (5). doi:10.1093/jnci/dju066. PMC 4112925. PMID 24832787.
- ^ Millner, LM; Linder, MW; Valdes R, Jr (Summer 2013). "Circulating tumor cells: a review of present methods and the need to identify heterogeneous phenotypes". Annals of Clinical and Laboratory Science. 43 (3): 295–304. PMC 5060940. PMID 23884225.
- ^ Marrinucci, D; Bethel, K; Luttgen, M; Nieva, J; Kuhn, P; Kuhn, P (Sep 2009). "Circulating tumor cells from well-differentiated lung adenocarcinoma retain cytomorphologic features of primary tumor type". Archives of Pathology & Laboratory Medicine. 133 (9): 1468–71. doi:10.5858/133.9.1468. PMC 4422331. PMID 19722757.
- ^ a b Attard G, Swennenhuis JF, Olmos D, Reid AH, Vickers E, A'Hern R, Levink R, Coumans F, Moreira J, Riisnaes R, Oommen NB, Hawche G, Jameson C, Thompson E, Sipkema R, Carden CP, Parker C, Dearnaley D, Kaye SB, Cooper CS, Molina A, Cox ME, Terstappen LW, de Bono JS (2009). "Characterization of ERG, AR and PTEN gene status in circulating tumor cells from patients with castration-resistant prostate cancer". Cancer Res. 69 (7): 2912–8. doi:10.1158/0008-5472.CAN-08-3667. PMID 19339269.
- ^ a b Cohen SJ, Punt CJ, Iannotti N, Saidman BH, Sabbath KD, Gabrail NY, Picus J, Morse M, Mitchell E, Miller MC, Doyle GV, Tissing H, Terstappen LW, Meropol NJ (2008). "Relationship of circulating tumor cells to tumor response, progression-free survival, and overall survival in patients with metastatic colorectal cancer". J. Clin. Oncol. 26 (19): 3213–21. doi:10.1200/JCO.2007.15.8923. PMID 18591556.
- ^ Yu M, Ting DT, Stott SL, Wittner BS, Ozsolak F, Paul S, Ciciliano JC, Smas ME, Winokur D, Gilman AJ, Ulman MJ, Xega K, Contino G, Alagesan B, Brannigan BW, Milos PM, Ryan DP, Sequist LV, Bardeesy N, Ramaswamy S, Toner M, Maheswaran S, Haber DA (2012). "RNA sequencing of pancreatic circulating tumour cells implicates WNT signalling in metastasis". Nature. 487 (7408): 510–3. Bibcode:2012Natur.487..510Y. doi:10.1038/nature11217. PMC 3408856. PMID 22763454.
- ^ Sleijfer S, Gratama JW, Sieuwerts AM, et al. (2007). "Circulating tumour cell detection on its way to routine diagnostic implementation?". Eur J Cancer. 43 (18): 2645–50. doi:10.1016/j.ejca.2007.09.016. PMID 17977713.
- ^ Hayes DF, Smerage J.; Smerage (2008). "Is There a Role for Circulating Tumor Cells in the Management of Breast Cancer?". Clin Cancer Res. 14 (12): 3646–50. doi:10.1158/1078-0432.CCR-07-4481. PMID 18559576.
- ^ Pantel K, Alix-Panabières C, Riethdorf S (2009). "Cancer micrometastases". Nat Rev Clin Oncol. 6 (6): 339–51. doi:10.1038/nrclinonc.2009.44. PMID 19399023. S2CID 890927.
- ^ Pantel K, Riethdorf S.; Riethdorf (2009). "Pathology: are circulating tumor cells predictive of overall survival?". Nature Reviews Clinical Oncology. 6 (4): 190–1. doi:10.1038/nrclinonc.2009.23. PMID 19333222. S2CID 8904131.
- ^ Panteleakou Z, Lembessis P, Sourla A, et al. (2009). "Detection of circulating tumor cells in prostate cancer patients: methodological pitfalls and clinical relevance". Mol Med. 15 (3–4): 101–14. doi:10.2119/molmed.2008.00116. PMC 2600498. PMID 19081770.
- ^ Esmaeilsabzali H, Beischlag TV, Cox ME, Parameswaran AM, Park EJ (2013). "Detection and isolation of circulating tumor cells: principles and methods". Biotechnol. Adv. 31 (7): 1063–84. doi:10.1016/j.biotechadv.2013.08.016. PMID 23999357.
- ^ a b Nieva, J; Wendel, M; Luttgen, MS; Marrinucci, D; Bazhenova, L; Kolatkar, A; Santala, R; Whittenberger, B; Burke, J; Torrey, M; Bethel, K; Kuhn, P (Feb 2012). "High-definition imaging of circulating tumor cells and associated cellular events in non-small cell lung cancer patients: a longitudinal analysis". Physical Biology. 9 (1): 016004. Bibcode:2012PhBio...9a6004N. doi:10.1088/1478-3975/9/1/016004. PMC 3388002. PMID 22306961.
- ^ Hong, Yupeng; Fang, Francia; Zhang, Qi (December 2016). "Circulating tumor cell clusters: What we know and what we expect (Review)". International Journal of Oncology. 49 (6): 2206–2216. doi:10.3892/ijo.2016.3747. PMC 5117994. PMID 27779656.
- ^ Racila, E; Euhus, D; Weiss, AJ; Rao, C; McConnell, J; Terstappen, LW; Uhr, JW (Apr 1998). "Detection and characterization of carcinoma cells in the blood". Proceedings of the National Academy of Sciences. 95 (8): 4589–4594. Bibcode:1998PNAS...95.4589R. doi:10.1073/pnas.95.8.4589. PMC 22534. PMID 9539782.
- ^ a b c Marrinucci, Dena; Bethel, Kelly; Kolatkar, Anand; Luttgen, Madelyn; Malchiodi, Michael; Baehring, Franziska; Voigt, Katharina; Lazar, Daniel; Nieva, Jorge; Bazhenova, Lyudmilda; Ko, Andrew; Korn, W. Michael; Schram, Ethan; Coward, Michael; Yang, Xing; Metzner, Thomas; Lamy, Rachelle; Honnatti, Meghana; Yoshioka, Craig; Kunken, Joshua; Petrova, Yelena; Sok, Devin; Nelson, David; Kuhn, Peter (Feb 2012). "Fluid Biopsy in Patients with Metastatic Prostate, Pancreatic and Breast Cancers". Physical Biology. 9 (1): 016003. Bibcode:2012PhBio...9a6003M. doi:10.1088/1478-3975/9/1/016003. PMC 3387996. PMID 22306768.
- ^ Ferraldeschi, Roberta; McDaniel, Andrew; Krupa, Rachel; Louw, Jessica; Tucker, Eric; Bales, Natalee; Marrinucci, Dena; Riisnaes, Ruth; Mateo, Joaquin; Dittamore, Ryan; De Bono, Johann Sebastian; Tomlins, Scott A.; Attard, Gerhardt (February 2014). "CK- and small nuclear size circulating tumor cell (CTCs) phenotypes in metastatic castration-resistant prostate cancer (mCRPC)". Journal of Clinical Oncology. 32 (4_suppl): 209. doi:10.1200/jco.2014.32.4_suppl.209.
- ^ Aceto N, Bardia A, Miyamoto DT, Donaldson MC, Wittner BS, Spencer JA, Yu M, Pely A, Engstrom A, Zhu H, Brannigan BW, Kapur R, Stott SL, Shioda T, Ramaswamy S, Ting DT, Lin CP, Toner M, Haber DA, Maheswaran S (2014). "Circulating tumor cell clusters are oligoclonal precursors of breast cancer metastasis". Cell. 158 (5): 1110–22. doi:10.1016/j.cell.2014.07.013. PMC 4149753. PMID 25171411.
- ^ Divella R, Daniele A, Abbate I, Bellizzi A, Savino E, Simone G, Giannone G, Giuliani F, Fazio V, Gadaleta-Caldarola G, Gadaleta C, Lolli I, Sabbà C, Mazzocca A (2014). "The presence of clustered circulating tumor cells (CTCs) and circulating cytokines define an aggressive phenotype in metastatic colorectal cancer". Cancer Causes Control. 25 (11): 1531–41. doi:10.1007/s10552-014-0457-4. PMID 25135616. S2CID 16377917.
- ^ Ye Z, Mu Z, Wang C, Palazzo JP, Biederman L, Li B, Jaslow R, Avery T, Austin L, Yang H, Cristofanilli M (2016). "Prognostic values of circulating tumor cell (CTC) enumeration and their clusters in advanced breast cancer". Cancer Research. 76 (4 Supplement): P2–08–09. doi:10.1158/1538-7445.SABCS15-P2-08-09.
- ^ Cima, I.; Kong, S. L.; Sengupta, D.; Tan, I. B.; Phyo, W. M.; Lee, D.; Hu, M.; Iliescu, C.; Alexander, I.; Goh, W. L.; Rahmani, M.; Suhaimi, N.-A. M.; Vo, J. H.; Tai, J. A.; Tan, J. H.; Chua, C.; Ten, R.; Lim, W. J.; Chew, M. H.; Hauser, C. A. E.; van Dam, R. M.; Lim, W.-Y.; Prabhakar, S.; Lim, B.; Koh, P. K.; Robson, P.; Ying, J. Y.; Hillmer, A. M.; Tan, M.-H. (2016). "Tumor-derived circulating endothelial cell clusters in colorectal cancer". Science Translational Medicine. 8 (345): 345ra89. doi:10.1126/scitranslmed.aad7369. hdl:10754/615874. ISSN 1946-6234. PMID 27358499. S2CID 26085239.
- ^ Au S, Storey B, Moore J, Tang Q, Chen Y, Javaid S, Sarioglu A, Sullivan R, Madden M, O'Keefe R, Haber D, Maheswaran S, Langenau D, Stott S, Toner M (2016). "Clusters of circulating tumor cells traverse capillary-sized vessels". Proceedings of the National Academy of Sciences. 113 (18): 4937–52. Bibcode:2016PNAS..113.4947A. doi:10.1073/pnas.1524448113. PMC 4983862. PMID 27091969.
- ^ Ghossein RA, Bhattacharya S, Rosai J (1999). "Molecular detection of micrometastases and circulating tumor cells in solid tumors". Clin. Cancer Res. 5 (8): 1950–60. PMID 10473071.
- ^ Zhe, X; Cher M.L.; Bonfil R.D. (2011). "Circulating tumor cells: finding the needle in the haystack". Am J Cancer Res. 1 (6): 740–751. PMC 3195935. PMID 22016824.
- ^ a b Miller MC, Doyle GV, Terstappen LW (2010). "Significance of Circulating Tumor Cells Detected by the CellSearch System in Patients with Metastatic Breast Colorectal and Prostate Cancer". J Oncol. 2010: 1–8. doi:10.1155/2010/617421. PMC 2793426. PMID 20016752.
- ^ Swaby, RF; Cristofanilli, M (Apr 21, 2011). "Circulating tumor cells in breast cancer: a tool whose time has come of age". BMC Medicine. 9: 43. doi:10.1186/1741-7015-9-43. PMC 3107794. PMID 21510857.
- ^ Danila, DC; Fleisher, M; Scher, HI (Jun 15, 2011). "Circulating tumor cells as biomarkers in prostate cancer". Clinical Cancer Research. 17 (12): 3903–12. doi:10.1158/1078-0432.CCR-10-2650. PMC 3743247. PMID 21680546.
- ^ Tanaka F, Yoneda K, Kondo N, Hashimoto M, Takuwa T, Matsumoto S, Okumura Y, Rahman S, Tsubota N, Tsujimura T, Kuribayashi K, Fukuoka K, Nakano T, Hasegawa S (2009). "Circulating tumor cell as a diagnostic marker in primary lung cancer". Clin. Cancer Res. 15 (22): 6980–6. doi:10.1158/1078-0432.CCR-09-1095. PMID 19887487.
- ^ Negin, BP; Cohen, SJ (Jun 2010). "Circulating tumor cells in colorectal cancer: past, present, and future challenges". Current Treatment Options in Oncology. 11 (1–2): 1–13. doi:10.1007/s11864-010-0115-3. PMID 20143276. S2CID 11881681.
- ^ Mikolajczyk, SD; Millar, LS; Tsinberg, P; Coutts, SM; Zomorrodi, M; Pham, T; Bischoff, FZ; Pircher, TJ (2011). "Detection of EpCAM-Negative and Cytokeratin-Negative Circulating Tumor Cells in Peripheral Blood". Journal of Oncology. 2011: 1–10. doi:10.1155/2011/252361. PMC 3090615. PMID 21577258.
- ^ da Costa A, Oliveira JT, Gärtner F, Kohn B, Gruber AD, Klopfleisch R (2011). "Potential markers for detection of circulating canine mammary tumor cells in the peripheral blood". Vet. J. 190 (1): 165–8. doi:10.1016/j.tvjl.2010.09.027. PMID 21051248.
- ^ da Costa, A (2013). "Multiple RT-PCR markers for the detection of circulating tumour cells of metastatic canine mammary tumours". Veterinary Journal. 196 (1): 34–39. doi:10.1016/j.tvjl.2012.08.021. PMID 23036177.
- ^ Harb, W.; Fan, A.; Tran, T.; Danila, D.C.; Keys, D.; Schwartz, M.; and Ionescu-Zanetti, C. (2013). "Mutational Analysis of Circulating Tumor Cells Using a Novel Microfluidic Collection Device and qPCR Assay". Transl. Oncol. 6 (5): 528–538. doi:10.1593/tlo.13367. PMC 3799195. PMID 24151533.
- ^ a b c Pachmann K.; Camara O.; Kavallaris A.; Krauspe S.; Malarski N.; Gajda M.; Kroll T.; Jorke C.; Hammer U.; Altendorf-Hofmann A.; et al. (2008). "Monitoring the Response of Circulating Epithelial Tumor Cells to Adjuvant Chemotherapy in Breast Cancer Allows Detection of Patients at Risk of Early Relapse". J. Clin. Oncol. 26 (8): 1208–1215. doi:10.1200/JCO.2007.13.6523. PMID 18323545. S2CID 20074388.
- ^ Ronen, Shira; Kroft, Steven H.; Olteanu, Horatiu; Hosking, Paul R.; Harrington, Alexandra M. (2019). "Carcinocythemia: A rare entity becoming more common? A 3-year, single institution series of seven cases and literature review". International Journal of Laboratory Hematology. 41 (1): 69–79. doi:10.1111/ijlh.12924. ISSN 1751-5521. PMID 30216684.
- ^ Paterlini-Brechot P, Benali NL.; Benali (2007). "Circulating tumor cells (CTC) detection: Clinical impact and future directions". Cancer Lett. 253 (2): 180–204. doi:10.1016/j.canlet.2006.12.014. PMID 17314005.
- ^ "Veridex CellSearch Website". March 2010. Archived from the original on 2008-06-05. Retrieved 2010-03-14.
- ^ "Veridex LLC. CellSearch circulating tumor cell kit premarket notification—expanded indications for use—metastatic prostate cancer" (PDF). Food and Drug Administration. March 2010. Retrieved 2010-03-14.[데드링크]
- ^ Cristofanilli M, Budd GT, Ellis MJ, et al. (2004). "Circulating Tumor Cells, Disease Progression and Survival in Metastatic Breast Cancer". NEJM. 351 (8): 781–91. doi:10.1056/NEJMoa040766. PMID 15317891. S2CID 7445998.
- ^ Budd G, Cristofanilli M, Ellis M, et al. (2006). "Circulating Tumor Cells versus Imaging - Predicting Overall Survival in Metastatic Breast Cancer". Clin Cancer Res. 12 (21): 6404–09. doi:10.1158/1078-0432.CCR-05-1769. PMID 17085652.
- ^ JS DeBono; HI Scher; RB Montgomery; et al. (2008). "Circulating Tumor Cells (CTC) predict survival benefit from treatment in metastatic castration resistant prostate cancer (CRPC)". Clin Cancer Res. 14 (19): 6302–9. doi:10.1158/1078-0432.CCR-08-0872. PMID 18829513.
- ^ Allard WJ, Matera J, Miller MC, et al. (2004). "Tumor cells circulate in the peripheral blood of all major carcinomas but not in healthy subjects or patients with non-malignant diseases". Clin Cancer Res. 10 (20): 6897–6904. doi:10.1158/1078-0432.CCR-04-0378. PMID 15501967.
- ^ Riethdorf; Fritsche, H; Müller, V; Rau, T; Schindlbeck, C; Rack, B; Janni, W; Coith, C; et al. (2007). "Detection of Circulating Tumor Cells in Peripheral Blood of Patients with Metastatic Breast Cancer: A Validation Study of the CellSearch System". Clin Cancer Res. 13 (3): 920–8. doi:10.1158/1078-0432.CCR-06-1695. PMID 17289886.
- ^ Yu M.; et al. (2011). "Circulating tumor cells: approaches to isolation and characterization". The Journal of Cell Biology. 192 (3): 373–382. doi:10.1083/jcb.201010021. PMC 3101098. PMID 21300848.
- ^ Nagrath, Sunitha; Sequist, Lecia V.; Maheswaran, Shyamala; Bell, Daphne W.; Irimia, Daniel; Ulkus, Lindsey; Smith, Matthew R.; Kwak, Eunice L.; Digumarthy, Subba; Muzikansky, Alona; Ryan, Paula; Balis, Ulysses J.; Tompkins, Ronald G.; Haber, Daniel A.; Toner, Mehmet (December 2007). "Isolation of rare circulating tumour cells in cancer patients by microchip technology". Nature. 450 (7173): 1235–1239. Bibcode:2007Natur.450.1235N. doi:10.1038/nature06385. PMC 3090667. PMID 18097410.
- ^ Hoshino, Kazunori; Huang, Yu-Yen; Lane, Nancy; Huebschman, Michael; Uhr, Jonathan W.; Frenkel, Eugene P.; Zhang, Xiaojing (Oct 2011). "Microchip-based immunomagnetic detection of circulating tumor cells". Lab on a Chip. 11 (20): 3449–3457. doi:10.1039/c1lc20270g. PMC 3379551. PMID 21863182.
- ^ Peng, Chen; Yu-yen, Huang; Hoshino, Kazunori; Xiaojing, Zhang (2014). "Multiscale immunomagnetic enrichment of circulating tumor cells: from tubes to microchips". Lab on a Chip. 14 (3): 446–458. doi:10.1039/C3LC51107C. PMID 24292816. S2CID 205863853.
- ^ Huang, Yu-yen; Hoshino, Kazunori; Chen, Peng; Wu, Chun-hsien; Lane, Nancy; Huebschman, Michael; Liu, Huaying; Sokolov, Konstantin; Uhr, Jonathan W. (2012-10-30). "Immunomagnetic nanoscreening of circulating tumor cells with a motion controlled microfluidic system". Biomedical Microdevices. 15 (4): 673–681. doi:10.1007/s10544-012-9718-8. ISSN 1387-2176. PMC 3584207. PMID 23109037.
- ^ Hoshino, Kazunori; Chen, Peng; Huang, Yu-Yen; Zhang, Xiaojing (2012-05-15). "Computational Analysis of Microfluidic Immunomagnetic Rare Cell Separation from a Particulate Blood Flow". Analytical Chemistry. 84 (10): 4292–4299. doi:10.1021/ac2032386. ISSN 0003-2700. PMC 3359653. PMID 22510236.
- ^ Chen, Peng; Huang, Yu-Yen; Hoshino, Kazunori; Zhang, John X.J. (2015-03-04). "Microscale Magnetic Field Modulation for Enhanced Capture and Distribution of Rare Circulating Tumor Cells". Scientific Reports. 5: 8745. Bibcode:2015NatSR...5E8745C. doi:10.1038/srep08745. ISSN 2045-2322. PMC 4348664. PMID 25735563.
- ^ Huang, Yu-Yen; Chen, Peng; Wu, Chun-Hsien; Hoshino, Kazunori; Sokolov, Konstantin; Lane, Nancy; Liu, Huaying; Huebschman, Michael; Frenkel, Eugene (2015-11-05). "Screening and Molecular Analysis of Single Circulating Tumor Cells Using Micromagnet Array". Scientific Reports. 5: 16047. Bibcode:2015NatSR...516047H. doi:10.1038/srep16047. ISSN 2045-2322. PMC 4633592. PMID 26538094.
- ^ Chen, Peng; Huang, Yu-Yen; Bhave, Gauri; Hoshino, Kazunori; Zhang, Xiaojing (2015-08-20). "Inkjet-Print Micromagnet Array on Glass Slides for Immunomagnetic Enrichment of Circulating Tumor Cells". Annals of Biomedical Engineering. 44 (5): 1710–1720. doi:10.1007/s10439-015-1427-z. ISSN 0090-6964. PMC 4761332. PMID 26289942.
- ^ Wang, Huiqiang; Chen, Nanhai G.; Minev, Boris R.; Zimmermann, Martina; Aguilar, Richard J.; Zhang, Qian; Sturm, Julia B.; Fend, Falko; Yu, Yong A.; Cappello, Joseph; Lauer, Ulrich M.; Szalay, Aladar A. (September 2013). "Optical Detection and Virotherapy of Live Metastatic Tumor Cells in Body Fluids with Vaccinia Strains". PLOS ONE. 8 (9): e71105. Bibcode:2013PLoSO...871105W. doi:10.1371/journal.pone.0071105. PMC 3760980. PMID 24019862.
- ^ Agerbæk, Mette Ø.; Bang-Christensen, Sara R.; Yang, Ming-Hsin; Clausen, Thomas M.; Pereira, Marina A.; Sharma, Shreya; Ditlev, Sisse B.; Nielsen, Morten A.; Choudhary, Swati; Gustavsson, Tobias; Sorensen, Poul H.; Meyer, Tim; Propper, David; Shamash, Jonathan; Theander, Thor G.; Aicher, Alexandra; Daugaard, Mads; Heeschen, Christopher; Salanti, Ali (16 August 2018). "The VAR2CSA malaria protein efficiently retrieves circulating tumor cells in an EpCAM-independent manner". Nature Communications. 9 (1): 3279. Bibcode:2018NatCo...9.3279A. doi:10.1038/s41467-018-05793-2. PMC 6095877. PMID 30115931.
- ^ GILUPI. "GILUPI - CellCollector in vivo CTC isolation". www.gilupi.de.
- ^ Saucedo-Zeni Nadia; et al. (2012). "A novel method for the in vivo isolation of circulating tumor cells from peripheral blood of cancer patients using a functionalized and structured medical wire". International Journal of Oncology. 41 (4): 1241–1250. doi:10.3892/ijo.2012.1557. PMC 3583719. PMID 22825490.
- ^ 루케, 클라우스 등"폐암 환자의 종양 세포 열거 및 분자 특성화를 순환시키기 위한 생체내 도구로서의 GILUPI CellCollector." ASCO 연례 회의 절차제33권No. 15_supply. 2015.http://hwmaint.meeting.ascopubs.org/cgi/content/abstract/33/15_suppl/e22035 웨이백 머신에 2016-03-10 보관
- ^ Scheumann N; et al. (2015). "50P * Enumeration and Molecular Characterization of Circulating Tumor Cells in Lung Cancer Patients Using the Gilupi Cellcollector , an Effective in Vivo Device for Capturing CTCS". Annals of Oncology. 26: i14. doi:10.1093/annonc/mdv045.14.
- ^ "An Introduction to the CellSearch™" (PDF). Archived from the original (PDF) on 2014-01-23.
- ^ Sánchez-Lorencio, M.I.; Ramirez, P.; Saenz, L.; Martínez Sánchez, M.V.; De La Orden, V.; Mediero-Valeros, B.; Veganzones-De-Castro, S.; Baroja-Mazo, A.; Revilla Nuin, B.; Gonzalez, M.R.; Cascales-Campos, P.A.; Noguera-Velasco, J.A.; Minguela, A.; Díaz-Rubio, E.; Pons, J.A.; Parrilla, P. (November 2015). "Comparison of Two Types of Liquid Biopsies in Patients With Hepatocellular Carcinoma Awaiting Orthotopic Liver Transplantation". Transplantation Proceedings. 47 (9): 2639–2642. doi:10.1016/j.transproceed.2015.10.003. PMID 26680058.
- ^ Bethel, Kelly; Luttgen2, Madelyn; Damani, Samir; Kolatkar2, Anand; Lamy, Rachelle; Sabouri-Ghomi, Mohsen; Topol, Sarah; Topol2, Eric; Kuhn, Peter (9 Jan 2014). "Fluid phase biopsy for detection and characterization of circulating endothelial cells in myocardial infarction". Physical Biology. 11 (1): 016002. Bibcode:2014PhBio..11a6002B. doi:10.1088/1478-3975/11/1/016002. PMC 4143170. PMID 24406475.
- ^ Pachmann, Katharina (5 April 2015). "Current and potential use of MAINTRAC method for cancer diagnosis and prediction of metastasis". Expert Review of Molecular Diagnostics. 15 (5): 597–605. doi:10.1586/14737159.2015.1032260. PMID 25843106. S2CID 34030968.
- ^ Pachmann K.; Camara O.; Kavallaris A.; Schneider U.; Schünemann S.; Höffken K. (2005). "Quantification of the response of circulating epithelial cells to neodadjuvant treatment for breast cancer: a new tool for therapy monitoring". Breast Cancer Res. 7 (6): R975–979. doi:10.1186/bcr1328. PMC 1410761. PMID 16280045.
- ^ Lobodasch, Kurt; Fröhlich, Frank; Rengsberger, Matthias; Schubert, Rene; Dengler, Robert; Pachmann, Ulrich; Pachmann, Katharina (April 2007). "Quantification of circulating tumour cells for the monitoring of adjuvant therapy in breast cancer: An increase in cell number at completion of therapy is a predictor of early relapse". The Breast. 16 (2): 211–218. doi:10.1016/j.breast.2006.12.005. ISSN 0960-9776. PMID 17291754.
- ^ Camara O.; Rengsberger M.; Egbe A.; Koch A.; Gajda M.; Hammer U.; Jorke C.; Rabenstein C.; Untch M.; Pachmann K. (2007). "The relevance of circulating epithelial tumor cells (CETC) for therapy monitoring during neoadjuvant (primary systemic) chemotherapy in breast cancer". Ann. Oncol. 18 (9): 1484–1492. doi:10.1093/annonc/mdm206. PMID 17761704.
- ^ Pachmann K.; Camara O.; Kohlhase A.; Rabenstein C.; Kroll T.; Runnebaum I.B.; Hoeffken K. (2010). "Assessing the efficacy of targeted therapy using circulating epithelial tumor cells (CETC): the example of SERM therapy monitoring as a unique tool to individualize therapy". J. Cancer Res. Clin. Oncol. 137 (5): 821–828. doi:10.1007/s00432-010-0942-4. PMC 3074080. PMID 20694797.
- ^ Pachmann K.; Camara O.; Kroll T.; Gajda M.; Gellner A.K.; Wotschadlo J.; Runnebaum I.B. (2011). "Efficacy control of therapy using circulating epithelial tumor cells (CETC) as "Liquid Biopsy": trastuzumab in HER2/neu-positive breast carcinoma". J. Cancer Res. Clin. Oncol. 137 (9): 1317–1327. doi:10.1007/s00432-011-1000-6. PMC 3155034. PMID 21739182.
- ^ Hekimian K.; Meisezahl S.; Trompelt K.; Rabenstein C.; Pachmann K. (2012). "Epithelial Cell Dissemination and Readhesion: Analysis of Factors Contributing to Metastasis Formation in Breast Cancer". ISRN Oncol. 2012: 1–8. doi:10.5402/2012/601810. PMC 3317055. PMID 22530147.
- ^ Rolle A.; Günzel R.; Pachmann U.; Willen B.; Höffken K.; Pachmann K. (2005). "Increase in number of circulating disseminated epithelial cells after surgery for non-small cell lung cancer monitored by MAINTRAC is a predictor for relapse: A preliminary report". World J. Surg. Oncol. 3 (1): 18. doi:10.1186/1477-7819-3-18. PMC 1087511. PMID 15801980.
- ^ Camara Oumar; Kavallaris Andreas; Nöschel Helmut; Rengsberger Matthias; Jörke Cornelia; Pachmann Katharina (2006). "Seeding of Epithelial Cells into Circulation During Surgery for Breast Cancer: The Fate of Malignant and Benign Mobilized Cells". World Journal of Surgical Oncology. 4: 67. doi:10.1186/1477-7819-4-67. PMC 1599731. PMID 17002789.
- ^ Desitter I.; et al. (2011). "A New Device for Rapid Isolation by Size and Characterization of Rare Circulating Tumor Cells". Anticancer Research. 31 (2): 427–442. PMID 21378321.
- ^ Miller, M. Craig; Robinson, Peggy S.; Wagner, Christopher; O'Shannessy, Daniel J. (14 August 2018). "The Parsortix™ Cell Separation System—A versatile liquid biopsy platform". Cytometry Part A. 93 (12): 1234–1239. doi:10.1002/cyto.a.23571. PMC 6586069. PMID 30107082.
- ^ Tkaczuk KH, Goloubeva O, Tait NS, Feldman F, Tan M, Lum ZP, Lesko SA, Van Echo DA, Ts'o PO (2008). "The significance of circulating epithelial cells in Breast Cancer patients by a novel negative selection method". Breast Cancer Res. Treat. 111 (2): 355–64. doi:10.1007/s10549-007-9771-9. PMID 18064568. S2CID 25370612.
- ^ Wang ZP, Eisenberger MA, Carducci MA, Partin AW, Scher HI, Ts'o PO (2000). "Identification and characterization of circulating prostate carcinoma cells". Cancer. 88 (12): 2787–95. doi:10.1002/1097-0142(20000615)88:12<2787::aid-cncr18>3.0.co;2-2. PMID 10870062.
- ^ Polascik TJ, Wang ZP, Shue M, Di S, Gurganus RT, Hortopan SC, Ts'o PO, Partin AW (1999). "Influence of sextant prostate needle biopsy or surgery on the detection and harvest of intact circulating prostate cancer cells". J. Urol. 162 (3 Pt 1): 749–52. doi:10.1097/00005392-199909010-00034. PMID 10458358.
- ^ Ali A, Furusato B, Ts'o PO, Lum ZP, Elsamanoudi S, Mohamed A, Srivastava S, Moul JW, Brassell SA, Sesterhenn IA, McLeod DG (2010). "Assessment of circulating tumor cells (CTCs) in prostate cancer patients with low-volume tumors". Pathol. Int. 60 (10): 667–72. doi:10.1111/j.1440-1827.2010.02584.x. PMID 20846264. S2CID 205478411.
- ^ Hodgkinson, Cassandra L; Morrow, Christopher J; Li, Yaoyong; Metcalf, Robert L; Rothwell, Dominic G; Trapani, Francesca; Polanski, Radoslaw; Burt, Deborah J; Simpson, Kathryn L; Morris, Karen; Pepper, Stuart D; Nonaka, Daisuke; Greystoke, Alastair; Kelly, Paul; Bola, Becky; Krebs, Matthew G; Antonello, Jenny; Ayub, Mahmood; Faulkner, Suzanne; Priest, Lynsey; Carter, Louise; Tate, Catriona; Miller, Crispin J; Blackhall, Fiona; Brady, Ged; Dive, Caroline (1 June 2014). "Tumorigenicity and genetic profiling of circulating tumor cells in small-cell lung cancer". Nature Medicine. 20 (8): 897–903. doi:10.1038/nm.3600. PMID 24880617. S2CID 205393324.
- ^ Ozkumur E, Shah AM, Ciciliano JC, Emmink BL, Miyamoto DT, Brachtel E, Yu M, Chen PI, Morgan B, Trautwein J, Kimura A, Sengupta S, Stott SL, Karabacak NM, Barber TA, Walsh JR, Smith K, Spuhler PS, Sullivan JP, Lee RJ, Ting DT, Luo X, Shaw AT, Bardia A, Sequist LV, Louis DN, Maheswaran S, Kapur R, Haber DA, Toner M (2013). "Inertial focusing for tumor antigen-dependent and -independent sorting of rare circulating tumor cells". Science Translational Medicine. 5 (179): 179. doi:10.1126/scitranslmed.3005616. PMC 3760275. PMID 23552373.
- ^ Meng S, Tripathy D, Shete S, Ashfaq R, Haley B, Perkins S, Beitsch P, Khan A, Euhus D, Osborne C, Frenkel E, Hoover S, Leitch M, Clifford E, Vitetta E, Morrison L, Herlyn D, Terstappen LW, Fleming T, Fehm T, Tucker T, Lane N, Wang J, Uhr J (2004). "HER-2 gene amplification can be acquired as breast cancer progresses". Proc. Natl. Acad. Sci. U.S.A. 101 (25): 9393–8. Bibcode:2004PNAS..101.9393M. doi:10.1073/pnas.0402993101. PMC 438987. PMID 15194824.
- ^ Hayes DF, Walker TM, Singh B, et al. (2002). "Monitoring Expression of HER-2 on Circulating Epithelial Cells in Patients with advanced Breast Cancer". Int J Oncol. 21 (5): 1111–8. doi:10.3892/ijo.21.5.1111. PMID 12370762.
- ^ O'Hara SM, Moreno JG, Zweitzig DR, et al. (2004). "Multigene Reverse Transcription-PCR Profiling of Circulating Tumor Cells in Hormone-Refractory Prostate Cancer". Clin Chem. 50 (5): 826–835. doi:10.1373/clinchem.2003.028563. PMID 14988224.
- ^ de Bono JS, Attard G, Adjei A, et al. (2007). "Potential Applications for Circulating Tumor Cells expressing the Insulin Growth Factor-I Receptor". Clin Cancer Res. 13 (12): 3611–6. doi:10.1158/1078-0432.CCR-07-0268. PMID 17575225.
- ^ Karp DD, Pollak MN, Cohen RB, et al. (2009). "Pharmacokinetics and Pharmacodynamics of the IGF-IR Inhibitor Figitumumab (CP-751,871) in Combination with Paclitaxel and Carboplatin". Journal of Thoracic Oncology. 4 (11): 1397–1403. doi:10.1097/JTO.0b013e3181ba2f1d. PMC 2941876. PMID 19745765.
- ^ Klotz, Remi; Thomas, Amal; Teng, Teng; Han, Sung Min; Iriondo, Oihana; Li, Lin; Restrepo-Vassalli, Sara; Wang, Alan; Izadian, Negeen; MacKay, Matthew; Moon, Byoung-San (2019-01-01). "Circulating tumor cells exhibit metastatic tropism and reveal brain metastasis drivers". Cancer Discovery. 10 (1): CD–19–0384. doi:10.1158/2159-8290.CD-19-0384. ISSN 2159-8274. PMC 6954305. PMID 31601552.
- ^ AGJ Tibbe; MC Miller; LWMM Terstappen (2007). "Statistical Considerations for Enumeration of Circulating Tumor Cells". Cytometry Part A. 71A (3): 132–142. doi:10.1002/cyto.a.20369. PMID 17200956. S2CID 6648226.
- ^ F. A. W. Coumans; C. J. M. Doggen; G. Attard; et al. (2010). "All circulating EpCAM1CK1CD452 objects predict overall survival in castration-resistant prostate cancer". Annals of Oncology. 21 (9): 1851–7. doi:10.1093/annonc/mdq030. PMID 20147742.
- ^ Ashworth, T. R (1869). "A case of cancer in which cells similar to those in the tumours were seen in the blood after death". Australian Medical Journal. 14: 146–7.
- ^ Racila, E.; Euhus, D.; Weiss, A. J.; Rao, C.; McConnell, J.; Terstappen, L. W. M. M.; Uhr, J. W. (1998). "Detection and characterization of carcinoma cells in the blood". Proceedings of the National Academy of Sciences. 95 (8): 4589–4594. Bibcode:1998PNAS...95.4589R. doi:10.1073/pnas.95.8.4589. ISSN 0027-8424. PMC 22534. PMID 9539782.
- ^ Paul Liberti (November 22, 2013). "The tools that fueled the new world of Circulating Tumor Cells by Paul A. Liberti – BioMagnetic Solutions". biomargneticsolutions.com. Archived from the original on September 26, 2017. Retrieved September 25, 2017.
- ^ Fehm T, Sagalowsky A, Clifford E, Beitsch P, Saboorian H, Euhus D, Meng S, Morrison L, Tucker T, Lane N, Ghadimi BM, Heselmeyer-Haddad K, Ried T, Rao C, Uhr J (Jul 2002). "Cytogenetic evidence that circulating epithelial cells in patients with carcinoma are malignant". Clinical Cancer Research. 8 (7): 2073–84. PMID 12114406.
- ^ Fidler IJ (2003). "Timeline: The pathogenesis of cancer metastasis: the 'seed and soil' hypothesis revisited". Nature Reviews Cancer. 3 (6): 453–8. doi:10.1038/nrc1098. PMID 12778135. S2CID 9195161.
- ^ "Meeting Library - Meeting Library". meetinglibrary.asco.org.
- ^ Design, ISITE. "OASIS". www.abstractsonline.com.