β-락타마아제 저해제
β-Lactamase inhibitor베타-락타마제는 베타-락탐 항생제에 대한 박테리아 내성에 관여하는 효소 계열입니다. 베타락탐 항생제에 대한 박테리아 내성에서 박테리아는 베타락탐 고리를 분해하는 베타락타마제를 가지고 있어 항생제를 효과적으로 사용하지 못합니다. 그러나 베타-락타마제 억제제를 사용하면 박테리아의 이러한 효소가 억제되어 항생제가 효과를 발휘할 수 있습니다. 이러한 형태의 내성과 싸우기 위한 전략에는 분열에 더 저항력이 있는 새로운 베타-락탐 항생제의 개발과 베타-락타마제 억제제라고 불리는 효소 억제제의 종류의 개발이 포함되었습니다.[1] β-락타마제 억제제는 자체 항생제 활성이 거의 없지만 [2]베타-락탐 항생제의 세균 분해를 막아 약물이 효과적인 세균의 범위를 넓혀줍니다.
의료용
베타-락타마제 억제제의 가장 중요한 용도는 그람 음성 박테리아에 의해 알려져 있거나 발생하는 것으로 추정되는 감염의 치료에 있습니다. 베타-락타마제 생산은 이러한 병원체에서 베타-락탐 내성에 중요한 기여를 하기 때문입니다. 대조적으로, 그람 양성 박테리아에서 대부분의 베타-락탐 내성은 베타-락탐에 대한 결합을 감소시키는 페니실린 결합 단백질의 변이로 인한 것입니다.[3][4] 그람 양성 병원체인 황색포도상구균은 베타-락타마제를 생성하지만, 베타-락타마제 억제제는 가장 내성이 강한 균주(메티실린 내성 황색포도상구균)도 변이 페니실린 결합 단백질을 사용하기 때문에 이러한 감염의 치료에 더 적은 역할을 합니다.[5][6]
작용기전
앰블러 분류 시스템은 알려진 베타-락타마제 효소를 서열 상동성과 추정되는 계통발생적 관계에 따라 4개의 그룹으로 분류합니다. 클래스 A, C 및 D는 세린 프로테아제의 메커니즘과 유사한 다단계 메커니즘에 의해 베타-락탐을 절단합니다. 결합 시, 베타-락타마제 활성 부위의 세린 하이드록실기가 베타-락탐 고리 카르보닐기에 일시적인 공유 결합을 형성하고, 이 과정에서 베타-락탐 고리를 절단합니다. 두 번째 단계로, 물 분자에 의한 친핵성 공격은 베타-락탐 동안 효소와 카르보닐기 사이의 공유 결합을 절단합니다. 이것은 분해된 베타-락탐이 확산되도록 하고 효소를 자유롭게 하여 추가적인 베타-락탐 분자를 처리합니다.[citation needed]
현재 사용 가능한 베타-락타마제 억제제는 A급 베타-락타마제(타조박탐, 클라불라네이트 및 설박탐) 또는 A급, C급 및 일부 D급 베타-락타마제(아비박탐)에 효과적입니다. 베타락탐 항생제와 마찬가지로 베타락타마제에 의해 처리되어 초기 공유 중간체를 형성합니다. 베타락탐계 항생제의 경우와 달리 억제제는 자살 기질(타조박탐과 설박탐)로 작용하여 궁극적으로 베타락타마제의 분해를 유도합니다.[7] 반면 아비박탐은 베타-락탐 고리(비베타-락탐 베타-락타마제 억제제)를 포함하지 않고 대신 가역적으로 결합합니다.[8][9]
Ambler Class B 베타-락타마제는 메탈로프로테아제와 유사한 메커니즘에 의해 베타-락탐을 절단합니다. 공유 중간체가 형성되지 않아 시판되는 베타-락타마제 억제제의 작용기전은 해당되지 않습니다. 따라서 뉴델리 메탈로-베타-락타마제 1과 같은 메탈로 베타-락타마제를 발현하는 박테리아 균주의 확산은 상당한 우려를 낳았습니다.[10]
일반적으로 사용되는 에이전트
현재 시판되고 있는 β-락타마제 억제제는 개별 약물로 판매되고 있지 않습니다. 대신 유사한 혈청 반감기를 가진 β-락탐 항생제와 함께 투여됩니다. 이는 투약 편의성뿐만 아니라 한 가지 또는 다른 약물에 다양한 노출로 인해 발생할 수 있는 내성 발생을 최소화하기 위해 수행됩니다. 그람 음성 박테리아 감염을 치료하기 위해 사용되는 β-락탐 항생제의 주요 부류는 (β-락타마제에 의한 절단에 대한 대략적인 고유 내성 순서) 페니실린(특히 아미노페니실린 및 우레도페니실린), 3세대 세팔로스포린 및 카바페넴을 포함합니다. 개별 β-락타마제 변이체는 이러한 약물 그룹 중 하나 또는 다수를 표적으로 할 수 있으며, 주어진 β-락타마제 억제제에 의해 부분집합만이 억제됩니다.[9] β-lactamase 억제제는 박테리아에 의해 생성되는 β-lactamase 효소를 억제하여 이들 β-lactam 항생제의 유용한 스펙트럼을 확장시켜 줍니다.
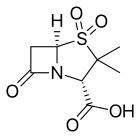
- β-lact암 코어를 갖는 β-lact아마제 억제제:
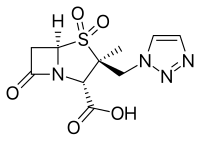
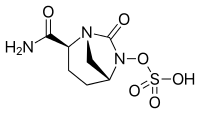
- 디아자비시클로옥탄 코어를 갖는 β-lact아마제 억제제:
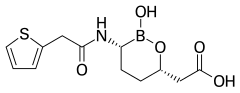
- 다른 유형의 비 β-lact암 코어와 함께 β-lact아마제 억제제:
베타락타마제 생성균
베타-락타마제를 생산할 수 있는 박테리아는 다음과 같습니다.[citation needed]
- 포도상구균
- MRSA(메티실린 내성 황색포도상구균)
- 장내세균과:
- 인플루엔자균(Hemophilus influenzae)
- 모락셀라 카타랄리스
- 나이세리아 고노르호에아과
- 녹농균
- 결핵균
조사.
일부 박테리아는 확장 스펙트럼 베타-락타마제(ESBL)를 생성하여 감염을 치료하기가 더 어렵고 페니실린, 세팔로스포린 및 모노박탐에 대한 추가 내성을 부여할 수 있습니다.[16] 보론산 유도체는 베타-락타마제를 통해 가수분해될 때 베타-락탐이 겪는 전이 상태를 모방하는 부위를 포함하고 있어 베타-락타마제의 새로운 활성 부위 억제제로서 광범위하고 광범위한 연구가 진행되고 있습니다. 이들은 일반적으로 많은 베타-락타마제의 활성 부위에 잘 맞는 것으로 밝혀졌으며 가수분해될 수 없는 편리한 특성을 가지고 있으므로 무용지물이 됩니다. 이는 클라불란산과 같은 대부분의 약제가 가수분해되기 때문에 제한된 기간 동안만 유용하기 때문에 임상적으로 사용되는 많은 경쟁 약제에 비해 유리한 약물 설계입니다. 이것은 일반적으로 가수분해되지 않는 억제제에서 필요한 것보다 더 높은 농도의 경쟁적 억제제가 필요하게 합니다. 다양한 보론산 유도체는 베타-락타마제의 다양한 이소형에 맞춰질 수 있는 잠재력을 가지고 있으며, 따라서 베타-락탐 항생제의 효능을 재정립할 수 있는 잠재력을 가지고 있습니다.[17]
참고문헌
- ^ Essack SY (October 2001). "The development of beta-lactam antibiotics in response to the evolution of beta-lactamases". Pharmaceutical Research. 18 (10): 1391–9. doi:10.1023/a:1012272403776. PMID 11697463. S2CID 34318096.
- ^ "Beta-Lactamase Inhibitors". Department of Nursing of the Fort Hays State University College of Health and Life Sciences. October 2000. Archived from the original on 2007-09-27. Retrieved 2007-08-17.
- ^ Georgopapadakou NH (October 1993). "Penicillin-binding proteins and bacterial resistance to beta-lactams". Antimicrobial Agents and Chemotherapy. 37 (10): 2045–53. doi:10.1128/aac.37.10.2045. PMC 192226. PMID 8257121.
- ^ Zapun A, Contreras-Martel C, Vernet T (March 2008). "Penicillin-binding proteins and beta-lactam resistance". FEMS Microbiology Reviews. 32 (2): 361–85. doi:10.1111/j.1574-6976.2007.00095.x. PMID 18248419.
- ^ Curello J, MacDougall C (July 2014). "Beyond Susceptible and Resistant, Part II: Treatment of Infections Due to Gram-Negative Organisms Producing Extended-Spectrum β-Lactamases". The Journal of Pediatric Pharmacology and Therapeutics. 19 (3): 156–64. doi:10.5863/1551-6776-19.3.156. PMC 4187532. PMID 25309145.
- ^ Wolter DJ, Lister PD (2013). "Mechanisms of β-lactam resistance among Pseudomonas aeruginosa". Current Pharmaceutical Design. 19 (2): 209–22. doi:10.2174/13816128130203. PMID 22894618.
- ^ Patrick, Graham L. (2017). An introduction to medicinal chemistry (6th ed.). Oxford, United Kingdom. ISBN 9780198749691. OCLC 987051883.
{{cite book}}: CS1 maint: 위치 누락 게시자(링크) - ^ Lahiri SD, Mangani S, Durand-Reville T, Benvenuti M, De Luca F, Sanyal G, Docquier JD (June 2013). "Structural insight into potent broad-spectrum inhibition with reversible recyclization mechanism: avibactam in complex with CTX-M-15 and Pseudomonas aeruginosa AmpC β-lactamases". Antimicrobial Agents and Chemotherapy. 57 (6): 2496–505. doi:10.1128/AAC.02247-12. PMC 3716117. PMID 23439634.
- ^ a b Drawz SM, Bonomo RA (January 2010). "Three decades of beta-lactamase inhibitors". Clinical Microbiology Reviews. 23 (1): 160–201. doi:10.1128/CMR.00037-09. PMC 2806661. PMID 20065329.
- ^ Biedenbach D, Bouchillon S, Hackel M, Hoban D, Kazmierczak K, Hawser S, Badal R (February 2015). "Dissemination of NDM metallo-β-lactamase genes among clinical isolates of Enterobacteriaceae collected during the SMART global surveillance study from 2008 to 2012". Antimicrobial Agents and Chemotherapy. 59 (2): 826–30. doi:10.1128/AAC.03938-14. PMC 4335866. PMID 25403666.
- ^ Watson ID, Stewart MJ, Platt DJ (September 1988). "Clinical pharmacokinetics of enzyme inhibitors in antimicrobial chemotherapy". Clinical Pharmacokinetics. 15 (3): 133–64. doi:10.2165/00003088-198815030-00001. PMID 3052984. S2CID 2388750.
- ^ Hazra S, Xu H, Blanchard JS (June 2014). "Tebipenem, a new carbapenem antibiotic, is a slow substrate that inhibits the β-lactamase from Mycobacterium tuberculosis". Biochemistry. 53 (22): 3671–8. doi:10.1021/bi500339j. PMC 4053071. PMID 24846409.
- ^ "FDA approves new treatment for complicated urinary tract and complicated intra-abdominal infections". Food and Drug Administration. July 17, 2019.
- ^ "Cilastatin/imipenem/relebactam — AdisInsight". Springer International Publishing AG. Retrieved 29 April 2016.
- ^ "FDA approves new antibacterial drug" (Press release). Food and Drug Administration. August 29, 2017.
- ^ Livermore DM (October 1995). "beta-Lactamases in laboratory and clinical resistance". Clinical Microbiology Reviews. 8 (4): 557–84. doi:10.1128/cmr.8.4.557. PMC 172876. PMID 8665470.
- ^ Leonard DA, Bonomo RA, Powers RA (November 2013). "Class D β-lactamases: a reappraisal after five decades". Accounts of Chemical Research. 46 (11): 2407–15. doi:10.1021/ar300327a. PMC 4018812. PMID 23902256.
외부 링크
- Xu H, Hazra S, Blanchard JS (June 2012). "NXL104 irreversibly inhibits the β-lactamase from Mycobacterium tuberculosis". Biochemistry. 51 (22): 4551–7. doi:10.1021/bi300508r. PMC 3448018. PMID 22587688.
- Kurz SG, Wolff KA, Hazra S, Bethel CR, Hujer AM, Smith KM, Xu Y, Tremblay LW, Blanchard JS, Nguyen L, Bonomo RA (December 2013). "Can inhibitor-resistant substitutions in the Mycobacterium tuberculosis β-Lactamase BlaC lead to clavulanate resistance?: a biochemical rationale for the use of β-lactam-β-lactamase inhibitor combinations". Antimicrobial Agents and Chemotherapy. 57 (12): 6085–96. doi:10.1128/AAC.01253-13. PMC 3837893. PMID 24060876.