티카실린
Ticarcillin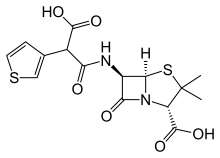 | |
| 임상자료 | |
|---|---|
| AHFS/Drugs.com | 모노그래프 |
| 메드라인플러스 | a685037 |
| 임신 , 카테고리 |
|
| 경로: 행정 | 정맥주사 |
| ATC 코드 | |
| 법적현황 | |
| 법적현황 |
|
| 약동학 데이터 | |
| 단백질 결합 | 45% |
| 제거 반감기 | 1.1시간 |
| 배설 | 레날 |
| 식별자 | |
| |
| CAS 번호 | |
| 펍켐 CID | |
| 드러그뱅크 | |
| 켐스파이더 | |
| 유니 | |
| 케그 | |
| 체비 | |
| 켐벨 | |
| CompTox 대시보드 (EPA) | |
| ECHA InfoCard | 100.047.451 |
| 화학 및 물리적 데이터 | |
| 공식 | C15H16N2O6S2 |
| 어금질량 | 384.42 g·190−1 |
| 3D 모델(JSmol) | |
| |
| |
| (iii) | |
티카실린은 카복시페니실린이다.티카실린/클라불란산으로서 클라불란산(Clavulanate)과 결합하여 판매하여 사용할 수 있다.페니실린이기 때문에 베타락탐 항생제의 더 큰 종류에 속하기도 한다.그것의 주요 임상 용도는 그람 음성 박테리아, 특히 녹농균과 프로테우스 저칼로니스의 치료를 위한 주사 가능한 항생제로 사용된다.스테노트로포모나스 말토필리아 감염을 치료할 수 있는 몇 안 되는 항생제 중 하나이기도 하다.null
그것은 흰색 또는 옅은 노란색 가루로 제공된다.물에 잘 녹지만 사용 직전에만 용해시켜 열화를 방지해야 한다.null
1963년에 특허를 얻었다.[1]null
작용기전
티카실린의 항생제 성질은 세포벽 합성 중 펩티도글리칸의 교차연결을 방지하는 능력에서 생겨나는데, 이때 박테리아가 분열을 시도하여 세포사멸을 일으킨다.null
티카실린은 페니실린과 마찬가지로 베타 락타마제에 의해 분해될 수 있는 β-락탐 링을 함유하고 있어 항생제의 활성화가 일어난다.따라서 β-락타마아제를 표현할 수 있는 박테리아는 β-락타암 항생제에 내성이 있다.적어도 부분적으로는 일반적인 β-락탐 링에 대해 티카실린은 페니실린에 알레르기가 있는 환자들에게 반응을 일으킬 수 있다.또한 티카실린은 클라불란산(co-ticarclav)과 같은 β-락타마아제 억제제와 짝을 이루는 경우가 많다.null
기타 용도
분자생물학에서 티카실린은 마커 유전자를 박테리아로 흡수하는 것을 테스트하기 위해 앰피실린의 대안으로 사용된다.매질에서 앰피실린이 고장날 때 발생하는 위성 식민지의 출현을 막는다.식물 분자생물학에서도 아그로박테리움을 죽이기 위해 사용되는데, 아그로박테리움을 식물의 세포에 유전자를 전달하는 데 쓰인다.null
투약 및 투여
티카실린은 구강으로 흡수되지 않으므로 정맥주사 또는 근육주사로 투여해야 한다.null
상호 및 준비
- 티카실린:Ticar는 이전에 Becham에 의해 판매되었고, 1999년까지 SmithKline Becham이 Glaxo와 합병하여 GlaxoSmithKline을 형성했으며, 영국에서는 더 이상 사용할 수 없다.미국의 배급은 2004년에 중단되었다.티카르는 티멘틴으로 대체되었다.
그러나 티멘틴은 티카르와 달리 클라불란산염을 함유하고 있다.
- 티카실린/클라불란산염:호주, 영국, 미국에서 티멘틴은 비첨, 그 당시 글락소스미스클라인에 의해 판매되었다.
합성
카베니실린은 주로 독성이 낮고, 취약한 녹농균 종에 의한 요로감염 치료에 효용성이 있기 때문에 클리닉에서 사용된다.효능이 낮고 구강 활성도가 낮으며 박테리아 베타 락타마제에 대한 민감성은 이러한 결손 없이 에이전트 교체에 취약하다.이 경주의 한 경쟁자는 티카리실린이다.그것의 기원은 부황은 대략 비닐 그룹(cf 메티오프로파민, 수펜타닐, 피자 라인 등)과 같다는 잘 알려진 사실에 따라 달라졌다.null
하나의 합성은 3-Thienylmalonic acid의 모노벤질 에스테르를 만들어 이것을 SOCl2로 염화산으로 전환하고 6-Aminopinicillan acid (6-APA)로 응축하는 것으로 시작되었다.수소폴리시스(Pd/C)는 티카실린의 합성을 완료했다.null
참조
- ^ Fischer J, Ganellin CR (2006). Analogue-based Drug Discovery. John Wiley & Sons. p. 491. ISBN 9783527607495.