크로마핀 세포
Chromaffin cell| 대수크로마핀세포 | |
|---|---|
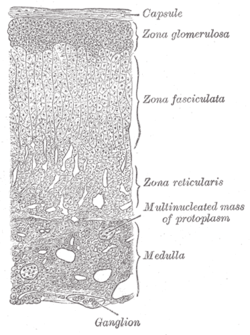 부신. (오른쪽 아래에 표시된 미둘라) | |
| 세부 사항 | |
| 위치 | 메둘라 부신 |
| 식별자 | |
| 라틴어 | 내분비강 |
| 메슈 | D019439 |
| TH | H3.08.02.6.00015 |
| FMA | 69263 |
| 미세조영술의 해부학적 용어 | |
크로마핀 세포, 또한 페로크롬세포는 포유류에서 부신의 메둘라에서 주로 발견되는 신경내분비 세포다. 이러한 세포들은 스트레스에 대한 반응, 체내의 이산화탄소와 산소 농도를 감시하는 것, 호흡의 유지와 혈압의 조절과 같은 다양한 기능을 한다.[1] 그들은 교감 신경계의 사전합성 교감 신경조직에 가까이 있으며, 구조적으로 그들은 사후합성 교감 신경세포와 유사하다. 크로마핀 세포를 활성화하기 위해 교감신경계의 스플란크닉신경이 아세틸콜린을 방출하고, 그 다음 부신 메둘라의 니코틴성 아세틸콜린 수용체에 결합한다. 이것은 카테콜아민 방출의 원인이 된다. 크로마핀 세포는 아드레날린(에피네프린)의 최대 80%와 노르아드레날린(노레피네프린)의 최대 20%를 다발성 장기에 대한 전신적 효과(하피네무스의 분비 뉴런과 유사)를 위해 전신 순환으로 방출하며 파라시린 신호를 보낼 수도 있다. 그래서 그것들은 신경내분비 세포라고 불린다.
구조
신경의 파고에서 기인하고 교감신경계(교감신경계라고 하는 세포에서 기인한다)와 관계되는 두 가지 종류의 세포가 있다.[2]
1) 신경절제술: 이 세포들은 인간에서 태아가 발달한 4~5주 동안 척추의 양쪽에서 등대동맥 바로 뒤에 있는 지역을 향해 교감성 갱년기(공감 체인)의 두 사슬을 형성한다. 이러한 갱년기로부터 시냅스 후 교감 섬유가 생겨 그들의 목표 기관 쪽으로 뻗어나갈 것이다. 이 세포들 중 일부는 부신 메둘라로 이동하여 부신 메둘라 내에서 (시냅스 후 교감 섬유가 없는) 교감성 갱도세포를 형성할 것이다. 이러한 세포에서 발생하는 종양을 신경블라스토마라고 부른다.[3]
2) 크로마핀 세포(또는 페로크롬세포): 이 세포들은 교감성 갱년기(파라강기라 이름 지어짐)에 인접한 영역과 부신 메둘라로 이동하며, 그곳에서 가장 풍부한 유형의 세포가 될 것이다. 포유류에서 가장 큰 크로마핀 세포의 아드레날린 성단은 주커칸델의 기관이다.[4] 이러한 세포에서 발생하는 종양을 파라강리오마 또는 페로크롬세포라고 부른다. 이러한 용어는 서로 교환하여 사용할 수 있지만 대개 파라강글리오마는 부신 바깥의 크로마핀 세포에서 비롯된 종양을 가리키는데, 이를 부신 밖에서는 외아드레날린 페로크로모시토마라고도 할 수 있는 반면, 페로크로모시토마는 일반적으로 부신 내 크로마핀 세포에서 비롯된 종양을 가리킨다.[2]
크로마핀 세포도 질신경과 경동맥 근처에 자리를 잡는다. 저농도에서는 아드레날린 크로마핀 세포도 방광벽, 전립선, 간 뒤에 상주한다.
비암말에서, 크로마핀 세포는 일반적으로 개별 기관으로 조직되지 않은 다양한 장소에서 발견되며, 분비를 위해 내분비나 파라신 신호에만 의존하면서 내경사가 없을 수도 있다.[5][6]
함수


부신 메둘라의 크로마핀 세포는 스판신경에 의해 내분되어 아드레날린(에피네프린), 노르아드레날린(노레피네프린), 약간의 도파민, 엔케팔린, 엔케팔린 함유 펩타이드, 그리고 다른 호르몬 몇 가지를 혈류로 분비한다. 분비된 아드레날린과 노르아드레날린은 흔히 싸움-비행 반응이라고 불리는 교감신경계 반응에 중요한 역할을 한다. 엥케팔린과 엥케팔린 함유 펩타이드는 엔돌핀이라는 내생성 펩타이드와는 관련이 있지만 (뇌하수체에서 분비되는) 구별된다. 이 모든 펩타이드들은 오피오이드 수용체에 결합되어 진통 반응을 일으킨다. 호르몬은 크로마핀 과립으로부터 분비된다; 여기서 효소 도파민 β-히드록실라제는 도파민의 노르아드레날린으로의 전환을 촉진한다.[7] N과 E 세포 형태는 구별된다(영국의 명명법에서 Na와 A 세포도 존재한다 - 노르아드레날린과 아드레날린도 있다). 전자는 노레피네프린을 생산하고, 후자는 글루코코르티코이드와 상호작용을 통해 N 세포에서 발생하며, 노레피네프린을 에피네프린으로 변환한다.[8]
임상적 유의성
이러한 세포에서 발생하는 신엽은 페로크로모사이토마스(글로무스 세포의 비크로마핀 또는 부교감 파라강리오마스와 대조적으로 크로마핀 또는 교감 파라강리오마라고도 한다.)이다. 때로는 부신에서 유래한 신엽만 페로크로모시토마스(pherochromocytomas)라고 명명되는 반면, 다른 것들은 엑스트라 아드레날린 파라강리오마(exter-adrender paragangliomas)
심부전
심부전 이후, 신체는 심박수와 심박출량을 증가시키기 위한 보상 메커니즘으로서 부신 메둘라에 대한 교감 활동을 증가시킨다. 이러한 교감 활성 증가는 부신 크로마핀 세포로부터 만성적으로 카테콜아민 합성과 분비를 증가시킨다. 이러한 에피네프린과 노르에피네프린 분비의 만성적인 증가는 카테콜아민에 대한 크로마핀 세포의 감소를 유발하여 세포막에 α2 아드레날린 수용체 생산 및 존재 감소를 초래한다. 이러한 α2 아드레날린 수용체의 감응화 및 하향 조절은 효소 아드레날린 G 단백질 결합 수용체 키나아제2(GRK2)의 상향 조절에 의해 발생하며, 이는 일반적으로 세포가 카테콜아민(catecholamines)을 과도하게 생산하지 못하도록 하는 정상적인 자분비형 음성 피드백을 효과적으로 제거하고 이를 양성 피드백 lo로 대체한다.분비가 증가하면 분비가 더 많이 발생하는 op.[9] GRK2의 이러한 상향조절은 또한 상향조절과 카테콜아민 합성의 속도제한 단계를 촉진하는 효소 tyrosine hydroxylase의 생산량 증가를 동반한다.[10]
역사
'크로마핀'이라는 단어는 크롬과 친화력의 포트만테우에서 유래되었다. 크롬염으로 얼룩을 지우면 시각화할 수 있기 때문에 이런 이름이 붙는다. 크롬염은 카테콜아민(catecholamines)을 산화시키고 중합하여 갈색색을 형성하는데, 노르아드레날린을 분비하는 세포에서 가장 강하게 나타난다. 크로마핀 세포는 페로크롬세포라고도 불린다.
엔트로크로마핀 세포는 크로마핀 세포와 역사학적으로 유사하기 때문에 그렇게 이름이 붙여지지만(크롬염으로 치료할 때도 노란색으로 얼룩진다) 그 기능은 상당히 다르며 신경 파고에서 파생된 것은 아니다.
파라간글리아는 교감성 갱년기 근처에 있는 크로마핀 세포나 글로무스 세포로 이루어진 군집이다.
참고 항목
참조
- ^ Schober, Andreas; Parlato, Rosanna; Huber, Katrin; Kinscherf, Ralf; Hartleben, Björn; Huber, Tobias B; Schütz, Günther; Unsicker, Klaus (2013). "Cell Loss and Autophagy in the Extra-Adrenal Chromaffin Organ of Zuckerkandl are Regulated by Glucocorticoid Signalling". Journal of Neuroendocrinology. 25 (1): 34–47. doi:10.1111/j.1365-2826.2012.02367.x. ISSN 0953-8194. PMC 3564403. PMID 23078542.
- ^ a b "Chapter 179. The Paraganglionic System: The Paraganglia - Review of Medical Embryology Book - LifeMap Discovery". discovery.lifemapsc.com. Archived from the original on 2016-12-20. Retrieved 2017-06-03.
- ^ "Chapter 164. The Autonomic Nervous System: The Sympathetic System - Review of Medical Embryology Book - LifeMap Discovery". discovery.lifemapsc.com. Archived from the original on 2017-05-05. Retrieved 2017-06-03.
- ^ Schober, Andreas; Parlato, Rosanna; Huber, Katrin; Kinscherf, Ralf; Hartleben, Björn; Huber, Tobias B.; Schütz, Günther; Unsicker, Klaus (1 January 2013). "Cell Loss and Autophagy in the Extra-Adrenal Chromaffin Organ of Zuckerkandl are Regulated by Glucocorticoid Signalling". Journal of Neuroendocrinology. 25 (1): 34–47. doi:10.1111/j.1365-2826.2012.02367.x. PMC 3564403. PMID 23078542.
- ^ Perry, SF; Capaldo, A (Nov 16, 2011). "The autonomic nervous system and chromaffin tissue: neuroendocrine regulation of catecholamine secretion in non-mammalian vertebrates". Autonomic Neuroscience: Basic and Clinical. 165 (1): 54–66. doi:10.1016/j.autneu.2010.04.006. PMID 20547474. S2CID 42402600.
- ^ Pohorecky, LA; Wurtman, RJ (Mar 1971). "Adrenocortical control of epinephrine synthesis" (PDF). Pharmacological Reviews. 23 (1): 1–35. PMID 4941407. Archived from the original (PDF) on 2016-03-05. Retrieved 2013-03-01.
- ^ Szewczyk, A; Lobanov, NA; Kicińska, A; Wójcik, G; Nałecz, MJ (2001). "ATP-sensitive K+ transport in adrenal chromaffin granules" (PDF). Acta Neurobiologiae Experimentalis. 61 (1): 1–12. PMID 11315316. Archived from the original (PDF) on 2017-08-09. Retrieved 2013-02-25.
- ^ Young; Lowe; Stevens; Heath, eds. (2006). Wheater's Functional Histology (5th ed.). Edinburgh: Churchill Livingstone. ISBN 978-0-443-06850-8.
- ^ Jafferjee, Malika; Reyes Valero, Thairy; Marrero, Christine; McCrink, Katie A.; Brill, Ava; Lymperopoulos, Anastasios (2016-03-01). "GRK2 Up-Regulation Creates a Positive Feedback Loop for Catecholamine Production in Chromaffin Cells". Molecular Endocrinology. 30 (3): 372–381. doi:10.1210/me.2015-1305. ISSN 0888-8809. PMC 5414648. PMID 26849467.
- ^ Lymperopoulos, Anastasios; Rengo, Giuseppe; Gao, Erhe; Ebert, Steven N.; Dorn, Gerald W.; Koch, Walter J. (2010-05-21). "Reduction of Sympathetic Activity via Adrenal-targeted GRK2 Gene Deletion Attenuates Heart Failure Progression and Improves Cardiac Function after Myocardial Infarction". Journal of Biological Chemistry. 285 (21): 16378–16386. doi:10.1074/jbc.M109.077859. ISSN 0021-9258. PMC 2871505. PMID 20351116.
외부 링크
- 역사학 이미지: 14507loa – 보스턴 대학교의 역사학 학습 시스템 - "내분비 시스템: 부신, 망막 및 망막"
- 부신 크로마핀 세포의 분비 제어
- UC-샌디에이고 크로마핀 세포 및 고혈압 연구
- Chromaffin 세포에 관한 연구
- Rat Chromaffin 세포 1차 배양액: 단일 셀 검사에 대한 표준화 및 품질 평가(프로토콜)



