Fc수용체
Fc receptor| 면역글로불린수용체 | |
|---|---|
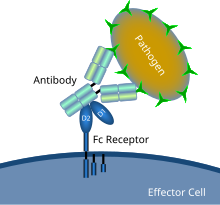 항체로 코팅된 미생물 병원체와 Fc 수용체 상호작용을 보여주는 개략도 | |
| 식별자 | |
| 기호. | Fc수용체 |
| 막질 | 10 |
Fc 수용체는 B 림프구, 엽상 수상 세포, 천연 킬러 세포, 대식세포, 호중구, 호산구, 호산구, 호염기구, 인간 혈소판 및 비만 세포를 포함한 특정 세포의 표면에서 발견되는 단백질로 면역 시스템의 보호 기능에 기여합니다.그 이름은 Fc(fragment crystalizable) 영역으로 알려진 항체의 일부에 대한 결합 특이성에서 유래했다.Fc 수용체는 감염된 세포에 부착되거나 병원균에 침입하는 항체에 결합한다.이들의 활동은 식세포 또는 세포독성 세포를 자극하여 미생물 또는 항체 매개 식세포 또는 항체 매개 세포독성에 의해 감염된 세포를 파괴합니다.플라비바이러스와 같은 일부 바이러스는 항체 의존적인 [1]감염증강으로 알려진 메커니즘에 의해 세포를 감염시키는 것을 돕기 위해 Fc 수용체를 사용한다.
반
Fc 수용체에는 몇 가지 다른 타입(약칭 FcR)이 있으며, 이들이 인식하는 항체의 종류에 따라 분류된다.항체의 종류를 식별하는 데 사용되는 라틴 문자는 해당 그리스 문자로 변환되며 이름의 'Fc' 부분 뒤에 배치됩니다.예를 들어, 항체의 가장 일반적인 종류인 IgG와 결합하는 것을 Fc-gamma 수용체(FcrR), IgA와 결합하는 것을 Fc-alpha 수용체(FcαR), IgE와 결합하는 것을 Fc-epsilon 수용체(FcrR)라고 한다.FcR의 등급은 또한 그것들을 발현하는 세포(대식세포, 과립구, 자연살해세포, T 및 B세포)와 각 [2]수용체의 신호전달 특성에 의해 구별된다.
Fc감마수용체
모든 Fc receptors 수용체(FcrR)는 면역글로불린 슈퍼패밀리에 속하며 옵손화([3]표시된) 미생물의 식세포증을 유도하는 가장 중요한 Fc 수용체이다.Fc includesRI(CD64), FcriRIIA(CD32), FcriRIIB(CD32), FcriRIIIA(CD16a), FcriRIIIB(CD16b) 등 분자구조가 [4]다르기 때문에 항체 친화력이 다르다.예를 들어 Fc'RI는 Fc'RII 또는 Fc'RIII보다 IgG에 더 강하게 결합됩니다.FcγRI는 또한 FcriRII 또는 FcriRIII보다 1개 많은 3개의 면역글로불린(Ig) 유사 도메인으로 구성된 세포외 부분을 가지고 있다.이 성질은 FcriRI가 유일한 IgG 분자(또는 단량체)와 결합할 수 있게 하지만,[5] 모든 Fc must 수용체는 활성화되기 위해 면역 복합체 내에서 여러 IgG 분자와 결합해야 한다.
Fc-gamma 수용체는 IgG에 대한 친화력이 다르며, 마찬가지로 서로 다른 IgG 아분류는 각 Fc 감마 [6]수용체에 대해 고유한 친화력을 가진다.이러한 상호작용은 IgG의 [6]CH2-84.4 위치에 있는 글리칸(올리고당)에 의해 더욱 조정된다.예를 들어 CH2-84.4 글리칸을 함유하는 푸코스는 입체장애를 발생시킴으로써 FciaRIIIA에 대한 IgG 친화력을 감소시킨다.[6]반면 갈락토스가 없고 대신 GlcNAc 부분으로 끝나는 G0 글리칸은 FcγRIIIA에 [6]대한 친화력을 증가시켰다.
또 다른 FcR은 여러 세포 유형에서 발현되며 구조가 MHC 클래스 I과 유사합니다.이 수용체는 또한 IgG와 결합하고 이 [7]항체의 보존에 관여한다.그러나 이 Fc 수용체는 태반을 통해 태아에게 또는 젖을 빨고 있는 아기에게 IgG를 산모로부터 전달하는데도 관여하기 때문에 신생아 Fc 수용체(FcRn)[8][9]라고 불린다.최근 연구는 이 수용체가 IgG 혈청 수준의 항상성에 역할을 한다는 것을 시사했다.
Fc-alpha 수용체
FcαR 하위 그룹에는 FcαRI(또는 CD89)[10]라고 하는 하나의 Fc 수용체만 속합니다.FcαRI는 호중구, 호산구, 단구, 일부 대식세포([10]쿠퍼세포 포함) 및 일부 수지상세포의 표면에서 발견된다.2개의 세포외 Ig-like 도메인으로 구성되며 면역글로불린 슈퍼패밀리와 다중사슬면역인식수용체([3]MIRR) 패밀리 모두의 구성원이다.2개의 FcR 시그널링 [10]체인에 관련지어 신호를 보냅니다.IgM이라고 [11]불리는 다른 항체에 대한 친화력이 더 높지만, 다른 수용체 또한 IgA와 결합할 수 있다.이 수용체는 Fc-alpha/mu 수용체(Fcα/μR)라고 불리며 I형 막 통과 단백질이다.세포외 부분에 하나의 Ig-like 도메인이 있는 이 Fc 수용체는 면역글로불린 슈퍼패밀리의 [12]구성원이다.
Fc-엡실론 수용체
Fc'R에는 다음 두 가지 유형이 [3]있습니다.
- 고친화성 수용체 FcεRI는 면역글로불린 슈퍼패밀리의 구성원이다(Ig-like 도메인이 2개 있다).FcriRI는 표피 랑게르한스 세포, 호산구,[13][14] 비만 세포 및 호염기구에서 발견된다.세포 분포의 결과로, 이 수용체는 알레르기 반응을 조절하는 데 중요한 역할을 한다.FcriRI는 항원 제시 세포에서도 발현되며 [15]염증을 촉진하는 사이토카인이라고 불리는 중요한 면역 매개체의 생성을 조절합니다.
- 저친화성 수용체 FcεRII(CD23)는 C형 렉틴이다.FcriRII는 막결합 수용체 또는 수용성 수용체로서 다기능을 가지고 있으며, B세포의 성장과 분화를 제어하고 호산구, 단구 및 호염기구들의 [16]IgE 결합을 차단한다.
요약표
| 수신자명 | 주항체배위자 | 배위자에 대한 친화력 | 셀 분포 | 항체 결합 후 효과 |
| FcriRI (CD64) | IgG1 및 IgG3 | 높음(Kd~10M−9) | 대식세포 호중구 호산구 수상 세포 | 식세포증 세포활성화 호흡 버스트의 활성화 미생물 살처분 유도 |
| FcriRIIA (CD32) | IgG | 낮음(Kd > 10−7 M) | 대식세포 호중구 호산구 혈소판 랑게르한스 세포 | 식세포증 탈과립(에오시노필) |
| Fc-RIIB1(CD32) | IgG | 낮음(Kd > 10−7 M) | B 셀 돛대 세포 | 식세포증 없음 세포 활성 억제 |
| Fc-RIB2(CD32) | IgG | 낮음(Kd > 10−7 M) | 대식세포 호중구 호산구 | 식세포증 세포 활성 억제 |
| FcriRIIIA (CD16a) | IgG | 낮음(Kd > 10−6 M) | NK세포 대식세포(특정 조직) | 항체 의존성 세포독성 유도(ADCC) 대식세포에 의한 사이토카인 방출 유도 |
| FcriRIIIB (CD16b) | IgG | 낮음(Kd > 10−6 M) | 호산구 대식세포 호중구 돛대 세포 모낭수상세포 | 미생물 살처분 유도 |
| FcriRI | IgE | 높음(Kd~10M−10) | 돛대 세포 호산구 호염기구 랑게르한스 세포 단구 | 탈과립 식세포증 |
| FcriRII (CD23) | IgE | 낮음(Kd > 10−7 M) | B세포 호산구 랑게르한스 세포 | 가능한 접착 분자 IgE는 사람의 장상피를 가로질러 운반된다. 알레르기 민감성(B세포)을 높이기 위한 포지티브 피드백 메커니즘 |
| FcαRI (CD89) | IgA | 낮음(Kd > 10−6 M) | 단구 대식세포 호중구 호산구 | 식세포증 미생물 살처분 유도 |
| Fcα/μR | IgA 및 IgM | IgM의 경우 높음, IgA의 경우 중간 | B세포 중상 세포 대식세포 | 엔도사이토시스 미생물 살처분 유도 |
| FcRn | IgG | 단구 대식세포 수상 세포 상피세포 내피세포 간세포 | IgG를 태반을 통해 산모에서 태아로 전달 모유에서 IgG를 산모에서 유아에게 전달 성능 저하로부터 IgG 보호 |
기능들

fc 수용체는 대식세포 및 단구, 호중구 및 호산구 등의 과립구, 선천성 면역계(천연 킬러 세포) 또는 적응성 면역계(예: B 세포)[17][18][19]의 림프구를 포함한 면역계의 많은 세포에서 발견된다.그들은 이 세포들이 미생물이나 미생물에 감염된 세포들의 표면에 붙어있는 항체에 결합할 수 있도록 하여, 이러한 세포들이 미생물 병원체를 식별하고 제거하는 것을 돕는다.Fc 수용체는 Fc [20]수용체를 보유한 세포를 활성화하는 상호작용인 Fc 영역(또는 꼬리)에서 항체를 결합합니다.식세포의 활성화는 Fc 수용체에 기인하는 가장 일반적인 기능이다.예를 들어 대식세포는 Fcγ [21]수용체의 관여에 따라 식세포증에 의해 IgG 코팅 병원체를 섭취하고 죽이기 시작한다.Fc 수용체와 관련된 또 다른 과정은 항체 의존성 세포독성(ADCC)이라고 불린다.ADCC 동안 NK 세포 표면의 FcγRIII 수용체는 NK 세포를 자극하여 과립에서 세포독성 분자를 방출하여 항체로 덮인 표적 [22]세포를 죽인다.Fc'RI에는 다른 기능이 있습니다.FcriRI는 과립구의 Fc 수용체로, 알레르기 반응과 기생충 감염에 대한 방어에 관여한다.적절한 알레르기 항원 또는 기생충이 존재할 때, 과립구 표면에 있는 적어도 두 개의 IgE 분자와 그 Fc 수용체의 가교 결합은 세포가 과립에서 [3]미리 형성된 매개체를 빠르게 방출하도록 트리거할 것이다.
시그널링 메커니즘 - Fc 감마 수용체
액티베이션
Fc 감마 수용체는 티로신 [23]잔류물의 인산화와 관련된 유사한 신호 전달 경로를 공유하는 비촉매 티로신 인산화 수용체 그룹에 속한다.수용체는 면역수용체 티로신 기반 활성화 모티브(ITAM)[24]로 알려진 중요한 활성화 모티브를 통해 세포 내에서 신호를 생성한다. ITAM은 수용체의 세포 내 꼬리에서 두 번 연속적으로 일어나는 아미노산(YXL)의 특정 배열이다.인산기가 Src 키나제 패밀리의 막 앵커 효소에 의해 ITAM의 티로신(Y) 잔기에 첨가되면 세포 내에서 신호 캐스케이드가 생성된다.이러한 인산화 반응은 전형적으로 Fc 수용체와 그 배위자의 상호작용을 따른다.ITAM은 FcγRIIA의 세포내 꼬리에 존재하며, 그 인산화 작용은 대식세포에서 식세포증을 유발한다.FcriRI 및 FcriRIIIA는 ITAM을 가지고 있지 않지만 활성화 신호를 식세포에 전달하는 다른 단백질과 상호작용할 수 있다.이 어댑터 단백질은 Fc sub 서브유닛이라고 불리며 FcriRIIA와 마찬가지로 ITAM의 특징인 2개의 YXXL 배열을 포함하고 있습니다.
억제
YXXL 모티브가 하나만 존재하는 것은 세포를 활성화하기에 충분하지 않으며 면역수용체 티로신 기반 억제 모티브(ITIM)로 알려진 모티브(I/VXXYXL)를 나타낸다. FcibRIB1 및 FcriRIIB2는 ITIM 시퀀스를 가지며 FccyRIB2는 억제 수용체를 유도하지 않는다.이러한 수용체의 억제 작용은 티로신 잔류물에서 인산기를 제거하는 효소에 의해 제어되며, 포스파타아제 SHP-1 및 SHIP-1은 Fc receptors [25]수용체에 의한 시그널링을 억제한다.FcriRIB에 대한 리간드의 결합은 ITAM 모티브의 티로신의 인산화로 이어진다.이 변형은 SH2 인식 도메인인 포스파타아제에 대한 결합 부위를 생성한다.ITAM 활성화 시그널링의 폐기는 Src 계열의 단백질 티로신 키나아제 억제 및 활성화 수용체(FcγR, TCR, BCR 및 사이토카인 수용체(예: c-Kit)[26]의 활성화와 같은 활성화 수용체에 의한 추가적인 다운스트림 시그널링을 방해하는 막 PIP3의 가수분해로 인해 발생한다.
Fc-RIIB에 의한 음성 시그널링은 활성화된 B세포의 조절에 주로 중요하다.양성 B 세포 시그널링은 외부 항원이 표면 면역 글로불린에 결합함으로써 시작됩니다.동일한 항원 특이 항체가 분비되어 피드백 억제 또는 음성 신호를 촉진할 수 있다.이 네거티브시그널링은 Fc-RIB에 의해 제공됩니다.[27]B 세포 결실 돌연변이와 지배 음성 효소를 이용한 실험은 음성 신호 전달에서 SH2 도메인 함유 이노시톨 5-포스파타아제(SHIP)에 대한 중요한 역할을 확고히 했다.SHIP를 통한 음성 시그널링은 Grb2 및 Shc와의 SH2 도메인 경쟁을 통해 Ras 경로를 억제하는 것으로 보이며, 알로스테릭 효소 활성제로 작용하거나 세포외 Ca2+[28]의 진입을 촉진하는 세포내 지질 매개체의 섭취를 포함할 수 있다.
세포활성화
식세포에
특정 항원 또는 표면 성분에 특정한 IgG 분자가 해당 Fab 영역(파편 항원 결합 영역)과 함께 병원체에 결합할 때, Fc 영역은 식세포의 직접 도달 범위를 바깥쪽으로 가리킵니다.식세포는 Fc영역과 Fc수용체를 [21]결합시킨다.수용체와 항체 사이에 많은 저친화성 상호작용이 형성되어 항체로 코팅된 미생물과 긴밀하게 결합한다.낮은 개인 친화력은 항원이 없을 때 Fc 수용체가 항체와 결합하는 것을 방지하고, 따라서 감염이 없을 때 면역 세포 활성화의 가능성을 감소시킨다.또한 항원이 없을 때 항체에 의한 식세포의 응집(응고)을 방지한다.병원체가 결합된 후 항체의 Fc 영역과 식세포의 Fc 수용체 사이의 상호작용에 의해 식세포증이 시작된다.병원체는 식세포의 세포막이 [29]병원체를 완전히 포위할 때까지 Fc 영역/Fc 수용체 복합체의 결합 및 방출을 수반하는 활성 과정에 의해 식세포에 의해 삼켜진다.
온NK 셀
NK세포의 Fc수용체는 병원균에 감염된 표적세포의 표면에 결합되어 있는 IgG를 인식하며 CD16 또는 FciiRII로 [30]불린다.IgG에 의한 FcriRIII의 활성화는 다른 면역세포에 신호를 보내는 IFN-γ 등의 사이토카인과 표적세포에 들어가 아포토시스를 유발함으로써 세포사멸을 촉진하는 천공 및 과립자임 등의 세포독성 매개체의 방출을 일으킨다.이 과정은 항체 의존 세포 매개 세포독성(ADCC)으로 알려져 있다.NK세포의 FcγRIII는 단량체 IgG(항원결합이 아닌 IgG)와도 연관될 수 있다.이 경우 Fc 수용체는 NK [31]세포의 활동을 억제합니다.
비만 세포상
IgE 항체는 알레르겐의 항원과 결합한다.이러한 알레르겐 결합 IgE 분자는 비만 세포 표면의 Fcγ 수용체와 상호작용한다.FcδRI의 결합에 따른 비만 세포의 활성화는 탈과립이라고 불리는 과정을 야기하며, 비만 세포는 세포질 과립에서 미리 형성된 분자를 방출한다. 이것들은 히스타민, 프로테오글리칸, 세린 단백질 분해효소 [32]등을 포함한 화합물의 혼합물이다.활성화된 비만세포는 또한 지질유래 매개체(프로스타글란딘, 류코트리엔, 혈소판활성인자 등)와 사이토카인(인터류킨1, 인터류킨3, 인터류킨4, 인터류킨5, 인터류킨6, 인터류킨13, 종양괴사인자알파, GM-CS)을 합성하여 분비한다.이 매개체들은 다른 백혈구를 유인함으로써 염증을 유발한다.
호산구상
식세포에 의한 섭취에는 구충(지렁이)성 주혈흡충과 같은 큰 기생충이 너무 크다.그들은 또한 대식세포와 돛대 세포에 의해 방출되는 물질들의 공격에 저항하는 내장이라고 불리는 외부 구조를 가지고 있다.그러나 이러한 기생충은 IgE로 코팅되어 호산구 표면에서 FcriRII에 의해 인식될 수 있다.활성화된 호산구는 주요 염기성 단백질과 같은 미리 형성된 매개체와 헬민스가 [35][36]저항하지 않는 페르옥시다아제 같은 효소를 방출한다.FcriRII 수용체와 Helminth 결합 IgE의 Fc 부분의 상호작용은 호산구가 [37]ADCC 동안 NK 세포와 유사한 메커니즘으로 이러한 분자를 방출하게 한다.
T림프구상
CD4+ T세포(성숙한h T세포)는 항체를 생산하는 B세포에 도움을 준다.활성화된 이펙터 CD4+ T 세포의 여러 서브셋이 질병 병리학에서 관찰된다.1993년 Sanders와 Lynch에 의해 요약된 이전 연구는 CD4+ T 세포 매개 면역 반응에서 FcRs에 대한 중요한 역할을 제안했고 세포 [38][39][40][41]표면에서 FcRs와 TCR 사이에 관절 신호 복합체의 형성을 제안했다.Chauhan과 동료들은 활성화된 CD4+ T 세포 표면에서 CD3 복합체와 함께 라벨이 부착된 IC의 혈소화 현상을 보고했으며, 따라서 TCR 복합체와 [42]FcR의 공존을 시사했다.이 두 수용체 모두 활성화된 CD4+ T세포의 막에서 꼭대기 구조를 형성하는 것이 관찰되어 이러한 수용체의 [43]횡방향 움직임을 시사한다.세포 표면에서 TCR 및 BCR 복합체와 FcR의 공존이 관찰되며,[44] T:B 세포 세포결합체는 접촉점에서 이러한 공존을 보여준다.이전 리뷰에서는 CD4+ T 셀에서 FcRs의 표현은 미해결 [45]질문으로 제시되었다.이것은 T세포가 FcRs를 발현하지 않는다는 현재의 패러다임을 확립했고, 이러한 발견들은 결코 실험적으로 [46]시험되지 않았다.초한과 동료들은 활성화된 CD4+T 세포에 [46]대한 FcR 배위자인 면역 복합체(ICs)의 결합을 보였다.CD16a 발현은 CD25, CD69 및 CD98을 발현하는 활성화된 인간 순진한 CD4+T 세포에서 유도되며 IC에 대한 결합은 이펙터 기억세포의 [47]생성으로 이어진다.CD16a 시그널링은 Syk(pSyk)[47][48][49]의 인산화에 의해 매개된다.
현재 연구는 CD16a와 유사한 인간 CD4+[48][50]T세포 활성화 시 CD32a의 유도발현을 시사한다. CD4+T세포에 대한 CD32a 발현도 HIV-1 연구진의 세 가지 독립적인 연구에서 제안되었다.활성화된 CD4+T 세포의 서브셋에서 CD16a 및 CD32a의 발현이 [48][50]확인되었습니다.핵산으로 구성된 IC에 결합할 때 세포 표면의 fcRs는 사이토카인 생성을 유발하고 핵산 감지 경로를 상향 조절합니다.FcRs는 세포 표면과 세포에 모두 존재한다.CD16a 시그널링은 핵산 감지 톨 유사 수용체의 발현을 상향 조절하여 세포 [47][51]표면에 재배치한다.CD16a는 인간 CD4+ T세포에 대한 새로운 늑장 자극 신호로,[52] 자가면역 시 CD28 요구 사항을 성공적으로 대체합니다.자가면역 백그라운드 CD4+ T셀은 CD28 코시그널링을 우회하여 완전히 [52]활성화됩니다.또한 CD28 코시그널링의 블록은 자가반응성 플라즈마 [53]B세포를 생성하는 자기항체 생성의 핵심 서브셋인 TFH세포의 발달을 억제하지 않는다.면역 항상성을 위해서는 늑장 자극 신호와 억제 신호 간의 균형이 필요하다.과도한 늑골 자극 및/또는 불충분한 공동 억제는 공차 분해 및 자가 면역성으로 이어집니다.CD16a 매개 코스트에뮬레이션은 활성화된 CD4+T 셀에서 양의 신호를 제공하며 FcrR [48]발현이 없는 정지 셀에서는 양의 신호를 제공하지 않는다.
「 」를 참조해 주세요.
레퍼런스
- ^ Anderson R (2003). "Manipulation of cell surface macromolecules by flaviviruses". Advances in Virus Research. 59: 229–74. doi:10.1016/S0065-3527(03)59007-8. ISBN 9780120398591. PMC 7252169. PMID 14696331.
- ^ Owen J, Punt J, Stranford S, Jones P (2009). Immunology (7th ed.). New York: W.H. Freeman and Company. p. 423. ISBN 978-14641-3784-6.
- ^ a b c d Fridman WH (September 1991). "Fc receptors and immunoglobulin binding factors". FASEB Journal. 5 (12): 2684–90. doi:10.1096/fasebj.5.12.1916092. PMID 1916092. S2CID 16805557.
- ^ Indik ZK, Park JG, Hunter S, Schreiber AD (December 1995). "The molecular dissection of Fc gamma receptor mediated phagocytosis". Blood. 86 (12): 4389–99. doi:10.1182/blood.V86.12.4389.bloodjournal86124389. PMID 8541526.
- ^ Harrison PT, Davis W, Norman JC, Hockaday AR, Allen JM (September 1994). "Binding of monomeric immunoglobulin G triggers Fc gamma RI-mediated endocytosis". The Journal of Biological Chemistry. 269 (39): 24396–402. doi:10.1016/S0021-9258(19)51097-3. PMID 7929100.
- ^ a b c d Maverakis E, Kim K, Shimoda M, Gershwin ME, Patel F, Wilken R, Raychaudhuri S, Ruhaak LR, Lebrilla CB (February 2015). "Glycans in the immune system and The Altered Glycan Theory of Autoimmunity: a critical review". Journal of Autoimmunity. 57 (6): 1–13. doi:10.1016/j.jaut.2014.12.002. PMC 4340844. PMID 25578468.
- ^ Zhu X, Meng G, Dickinson BL, Li X, Mizoguchi E, Miao L, Wang Y, Robert C, Wu B, Smith PD, Lencer WI, Blumberg RS (March 2001). "MHC class I-related neonatal Fc receptor for IgG is functionally expressed in monocytes, intestinal macrophages, and dendritic cells". Journal of Immunology. 166 (5): 3266–76. doi:10.4049/jimmunol.166.5.3266. PMC 2827247. PMID 11207281.
- ^ Firan M, Bawdon R, Radu C, Ober RJ, Eaken D, Antohe F, Ghetie V, Ward ES (August 2001). "The MHC class I-related receptor, FcRn, plays an essential role in the maternofetal transfer of gamma-globulin in humans". International Immunology. 13 (8): 993–1002. doi:10.1093/intimm/13.8.993. PMID 11470769.
- ^ Simister NE, Jacobowitz Israel E, Ahouse JC, Story CM (May 1997). "New functions of the MHC class I-related Fc receptor, FcRn". Biochemical Society Transactions. 25 (2): 481–6. doi:10.1042/bst0250481. PMID 9191140.
- ^ a b c Otten MA, van Egmond M (March 2004). "The Fc receptor for IgA (FcalphaRI, CD89)". Immunology Letters. 92 (1–2): 23–31. doi:10.1016/j.imlet.2003.11.018. PMID 15081523.
- ^ Shibuya A, Honda S (December 2006). "Molecular and functional characteristics of the Fcalpha/muR, a novel Fc receptor for IgM and IgA". Springer Seminars in Immunopathology. 28 (4): 377–82. doi:10.1007/s00281-006-0050-3. PMID 17061088. S2CID 23794895.
- ^ Cho Y, Usui K, Honda S, Tahara-Hanaoka S, Shibuya K, Shibuya A (June 2006). "Molecular characteristics of IgA and IgM Fc binding to the Fcalpha/muR". Biochemical and Biophysical Research Communications. 345 (1): 474–8. doi:10.1016/j.bbrc.2006.04.084. hdl:2241/102010. PMID 16681999.
- ^ Ochiai K, Wang B, Rieger A, Kilgus O, Maurer D, Födinger D, Kinet JP, Stingl G, Tomioka H (1994). "A review on Fc epsilon RI on human epidermal Langerhans cells". International Archives of Allergy and Immunology. 104 Suppl 1 (1): 63–4. doi:10.1159/000236756. PMID 8156009.
- ^ Prussin C, Metcalfe DD (February 2006). "5. IgE, mast cells, basophils, and eosinophils". The Journal of Allergy and Clinical Immunology. 117 (2 Suppl Mini–Primer): S450-6. doi:10.1016/j.jaci.2005.11.016. PMID 16455345.
- ^ von Bubnoff D, Novak N, Kraft S, Bieber T (March 2003). "The central role of FcepsilonRI in allergy". Clinical and Experimental Dermatology. 28 (2): 184–7. doi:10.1046/j.1365-2230.2003.01209.x. PMID 12653710. S2CID 2080598.
- ^ Kikutani H, Yokota A, Uchibayashi N, Yukawa K, Tanaka T, Sugiyama K, Barsumian EL, Suemura M, Kishimoto T (1989). "Structure and function of Fc epsilon receptor II (Fc epsilon RII/CD23): a point of contact between the effector phase of allergy and B cell differentiation". Ciba Foundation Symposium. Novartis Foundation Symposia. 147: 23–31, discussion 31–5. doi:10.1002/9780470513866.ch3. ISBN 9780470513866. PMID 2695308.
- ^ Selvaraj P, Fifadara N, Nagarajan S, Cimino A, Wang G (2004). "Functional regulation of human neutrophil Fc gamma receptors". Immunologic Research. 29 (1–3): 219–30. doi:10.1385/IR:29:1-3:219. PMID 15181284. S2CID 85351071.
- ^ Sulica A, Chambers WH, Manciulea M, Metes D, Corey S, Rabinowich H, Whiteside TL, Herberman RB (1995). "Divergent signal transduction pathways and effects on natural killer cell functions induced by interaction of Fc receptors with physiologic ligands or antireceptor antibodies". Natural Immunity. 14 (3): 123–33. PMID 8832896.
- ^ Sarfati M, Fournier S, Wu CY, Delespesse G (1992). "Expression, regulation and function of human Fc epsilon RII (CD23) antigen". Immunologic Research. 11 (3–4): 260–72. doi:10.1007/BF02919132. PMID 1287120. S2CID 83698996.
- ^ Raghavan M, Bjorkman PJ (1996). "Fc receptors and their interactions with immunoglobulins" (PDF). Annual Review of Cell and Developmental Biology. 12: 181–220. doi:10.1146/annurev.cellbio.12.1.181. PMID 8970726.
- ^ a b Swanson JA, Hoppe AD (December 2004). "The coordination of signaling during Fc receptor-mediated phagocytosis". Journal of Leukocyte Biology. 76 (6): 1093–103. doi:10.1189/jlb.0804439. hdl:2027.42/141562. PMID 15466916. S2CID 13912335.
- ^ Sun PD (2003). "Structure and function of natural-killer-cell receptors". Immunologic Research. 27 (2–3): 539–48. doi:10.1385/IR:27:2-3:539. PMID 12857997. S2CID 29921323.
- ^ Dushek O, Goyette J, van der Merwe PA (November 2012). "Non-catalytic tyrosine- phosphorylated receptors". Immunological Reviews. 250 (1): 258–276. doi:10.1111/imr.12008. PMID 23046135. S2CID 1549902.
- ^ Cambier JC (February 1995). "New nomenclature for the Reth motif (or ARH1/TAM/ARAM/YXXL)". Immunology Today. 16 (2): 110. doi:10.1016/0167-5699(95)80105-7. PMID 7888063.
- ^ Huang ZY, Hunter S, Kim MK, Indik ZK, Schreiber AD (June 2003). "The effect of phosphatases SHP-1 and SHIP-1 on signaling by the ITIM- and ITAM-containing Fcgamma receptors FcgammaRIIB and FcgammaRIIA". Journal of Leukocyte Biology. 73 (6): 823–9. doi:10.1189/jlb.0902454. PMID 12773515. S2CID 14502303.
- ^ Cambier JC (June 1997). "Inhibitory receptors abound?". Proceedings of the National Academy of Sciences of the United States of America. 94 (12): 5993–5. Bibcode:1997PNAS...94.5993C. doi:10.1073/pnas.94.12.5993. PMC 33673. PMID 9177155.
- ^ Takai T, Ono M, Hikida M, Ohmori H, Ravetch JV (January 1996). "Augmented humoral and anaphylactic responses in Fc gamma RII-deficient mice". Nature. 379 (6563): 346–9. Bibcode:1996Natur.379..346T. doi:10.1038/379346a0. PMID 8552190. S2CID 4364705.
- ^ Coggeshall KM (June 1998). "Inhibitory signaling by B cell Fc gamma RIIb". Current Opinion in Immunology. 10 (3): 306–12. doi:10.1016/s0952-7915(98)80169-6. PMID 9638367.
- ^ Joshi T, Butchar JP, Tridandapani S (October 2006). "Fcgamma receptor signaling in phagocytes". International Journal of Hematology. 84 (3): 210–6. doi:10.1532/IJH97.06140. PMID 17050193. S2CID 6501210.
- ^ Trinchieri G, Valiante N (1993). "Receptors for the Fc fragment of IgG on natural killer cells". Natural Immunity. 12 (4–5): 218–34. PMID 8257828.
- ^ Sulica A, Galatiuc C, Manciulea M, Bancu AC, DeLeo A, Whiteside TL, Herberman RB (April 1993). "Regulation of human natural cytotoxicity by IgG. IV. Association between binding of monomeric IgG to the Fc receptors on large granular lymphocytes and inhibition of natural killer (NK) cell activity". Cellular Immunology. 147 (2): 397–410. doi:10.1006/cimm.1993.1079. PMID 8453679.
- ^ Yamasaki S, Saito T (2005). "Regulation of mast cell activation through FcepsilonRI". Chemical Immunology and Allergy. 87: 22–31. doi:10.1159/000087568. ISBN 3-8055-7948-9. PMID 16107760.
- ^ Wakahara S, Fujii Y, Nakao T, Tsuritani K, Hara T, Saito H, Ra C (November 2001). "Gene expression profiles for Fc epsilon RI, cytokines and chemokines upon Fc epsilon RI activation in human cultured mast cells derived from peripheral blood". Cytokine. 16 (4): 143–52. doi:10.1006/cyto.2001.0958. PMID 11792124.
- ^ Metcalfe DD, Baram D, Mekori YA (October 1997). "Mast cells". Physiological Reviews. 77 (4): 1033–79. doi:10.1152/physrev.1997.77.4.1033. PMID 9354811.
- ^ David JR, Butterworth AE, Vadas MA (September 1980). "Mechanism of the interaction mediating killing of Schistosoma mansoni by human eosinophils". The American Journal of Tropical Medicine and Hygiene. 29 (5): 842–8. doi:10.4269/ajtmh.1980.29.842. PMID 7435788.
- ^ Capron M, Soussi Gounni A, Morita M, Truong MJ, Prin L, Kinet JP, Capron A (1995). "Eosinophils: from low- to high-affinity immunoglobulin E receptors". Allergy. 50 (25 Suppl): 20–3. doi:10.1111/j.1398-9995.1995.tb04270.x. PMID 7677229. S2CID 36197719.
- ^ Gounni AS, Lamkhioued B, Ochiai K, Tanaka Y, Delaporte E, Capron A, Kinet JP, Capron M (January 1994). "High-affinity IgE receptor on eosinophils is involved in defence against parasites". Nature. 367 (6459): 183–6. Bibcode:1994Natur.367..183S. doi:10.1038/367183a0. PMID 8114916. S2CID 4331405.
- ^ Pichler WJ, Lum L, Broder S (1978). "Fc-receptors on human T lymphocytes. I. Transition of Tgamma to Tmu cells". J Immunol. 121 (4): 1540–1548. PMID 308968.
- ^ Sandor M, Lynch RG (May 1993). "Lymphocyte Fc receptors: the special case of T cells". Immunol. Today. 14 (5): 227–31. doi:10.1016/0167-5699(93)90168-K. PMID 8517922.
- ^ Engelhardt W, Matzke J, Schmidt RE (1995). "Activation-dependent expression of low affinity IgG receptors Fc gamma RII(CD32) and Fc gamma RIII(CD16) in subpopulations of human T lymphocytes". Immunobiology. 192 (5): 297–320. doi:10.1016/s0171-2985(11)80172-5. PMID 7649565.
- ^ Moretta L, Webb SR, Grossi CE, Lydyard PM, Cooper MD (1977). "Functional analysis of two human T-cell subpopulations: help and suppression of B-cell responses by T cells bearing receptors for IgM or IgG". J Exp Med. 146 (1): 184–200. doi:10.1084/jem.146.1.184. PMC 2180738. PMID 301544.
- ^ Chauhan AK, Moore TL (2011). "T cell activation by terminal complex of complement and immune complexes". The Journal of Biological Chemistry. 286 (44): 38627–38637. doi:10.1074/jbc.M111.266809. PMC 3207419. PMID 21900254.
- ^ Chauhan AK, Moore TL (2011). "T cell activation by terminal complex of complement and immune complexes". The Journal of Biological Chemistry. 286 (44): 38627–38637. doi:10.1074/jbc.M111.266809. PMC 3207419. PMID 21900254.
- ^ Sandor M, Lynch RG (1993). "Lymphocyte Fc receptors: the special case of T cells". Immunology Today. 14 (5): 227–231. doi:10.1016/0167-5699(93)90168-K. PMID 8517922.
- ^ Nimmerjahn F, Ravetch JV (January 2008). "Fcgamma receptors as regulators of immune responses". Nat. Rev. Immunol. 8 (1): 34–47. doi:10.1038/nri2206. PMID 18064051. S2CID 34597359.
- ^ a b Bruhns P, Jönsson F (November 2015). "Mouse and human FcR effector functions". Immunol. Rev. 268 (1): 25–51. doi:10.1111/imr.12350. PMID 26497511. S2CID 19544801.
- ^ a b c Chauhan AK, Moore TL, Bi Y, Chen C (January 2016). "FcγRIIIa-Syk Co-signal Modulates CD4+ T-cell Response and Up-regulates Toll-like Receptor (TLR) Expression". J. Biol. Chem. 291 (3): 1368–86. doi:10.1074/jbc.M115.684795. PMC 4714221. PMID 26582197.
- ^ a b c d Chauhan AK, Chen C, Moore TL, DiPaolo RJ (February 2015). "Induced expression of FcγRIIIa (CD16a) on CD4+ T cells triggers generation of IFN-γhigh subset". J. Biol. Chem. 290 (8): 5127–40. doi:10.1074/jbc.M114.599266. PMC 4335247. PMID 25556651.
- ^ Chauhan AK, Moore TL (2012). "Immune complexes and late complement proteins trigger activation of Syk tyrosine kinase in human CD4(+) T cells". Clin Exp Immunol. 167 (2): 235–245. doi:10.1111/j.1365-2249.2011.04505.x. PMC 3278689. PMID 22235999.
- ^ a b Holgado MP, Sananez I, Raiden S, Geffner JR, Arruvito L (2018). "CD32 Ligation Promotes the Activation of CD4+ T Cells". Front Immunol. 9: 2814. doi:10.3389/fimmu.2018.02814. PMC 6284025. PMID 30555482.
- ^ Chauhan AK (2017). "FcgammaRIIIa Signaling Modulates Endosomal TLR Responses in Human CD4+ T Cells". J Immunol. 198 (12): 4596–4606. doi:10.4049/jimmunol.1601954. PMC 5505339. PMID 28500073.
- ^ a b Bour-Jordan H, Esensten JH, Martinez-Llordella M, Penaranda C, Stumpf M, Bluestone JA (2011). "Intrinsic and extrinsic control of peripheral T-cell tolerance by costimulatory molecules of the CD28/ B7 family". Immunol Rev. 241 (1): 180–205. doi:10.1111/j.1600-065X.2011.01011.x. PMC 3077803. PMID 21488898.
- ^ Weber JP, Fuhrmann F, Feist RK, Lahmann A, Al Baz MS, Gentz LJ, Vu Van D, Mages HW, Haftmann C, Riedel R, Grun JR, Schuh W, Kroczek RA, Radbruch A, Mashreghi MF, Hutloff A (2015). "ICOS maintains the T follicular helper cell phenotype by down-regulating Kruppel-like factor 2". The Journal of Experimental Medicine. 212 (2): 217–233. doi:10.1084/jem.20141432. PMC 4322049. PMID 25646266.
추가 정보
- Janeway CA, Travers P, Waldport M, Shlomchik MJ (2001). "Chapter 9. The Humoral Immune Response". Immunobiology: The Immune System in Health and Disease (5th ed.). New York: Garland. ISBN 978-0-8153-3642-6.
- Abbas AK, Lichtman AH, Pillai S (2012). "Chapter 12: Effector Mechanisms of Humoral Immunity". Cellular and molecular immunology (7th ed.). Philadelphia: Elsevier/Saunders. ISBN 978-1-4377-1528-6.
- Gerber JS, Mosser DM (February 2001). "Stimulatory and inhibitory signals originating from the macrophage Fcgamma receptors". Microbes and Infection. 3 (2): 131–9. doi:10.1016/s1286-4579(00)01360-5. PMID 11251299.
- Maverakis E, Kim K, Shimoda M, Gershwin ME, Patel F, Wilken R, Raychaudhuri S, Ruhaak LR, Lebrilla CB (February 2015). "Glycans in the immune system and The Altered Glycan Theory of Autoimmunity: a critical review". Journal of Autoimmunity. 57: 1–13. doi:10.1016/j.jaut.2014.12.002. PMC 4340844. PMID 25578468.




