모낭성 수지상세포
Follicular dendritic cells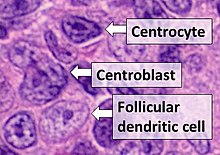
- centrocytes는 각질, 길쭉, 갈라짐 또는 꼬임 핵이 있는 작은 크기에서 중간 크기까지입니다.
- centroblasts는 염기성 핵이 1~3개씩 핵막을 부착하고 있는 보다 큰 세포다.
- 엽상 덴드리트 세포는 둥근 핵, 중앙에 위치한 핵, 싱겁고 분산된 염색질, 인접 핵막의 평탄화 등을 가지고 있다.
모낭성 수지상세포(FDC)는 림프조직의 B세포 부위의 1차 림프포와 2차 림프포(림프절)에서 발견되는 면역계의 세포다.[1][2][3]Dendritic cells(DC)와 달리 FDC는 골수형 조혈모세포에서 유래된 것이 아니라 중피에서 유래한 것이다.[4]FDC의 가능한 기능으로는 림프조직의 세포와 마이크로아키텍처, B세포를 지지하기 위한 항원 포획, 생식선 중심에서 파편 제거 촉진, 자가면역성 보호 등이 있다.FDC가 기여할 수 있는 질병 과정에는 1차 FDC-tumor, 만성 염증 조건, HIV-1 감염 개발, 신경침투성 스크랩이 포함된다.
위치 및 분자 표식기
모낭 DC는 림프절, 비장, 점막 관련 림프조직(MALT)의 B세포 영역의 1차 및 2차 모낭에서 발견되는 비이동 모집단이다.그들은 FDCs 공정들 사이의 세포간 연결과 모낭 B세포와의 친밀한 상호작용 때문에 안정적인 네트워크를 형성한다.[5][6]모낭 DC 네트워크는 전형적으로 모낭의 중심을 형성하며 모낭에서 국민간 지역이나 T-세포 영역까지 확장되지 않는다.아마도, 이러한 초기 항원 처리와 포획 사이트와의 분리는 포고세포에 의해 보호되거나 제거되지 않고 오랫동안 음소화 된 항원을 표시할 수 있는 보호 환경을 제공한다.엽상 DC는 보완 수용체 CR1과 CR2(각각 CD 35와 CD 21), Fc-receptor FcγRIb(CD32)의 발현이 높다.추가적인 FDC 고유 분자 표지는 FDC-M1, FDC-M2 및 C4이다.[7]다른 DC나 대식세포와 달리 FDC는 MHC 등급 II 항원 분자가 부족하고 패턴인식 수용체를 거의 표현하지 못하기 때문에 비흡음성 항원을 포획할 능력이 거의 없다.[5]
개발
엽상 DC는 삽입성 중피 전구체로부터 발달한다.[7]중증 복합면역결핍증(SCID) 마우스 모델은 이러한 전구체가 골수 할당제를 가진 수혜자에게 전달될 수 있음을 보여주며, 이 경우 기증자와 수혜자의 FDC 네트워크는 나중에 수혜자의 림프구 구획에서 발견될 수 있다.[8]TNF-a와 림프톡신(LT)에 의해 매개되는 FDC 전구체와 림프구 세포 사이의 상호작용은 정상적인 FDC 개발 및 유지보수에 매우 중요하다.TNF-a는 TNFRI 수용체에 결합되며, LT는 FDC 전구체에 표현된 LTβ-수용체와 상호작용한다.B세포가 없거나 TNF-a와 림포톡신(LT) 생성이 막힌 생쥐에서는 FDC 표현형을 가진 세포가 빠져 있다.[9][10]
기능들
림프형 마이크로아키텍처 구성
정상 림프 조직에서, 재순환되는 휴식 B 세포는 FDC 네트워크를 통해 이동하지만, 항원 활성 B 세포는 차단되어 FDC 네트워크 내에서 클론 확장을 거치면서 생식 중심(GC)을 생성한다. FDC는 림프 세포를 끌어들이고 조직하는 케모킨 CXCL13의 주요 생산자들 중 하나이다.[11]
항원 캡처, 메모리 B세포 지원
모낭 DC 수용체 CR1, CR2 및 FcγRIb는 보완제나 항체에 의해 발작된 항원을 트랩한다.이 항원은 나중에 B 세포에 표시하기 위해 분해되지 않는 순환 내막 구획에 포함된다.[12]미래 기억 세포로 선택되기 위해서는 GC B 세포가 FDC에 제시된 항원을 결합해야 하며 그렇지 않으면 세포사멸에 돌입한다.
파편 제거
FDC는 세포와 포구체를 교차 연결하는 브리징 인자 MFGE8을 분비함으로써 GC에서 선별적인 이물질 제거를 촉진한다.[13][14]
자가면역 방지
주로 FDC에 의해 림프 조직에서 생성되는 인자 Mfge는 세포 사멸을 촉진하는 것으로 알려져 있다.생쥐에서 이 인자의 결손은 전신 루푸스 에리테마토스(SLE)와 유사한 상태를 초래한다.더욱이 FDC가 없는 LT 또는 LT 수용체가 부족한 생쥐는 자가면역성을 암시하는 일반화된 림프구 침투가 발생한다.이러한 발견은 FDC가 잠재적으로 자가반응이 가능한 파편들을 발생 센터에서 제거함으로써 유기체를 자가면역성으로부터 보호할 수 있음을 시사한다.[13]
B-세포와의 상호작용
비인지산(항원 특정이 아님) B 세포는 항원을 FDC로 운반하는 데 중요한 역할을 한다.그들은 림프나 대식세포로부터 직접 CR1/2 의존적인 방법으로 면역 복합체를 포착하고, 림프 조직으로 이동하여 거기서 보완된 오피니언 항원을 FDC로 전달한다.[15][16]
FDC는 다시 화학 반응제 CXCL13으로 B 세포를 끌어들인다.CXCL13의 수용체인 CXCR5가 부족한 B세포는 여전히 흰 펄프로 들어가지만 국소화가 잘못돼 체계성이 떨어진다.모낭 구조를 생성하기 위해서는 B세포가 생산하는 중재자 임파독소(LT)에 의해 FDC가 자극을 받을 필요가 있다.B세포에 대한 CXCR5의 자극은 LT생성을 상향 조정하여 FDCR 활성화로 이어지고 추가 CXCL13 분비를 자극하여 양의 피드-포워드 루프를 생성한다.이로 인해 항원 활성 B세포가 갇혀 체세포 돌연변이를 겪고 양과 음의 선택을 받는 생식중심(GC)이 형성되며 이소형 전환, 고선호도 플라즈마 세포와 기억 B세포로 분화된다.FDC와 B세포 사이의 접착은 ICAM-1(CD54)-LFA-1(CD11a)과 VCAM-VLA-4 분자로 매개된다.[7]자동소거 B세포는 물론 FDCs 표면에서 포획된 항원에 대한 친화력이 낮은 활성 B세포는 세포사멸을 겪는 반면,[17] 항원 복합체를 통해 FDC에 바인딩된 B세포는 FDC와의 상호작용에 의한 세포사멸 차단으로 인해 생존한다.
질병.
희귀한 1차 FDC 튜머가 설명되었다.이러한 사포체는 흔히 림프조직과 관련되지만, 여러 경우에서 간, 담즙관, 췌장, 갑상선, 비인두, 팔라툼, 위 또는 십이지장에서 종양은 간, 담즙관, 갑상선, 비인두, 팔라툼, 위 또는 십이지장에서 발견되었다.여러 만성 염증 조건에서는 류마티스성 관절염(RA) 환자의 시낭 조직, 뫼그렌 증후군 환자의 침샘, 사이비 B세포 림(Lym) 환자의 피부 등 상당히 예상치 못한 장소에서 CXCL13 케모킨을 생성하고 그러한 FDC 마커를 운반하는 세포가 관찰되어 왔다.phoma.[7] 엽록체 dendritic cells는 HIV-1을[18][19][20] 위한 안식처를 제공하고 헥스타크린 신호 메커니즘을 통해 인접한 감염된 단세포에서 HIV-1 복제를 촉진함으로써 HIV-1 감염 개발에 참여한다.[21]FDC가 신경침습성 스크랩에서 프리온 복제와 신경침착을 촉진할 수 있다는 일부 증거도 있다.[22]
참고 항목
- 미국 국립 의학 도서관의 폴릭술라+덴드리틱+셀(MesH)
참조
- ^ Liu Y, Grouard G, de Bouteiller O, Banchereau J (1996). Follicular dendritic cells and germinal centers. Int Rev Cytol. International Review of Cytology. Vol. 166. pp. 139–79. doi:10.1016/S0074-7696(08)62508-5. ISBN 978-0-12-364570-8. PMID 8881775.
- ^ Heesters, Balthasar A.; Myers, Riley C.; Carroll, Michael C. (2014-06-20). "Follicular dendritic cells: dynamic antigen libraries". Nature Reviews Immunology. 14 (7): 495–504. doi:10.1038/nri3689. ISSN 1474-1733. PMID 24948364. S2CID 7082877.
- ^ Aguzzi, Adriano; Kranich, Jan; Krautler, Nike Julia (March 2014). "Follicular dendritic cells: origin, phenotype, and function in health and disease". Trends in Immunology. 35 (3): 105–113. doi:10.1016/j.it.2013.11.001. ISSN 1471-4906. PMID 24315719.
- ^ Banchereau J, Steinman RM (1998). "Dendritic cells and the control of immunity". Nature. 392 (6673): 245–52. Bibcode:1998Natur.392..245B. doi:10.1038/32588. PMID 9521319. S2CID 4388748.van Nierop K, de Groot C (2002). "Human follicular dendritic cells: function, origin and development". Semin Immunol. 14 (4): 251–7. doi:10.1016/S1044-5323(02)00057-X. PMID 12163300.
- ^ a b Male D, Brostoff J, Roth D, Roitt I (2007). Immunology (7th ed.). ISBN 978-0-323-03399-2.
- ^ Banchereau J, Steinman RM (1998). "Dendritic cells and the control of immunity". Nature. 392 (6673): 245–52. Bibcode:1998Natur.392..245B. doi:10.1038/32588. PMID 9521319. S2CID 4388748.
- ^ a b c d van Nierop K, de Groot C (2002). "Human follicular dendritic cells: function, origin and development". Semin Immunol. 14 (4): 251–7. doi:10.1016/S1044-5323(02)00057-X. PMID 12163300.
- ^ Kapasi ZF, Qin D, Kerr WG, Kosco-Vilbois MH, Shultz LD, Tew JG, Szakal AK (1998). "Follicular dendritic cell (FDC) precursors in primary lymphoid tissues". The Journal of Immunology. 160 (3): 1078–84. PMID 9570519.
- ^ Wang Y, Wang J, Sun Y, Wu Q, Fu YX (2001). "Complementary effects of TNF and lymphotoxin on the formation of germinal center and follicular dendritic cells". Journal of Immunology. 166 (1): 330–7. doi:10.4049/jimmunol.166.1.330. PMID 11123309.
- ^ Ettinger R, Mebius R, Browning JL, Michie SA, van Tuijl S, Kraal G, van Ewijk W, McDevitt HO (1998). "Effects of tumor necrosis factor and lymphotoxin on peripheral lymphoid tissue development". Int Immunol. 10 (6): 727–41. doi:10.1093/intimm/10.6.727. PMID 9678753.
- ^ Cyster JG (2010). "B cell follicles and antigen encounters of the third kind". Nat Immunol. 11 (11): 989–96. doi:10.1038/ni.1946. PMID 20959804. S2CID 26439962.
- ^ Balthasar, Heesters; Priyadarshini, Chatterjee; Young-A, Kim; Santiago, Gonzalez; Michael, Kuligowski; Tomas, Kirchhausen; Michael, Carroll (2013). "Endocytosis and recycling of immune complexes by follicular dendritic cells enhances B cell binding and activation". Frontiers in Immunology. 4. doi:10.3389/conf.fimmu.2013.02.00438. ISSN 1664-3224.
- ^ a b Aguzzi A, Krautler NJ (2010). "Characterizing follicular dendritic cells: A progress report". European Journal of Immunology. 40 (8): 2134–8. doi:10.1002/eji.201040765. PMID 20853499.
- ^ Kranich J, Krautler NJ, Heinen E, Polymenidou M, Bridel C, Schildknecht A, Huber C, Kosco-Vilbois MH, Zinkernagel R, Miele G, Aguzzi A (2008). "Follicular dendritic cells control engulfment of apoptotic bodies by secreting Mfge8". J Exp Med. 205 (6): 1293–302. doi:10.1084/jem.20071019. PMC 2413028. PMID 18490487.
- ^ Phan, Tri Giang; Grigorova, Irina; Okada, Takaharu; Cyster, Jason G (2007-07-29). "Subcapsular encounter and complement-dependent transport of immune complexes by lymph node B cells". Nature Immunology. 8 (9): 992–1000. doi:10.1038/ni1494. ISSN 1529-2908. PMID 17660822. S2CID 35256900.
- ^ Carrasco, Yolanda R.; Batista, Facundo D. (July 2007). "B Cells Acquire Particulate Antigen in a Macrophage-Rich Area at the Boundary between the Follicle and the Subcapsular Sinus of the Lymph Node". Immunity. 27 (1): 160–171. doi:10.1016/j.immuni.2007.06.007. ISSN 1074-7613. PMID 17658276.
- ^ Aguzzi A, Kranich J, Krautler NJ (2014). "Follicular dendritic cells: origin, phenotype, and function in health and disease". Trends in Immunology. 35 (3): 105–113. doi:10.1016/j.it.2013.11.001. PMID 24315719.
- ^ Cavert W, Notermans DW, Staskus K, Wietgrefe SW, Zupancic M, Gebhard K, Henry K, Zhang ZQ, Mills R, McDade H, Schuwirth CM, Goudsmit J, Danner SA, Haase AT (1997). "Kinetics of response in lymphoid tissues to antiretroviral therapy of HIV-1 infection". Science. 276 (5314): 960–4. doi:10.1126/science.276.5314.960. PMID 9139661.
- ^ Pantaleo G, Graziosi C, Demarest JF, Butini L, Montroni M, Fox CH, Orenstein JM, Kotler DP, Fauci AS (1993). "HIV infection is active and progressive in lymphoid tissue during the clinically latent stage of disease". Nature. 362 (6418): 355–8. Bibcode:1993Natur.362..355P. doi:10.1038/362355a0. PMID 8455722. S2CID 4326634.
- ^ Heesters, Balthasar A.; Lindqvist, Madelene; Vagefi, Parsia A.; Scully, Eileen P.; Schildberg, Frank A.; Altfeld, Marcus; Walker, Bruce D.; Kaufmann, Daniel E.; Carroll, Michael C. (2015-12-01). "Follicular Dendritic Cells Retain Infectious HIV in Cycling Endosomes". PLOS Pathogens. 11 (12): e1005285. doi:10.1371/journal.ppat.1005285. ISSN 1553-7374. PMC 4666623. PMID 26623655.
- ^ Ohba K, Ryo A, Dewan MZ, Nishi M, Naito T, Qi X, Inagaki Y, Nagashima Y, Tanaka Y, Okamoto T, Terashima K, Yamamoto N (2009). "Follicular dendritic cells activate HIV-1 replication in monocytes/macrophages through a juxtacrine mechanism mediated by P-selectin glycoprotein ligand 1". Journal of Immunology. 183 (1): 524–32. doi:10.4049/jimmunol.0900371. PMID 19542463.
- ^ Montrasio F, Frigg R, Glatzel M, Klein MA, Mackay F, Aguzzi A, Weissmann C (2000). "Impaired prion replication in spleens of mice lacking functional follicular dendritic cells". Science. 288 (5469): 1257–9. Bibcode:2000Sci...288.1257M. doi:10.1126/science.288.5469.1257. PMID 10818004.
| 위키다양성에는 모낭성 수지상세포에 대한 학습자원이 있다. |

