용존 유기 탄소
Dissolved organic carbon
| 의 시리즈의 일부 |
| 탄소 순환 |
|---|
 |
유기 탄소 대기 불가동은 0.22, 0.7미크론으로 일반적으로 사이의 모공 크기를 필터를 통과할 수 있는지로 정의한 용해된 유기 탄소(디오씨)는 소수 부분입니다.[2]그 파편 필터에 남아 있는 미립자적(POC)이라고 불린다.[3]
용존유기물(DOM)은 델 텔레폰 어드바이저와 교환하여 자주 사용되는 밀접한 관련 용어입니다.DOC는 특히 용해된 유기물 중 탄소 질량을 의미하지만, DOM은 용해된 유기물의 총 질량을 의미한다.따라서 DOM에는 질소, 산소, 수소 등 유기물질에 존재하는 다른 원소의 질량도 포함되어 있습니다.DOC는 DOM의 컴포넌트로 일반적으로 DOM의 약 [4]2배의 DOM이 존재합니다.DOC에 대해 할 수 있는 많은 문장은 DOM에 동일하게 적용됩니다.또, 그 반대의 경우도 마찬가지입니다.
델 텔레폰 어드바이저는 해양 및 담수 시스템에 풍부하며 지구상에서 가장 순환이 많은 유기물 저장소의 하나로 대기 중과 동일한 양의 탄소를 차지하며 전체 유기 [5]탄소의 최대 20%를 차지합니다.일반적으로 유기탄소화합물은 식물과 동물을 포함한 죽은 유기물로부터의 분해 과정의 결과물이다.델 텔레폰 어드바이저(델 텔레폰 어드바이저)는 특정 수역의 내부 또는 외부에서 발생할 수 있습니다.수역 내에서 발생하는 DOC는 보통 수생식물 또는 조류에서 발생하는 DOC로 알려져 있으며, 수역 밖에서 발생하는 DOC는 동종 DOC로 알려져 있으며, 일반적으로 토양 또는 [6]육생식물에서 발생하는 DOC는 수역 밖에서 발생하는 DOC로 알려져 있습니다.유기 토양의 비율이 높은 육지에서 물이 나올 경우, 이러한 구성 요소는 DOC로서 강과 호수로 배수될 수 있습니다.
해양 DOC 풀은 화학적 세계와 생물학적 세계 사이의 경계에 있기 때문에 해양 생태계의 기능에 중요하다.델 텔레폰 어드바이저(DOC)는 해양식품망에 연료를 공급하고 있으며, 지구 [7]탄소 순환의 주요 구성요소입니다.
개요

델 텔레폰 어드바이저(DOC)는 미생물의 성장을 지원하는 기본 영양소이며 미생물 루프를 [10]통한 전지구 탄소 순환에서 중요한 역할을 합니다.전통적인 의미에서 먹이를 먹지 않는 일부 유기체(단계)에서는 용해된 물질이 유일한 외부 식량원이 [11]될 수 있다.또한 DOC는 하천에 유기물을 적재하는 지표이며, 유기물의 지상 처리(예를 들어 토양, 숲 및 습지 내)를 지원한다.용존 유기 카본은 고차 스트림에 비해 1차 스트림에서 생분해성 용존 유기 카본(BDOC)의 비율이 높습니다.광범위한 습지, 습지 또는 늪이 없는 경우, 방해를 받지 않은 유역의 DOC 염기 흐름 농도는 일반적으로 약 1 - 20 mg/L [12]탄소 범위이다.탄소 농도는 생태계마다 상당히 다르다.예를 들어, 에버글레이즈는 산맥의 꼭대기 근처에 있고 바다 한가운데는 바닥 근처에 있을 수 있다.때때로 높은 농도의 유기 탄소는 인공적인 영향을 나타내지만,[13] 대부분의 DOC는 자연적으로 발생한다.
BDOC 분율은 이종영양 박테리아가 에너지와 [14]탄소의 원천으로 사용할 수 있는 유기 분자로 구성되어 있습니다.DOC의 일부 하위 집합은 식수 [15]소독 부산물의 전구체를 구성합니다.BDOC는 물 분배 [16]시스템 내에서 바람직하지 않은 생물학적 재생에 기여할 수 있다.
총유기탄소(TOC)의 용해분율은 운용분류이다.많은 연구자들이 0.45μm 필터를 통과하는 화합물에 대해 "용해"라는 용어를 사용하지만, 0.22μm 필터는 더 높은 콜로이드 [2]농도를 제거하기 위해 사용되었다.
해양 화학에서 일반적으로 사용되는 용해물의 정의는 공칭 공극 크기가 약 0.7μm인 GF/F 필터를 통과하는 모든 물질입니다(Whatman glass 마이크로파이버 필터, 0.6–0.8μm 입자[17] 유지).권장되는 절차는 HTCO 기술입니다.HTCO 기술에서는 프리버스트 유리섬유필터(일반적으로 GF/F 분류)[18]를 통한 여과가 필요합니다.
유연하고 고집불통
용해된 유기물은 그 반응성에 따라 불안정한 물질 또는 완고한 물질로 분류될 수 있다.반항적인 DOC는 내화성 DOC라고도 불리며, 이러한 용어는 DOC의 맥락에서 서로 바꿔서 사용되는 것으로 보입니다.DOC의 기원과 조성에 따라 동작과 사이클링이 다릅니다.DOC의 취약한 부분은 미생물 또는 광화학적으로 매개되는 과정을 통해 빠르게 분해되는 반면, 내화성 DOC는 분해에 강하고 바다에서 수천 년 동안 지속될 수 있습니다.해안 바다에서는 육지 식물의 배설물이나 토양에서 나오는 유기물이 더 내화성이[19] 있는 것으로 보여서 종종 보수적으로 행동한다.또한, 내화성 DOC는 유연한 DOC의 세균 변환에 의해 바다에서 생성되며,[20][21][22] 이는 그 구성을 재구성한다.
자연 시스템의 지속적인 생산과 열화로 인해, DOC 풀에는 각각 자체 반응성을 [23]가진 반응성 화합물 스펙트럼이 포함되어 있으며, 다음 표에 표시된 것처럼 회전 [24]시간에 따라 연약성 화합물부터 역저항성 화합물까지 분율로 구분됩니다.
델 텔레폰 어드바이저 풀의 스펙트럼(labile에서 redistant까지) | |||
|---|---|---|---|
| DOC 프랙션 | 약어 | 회전 시간 | 양 |
| 불안정하다 | DOCL | 몇 시간에서 며칠까지 | 200 Tg C 미만 |
| 반연성 | DOCSL | 몇 주에서 몇 달 | 최대 600 Tg C |
| 반충격성 | DOCSR | 수십 년 | 최대 1,400 Tg C |
| 반항적인 | DOCR | 수천 년 | 최대 63000 Tg C |
| 내성이 높은 | 수만 년 | ||
회전이나 퇴화 시기에 이 넓은 범위의 화학적 구성, 구조, 분자 size,[25][26]지만 열화는 환경 조건(예를 들어, 영양소), 전핵 생물 다양성, 산화 환원 반등 상태, 철 가용성,mineral-particle자 단체, 온도, 일광 노출, 생물학적 제품에 의존과 연관되어 있다.r의 이온분출성 화합물 및 개별 [25][27][28][29][30][31]분자의 프라이밍 또는 희석 효과.예를 들어, 리그닌은 호기성 토양에서는 분해될 수 있지만, 무독성 해양 [32]퇴적물에서는 상대적으로 저항력이 강하다.이 예는 생태계의 특성에 따라 생물학적 가용성이 다르다는 것을 보여준다.따라서 석유, 카르복실기가 풍부한 지방환 분자 등 통상적으로 오래되고 완고한 화합물이라도 적절한 [33][34]환경환경에서 분해할 수 있다.
지구 생태계
흙
용존유기물(DOM)은 가장 활동적이고 이동성이 높은 탄소 풀 중 하나이며 전지구 탄소 [41]순환에 중요한 역할을 합니다.또한 용존유기탄소(DOC)는 토양 음전하 탈질공정, 토양용액 중의 산염기 반응, 영양소(카티온)의 유지 및 전위, 중금속 및 이종생물제의 [42]고정화에 영향을 미칩니다.토양 DOM은 강우 시 용해된 대기 탄소, 쓰레기와 농작물 잔류물, 거름, 뿌리 삼출물, 토양 유기물(SOM)의 분해와 같은 다양한 소스(입력물)로부터 도출될 수 있다. 토양에서 DOM 가용성은 흡착 및 탈착에 의해 변조된 광물 성분(예: 점토, Fe 및 Al 산화물)과의 상호작용에 따라 달라진다.오리션 프로세스.[43]또한 광물과 고정화 과정을 통해 SOM 분율(예: 안정화 유기 분자와 미생물 바이오매스)에 의존한다.또한 이러한 상호작용의 강도는 토양 고유의 특성,[44] 토지 사용 및 농작물 [43][35]관리에 따라 변화한다.
유기물 분해 과정에서 대부분의 탄소는 미생물 산화에 의해 대기 중에 CO로2 손실된다.토양 유형 및 경관 경사, 침출 및 유출도 토양 [45]내 DOM 손실과 관련된 중요한 과정이다.물이 잘 빠진 토양에서는 침출된 DOC가 수면에 도달하여 지하수를 [45][46]오염시킬 수 있는 영양소와 오염 물질을 방출할 수 있으며, 유출물은 DOM과 이종 생물 물질을 다른 지역, 강 및 [35]호수로 운반합니다.
지하수
강수량과 지표수는 녹은 유기탄소(DOC)를 식물과 식물의 쓰레기로부터 침출시켜 토양 기둥을 통해 포화 지대로 침투시킨다.DOC의 농도, 조성 및 생물학적 가용성은 토양 컬럼을 통과하는 동안 흡착, 탈착, 생분해 및 생합성을 포함한 다양한 물리화학적 및 생물학적 과정에 의해 변화한다.소수성 분자는 토양 광물에 우선적으로 분할되어 친수성 분자보다 토양에 오래 머무른다.토양 내 콜로이드와 용해된 분자의 소수성 및 잔류 시간은 크기, 극성, 전하 및 생물학적 가용성에 의해 제어된다.바이오 가용 DOM은 미생물 분해되어 크기와 분자량이 감소한다.새로운 분자는 토양 미생물에 의해 합성되며, 이러한 대사물 중 일부는 지하수의 [36]DOC 저장소로 들어갑니다.
담수 생태계
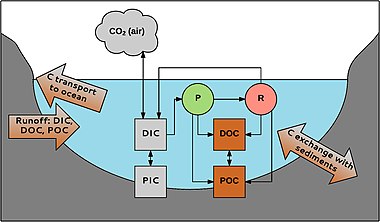
수생 탄소는 다양한 형태로 발생한다.우선 유기탄과 무기탄소를 구분한다.유기 탄소는 이물질이나 1차 생산자로부터 유래한 유기 화합물의 혼합물입니다.POC(Particle Organic Carbon, Particle > 0.45 μm)와 DOC(Disolved Organic Carbon, Particle < 0.45 μm)로 나눌 수 있다.델 텔레폰 어드바이저에서는 보통 수생 유기 탄소 총량의 90%를 차지합니다.농도 범위는 0.1 ~ >[47] 300 mg L-1이다.
마찬가지로 무기탄소도 미립자(PIC)와 용해상(DIC)으로 구성된다.PIC는 주로 탄산염(예: CaCO3)으로 구성되며, DIC는32- 탄산염(CO), 중탄산염3−(HCO), CO2 및 무시할 수 있을 정도로 적은 양의 탄산(HCO23)으로 구성됩니다.무기 탄소 화합물은 물의 [48]pH에 의존하는 평형 상태로 존재한다.담수의 DIC 농도는 산성수에서 약 0에서 탄산염이 풍부한 [49]퇴적물이 있는 지역의 60mg C L-1까지 다양하다.
POC를 분해하여 DOC를 형성할 수 있습니다.DOC는 응집함으로써 POC가 될 수 있습니다.무기 탄소와 유기 탄소는 수생 생물을 통해 연결되어 있다.CO2는 예를 들어 대식세포에 의해 광합성(P)에 사용되며 호흡(R)에 의해 생성되어 대기와 교환된다.유기 탄소는 유기체에 의해 생성되며 생물체의 수명 동안과 후에 방출된다. 예를 들어, 하천에서는 총 DOC 양의 1-20%가 [38]대식물에 의해 생성된다.탄소는 집수지에서 시스템으로 유입될 수 있으며 강과 개울을 통해 바다로 운반된다.퇴적물에서도 탄소와 교환이 있는데, 예를 들어 수생 [50]서식지에서 탄소 격리에 중요한 유기 탄소의 매몰이다.
수생 시스템은 전지구 탄소 격리에서 매우 중요하다. 예를 들어 유럽 생태계를 비교할 때 내륙 수생 시스템은 두 번째로 큰 탄소 흡수대(19-41 Tg C y-1)를 형성한다. 숲만이 더 많은 탄소를 차지한다(125-223 Tg C y-1).[51][37]
해양 생태계
원천
해양 시스템에서 DOC는 자동 또는 동종 선원에서 유래합니다.자기계 DOC는 시스템 내에서 주로 플랑크톤 유기체에 의해 생성되며, 해저 미세 조류, 해저 플럭스 및 [54]대식물에 의해 추가로 연안 수역에서 생성된다. 반면, 동종 DOC는 지하수 및 대기 [55][56]입력에 의해 보충되는 지상 기원에 의해 주로 생성된다.토양에서 유래한 부식물질 외에 지상 DOC에는 비가 오는 동안 수출되는 식물에서 침출된 물질, 식물 물질의 대기로의 방출 및 수중 환경에서의 퇴적(예: 휘발성 유기 탄소 및 꽃가루) 및 수천 개의 합성 인간이 만든 유기 화학 물질도 포함됩니다.미량 [57][56][7]농도의 바다
용해된 유기 탄소(DOC)는 지구의 주요 탄소 풀 중 하나입니다.대기와 비슷한 양의 탄소를 함유하고 있으며 해양 바이오매스에 결합되어 있는 탄소량을 200배 [58]이상 초과합니다.DOC는 일차 생산 공정과 동물성 플랑크톤 방목 [59]공정에서 주로 표면 근방에서 생산됩니다.해양 DOC의 다른 원천으로는 [59]입자로부터의 용해, 지상 및 열수 분출구 투입,[60] 미생물 생산 등이 있습니다.원핵생물(박테리아 및 고세균)은 사망률(예: 바이러스 분로)뿐만 아니라 캡슐 물질, 외부 고분자 및 가수 분해 [59]효소의 방출을 통해 DOC 풀에 기여한다.원핵생물은 또한 DOC의 주요 분해체이지만, 가장 완고한 형태의 DOC는 열수계에서 매우 느린 비생물학적 분해나 가라앉는 입자에 대한 흡착이 주요 제거 메커니즘일 수 있다.이 활성 탄소 저장소의 [61]순환 및 분포를 이해하려면 DOC-마이크로브 상호작용에 대한 기계적 지식이 중요합니다.
식물성 플랑크톤
식물성 플랑크톤은 일반적으로 총 1차 [62]생산량의 5~30%를 차지하는 세포 외 방출에 의해 DOC를 생성하지만, 이는 [63]종마다 다르다.그럼에도 불구하고, 세포외 DOC의 방출은 높은 빛과 낮은 영양 수준 하에서 강화되므로, 부영양에서 부족 영양 영역으로 상대적으로 증가해야 하며, 아마도 세포 에너지를 [64]소멸시키는 메커니즘으로 증가할 것이다.식물성 플랑크톤은 또한 영양소 제한과 같은 생리학적 스트레스 상황에서 [65]자가 분해를 통해 DOC를 생성할 수 있다.다른 연구에서는 식물성 플랑크톤과 [66][7]박테리아를 섭취하는 메소 및 매크로 동물성 플랑크톤과 관련된 DOC 생산이 입증되었다.
주플랑크톤
동물성 플랑크톤에 의한 DOC 방출은 미생물에게 [67][66]중요한 에너지원이 될 수 있는 허술한 섭식, 배설 및 배변을 통해 발생합니다.이러한 DOC 생산량은 식품 농도가 높고 대형 동물성 플랑크톤 [68][7]종이 우세한 시기에 가장 크다.
박테리아와 바이러스
박테리아는 종종 DOC의 주요 소비자로 간주되지만, 세포 분열과 바이러스 [69][70][52]용해 중에 DOC를 생성할 수도 있습니다.박테리아의 생화학적 구성 요소는 다른 유기체와 대체로 동일하지만, 세포벽의 일부 화합물은 독특하고 박테리아에서 파생된 DOC(펩티도글리칸)를 추적하는 데 사용됩니다.이러한 화합물은 바다에 널리 분포되어 있어 해양 시스템에서 [71]세균 DOC 생산이 중요할 수 있음을 시사합니다.바이러스는 조류, 박테리아, 동물성 [72]플랑크톤을 포함한 모든 생명체를 감염시키는 해양에서 가장 풍부한 생명체이다.감염 후 바이러스는 휴면(용해성) 또는 생산(용해성)[73] 상태가 됩니다.용해 사이클로 인해 세포가 중단되고 DOC가 [74][7]방출됩니다.


대식동물
해양 대식동물(즉, 대식조류 및 해초류)은 생산성이 높고 연안 수역의 넓은 지역에 걸쳐 분포하고 있지만, DOC의 생산은 그다지 주목을 받지 못했다.대식세포는 성장 중 DOC를 방출하며, 보수적인 추정치(부식조직으로부터의 방출 제외)는 대식세포가 총 1차 [79][80]생산의 1-39%를 방출하는 반면, 해초는 총 1차 [81]생산의 DOC로 5% 미만을 방출한다는 것을 시사한다.발표된 DOC는 탄수화물이 풍부하며 온도와 [82]빛 가용성에 따라 비율이 달라집니다.전 세계적으로 대식동물 군집에서는 연간 전지구 하천 DOC 투입량(250 Tg C yr–1)[82][7]의 약 절반인 160 Tg C yr–1을 생성하도록 제안되었다.
해양 퇴적물
해양 퇴적물은 OM 분해와 해양 수몰의 주요 지점을 나타내며,[84] 물기둥에서 발견된 것보다 최대 1000배 높은 밀도로 미생물을 수용한다.퇴적물의 DOC 농도는 종종 위에 있는 [85]물기둥보다 훨씬 높다.이러한 농도 차이는 지속적인 확산 플럭스를 발생시키고 퇴적물이 350 Tg C yr–1을 방출하는 주요 DOC 선원이며 이는 [86]강으로부터의 DOC 투입에 필적한다.이 추정치는 계산된 확산 플럭스를 기반으로 하며 DOC를 방출하는 재정지 이벤트를 포함하지 않으므로 추정치는 보수적일 수 있습니다.또한 일부 연구에 따르면 지열 시스템과 석유 유출은 해양 심층 [88][89]분지에 사전 노화 DOC로 기여하지만, 현재 전체 투입량에 대한 일관된 글로벌 추정치가 부족하다.전 세계적으로 지하수는 바다로 [90]가는 담수 DOC 플럭스의 알려지지 않은 부분을 차지한다.지하수의 DOC는 육지,[91] 침투 해양 및 현장 미생물 생성 물질의 혼합물입니다.일반적으로 지하수의 농도가 연안 [92]해수보다 높기 때문에 연안 해역에 대한 DOC의 플럭스는 중요할 수 있지만, 현재 신뢰할 수 있는 글로벌 추정치가 부족하다.[7]
싱크
는 대양의 바닷물 칼럼에서 디오씨를 제거하는 주요 과정:내에(1)열적 성능 저하., 해저 열수 시스템;microparticles에[93](2)거품 응고와 비생물적 응집이나 입자에 흡수[94], 광화학 반응들을 통해[95](3)비생물적 저하,[96][97]과 종속 영양 marin에 의해(4)생물적 분해 있다.e원핵 생물들.[98]광화학 및 미생물 분해의 결합 효과가 [99][7]DOC의 주요 흡수원을 나타낸다고 제안되었다.
열화
- 해양 내화물 DOC 제거지표수에서 식물성 플랑크톤 생산과 먹이 거미줄 역학은 다양한 반응성을 가진 용해된 분자의 다양한 혼합물을 방출합니다.박테리아와 고세균은 상층 해양의 표면과 중엽수에서 유연하고 반연성 형태의 DOC를 사용하며, 수천 년 동안 바다에 존재하는 광대한 내화 DOC(RDOC)를 남깁니다.바다는 다양한 미생물과 물리화학적 과정을 가지고 있으며, 이러한 분자들이 환경 조건과 그것들을 분해할 수 있는 미생물들을 만났을 때 불응성 DOC를 제거할 수 있는 잠재력을 가지고 있습니다.물리적 혼합은 내화물 DOC를 해양 전체로 운반하므로 제거 가능성이 높아집니다.심해수는 열수 순환에 포함될 수 있으며 열분해로 관련 DOC를 제거할 수 있습니다.해양 상부에서 가라앉은 입자는 미생물 활동의 핫스팟을 유발하고 내화성 분자의 제거를 촉진하는 불안정한 DOC(Labile DOC)를 방출합니다.지표면 아래 물을 햇빛이 비치는 물에 혼합하면 내화성 DOC가 따뜻한 온도와 광화학 과정에 노출되어 내화성 분자를 광물화하고 간단한 화합물(예: 피루브산, 포름알데히드)로 변환하여 신속하게 미생물을 이용할 수 있습니다.따라서 바다에서 내화분자의 수명은 지구전복순환(GOC) 속도에 의해 조절되는 것으로 보인다.이 관계는 내화 DOC(내화 패널)[100]의 생산 속도가 일정하다고 가정할 때 GOC의 속도가 느려지면 내화 DOC의 저장 용기 크기가 증가할 수 있음을 나타냅니다.
유출 DOC 농도가 유입보다 낮은 고온 열수능선 플랭크에서 DOC 열화가 발견되었습니다.이러한 프로세스가 전 세계적으로 미치는 영향은 조사되지 않았지만, 현재 데이터에 따르면 마이너 DOC [93]싱크인 것으로 나타납니다.비생물학적 DOC 응집 현상은 담수와 바닷물이 [101]혼합될 때 염도의 급격한 변화(분) 중에 종종 관찰된다.응집 작용은 부식성 화합물을 제거하고 분자 크기를 줄임으로써 DOC를 침전 및/또는 필터 피더에 의해 소비될 수 있는 미립자 유기 응집체로 변화시키지만 응집된 [102]DOC의 세균 분해를 촉진하기도 한다.응집 작용이 연안 해역에서 DOC 제거에 미치는 영향은 매우 다양하며, 일부 연구에서는 DOC [103][104]풀의 최대 30%를 제거할 수 있는 반면 다른 연구에서는 훨씬 낮은 값(3-6%;)[105]을 발견했다.이러한 차이는 DOC 화학 성분, pH, 금속 양이온 농도, 미생물 반응성 및 이온 [101][106][7]강도의 계절 및 시스템 차이로 설명될 수 있습니다.
CDOM
DOC(Colored fraction)의 유색분율(CDOM)은 파란색과 UV-라이트 범위의 빛을 흡수하기 때문에 플랑크톤 생산성에 부정적인 영향을 미칩니다. 그렇지 않으면 광합성에 사용할 수 있고 해로운 [107][108]UV-라이트로부터 플랑크톤 유기체를 보호함으로써 플랑크톤 생산성에 부정적인 영향을 미칩니다.그러나 자외선의 피해와 복구능력은 매우 다양하기 때문에 자외선의 변화가 플랑크톤 [109][110]군집 전체에 어떤 영향을 미칠지에 대해서는 공감대가 형성되어 있지 않다.빛의 CDOM 흡수는 영양소에 영향을 주고 금속 및 DOC 화학 조성에 영향을 미치며 DOC [97]열화를 촉진할 수 있는 복잡한 범위의 광화학 과정을 시작합니다.
광열화
광분해는 CDOM을 더 작고 덜 착색된 분자(예: 유기산) 또는 무기 탄소(CO, CO2) 및 영양소 소금(NH4−, HPO2−
4)[111][96][112]으로 변환하는 것을 포함한다.따라서, 일반적으로 광분해는 완고한 저항제를 바이오매스 생산과 호흡을 위해 원핵생물이 빠르게 사용할 수 있는 유연한 DOC 분자로 변환한다는 것을 의미한다.하지만, 그것은 또한 트리글리세리드 같은 화합물을 미생물에 의해 덜 분해되는 더 복잡한 방향족 [113][114]화합물로 변환함으로써 CFOM을 증가시킬 수 있다.게다가, 자외선은 [115]예를 들어 미생물에 해로운 활성산소종을 생산할 수 있다.광화학 과정이 DOC 풀에 미치는 영향도 화학 [116]조성에 따라 달라지는데, 일부 연구는 최근에 생성된 자동 톤 DOC가 생물학적 가용성이 떨어지는 반면, 다른 연구는 그 반대가 [117][118][119]발견되었지만, 동종 톤 DOC가 햇빛 노출 후 원핵 생물에게 더 생물학적 가용성이 높아진다는 것을 시사한다.광화학 반응은 지상 유도 CMOM의 높은 부하를 받는 연안 해역에서 특히 중요하며, 지상 DOC의 약 20~30%가 빠르게 광분해 [120]및 소비된다.또한 해양 시스템에서 DOC의 광분해는 무기 탄소를 최대 180Tg C yr–1 생성하며, DOC의 추가 100Tg C yr–1은 [96][121]미생물 분해에 더 유용하게 사용된다.전지구 해양 추정의 또 다른 시도에서는 광분해(210 Tg C yr–1)가 하천 DOC의 연간 글로벌 입력(250 Tg C yr–1;)[122]과 거의 동일하며, 다른 시도에서는 직접 광분해가 하천 DOC [123][124][7]입력을 초과한다고 제안한다.
반항적인 DOC
DOC는 개념적으로 이종영양 미생물에 의해 빠르게 흡수되는 불안정한 DOC와 바다에 축적된 완고한 DOC 저장소로 나뉜다(Hansell의 [24]정의에 따름).그 저항성의 결과로 축적된 DOC는 지표수에서 1,000년에서 4,000년,[125] 심해에서 3,000년에서 6000년 사이의 평균 방사성 탄소 연령에 도달하며,[126] 이는 각각 300년에서 1,400년 사이의 여러 심해 혼합 주기를 통해 지속됨을 나타낸다.이러한 평균 방사성 탄소 연령 뒤에는 다양한 연령대가 숨겨져 있다.폴렛 등은 DOC가 현대 방사성 탄소 연령의 극히 일부이며, 최대 [127][61]12,000년의 방사성 탄소 연령에 이르는 DOC도 포함되어 있다고 밝혔다.
분배
1990년대 후반에 개발된 보다 정밀한 측정 기술은 용해된 유기 탄소가 해양 환경에서 수직 및 [128]표면 전체에 어떻게 분포되는지를 잘 이해할 수 있게 해 주었다.바다에 용해된 유기 탄소는 매우 연약한 것에서부터 매우 반항적인 것까지 범위에 걸쳐 있다는 것이 이제 이해되고 있다.불안정한 용해성 유기 탄소는 주로 해양 생물에 의해 생성되고 표면 바다에서 소비되며, 해양 [129]박테리아에 의해 쉽게 사용되는 당, 단백질, 그리고 다른 화합물들로 구성되어 있다.고분자성 용존유기탄소는 물기둥 전체에 고르게 분포되어 있으며 리그닌, 꽃가루, 후민산 등 해양생물이 사용하기 어려운 구조적으로 복잡한 화합물로 구성되어 있다.그 결과, 관찰된 수직 분포는 상층수기둥의 고농도와 [130]저농도로 구성되어 있다.
- 해양 DOC의 명백한 저항성을 제어하는 환경 프로세스점은 DOC 분자를 나타내고 화살표는 DOC 농도와 분자 구성에 영향을 미치는 물리화학적 및 생물학적 프로세스를 나타냅니다.해수면에서는 1차 생산에서 유래한 DOC가 미생물 분해(검은 화살표), 광화학 분해(노란색 화살표), 입자 교환(녹색 화살표)을 통해 빠르게 재메네랄화되거나 변형된다.불안정한 구성요소는 물기둥 아래로 제거되고 DOC는 입자 교환(갈색 화살표), 침전물 용해(회색 화살표), 미생물 재작업(흰색 화살표) 등의 프로세스에 의해 희석됩니다. 이러한 프로세스는 벌크 DOC 풀에서 분자를 계속 변경, 추가 및/또는 제거합니다.따라서 해양 내부에서의 DOC의 명백한 저항은 주로 환경적 [78]맥락에 의해 제어되는 신생 특성이다.
수직 분포뿐만 아니라 수평 분포도 모델링 및 샘플링되었습니다.[131]수심 30m의 바다 표면에서는 남태평양 환류, 남대서양 환류, 인도양에서 고농도의 유기탄소가 검출된다.수심 3000m의 북대서양심층수에서는 고농도 표면 해양에서 용존된 유기 탄소가 수심까지 제거되는 농도가 가장 농도가 높은 곳은 북대서양심층수이다.북부 인도양에서는 높은 담수 플럭스와 침전물로 인해 높은 DOC가 관찰됩니다.해저 수평운동의 시간 척도가 수천 년이기 때문에, 내화성 용해 유기 탄소는 북대서양에서 천천히 소비되어 북태평양에서 [131]최소치에 도달합니다.
긴급시
용해된 유기물은 수천, 아마도 수백만 개의 유기 화합물로 이루어진 이질적인 풀입니다.이들 화합물은 성분과 농도(PM부터 μM까지)가 다를 뿐만 아니라 다양한 생물(식물 플랑크톤, 동물 플랑크톤, 박테리아)과 환경(지상 식물과 토양, 연안 가장자리 생태계)에서 유래하며 최근 또는 수천 년 전에 생성되었을 수 있다.또한 동일한 소스 및 동일한 연령의 유기 화합물이라도 동일한 [78]DOM 풀 내에 축적되기 전에 다른 처리 이력을 받았을 수 있습니다.
내부 해양 DOM은 햇빛에 노출되고, 이종영양에 의한 이용, 응집과 응고, 입자와의 상호작용을 거쳐 남아있는 고도로 변형된 분율이다.DOM 풀내의 이러한 프로세스의 대부분은, 복합 또는 클래스 고유의 것입니다.예를 들어, 축합 방향족 화합물은 감광성이 [132]높은 반면, 단백질, 탄수화물 및 그 단량체는 박테리아에 [133][134][135]쉽게 흡수된다.미생물 및 기타 소비자는 사용하는 DOM의 유형을 선택할 수 있으며 일반적으로 특정 유기 화합물을 다른 것보다 선호합니다.그 결과 DOM은 지속적으로 재작업되기 때문에 반응성이 낮아집니다.다시 말해, DOM 풀은 열화와 함께 불안정성이 떨어지고 내화성이 높아집니다.재작업 시 소비자 [70][21][136][100]커뮤니티에 의한 물리적 혼합, 입자와의 교환 및/또는 유기 분자의 생산에 의해 유기 화합물이 벌크 DOM 풀에 지속적으로 추가되고 있습니다.따라서 분해 중에 발생하는 조성 변화는 단순히 더 많은 인화성 성분을 제거하고 결과적으로 더 적은 인화성 [78]화합물을 축적하는 것보다 더 복잡하다.
따라서 용해된 유기물 저항성(즉, 분해 및/또는 이용에 대한 전체적인 반응성)은 새로운 특성이다.유기물 분해 중 및 [78]검토 중인 DOM 풀에 유기화합물을 제거하거나 첨가하는 다른 프로세스와 함께 DOM에 대한 인식은 변화한다.
미생물 분해에 대한 고농도의 DOC의 놀라운 저항성은 몇 가지 [137]가설에 의해 다루어졌습니다.일반적으로 DOC의 완강한 분율은 미생물에 의한 분해를 방지하는 특정 화학적 성질을 가지고 있다는 개념이다("내적 안정성 가설")대체 또는 추가 설명은 "희석 가설"에 의해 제시된다. 즉, 모든 화합물은 불안정하지만 미생물 집단을 유지하기에는 개별적으로 너무 낮은 농도로 존재하지만 집합적으로 큰 [138]풀을 형성한다.희석 가설은 최근의 실험 [139][140][61]및 이론 연구에서 지지를 얻고 있다.
DOM 분리 및 분석
DOM은 자연에서 NMR 또는 MS와 직접 분석하기 위해 낮은 농도로 발견되며, 또한 DOM 시료에는 그러한 [141]기법과 호환되지 않는 고농도의 무기염이 함유되어 있는 경우가 많다.따라서 [141][142]시료의 농축 및 분리 단계가 필요하다.가장 많이 사용되는 격리 기술은 여과, 역삼투, 고체상 [143]추출이다.그 중에서 고체상 추출은 가장 저렴하고 쉬운 [142]기술로 여겨진다.
「 」를 참조해 주세요.
레퍼런스
- ^ Roshan, S. 및 DeVries, T. (2017년) "부족한 해양에서 효율적으로 용해된 유기 탄소 생산 및 수출"Nature Communications, 8 (1) : 1~8.doi : 10.1038/s41467-017-02227-3.
- ^ a b "Organic Carbon". Bio-geochemical Methods. Retrieved 27 November 2018.
- ^ Kenny, Jonathan E.; Bida, Morgan; Pagano, Todd (October 2014). "Trends in Levels of Allochthonous Dissolved Organic Carbon in Natural Water: A Review of Potential Mechanisms under a Changing Climate". Water. 6 (10): 2862–2897. doi:10.3390/w6102862.
- ^ Moody, C.S. 및 Worrall, F. (2017) "DOM 조성 및 하이드로 기후 변수를 사용한 DOC 열화 모델링 속도"지구물리학연구저널: 생물지리학, 122(5): 1175–1191. doi: 10.1002/2016JG003493.
- ^ Hedges, John I. (3 December 1991). "Global biogeochemical cycles: progress and problems" (PDF). Marine Chemistry. 39 (1–3): 67–93. doi:10.1016/0304-4203(92)90096-s.
- ^ Kritzberg, Emma S.; Cole, Jonathan J.; Pace, Michael L.; Granéli, Wilhelm; Bade, Darren L. (March 2004). "Autochthonous versus allochthonous carbon sources of bacteria: Results from whole-lake 13C addition experiments" (PDF). Limnology and Oceanography. 49 (2): 588–596. Bibcode:2004LimOc..49..588K. doi:10.4319/lo.2004.49.2.0588. ISSN 0024-3590. S2CID 15021562.
- ^ a b c d e f g h i j k l m n Lönborg, C., Carreira, C., Jickells, T. 및 Alvarez-Salgado, X.A.(2020) "해양용존유기탄소(DOC) 사이클링에 대한 글로벌 변화의 영향"해양과학 분야 프런티어, 7:466.doi:10.3389/fmars.2020.00466.
 자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다.
자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다. - ^ Monroy, P., Herndez-Garcia, E., Rossi, V. 및 Lopez, C.(2017) "해양 흐름에서 생물 입자의 동적 침하를 모델링"지구물리학의 비선형 프로세스, 24(2): 293–305. doi:10.5194/npg-24-293-2017.
 자료는 Creative Commons Attribution 3.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다.
자료는 Creative Commons Attribution 3.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다. - ^ Simon, M., Grossart, H., Schweitzer, B. 및 Floug, H.(2002) "수생 생태계에서 유기 골재의 미생물 생태"수생 미생물 생태, 28:175~211.doi:10.3354/ame028175.
- ^ Kirchman, David L.; Suzuki, Yoshimi; Garside, Christopher; Ducklow, Hugh W. (15 August 1991). "High turnover rates of dissolved organic carbon during a spring phytoplankton bloom". Nature. 352 (6336): 612–614. Bibcode:1991Natur.352..612K. doi:10.1038/352612a0. S2CID 4285758.
- ^ Jaeckle, W.B.; Manahan, D.T. (1989). "Feeding by a "nonfeeding" larva: uptake of dissolved amino acids from seawater by lecithotrophic larvae of the gastropod Haliotis rufescens". Marine Biology. 103: 87–94. doi:10.1007/BF00391067. S2CID 84541307.
- ^ Cheremisinoff, Nicholas; Davletshin, Anton (2015). "Hydraulic Fracturing Operations: Handbook of Environmental Management Practices". Environmental Management. ISBN 9781119099994.
- ^ Elser, Stephen (2014). "Brown Water: The Ecological and Economic Implications of Increased Dissolved Organic Carbon in Lakes".
{{cite journal}}:Cite 저널 요구 사항journal=(도움말) - ^ Wu, Qing; Zhao, Xin-Hua; Wang, Xiao-Dan (2008). "Relationship Between Heterotrophic Bacteria and Some Physical and Chemical Parameters in a Northern City's Drinking Water Distribution Networks of China". 2008 2nd International Conference on Bioinformatics and Biomedical Engineering. pp. 4713–4716. doi:10.1109/ICBBE.2008.336. ISBN 978-1-4244-1747-6. S2CID 24876521.
- ^ "Dissolved Organic Carbon (DOC)".
- ^ Narayana, P.S.; Varalakshmi, D; Pullaiah, T; Sambasiva Rao, K.R.S. (2018). Research Methodology in Zoology. p. 225. ISBN 9789388172400.
- ^ "Whatman glass microfiber filters, Grade GF/F". Merck.
- ^ Knap, A. Michaels; A. Close; A. Ducklow; H. Dickson, A. (1994). Protocols for the Joint Global Ocean Flux studies (JGOFS) core measurements. JGOFS.
- ^ Cauwet G (2002) "해안 지역의 DOM"입력: Hansell D 및 Carlson C(Eds)해양 용해 유기물의 생물 지구 화학, 579-610쪽, 엘세비어.ISBN 9780080500119.
- ^ Travlay, L. and Benner, R. (2006) "부식 식물 잔해에서 N-면역화와 유기물 보존에 대한 미생물적 기여"Geochimica et Cosmochimica Acta, 70 (1): 133~146. doi: 10.1016/j.gca. 2005.08.024.
- ^ a b Jiao, Nianzhi; Herndl, Gerhard J.; Hansell, Dennis A.; Benner, Ronald; Kattner, Gerhard; Wilhelm, Steven W.; Kirchman, David L.; Weinbauer, Markus G.; Luo, Tingwei; Chen, Feng; Azam, Farooq (2010). "Microbial production of recalcitrant dissolved organic matter: long-term carbon storage in the global ocean". Nature Reviews Microbiology. 8 (8): 593–599. doi:10.1038/nrmicro2386. PMID 20601964. S2CID 14616875.
- ^ Lee, S.A., Kim, T.H. 및 Kim, G.(2020) "안정적인 탄소 동위원소를 사용하여 해안만에서 용해된 유기 탄소의 육상 및 해양 공급원을 추적한다."생물 지구과학, 17(1) 도:10.5194/bg-17-135-2020.
 자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다.
자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다. - ^ a b Vahatalo, A. V., H. 및 Mantiniemi, S.(2010).베타 분포에 의해 설명되는 자연 유기물의 생분해성 연속체와 생분해 속도론.생물지구화학 100, 227~240.doi: 10.1007/s10533-010-9419-4
- ^ a b c d Hansell, Dennis A. (2013). "Recalcitrant Dissolved Organic Carbon Fractions". Annual Review of Marine Science. 5: 421–445. doi:10.1146/annurev-marine-120710-100757. PMID 22881353.
- ^ a b 아몬, R. M. W., 베너, R. (1996년).용해된 유기물의 다양한 크기의 세균 이용.림놀.Oceanogr. 41, 41-51.doi: 10.4319/lo.196.41.0041
- ^ 베너, R. 및 아몬, R. M. (2015).바다에 있는 주요 생물 원소의 크기-반응성 연속체.Ann. Mar. Sci. 7, 185–205.doi: 10.1146/anurev-marine-010213-135126
- ^ Thingstad, T. F., Havskum, H., Kaas, H., Nielsen, T. G., 리만, B., Lefevre, D. 등(1999)P 제한 조건에서의 박테리아-프로토스트 상호작용 및 유기물 분해: 간단한 모델을 이용한 인클로저 실험 분석.림놀.Oceanogr. 44, 62~79.doi: 10.4319/lo.199.44.1.0062
- ^ 델 지오르지오, P. 및 데이비스, J. (2003)수생 생태계의 "수생 생태계에 걸친 용해된 유기물 능력 및 소비 패턴":용해된 유기물의 상호작용, Eds S. E. Findlay 및 R. L. Shinsabaugh (샌디에이고, CA: 아카데미 프레스), 399-424.doi: 10.1016/B978-012256371-3/50018-4.
- ^ 비앙치, T.S. (2011년)연안 해양에서 육상에서 유래한 유기 탄소의 역할: 패러다임의 변화와 프라이밍 효과.검사님, Natl.Acad. Sci. U.S.A. 108, 19473~19481.doi: 10.1073/pnas.1017982108
- ^ 캐트너, G., 사이먼, M. 및 코흐, B.P.(2011).해양의 미생물 탄소 펌프에서 "용존 유기물의 분자 특성 및 원핵생물 이용 제약"은 eds N. Jiao, F. Azam 및 S.이다.샌서스(워싱턴 DC: 사이언스/AAAS).
- ^ Keil, R. G., Mayer, L. M. (2014).지구화학에 관한 논문의 "미네랄 매트릭스와 유기물" 제2편, eds H. Holland 및 K.투레키안(Oxford:엘세비어), 337-359.doi: 10.1016/B978-08-095975-7.01024-X
- ^ Biancchi, T.S., Cui, X., Blair, N.E., Burdige, D.J., Eglinton, T.I. 및 Galy, V.(2018).육지-해양 경계면의 유기 탄소 매장 및 산화 센터.조직. 지구화학. 115, 138~155.doi: 10.1016/j.orggechem. 2017.09.008
- ^ Ward, N. D., Keil, R. G., Mediros, P. M., Brito, D. C., C., Cunha, A. C., Dittmar, T. 등(2013).아마존 강에서 지상유래 고분자의 분해.Nat. Geosci. 6, 530-533.doi: 10.1038/ngeo1817
- ^ Myers-Pigg, A. N., Louchouarn, P., Amon, R. M. W., Prokushkin, A., Pierce, K. 및 Rubtsov, A. (2015).시베리아 북극의 주요 하천에서 불안정한 발열성 유기 탄소가 용해되어 산불의 신진대사 연결에 영향을 미칩니다.지구 물리학.Res. Let. 42, 377–385.doi:2014.1002/GL062762
- ^ a b c Gmach, M.R., Cherubin, M.R., Kaiser, K. 및 Cerri, C.E.P.(2020) "토양의 용해된 유기물에 영향을 미치는 프로세스: 리뷰"Scientia Agricola, 77(3).doi:10.1590/1678-992x-2018-0164.
 자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다.
자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다. - ^ a b Shen, Y., Chapelle, F.H., Strom, E.W. 및 Benner, R. (2015) "지하수에 용해된 유기물의 기원과 생물학적 가용성"생물지구화학, 122(1): 61-78.도이:10.1038/s41467-019-11394-4.
 자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다.
자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다. - ^ a b Reitsema, R.E., Meire, P. and Schoelynck, J. (2018) "변화하는 세상에서 담수 대식물의 미래: 용해된 유기 탄소량과 품질 그리고 대식물과 그것의 상호작용"식물과학 분야 프런티어, 9:629.doi:10.3389/fpls.2018.00629.
 자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다.
자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다. - ^ a b 토마스, J. D. (1997년)담수 생태계에서 용해된 유기물, 특히 유리 아미노산과 부식물질의 역할.신선하다.Biol. 38, 1~36.doi: 10.1046/j.1365-2427.197.00206.x
- ^ Cole, J. J., Prearie, Y. T., Caraco, N. F., McDowell, W. H., Tranvik, L. J., Striegl, R. G. 등(2007).전 세계 탄소 순환 배관: 내수를 지상 탄소 예산에 통합합니다.에코시스템 10, 172~185.doi: 10.1007/s10021-006-9013-8
- ^ Raymond, P. A., Hartmann, J., Lauerwald, R., Sobek, S., McDonald, C., Hoover, M. 등(2013).내해에서 배출되는 전지구 이산화탄소.네이처 503, 355–359.도이: 10.1038/네이처 12760
- ^ 칼비츠, K., 솔린저, S., 파크, J.H.;미할직, B; 매츠너, E. 2000토양에서 용해된 유기물의 역학에 대한 통제: 재검토.토양과학 165: 277–304.
- ^ 제크, 노스캐롤라이나주 세네시, 조지아주 구겐버거, 카이저, 케이저, 레만, 티엠주 미아노, 밀트너, 조지아주 슈로트열대지방의 토양 유기물의 부식 및 광물화를 제어하는 요인.지오더마 79: 117~161.
- ^ a b A.R. 사이디, R.J. 스머닉, J.A. 발독, K. 카이저, K., 샌더맨, J. 2015.수산화철 코팅 유무에 관계없이 필로규산염에 흡착된 유기탄소의 미생물 분해.유럽 토양 과학 저널 66: 83~94.
- ^ Kaiser, K.; Guggenberger, G. 2007.미세공공성 괴사이트에 의한 유기물의 흡착 안정화: 작은 구멍으로의 흡착 대 표면 복합화.유럽 토양 과학 저널 58: 45-59.
- ^ a b 버지니아 주, 버지니아 주, 고인 주, 모타발리 주, 우다와타 주, 2009년인접한 3개 농업 유역의 쌍수 연구에서 유출 및 용해된 유기 탄소 손실.농업, 생태계 및 환경 130: 115~122.
- ^ 스파링, G.; Chibnall, E.; Pronger, J.; Rutledge, S.; Wall, A.; Campbell, D.; Schipper, L. 2016.뉴질랜드 와이카토의 젖소가 방목한 알로파닉 토양에서 녹은 유기 탄소의 연간 침출 손실 추정치.뉴질랜드 농업 연구 저널 59: 32-49.
- ^ Sobek, S., Tranvik, Y. T. 프레리, Kortelainen, P. 및 Cole, J. J.(2007)용해된 유기 탄소의 패턴과 규제: 널리 분포된 7,500개의 호수를 분석합니다.림놀.오션오그.52, 1208~1219.doi: 10.4319/lo.2007.52.3.1208
- ^ W. Stumm과 J. Morgan(1996년).수생화학:자연수에서의 화학적 균형과 비율.환경과학 및 기술.뉴욕: John Wiley & Sons, Inc.
- ^ Madsen, T. V. 및 Sand-Jensen, K. (1991)수생 대식물의 광합성 탄소 동화아쿠아트. Bot. 41, 5-40.도이: 10.1016/0304-3770(91)90037-6
- ^ Regnier, P., Friedlingstein, P., Ciais, P., 맥켄지, F.T., 그루버, N., 얀센스, I.A. 등(2013).육지에서 바다로 가는 탄소 플럭스의 인위적인 섭동.Nat. Geosci. 6, 597–607.doi: 10.1038/ngeo1830
- ^ Luysaert, S., Abril, G., Andres, R., Bastviken, D., Bellassen, V., Bergamaschi, P. 등(2012).2001년부터 2005년까지 유럽 육지와 내수의 CO2, CO, CH4 및 NO2 균형.생물지리학 9, 3357-3380.도이: 10.5194/bg-9-3357-2012
- ^ a b N. 가와사키와 R. 베너(2006).세포의 성장과 감소 동안 용해된 유기물의 박테리아 방출: 분자 기원과 구성.림놀.Oceanogr. 51, 2170–2180.doi: 10.4319/lo.2006.51.5.170
- ^ 뢴보리, C., 알바레스 살가도, X. A., 데이비드슨, K. 및 밀러, A. E. J.(2009).연안 이종영양 미생물 집단에 의한 생체 가용 및 내화성 용해 유기물 생산.하구Coast. Shelf Sc. 82, 682–688.doi: 10.1016/j.ecss. 2009.02.026
- ^ S. 와다, M.N. 아오키, Y. 쓰치야, T. 사토, H. 시나가와, T. 하마(2007)일본 이즈 반도 시모다 시 오우라 만의 에클로니아 카바 젤만에서 방출된 용존 유기물의 정량적 정성적 분석.J. Exp. Mar. Biol.Ecol.394, 344–358.doi: 10.1016/j.jembe.2007.05.024
- ^ 윌리, J. D., 키버, R. J., 아이먼, M. S. 주니어 및 브룩스 에이버리, G. (2000).빗물은 유기 탄소 농도와 전지구 플럭스를 용해시켰다.지구본. 생물 지구 화학.사이클 14, 139~148.doi: 10.1029/1999GB900036
- ^ a b 레이먼드, P. A., 스펜서, R. G. M. (2015).해양용해유기물생물지구화학의 "리버라인 DOM.A. 한셀과 C.A. 칼슨 (암스테르담:엘세비어), 509-533.doi: 10.1016/B978-0-12-405940-5.00011-X
- ^ Dachs, J. 및 Méjanelle, L.(2010).연안 해역, 퇴적물, 생물군의 유기 오염 물질: 인류세 동안 생태계의 관련 요인?하구 해안 33, 1~14.도이: 10.1007/s12237-009-9255-8
- ^ Hansell, Dennis; Carlson, Craig; Repeta, Daniel; Schlitzer, Reiner (2009). "Dissolved Organic Matter in the Ocean: A Controversy Stimulates New Insights". Oceanography. 22 (4): 202–211. doi:10.5670/oceanog.2009.109. hdl:1912/3183. S2CID 129511530.
- ^ a b c d Carlson, Craig A.; Hansell, Dennis A. (2015). "DOM Sources, Sinks, Reactivity, and Budgets". Biogeochemistry of Marine Dissolved Organic Matter. pp. 65–126. doi:10.1016/B978-0-12-405940-5.00003-0. ISBN 9780124059405.
- ^ Zigah, Prosper K.; McNichol, Ann P.; Xu, Li; Johnson, Carl; Santinelli, Chiara; Karl, David M.; Repeta, Daniel J. (2017). "Allochthonous sources and dynamic cycling of ocean dissolved organic carbon revealed by carbon isotopes". Geophysical Research Letters. 44 (5): 2407–2415. Bibcode:2017GeoRL..44.2407Z. doi:10.1002/2016GL071348. hdl:1912/8912. S2CID 55057882.
- ^ a b c Mentges A.;Feenders, C;도이치, C;블라시우스, B, 디트 마를, T.(2019년)."해양 용존 유기 탄소의 장기 안정성 화합물과 미생물을 중립적인 네트워크로부터 출발한 것".과학 보고서. 9(1):17780.Bibcode:2019NatSR...917780M.doi:10.1038/s41598-019-54290-z.PMC 6883037.PMID 31780725.재료는 창조적 공용 귀인 4.0국제 라이센스 하에 가능하다 이 원본에서 복사되었다.
- ^ 칼, D. M., 헤벨, D. V., 비요크만, K. 및 레틀리에, R. M. (1998).극소영양 북태평양의 생산성에 대한 용해된 유기물 방출의 역할.림놀.오션오그.43, 1270~1286.doi: 10.4319/lo.198.43.6.1270
- ^ Wetz, M. S. 및 Wheeler, P. A. (2007)해안 규제에 의한 용해된 유기물의 방출.림놀.오션오그.52, 798~807.doi: 10.4319/lo.2.0798
- ^ 손턴, D.C.O. (2014년)현재와 미래의 바다에서 식물성 플랑크톤에 의해 방출되는 용해 유기물(DOM).Euro. J. Phycol. 49, 20~46.doi: 10.1080/09670262.2013.875596
- ^ 보켈, W. H. M. V., 한센, F. C., 리그만, R. P. M.(1992)봄꽃의 용해에 의한 감소와 미생물 먹이사슬과의 결합.마르 에콜Prog. Ser. 81, 269~276.doi: 10.3354/meps081269
- ^ a b Hygum, B. H., Petersen, J. W. 및 Söndergoard, M. (1997).동물성 플랑크톤 방목 활동에 의해 방출되는 용해된 유기 탄소 - 박테리아를 위한 고품질 기질 풀.J. 플랑크톤 레퍼런스 19, 97–111. doi: 10.1093/플랑크트/19.1.97
- ^ 램퍼트, W. (1978)동물성 플랑크톤을 방목함으로써 용해된 유기 탄소를 방출한다.림놀.Oceanogr. 23, 831-834.doi: 10.4319/lo.1978.23.4.0831
- ^ 주마르스, P. A., 펜리, D. L., 바로스, J. A. 및 페리, M. J. (1989)미생물 루프 폐쇄: 동물의 불완전 섭취, 소화 및 흡수로 인해 이종 영양 박테리아로 가는 용해된 탄소 경로.심해 해상도 36, 483–495.doi: 10.1016/0198-0149(89)90001-0
- ^ 이투리아가, R.와 졸나이, A.(1981년.자연 이종 영양 집단에 의한 일부 용해 유기 화합물의 변형.마르 비올62, 125~129.doi: 10.1007/BF00388174
- ^ a b Ogawa, H.; Amagai, Y.; Koike, I.; Kaiser, K.; Benner, R. (2001). "Production of refractory dissolved organic matter by bacteria". Science. 292 (5518): 917–920. doi:10.1126/science.1057627. PMID 11340202. S2CID 36359472.
- ^ 매카시, M., 프라툼, T., 헤지스, J. 및 베너, R.(1997).바다에 용해된 유기 질소의 화학적 조성.네이처 390, 150~154.doi: 10.1038/36535
- ^ 서틀, C. A. (2005)바다에 있는 바이러스.네이처 437, 356–361.doi: 10.1038/nature04160
- ^ 와인바우어, M. A. G. (2004)원핵 바이러스의 생태.FEMS 미생물개정판 28, 127~181.doi: 10.1016/j.femsre.2003.08.001
- ^ Lönborg, C., Middelboe, M. 및 Brussaard, C. P. D.(2013).마이크로모나스 푸실라의 바이러스 용해: 용해된 유기물 생성 및 조성에 미치는 영향.생물지구화학 116, 231~240.doi: 10.1007/s10533-013-9853-1
- ^ Hansell DA와 Craig AC(2015) "해양용해유기물과 탄소순환"해양학, 14(4): 41~49.doi:10.5670/oceanog.2001.05.
 자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다.
자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다. - ^ Krabberød, AK; Bjorbækmo, MFM; Shalchian-Tabrizi, K.; Logares, R. (2017). "Exploring the oceanic microeukaryotic interactome with metaomics approaches". Aquatic Microbial Ecology. 79: 1–12. doi:10.3354/ame01811.
 자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다.
자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다. - ^ Delong, Edward F.; Karl, David M. (2005). "Genomic perspectives in microbial oceanography". Nature. 437 (7057): 336–342. doi:10.1038/nature04157. PMID 16163343. S2CID 4400950.
- ^ a b c d e 바그너, S., 슈보츠, F., 카이저, K., 홀만, C., 와스카, H., 로셀, 체육, 한스만, R. 엘버트, M., 미드델부르크, J.J. 엥겔, A. 및 블랫만.해양과학의 국경, 7:341.doi:10.3389/fmars.2020.00341.
 자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다.
자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다. - ^ 브릴린스키, M. (1977년)일부 해양 대식물에 의해 용해된 유기물이 방출된다.3월 Biol. 39, 213–220.doi: 10.1007/BF00390995
- ^ 버그널, A. M. (1983)하구조간대식세포증식세포로부터의 용존유기탄소의 방출.3월 비올 73, 37~42.도이: 10.1007/BF00396283
- ^ 펜실베이니아주 펜헤일과 버지니아주 스미스(1977년).장어풀(조스테라 마리나)과 그 착생식물에 의한 용존 유기탄소 배출.림놀.Oceanogr. 22, 400–407.doi: 10.4319/lo.1977.22.3.0400
- ^ a b Barron, C. 및 Duarte, C. M. (2015년)용해된 유기 탄소 풀과 연안 해양으로부터의 수출.지구본. 생물 지구 화학.사이클 29, 1725~1738.doi: 10.1002/2014GB005056
- ^ 마틴, P., 체루쿠루, 노스, 탄, 미국, 산울라니, 노스, 무자히드, A. 및 뮐러, M.(2018) "이탄지대가 흐르는 강과 보르네오, 생물과학의 해안 수역에서의 토종 용존 유기탄소 유통과 순환" (682년)
 자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다.
자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다. - ^ Hewson, I., O'neil, J. M., Fuhrman, J. A. 및 Dennison, W. C.(2001)두 아열대 하구의 부영양화 구배를 따라 퇴적물과 수면 위에 있는 바이러스와 같은 입자의 분포와 풍부함.림놀.오션오그.46, 1734~1746.doi: 10.4319/lo.2001.46.7.1734
- ^ Burdige, D. J. 및 Gardner, K. G.(1998).해양 퇴적물 기공 수역에서 용해된 유기 탄소의 분자량 분포.3월 62, 45~64일 도이: 10.1016/S0304-4203(98)00035-8
- ^ D.J. 버디지, T. 코마다(2014).해양용존유기물 생물지구화학의 "침전공물"은 eds D.A. 한센과 C.A. Carlson (Cambridge, MA: Academic Press), 535-577.doi: 10.1016/B978-0-12-405940-5.00012-1
- ^ 코마다, T., 레이머즈, C.E.(2001)하천-해양 전환에서 고체와 용액 단계 사이의 유기 탄소의 재유발 분할.3월 76일 155–174.doi: 10.1016/S0304-4203(01)00055-X
- ^ T. 디트마 및 B. P. 코흐(2006).심해에서 녹는 열 발생성 유기물.3월 화학 102, 208~217.doi: 10.1016/j.marchem.2006.04.003
- ^ Dittmar, T. 및 Paeng, J.(2009).해양 용존 유기물 중 열에 의해 유발되는 분자 특징입니다.Nat. Geosci. 2, 175~179.doi: 10.1038/ngeo440
- ^ Burnett, W. C., Aggarwal, P. K., A., Bokuniewicz, H., Cable, J. E., Charette, M. A. 등(2006).여러 가지 방법을 통해 연안 지역의 해저 지하수 방류량 정량화.Sci. Total Environment.367, 498-543.doi: 10.1016/j.scitotenv.2006.05.009
- ^ K. 롱네커 및 E.B. 쿠자윈스키(2011).지하수에 용해된 유기물의 조성.거침.코스모킴.Acta 75, 2752~2761.doi: 10.1016/j.gca.2011.02.020
- ^ Webb, J.R., Santos, I.R., Maher, D.T., Tait, D.R., Cyronak, T., 사다트누리, M. 등(2019년)해안 수역에 대한 용해된 유기물의 공급원으로서의 지하수: 12개의 얕은 해안 시스템의 라돈과 CFOM 관측에서 얻은 통찰력.림놀.오션오그.64, 182–194.doi: 10.1002/lno.11028
- ^ a b Lang, S. Q., D. A., Lilley, M. D., Paul Johnson, H. 및 Hedges, J. I. (2006)용존 유기 탄소는 용존 축과 용융 플랭크 열수 시스템에 있습니다.거침.코스모킴.Acta 70, 3830–3842.doi: 10.1016/j.gca.2006.04.031
- ^ Kerner, M., Hohenberg, H., Ertl, S., Recermann, M. 및 Spitzy, A.(2003).강물에 녹아있는 유기물 토미셀과 같은 미립자를 자가 조직화.Nature 422, 150~154.doi: 10.1038/nature01469
- ^ W.C. 친, M. V. 오렐라나 및 P. 버듀고(1998).해양용해 유기물을 폴리머겔에 자발적으로 조립하는 것.네이처 391, 568~572.doi: 10.1038/35345
- ^ a b c Moran, M. A. 및 Zepp, R. G.(1997).용해된 유기물로부터 생물학적으로 취약한 화합물을 형성할 때 광반응의 역할.림놀.오션오그.42, 1307~1316.doi: 10.4319/lo.1997.42.6.1307
- ^ a b Mopper, K., Kiber, D. J. 및 Stubbins, A. (2015).해양용해유기물생물지구화학의 "유기물 해양광화학" eds C.A. 칼슨과 D.A. Hansell (암스테르담:엘세비어), 389~450.doi: 10.1016/B978-0-12-405940-5.00008-X
- ^ 뢴보르그, C. 및 알바레스 살가도, X. A.(2012).연안 해양에서 바이오 가용 용존 유기물의 재활용 대 수출 및 대륙붕 펌프의 효율성.지구본. 생물 지구 화학.사이클 26:GB3018.doi: 10.1029/2012 GB004353
- ^ C. A. 칼슨 및 D. A. 한셀(2015).해양용존유기물 생물지구화학, eds C.의 "DOM 소스, 싱크, 반응성 및 예산"A. 칼슨과 D.A. Hansell (샌디에이고, 캘리포니아: 아카데미 프레스), 65~126.doi: 10.1016/B978-0-12-405940-5.00003-0
- ^ a b Shen, Yuan; Benner, Ronald (2018). "Mixing it up in the ocean carbon cycle and the removal of refractory dissolved organic carbon". Scientific Reports. 8 (1): 2542. doi:10.1038/s41598-018-20857-5. PMC 5803198. PMID 29416076.
 자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다.
자료는 Creative Commons Attribution 4.0 International License에 따라 제공되는 이 소스로부터 복사되었습니다. - ^ a b 숄코비츠, E. R. (1976년)하천수와 바닷물이 혼합되는 동안 용해된 유기물과 무기물의 응집.거침.코스모킴.Acta 40, 831-845.doi: 10.1016/0016-7037(76)90035-1
- ^ L. J. 트란빅과 J. M. 시버스(1989년).응집된 부식물질이 유리하고 부착된 원양 미생물에 미치는 영향.림놀.Oceanogr. 34, 688–699.doi: 10.4319/lo.1989.34.4.0688
- ^ 멀홀랜드, P. J. (1981)남동쪽 늪지류에서 발생하는 미립자 유기탄소 생성림놀.오션오그.26, 790~795.doi: 10.4319/lo.26.4.0790
- ^ 파월, R. T., 랜딩, W. M., 바우어, J. E. (1996년).미국 남동부 하구에 있는 콜로이드 미량 금속, 유기 탄소, 질소.3월 55일 165~176일 도이: 10.1016/S0304-4203(96)00054-0
- ^ 숄코비츠, E.R., 보일, E.A., 프라이스, N.B.(1978년).하구 혼합 시 용해된 후민산과 철분 제거.어스 플래닛제40장, 130~136장 도이: 10.1016/0012-821X(78)90082-1
- ^ Volk, C., Bell, K., Ibrahim, E., Verges, D., Amy, G. 및 Lechevallier, M. (2000).음용수 내 유기물 및 그 생분해성 분율 제거에 대한 강화되고 최적화된 응고의 영향.물 번호 34, 3247–3257.doi: 10.1016/S0043-1354(00)00033-6
- ^ 윌리엄슨, C.E., 스템버거, R.S., 모리스, D.P., 프로스트, T.A. 및 폴슨, S.G. (1996년)북미 호수의 자외선 방사선: DOC 측정의 감쇠 추정치 및 플랑크톤 군집의 영향.림놀.Oceanogr. 41, 1024–1034.doi: 10.4319/lo.196.41.5.1024
- ^ 윌리엄슨, C. E., Overholt, E. P., Pilla, R. M., Leach, T. H., Brentrup, J. A., Koll, L. B. 등 (2015년)호수에서 장기간 갈색이 된 생태학적 결과.Sci. Rep. 5:1866. doi:10.1038/srep186666
- ^ Jeffrey, W. H., Aas, P., Lyons, M. M., Coup, R. B., 플레저, R. J. 및 Mitchell, D. L. (1996년)해양 박테리오플랑크톤의 주변 태양 방사선에 의한 광손상.광화학.포토바이올.64, 419~427.doi: 10.11/j.1751-1097.196.tb03086.x
- ^ 로드, S. C., 폴로프스키, M. 및 톨리안, R. (2001)다프니아속 동물성 플랑크톤의 수직 분포에 대한 자외선의 영향.네이처 412, 69~72.doi: 10.1038/35083567
- ^ W. L. 밀러와 R. G.(1995).육지 유기물로부터 용존 무기 탄소를 광화학적으로 생산하는 것: 해양 유기 탄소 순환의 의의.지구 물리학.Res. 22, 417–420.doi: 10.1029/94GL03344
- ^ Moran, M. A., Sheldon, W. M. 및 Zepp, R. G. (2000).탄소 손실 및 광학 특성은 에추아린 용해 유기물의 장기적인 광화학 및 생물학적 분해 중에 변화한다.림놀.Oceanogr. 45, 1254–1264.doi: 10.4319/lo.2000.45.6.1254
- ^ 키버, R. J., 하이드로, L. H. 및 시튼, P. J.(1997).바닷물 속 트리글리세리드 및 지방산의 광산화: 해양 부식물질 형성에 미치는 영향.림놀.오션오그.42, 1454~1462.doi: 10.4319/lo.197.42.6.1454
- ^ Berto, S., Laurentiis, E. D., Tota, T., Chiavazza, E., Danielle, P. G., Minella, M. 등 (2016년)L-티로신의 광변환에 의해 발생하는 부식물질의 특성.Sci. Total Environment. 546, 434~444.doi: 10.1016/j.scitotenv.2015.12.047
- ^ 허드슨, J. J., 딜런, P. J. 및 K. M. 소머즈(2003).한대호에서 용해된 유기 탄소의 장기 패턴: 입사 방사선, 강수량, 대기 온도, 남쪽 진동 및 산 퇴적물의 역할.하이드롤어스 시스템7, 390-398.도이: 10.5194/hes-7-390-2003
- ^ Benner, R., B., Kaiser, K. 및 Amon, R. M. W. (2004)하천에서 북극해로의 젊은 토종 용해 유기 탄소 수출.지구 물리학.Res. Let. 31:L05305.doi:10.1029/2003GL019251
- ^ Obernosterer, I.와 Herndl, G. J.(1995).식물성 플랑크톤 세포외 방출 및 세균 성장: 무기 N:P 비율에 의존합니다.마르 에콜Prog. Ser. 116, 247~257.doi: 10.3354/meps116247
- ^ 베너, R. 및 지글러, S.(1999년).제8회 미생물생태학 심포지엄 속보에서 "용존 유기물의 광화학 변환은 생물반응성 기질뿐만 아니라 생물반응성 기질을 생성합니까?", eds C. R. Bell, M. Brylinsky, P.Johnson-Green(TX, Port Aransas: 텍사스 대학교 오스틴).
- ^ Sulzberger, B. 및 Durish-Kaiser, E.(2009).용존유기물질의 화학적 특성(DOM): DOM 흡수특성 및 생체이용가능성의 자외선에 의한 변화를 이해하기 위한 전제조건.Aquat. Sci. 71, 104~126.doi: 10.1007/s00027-008-8082-5
- ^ W. L. 밀러와 Moran, M. A.(1997).연안 해양 환경에서 내화성 용존 유기물을 분해할 때 광화학 및 미생물 과정의 상호작용.림놀.오션오그.42, 1317~1324.doi: 10.4319/lo.197.42.6.1317
- ^ Stubbins, A., Uher, G., Law, C. S., Mopper, K., Robinson, C. 및 Upstill-Goddard, R. C.(2006).개방 해양 일산화탄소 광생성.Deep Sea Resence.II 상단Stud. Oceanogr. 53, 1695–1705.doi: 10.1016/j.dsr2.2006.05.011
- ^ W. L. 밀러, Moran, M. A., Sheldon, Zepp, R. G. 및 Opshal, S. (2002)생물학적 연성 광생성물의 형성을 위한 겉보기 양자 수율 스펙트럼의 결정.림놀.오션오그.47, 343-352.doi: 10.4319/lo.2.0343
- ^ 앤드류스, S. 및 자피리우, O. C. (2000).바닷물에서의 광화학 산소 소비: 착색 용해 유기물의 주요 오염수?림놀.Oceanogr. 45, 267~277.doi: 10.4319/lo.2000.45.2.0267
- ^ Wang, X.-C., Chen, R.F. 및 Gardner, G.B.(2004).미시시피강 하구 및 멕시코만 북부 연안 해역의 용해 및 미립자 유기 탄소의 공급원 및 수송.3월 화학 89, 241~256.doi: 10.1016/j.marchem.2004.02.014
- ^ Walker, Brett D.; Beaupré, Steven R.; Guilderson, Thomas P.; McCarthy, Matthew D.; Druffel, Ellen R. M. (2016). "Pacific carbon cycling constrained by organic matter size, age and composition relationships". Nature Geoscience. 9 (12): 888–891. Bibcode:2016NatGe...9..888W. doi:10.1038/ngeo2830.
- ^ Khatiwala, S.; Primeau, F.; Holzer, M. (2012). "Ventilation of the deep ocean constrained with tracer observations and implications for radiocarbon estimates of ideal mean age". Earth and Planetary Science Letters. 325–326: 116–125. Bibcode:2012E&PSL.325..116K. doi:10.1016/j.epsl.2012.01.038.
- ^ Follett, Christopher L.; Repeta, Daniel J.; Rothman, Daniel H.; Xu, Li; Santinelli, Chiara (2014). "Hidden cycle of dissolved organic carbon in the deep ocean". Proceedings of the National Academy of Sciences. 111 (47): 16706–16711. Bibcode:2014PNAS..11116706F. doi:10.1073/pnas.1407445111. PMC 4250131. PMID 25385632.
- ^ Sharp, Jonathan H. (6 August 1996). "Marine dissolved organic carbon: Are the older values correct?". Marine Chemistry. 56 (3–4): 265–277. doi:10.1016/S0304-4203(96)00075-8.
- ^ Sondergaard, Morten; Mathias Middelboe (9 March 1995). "A cross-system analysis of labile dissolved organic carbon" (PDF). Marine Ecology Progress Series. 118: 283–294. Bibcode:1995MEPS..118..283S. doi:10.3354/meps118283.
- ^ Gruber, David F.; Jean-Paul Simjouw; Sybil P. Seitzinger; Gary L. Taghon (June 2006). "Dynamics and Characterization of Refractory Dissolved Organic Matter Produced by a Pure Bacterial Culture in an Experimental Predator-Prey System". Applied and Environmental Microbiology. 72 (6): 4184–4191. doi:10.1128/AEM.02882-05. PMC 1489638. PMID 16751530.
- ^ a b Hansell, Dennis A.; Craig A. Carlson; Daniel J. Repeta; Reiner Schlitzer (2009). "Dissolved Organic Matter in the Ocean: A Controversy Stimulates New Insights". Oceanography. 22 (4): 202–211. doi:10.5670/oceanog.2009.109. hdl:1912/3183.
- ^ Stubbins, A., Niggemann, J. 및 Dittmar, T.(2012).심해 용존 블랙 카본의 광내구성.생물지리학 9, 1661-1670.도이: 10.5194/bg-9-1661-2012
- ^ Hodson, R. E., Maccubbin, A. E., 그리고 포메로이, L. R. (1981)활성 및 부착 박테리오플랑크톤에 의한 용해된 아데노신 삼인산 이용.3월 Biol. 64, 43-51.doi: 10.1007/bf00394079
- ^ Hollibaugh, J. T.와 Azam, F.(1983).바닷물에 용해된 단백질의 미생물 분해.림놀.Oceanogr. 28, 1104–1116.doi: 10.4319/lo.1983.28.6.1104
- ^ 퍼거슨, R. L., 순다, W. G. (1984년).플랑크톤 해양세균에 의한 아미노산 이용: 청정기술의 중요성 및 저기질첨가의 중요성림놀.Oceanogr. 29, 258~274.doi: 10.4319/lo.1984.29.2.0258
- ^ Kaiser, K. 및 Benner, R. (2008)유해 유기 탄소와 질소의 해양 저수지에 대한 주요 박테리아 기여.림놀.Oceanogr. 53, 99~112.doi: 10.4319/lo.2008.53.1.0099
- ^ Dittmar, Thorsten (2015). "Reasons Behind the Long-Term Stability of Dissolved Organic Matter". Biogeochemistry of Marine Dissolved Organic Matter. pp. 369–388. doi:10.1016/B978-0-12-405940-5.00007-8. ISBN 9780124059405.
- ^ Jannasch, Holger W. (1967). "Growth of Marine Bacteria at Limiting Concentrations of Organic Carbon in Seawater1". Limnology and Oceanography. 12 (2): 264–271. Bibcode:1967LimOc..12..264J. doi:10.4319/lo.1967.12.2.0264.
- ^ Arrieta, J. M.; Mayol, E.; Hansman, R. L.; Herndl, G. J.; Dittmar, T.; Duarte, C. M. (2015). "Dilution limits dissolved organic carbon utilization in the deep ocean". Science. 348 (6232): 331–333. Bibcode:2015Sci...348..331A. doi:10.1126/science.1258955. PMID 25883355. S2CID 28514618.
- ^ Traving, Sachia J.; Thygesen, Uffe H.; Riemann, Lasse; Stedmon, Colin A. (2015). "A Model of Extracellular Enzymes in Free-Living Microbes: Which Strategy Pays Off?". Applied and Environmental Microbiology. 81 (21): 7385–7393. doi:10.1128/AEM.02070-15. PMC 4592861. PMID 26253668.
- ^ a b Nebbioso, Antonio; Piccolo, Alessandro (January 2013). "Molecular characterization of dissolved organic matter (DOM): a critical review". Analytical and Bioanalytical Chemistry. 405 (1): 109–124. doi:10.1007/s00216-012-6363-2. ISSN 1618-2642. PMID 22965531. S2CID 36714947.
- ^ a b Minor, Elizabeth C.; Swenson, Michael M.; Mattson, Bruce M.; Oyler, Alan R. (21 August 2014). "Structural characterization of dissolved organic matter: a review of current techniques for isolation and analysis". Environmental Science: Processes & Impacts. 16 (9): 2064–2079. doi:10.1039/C4EM00062E. PMID 24668418.
- ^ Green, Nelson W.; Perdue, E. Michael; Aiken, George R.; Butler, Kenna D.; Chen, Hongmei; Dittmar, Thorsten; Niggemann, Jutta; Stubbins, Aron (20 April 2014). "An intercomparison of three methods for the large-scale isolation of oceanic dissolved organic matter". Marine Chemistry. 161: 14–19. doi:10.1016/j.marchem.2014.01.012. ISSN 0304-4203.
외부 링크
| Wikimedia Commons에는 용해된 유기 탄소 관련 미디어가 있습니다. |
- Hansell DA 및 Carlson CA (Ed.) (2014) 해양용존유기물 생물지구화학, 제2판, 학술출판.ISBN 9780124071537.
- Stone, Richard (18 June 2010). "Marine Biogeochemistry: The Invisible Hand Behind A Vast Carbon Reservoir". Science. 328 (5985): 1476–1477. Bibcode:2010Sci...328.1476S. doi:10.1126/science.328.5985.1476. PMID 20558685.