삼산화 붕소
Boron trioxide![Crystal structure of B2O3 [1]](http://upload.wikimedia.org/wikipedia/commons/thumb/d/d9/B2O3powder.JPG/220px-B2O3powder.JPG) | |
 | |
| 이름 | |
|---|---|
| 기타 이름 붕소산화물, 디보론삼산화물, 붕소세키오화화물, 붕소산화물, 붕소화합물, 붕소화합물 무수화 붕산 | |
| 식별자 | |
| |
3D 모델(JSmol) | |
| 체비 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.013.751 |
| EC 번호 |
|
| 11108 | |
펍켐 CID | |
| RTECS 번호 |
|
| 유니 | |
CompTox 대시보드 (EPA) | |
| 특성. | |
| B2O3 | |
| 어금질량 | 69.152 g/190 |
| 외관 | 희고 유리 같은 고체 |
| 밀도 | 2.460 g/cm3, 액체; 2.55 g/cm3, 삼각; |
| 녹는점 | 450°C(842°F; 723K) (트리거) 510°C(계측면) |
| 비등점 | 1,860 °C(3,380 °F, 2,130 K) ,[2] 1500 °C에서[3] 서브라임 |
| 1.1 g/100 mL(10 °C) 3.3 g/100 mL(20°C) 15.7 g/100 mL (100 °C) | |
| 용해성 | 메탄올에 부분적으로 용해되는 |
| 산도(pKa) | ~ 4 |
자기 감수성(magnetic susibility) | -39.0·10cm−63/190cm |
| 열화학 | |
열 용량 (C) | 66.9 J/mol K |
성 어금니 엔트로피 (S | 80.8 J/mol K |
의 성 엔탈피 대형화 (ΔfH⦵298) | -1254 kJ/mol |
기브스 자유 에너지 (ΔfG˚) | -832 kJ/mol |
| 위험 | |
| 주요 위험 | 자극성[4] |
| 안전자료표 | 참고 항목: 데이터 페이지 |
| GHS 픽토그램 |  |
| GHS 시그널 워드 | 위험 |
| H360FD | |
| P201, P202, P281, P308+313, P405, P501 | |
| NFPA 704(화재 다이아몬드) | |
| 플래시 포인트 | 불연성의 |
| 치사량 또는 농도(LD, LC): | |
LD50(중간 선량) | 3163mg/kg(도덕, 마우스)[5] |
| NIOSH(미국 건강 노출 제한): | |
PEL(허용) | TWA 15mg/m3[4] |
REL(권장) | TWA 10mg/m3[4] |
IDLH(즉시 위험) | 2000 mg/m3[4] |
| 부가자료페이지 | |
| 굴절률(n), 유전 상수(상수r) 등 | |
열역학 자료 | 위상 거동 고체-기체-가스 |
| UV, IR, NMR, MS | |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |
삼산화 붕소는 붕소의 산화물 중 하나이다. 그것은23 BO라는 공식을 가진 하얗고 유리 같은 고체다. 그것은 거의 항상 유리(비형) 형태로 발견되지만, 광범위한 어네일링(즉, 오랜 열로 인해) 후에 결정화될 수 있다.
유리 붕소산화물(g-BO23)은 붕소와 산소가 번갈아 3코드와 2코드로 이루어진 6엠베드 고리인 붕소 고리로 구성되어 있는 것으로 생각된다. 많은 보록솔 고리가 있는 정확한 밀도로 질서 정연한 모델을 제작하는 것이 어렵기 때문에, 이 견해는 처음에는 논란이 되었지만, 최근 그러한 모델들이 건설되어 실험과 매우 일치하여 특성을 보여주고 있다.[6] 이제 유리 BO의23 붕소 고리에 속하는 붕소 원자의 분율이 0.73과 0.83 사이에 있고, 0.75는 0.75와 0.83 사이에 있다는 것이 실험 및 이론 연구로부터 인정되고 있다.[7][8][9][10][11]3⁄4)는 링과 비 링 유닛 사이의 1:1 비율에 해당한다. 보록솔 고리의 수는 온도가 상승하면서 액체 상태에서 감소한다.[12]
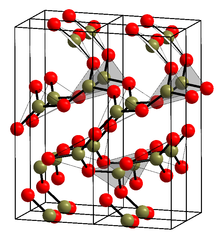
결정체 형태(α-BO23)(인포박스의[1] 구조 참조)는 BO3 삼각형으로만 구성되어 있다. 이 삼각망, 석영과 같은 네트워크는 여러 기가파스칼(9.5 GPA)에서 단색 β-BO로23 코사이트 같은 변환을 거친다.[13]
준비
삼산화 붕소는 용융로에서 붕사를 황산으로 처리하여 생산된다. 750 °C 이상의 온도에서 녹은 붕소 산화층은 황산나트륨과 분리된다. 그런 다음 96~97% 순도로 분해, 냉각 및 획득한다.[3]
또 다른 방법은 붕산을 300 °C 이상으로 가열하는 것이다. 붕산은 처음에는 약 170℃에서 증기(HO2(g))와 메타볼릭산(HBO2)으로 분해되며, 300℃ 이상에서 가열하면 더 많은 증기와 삼산화디보론(diboron)이 생성된다. 반응은 다음과 같다.
- H3BO3 → HBO2 + H2O
- 2HBO2 → BO23 + HO2
붕산은 가열된 유체화 침대를 타고 무수 마이크로 크리스탈린23 BO로 간다.[14] 조심스럽게 조절된 난방율은 물이 진화할 때 껌을 피한다. 녹은 붕소산화물은 규산염을 공격한다. 아세틸렌 열분해를 통해 내부적으로 그래피티화된 관은 통과된다.[15]
주변 압력에서 용융된 α-BO의23 결정화는 운동적으로 강하게 선호되지 않는다(비교 액체와 결정 밀도). 비정형 고체의 결정화를 위한 임계 조건은 10 kbar 및 ~200 °C이다.[16] 그것의 제안된 반동형 우주 그룹 P31 (#144); P32 (#145) [17][18](예: γ-글리신)은 반동형 우주 그룹 P3211 (#152); P3212 (#154) [19](예: α-쿼츠)로 수정되었다.
또한, 산화 붕소는 디보레인26(BH)이 공기 중 산소 또는 미량의 습기와 반응할 때 형성된다.
- 2B2H6(g) + 3O2(g) → 2B2O3(s) + 6H2(g)
- B2H6(g) + 3H2O(g) → B2O3(s) + 6H2(g)[20]
적용들
- 유리 및 에나멜의 플럭싱제
- 붕소 카바이드와 같은 다른 붕소 화합물을 합성하기 위한 시작 재료
- 유리섬유(광섬유)에 사용되는 첨가제
- 붕소산염 유리 생산에 사용되는 성분
- 갈륨 비소 단결정 생산을 위한 액상캡슐화 Czochalski 공정의 불활성 캡핑층
- 유기합성의 산성 촉매로서
참고 항목
참조
- ^ Jump up to: a b Gurr, G. E.; Montgomery, P. W.; Knutson, C. D.; Gorres, B. T. (1970). "The Crystal Structure of Trigonal Diboron Trioxide". Acta Crystallographica B. 26 (7): 906–915. doi:10.1107/S0567740870003369.
- ^ High temperature corrosion and materials chemistry: proceedings of the Per Kofstad Memorial Symposium. Proceedings of the Electrochemical Society. The Electrochemical Society. 2000. p. 496. ISBN 978-1-56677-261-7.
- ^ Jump up to: a b Patnaik, P. (2003). Handbook of Inorganic Chemical Compounds. McGraw-Hill. p. 119. ISBN 978-0-07-049439-8. Retrieved 2009-06-06.
- ^ Jump up to: a b c d NIOSH Pocket Guide to Chemical Hazards. "#0060". National Institute for Occupational Safety and Health (NIOSH).
- ^ "Boron oxide". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Ferlat, G;샤르 팡티에, T.;Seitsonen, A.P., 다카다 A.;Lazzeri, M., 코미어씨, L.;Calas, G;마우리.F(2008년)."Boroxol 반지 액체에 Vitreous B2O3 제1원칙에서".Phys. 목사 레트 사람. 101(6):065504.Bibcode:2008PhRvL.101f5504F.doi:10.1103/PhysRevLett.101.065504.PMID 18764473.;Ferlat, G;Seitsonen, A.P.;Lazzeri, M.;마우리, F(2012년)."B2O3에 숨겨진 동소체 드라이브 유리화".자연 재료 불능. 11(11):925–929. arXiv:1209.3482.Bibcode:2012NatMa..11..925F. doi:10.1038/NMAT3416. PMID 22941329.S2CID 11567458.
- ^ Hung, I.; et al. (2009). "Determination of the bond-angle distribution in vitreous B2O3 by rotation (DOR) NMR spectroscopy". Journal of Solid State Chemistry. 182 (9): 2402–2408. Bibcode:2009JSSCh.182.2402H. doi:10.1016/j.jssc.2009.06.025.
- ^ Soper, A. K. (2011). "Boroxol rings from diffraction data on vitreous boron trioxide". J. Phys.: Condens. Matter. 23 (36): 365402. Bibcode:2011JPCM...23.5402S. doi:10.1088/0953-8984/23/36/365402. PMID 21865633.
- ^ Joo, C.; et al. (2000). "The ring structure of boron trioxide glass". Journal of Non-Crystalline Solids. 261 (1–3): 282–286. Bibcode:2000JNCS..261..282J. doi:10.1016/s0022-3093(99)00609-2.
- ^ Zwanziger, J. W. (2005). "The NMR response of boroxol rings: a density functional theory study". Solid State Nuclear Magnetic Resonance. 27 (1–2): 5–9. doi:10.1016/j.ssnmr.2004.08.004. PMID 15589722.
- ^ Micoulaut, M. (1997). "The structure of vitreous B2O3 obtained from a thermostatistical model of agglomeration". Journal of Molecular Liquids. 71 (2–3): 107–114. doi:10.1016/s0167-7322(97)00003-2.
- ^ Alderman, O. L. G. Ferlat, G. Baroni, A. Salanne, M. Micoulaut, M. Benmore, C. J. Lin, A. Tamalonis, A. Weber, J. K. R. (2015). "Liquid B2O3 up to 1700K: X-ray diffraction and boroxol ring dissolution" (PDF). Journal of Physics: Condensed Matter. 27 (45): 455104. Bibcode:2015JPCM...27S5104A. doi:10.1088/0953-8984/27/45/455104. PMID 26499978.CS1 maint: 여러 이름: 작성자 목록(링크)
- ^ Brazhkin, V. V.; Katayama, Y.; Inamura, Y.; Kondrin, M. V.; Lyapin, A. G.; Popova, S. V.; Voloshin, R. N. (2003). "Structural transformations in liquid, crystalline and glassy B2O3 under high pressure". JETP Letters. 78 (6): 393–397. Bibcode:2003JETPL..78..393B. doi:10.1134/1.1630134. S2CID 189764568.
- ^ Kocakuşak, S.; Akçay, K.; Ayok, T.; Koöroğlu, H. J.; Koral, M.; Savaşçi, Ö. T.; Tolun, R. (1996). "Production of anhydrous, crystalline boron oxide in fluidized bed reactor". Chemical Engineering and Processing. 35 (4): 311–317. doi:10.1016/0255-2701(95)04142-7.
- ^ Morelock, C. R. (1961). "Research Laboratory Report #61-RL-2672M". General Electric. Cite 저널은 필요로 한다.
journal=(도움말) - ^ Aziz, M. J.; Nygren, E.; Hays, J. F.; Turnbull, D. (1985). "Crystal Growth Kinetics of Boron Oxide Under Pressure". Journal of Applied Physics. 57 (6): 2233. Bibcode:1985JAP....57.2233A. doi:10.1063/1.334368.
- ^ Gurr, G. E.; Montgomery, P. W.; Knutson, C. D.; Gorres, B. T. (1970). "The crystal structure of trigonal diboron trioxide". Acta Crystallographica B. 26 (7): 906–915. doi:10.1107/S0567740870003369.
- ^ Strong, S. L.; Wells, A. F.; Kaplow, R. (1971). "On the crystal structure of B2O3". Acta Crystallographica B. 27 (8): 1662–1663. doi:10.1107/S0567740871004515.
- ^ Effenberger, H.; Lengauer, C. L.; Parthé, E. (2001). "Trigonal B2O3 with Higher Space-Group Symmetry: Results of a Reevaluation". Monatshefte für Chemie. 132 (12): 1515–1517. doi:10.1007/s007060170008. S2CID 97795834.
- ^ AirProducts (2011). "Diborane Storage & Delivery" (PDF). Archived from the original (PDF) on 2015-02-04. Retrieved 2013-08-21. Cite 저널은 필요로 한다.
journal=(도움말)



