아닐린
Aniline| | |||
| 이름 | |||
|---|---|---|---|
| 우선 IUPAC 이름 아닐린[1] | |||
| 시스템 IUPAC 이름 벤제나민 | |||
| 기타 이름 페닐아민 아미노벤젠 벤자민 | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 3 DMet | |||
| 605631 | |||
| 체비 | |||
| 첸블 | |||
| 켐스파이더 | |||
| 드러그뱅크 | |||
| ECHA 정보 카드 | 100.000.491 | ||
| EC 번호 |
| ||
| 2796 | |||
| 케그 | |||
PubChem CID | |||
| RTECS 번호 |
| ||
| 유니 | |||
| UN 번호 | 1547 | ||
CompTox 대시보드 (EPA ) | |||
| |||
| |||
| 특성. | |||
| C6H7N | |||
| 몰 질량 | 93.199g/140g/140−1 | ||
| 외모 | 무색 액체 | ||
| 밀도 | 1.0297 g/mL | ||
| 녹는점 | - 6.30 °C (20.66 °F, 266.85 K) | ||
| 비등점 | 184.13°C(363.43°F, 457.28K) | ||
| 20 °C에서 3.6 g/100 mL | |||
| 증기압 | 0.6mmHg(20°[2]C) | ||
| 산도(pKa) |
| ||
자화율(δ) | - 62.95 · 10−6 cm3 / 세로 | ||
굴절률(nD) | 1.58364 | ||
| 점성 | 3.71cP(25°C에서 3.71mPa·s) | ||
| 열화학 | |||
표준 엔탈피/ 연소 (δHc⦵298) | −3394 kJ/mol | ||
| 위험 요소 | |||
| 산업안전보건(OHS/OSH): | |||
주요 위험 요소 | 잠재적 직업성 발암 물질 | ||
| GHS 라벨링: | |||
     | |||
| 위험. | |||
| H301, H311, H317, H318, H331, H341, H351, H372, H400 | |||
| P201, , , , , , , , , , , , , , , , , , , , , , , , , , ,, | |||
| NFPA 704(파이어 다이아몬드) | |||
| 플래시 포인트 | 70 °C (158 °F, 343 K) | ||
| 770 °C (1,420 °F, 1,040 K) | |||
| 폭발 한계 | 1.3~11%[2] | ||
| 치사량 또는 농도(LD, LC): | |||
LDLo(최저 공개) | 195mg/kg (개, 구강) 250 mg/kg (랫드, 경구) 464 mg/kg (경구) 440 mg/kg (쥐, 경구) 400 mg/kg (돼지, 구강)[4] | ||
LC50(중간 농도) | 175 ppm (표준, 7시간)[4] | ||
LCLo(최저 공개) | 250ppm (랫, 4시간) 180ppm (고양이, 8시간)[4] | ||
| NIOSH(미국 건강 노출 제한): | |||
PEL(허용) | TWA 5ppm(19mg/m3) [피부][2] | ||
REL(권장) | Ca [잠재적인 직업성 발암물질][2] | ||
IDLH(즉시 위험) | 100ppm[2] | ||
| 관련 화합물 | |||
| 1-나프틸아민 2-나프틸아민 | |||
관련 화합물 | 페닐히드라진 니트로소벤젠 니트로벤젠 | ||
| 보충 데이터 페이지 | |||
| 아닐린(데이터 페이지) | |||
달리 명시되지 않은 한 표준 상태(25°C[77°F], 100kPa)의 재료에 대한 데이터가 제공됩니다. | |||
아닐린은 화학식이652 CHNH인 유기화합물이다.아미노기에 결합된 페닐기로 이루어진 아닐린은 가장 단순한 방향족이다.산업적으로 중요한 일반 화학 물질일 뿐만 아니라 미세 화학 합성을 위한 다목적 시작 물질입니다.폴리우레탄, 염료 및 기타 공업용 화학물질의 전구체 제조에 주로 사용됩니다.대부분의 휘발성 아민처럼 썩은 생선 냄새가 난다.쉽게 점화되어 방향족 [6]화합물 특유의 매캐한 불꽃과 함께 연소됩니다.그것은 인간에게 독성이 있다.
벤젠에 비해 전자가 풍부하다.따라서 친전자성 방향족 치환 반응에 보다 빠르게 관여한다.마찬가지로 산화되기 쉽습니다. 갓 정제된 아닐린은 거의 무채색 기름이지만, 공기에 노출되면 강한 색상의 산화 불순물이 형성되어 노란색 또는 빨간색으로 점차 어두워집니다.아닐린은 디아조틴화되어 디아조늄 염을 얻을 수 있으며, 디아조늄 염은 다양한 친핵성 치환 반응을 일으킬 수 있다.
아니린은 궁극적으로 "인디고 관목"을 뜻하는 포르투갈 아닐에서 유래했으며, 접미사 -ine은 "유래 물질"[7]을 의미한다.
다른 아민들과 마찬가지로 아닐린은 염기(pKaH = 4.6)이자 친핵체이지만 구조적으로 유사한 지방족 아민보다는 적다.
벤젠의 초기 공급원이 콜타르였기 때문에 아닐린 염료는 콜타르 염료라고도 불립니다.
구조.
아릴-N 거리
아닐린에서 C-N [9]결합길이는 1.41Ω으로 [8]시클로헥실아민은 1.47Ω으로 N과 [10]C의 부분 δ결합을 나타낸다.아닐린에서 C(aryl)-NH2 거리는 치환 효과에 매우 민감하다.이 거리는 2,4,6-트리니트로아닐린에서 [11]1.34Ω인데 반해 3-메틸아닐린에서는 1.44Ω이다.
피라미드화
아닐린의 아민은 약간 피라미드화된 분자로, 질소의 교배는2 sp와 sp 사이입니다3.질소는 높은 p 특성을 가진 것으로 설명됩니다.아닐린의 아미노기는 지방족 아민과 아릴 치환기의 결합으로 인해 지방족 아민의 아미노기보다 평평하다(즉, "샤워 피라미드").관측된 기하학은 두 가지 경쟁 요인 사이의 타협을 반영한다. 1) 유의한 s 특성을 가진 궤도에서의 N개 고립 쌍의 안정화(s 특성을 가진 궤도들은 에너지가 더 낮다) 반면 2) 아릴 고리 선호 평탄성으로 N개 고립 쌍의 비국재화(순수 p 오비탈에서 단일 쌍은 다음을 제공함)벤젠 고리 δ [12][13]계통의 궤도와 가장 잘 겹친다.)
이러한 요인들과 일관되게, 전자 공여 그룹을 가진 치환 아닐린은 더 피라미드화되어 있는 반면, 전자 인출 그룹을 가진 아닐린은 더 평면적이다.모계 아닐린에서 단독쌍은 sp 교잡에 대응하는 약 12%s [12]특성이다7.3(비교하기 위해 알킬아민은 일반적으로 sp에 가까운3 오비탈에 단독쌍을 가진다).
C–N 결합과 H–N–H 각도의 이등분선 사이의 피라미드화 각도는 142.5°[14]이다.비교를 위해 보다 강한 피라미드형 메틸아민에서는 이 값이 125° 이하인 반면, 포름아미드는 180°의 각도로 한다.
생산.
산업용 아닐린 생산은 두 가지 단계를 포함한다.먼저 벤젠을 질산과 황산의 농축 혼합물로 50~60℃에서 질화시켜 니트로벤젠을 얻는다.니트로벤젠은 금속 [15]촉매가 있는 상태에서 수소화됩니다(일반적으로 200~300°C).
니트로벤젠을 아닐린으로 환원하는 것은 1842년 니콜라이 진닌에 의해 처음으로 이루어졌으며, 환원제로서 무기 황화물을 사용했다(진닌 반응).1854년 Antoine Béchamp가 환원제로 철을 사용하여 니트로벤젠을 아닐린으로 환원(Bechamp reduction)하는 과정도 수행하였다.
쿠멘 [6]공정에서 유래한 암모니아 및 페놀로부터 아닐린을 조제할 수도 있다.
상업에 있어서, 아닐린의 3브랜드:은 순수한 아닐린 파란 색을 아닐린 기름과, 레드 와인으로 아닐린 기름, 아닐린과 ortho-과 para-toluidines의 같은 분자 수의 양의 혼합물, 그리고 safranine에고 당홍 퓨전distillate(échappés)로부터 얻어진 것이다 아닐린과 ortho-toluidine가 들어 있아닐린유, 구별된다.[16]
관련 아닐린 유도체
페닐기가 추가로 치환되는 곳은 아닐린의 많은 유사체들이 알려져 있다.이것들은 톨루이딘, 자일리딘, 클로로아닐린, 아미노벤조산, 니트로아닐린, 그리고 많은 다른 것들을 포함합니다.치환된 방향족 화합물의 질화 처리 후 환원을 통해 제조되는 경우가 많습니다.예를 들어 이 방법은 톨루엔을 톨루이딘으로, 클로로벤젠을 4-클로로아닐린으로 [6]변환하는 데 사용된다.또는 Buchwald-Hartwig 커플링 또는 Ullmann 반응접근을 이용하여 할로겐화아릴을 [17]암모니아수 또는 기체로 아민화할 수 있다.
반응
아닐린의 화학작용은 풍부합니다.왜냐하면 그 화합물은 오랫동안 저렴하게 구할 수 있었기 때문입니다.다음은 그 반응의 몇 가지 등급입니다.
산화

아닐린의 산화는 많이 연구되어 질소에 국소적인 반응을 일으키거나 더 일반적으로 새로운 C-N 결합을 형성할 수 있다.알칼리성 용액에서는 아조벤젠이 생성되고, 비산에서는 보라색 비올라닐린이 생성된다.크롬산은 그것을 퀴논으로 바꾸는 반면, 염소산염은 특정 금속염(특히 바나듐)의 존재 하에서 아닐린을 검은색으로 만든다.염산과 염소산칼륨은 클로로닐을 생성한다.중성용액 중 과망간산칼륨은 니트로벤젠, 알칼리용액에서 아조벤젠, 암모니아 및 옥살산, 산용액에서 아닐린 블랙으로 산화한다.하이포아염소산은 4-아미노페놀과 파라아미노디페닐아민을 [16]생성한다.과황산염에 의한 산화는 다양한 폴리아닐린을 생성한다.이들 중합체는 풍부한 산화환원 및 산염기 특성을 보인다.

직교 및 파라 위치에서의 친전자성 반응
페놀과 마찬가지로 아닐린 유도체는 친전자성 치환 반응에 매우 민감하다.고리의 높은 반응성은 고리의 전자 기증 능력을 향상시키는 에나민임을 나타냅니다.예를 들어 180 °C에서 아닐린과 황산을 반응시키면 술파닐산인 HNCHSOH가2643 생성된다.
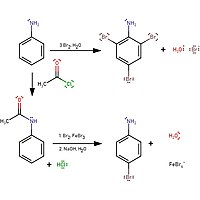
아닐린에 브롬수를 첨가하면 브롬수가 탈색되어 2,4,6-트리보아닐린의 백색 침전이 형성된다.단일 치환 제품을 생성하려면 염화아세틸에 의한 보호가 필요합니다.
4-브로모아닐린을 형성하는 반응은 염화 아세틸로 아민을 보호한 후 가수분해하여 아닐린을 재형성하는 것이다.
아닐린의 가장 큰 규모의 산업적 반응은 포름알데히드와의 알킬화를 포함한다.이상화된 방정식을 다음에 나타냅니다.
- 2652 CHNH + CHO2 → CH2(CHNH642)2 + HO2
결과 디아민은 4,4'-MDI 및 관련 디이소시아네이트의 전구체이다.
질소 반응
기본성
아닐린은 약한 염기예요아닐린과 같은 방향족들은 일반적으로 지방족 아민들보다 훨씬 약한 염기들이다.아닐린은 강한 산과 반응하여 아닐리늄(또는 페닐암모늄) 이온(CH-NH653+)[18]을 형성합니다.
전통적으로 아닐린의 약한 염기성은 질소의 단일 쌍이 벤젠 고리의 pi 계통에 부분적으로 비국재화되기 때문에 전기음성2 sp 카본과 공명 효과의 조합에 기인한다.(아래 그림 참조):
이러한 분석에서 누락되는 것은 용매화의 고려사항이다.예를 들어 아닐린은 기체상에서는 암모니아보다 염기성이 높지만 수용액에서는 [19]1만 배나 적다.
아실화
아닐린은 염화아세틸과 같은 아실염화물과 반응하여 아미드를 생성한다.아닐린에서 형성되는 아미드는 아닐리드라고 불리기도 하는데, 예를 들어 CH-CO-NH-CH는365 아세트아닐리드이다.고온에서 아닐린과 카르본산은 반응하여 아닐리드를 [20]생성한다.
N-알킬화
N-메틸아닐린과 메탄올을 산성 촉매보다 높은 온도에서 사용하면 N-메틸아닐린과 디메틸아닐린이 생성됩니다.
- CHNH652 + 2 CHOH3 → CHN65(CH3)2 + 2HO2
N-메틸아닐린과 디메틸아닐린은 각각 193~195°C와 192°C의 끓는점을 가진 무색 액체이다.이 파생상품들은 컬러 산업에서 중요하다.아닐린은 요오드화 알킬과 직접 결합하여 2차 및 3차 아민을 [16]형성합니다.
이황화탄소유도체
이황화탄소와 함께 끓이면 술포카르바닐라이드(시페닐티오우레아)(CS(NHCH65))2를 얻을 수 있어 페닐이소티오시아네이트(CHNS65) 및 트리페닐구아니딘(CHN65=C(NHCH65)2[16]로 분해될 수 있다.
디아조타이제이션
아닐린과 그 고리 치환 유도체는 아질산과 반응하여 디아조늄염을 형성한다.이러한 중간생성물을 통해 아민기는 샌드마이어 반응을 통해 -OH, -CN 또는 할로겐화물로 전환될 수 있다.이 디아조늄 소금은 또한 커플링이라고 불리는 과정에서 벤젠아조페놀로 알려진 염료를 생산하기 위해 NaNO와2 페놀과 반응할 수 있습니다.1차 방향족 아민을 디아조늄 소금으로 바꾸는 반응을 디아조화라고 한다.이 반응에서 1차 방향족 아민은 니트릴 나트륨 및 HCl 2몰과 반응하는데, 이는 온도가 0.5°C였으며 주요 산물로 벤젠 디아조늄 소금을 형성하고 물과 염화 나트륨을 형성하기 때문에 얼음 냉 혼합물이라고 알려져 있다.
기타 반응
그것은 니트로벤젠과 반응하여 Wohl-Aue 반응에서 페나진을 생성한다.수소화는 시클로헥실아민을 생성한다.
실험실의 표준 시약인 아닐린은 많은 틈새 반응에 사용됩니다.아세트산염은 탄수화물에 대한 아닐린 아세트산염 테스트에 사용되며, 푸르푸랄로 전환하여 펜토스를 식별한다.Nissl [citation needed]염색체의 신경 RNA를 파란색으로 염색하는 데 사용됩니다.
사용하다
아닐린은 주로 포름알데히드와의 축합에 의한 메틸렌디아닐린 및 관련 화합물 제조에 사용된다.디아민은 포스겐과 응축되어 우레탄 [6]중합체의 전구체인 메틸렌디페닐디이소시아네이트를 생성한다.
 대부분의 아닐린은 폴리우레탄의 전구체인 메틸렌디아닐린의 생산에 소비된다.
대부분의 아닐린은 폴리우레탄의 전구체인 메틸렌디아닐린의 생산에 소비된다.
다른 용도로는 고무 가공 화학 물질(9%), 제초제(2%), 염료 및 색소(2%)[21] 등이 있습니다.고무 첨가물로는 페닐렌디아민, 디페닐아민 등의 아닐린 유도체가 항산화제이다.아닐린으로부터 제조된 약물의 예로는 파라세타몰(아세트아미노펜, 타이레놀)이 있다.염료 산업에서 아닐린의 주요 용도는 청바지의 [6]청색인 인디고의 선구자이다.

역사
아닐린은 1826년 오토 언베르도르벤에 의해 인디고의 [22]파괴 증류에 의해 처음 분리되었다.크리스탈린이라고 불렀어1834년, Friedlieb Runge는 석회의 염화물로 처리했을 때 아름다운 파란색으로 변하는 물질을 콜타르에서 분리했다.그는 그것을 캬놀 [23]또는 시아놀이라고 이름 지었다.1840년, 칼 줄리어스 프리체 (1808–1871)는 인디고를 가성 포타쉬로 처리했고 그가 인디고를 생산하는 식물의 이름을 따서 아닐린(Aniline, Indigofera acputicalosa)[24][25]이라고 이름 붙인 기름을 얻었습니다.1842년 니콜라이 니콜라예비치 지닌은 니트로벤젠을 환원시키고 벤지담이라는 [26]염기를 얻었다.1843년, August Wilhelm von Hofmann은 이것들이 모두 같은 물질이라는 것을 보여주었고, 그 후에 페닐아민 또는 아닐린으로 [27]알려졌다.
합성 염료 산업
1856년, 키니네를 합성하려고 노력하던 중, 폰 호프만의 제자 윌리엄 헨리 퍼킨은 마우베인을 발견하고 최초의 상업용 합성 염료를 생산하는 산업에 뛰어들었습니다.후크신, 사프라닌, 면죄부와 같은 다른 아닐린 염료들이 뒤따랐다.마우베인이 발견되었을 때 아닐린은 비쌌다.곧이어 앙투안 [28]베샹이 1854년에 보고한 방법을 적용하여 "톤 단위로"[29] 준비되었다.베샹의 감소는 독일에서 대규모 염료 산업의 발전을 가능하게 했습니다.오늘날 BASF(Badische Anilin-and Soda-Fabrik, 영어: Baden Aniline and Soda Factory)는 현재 가장 큰 화학 공급 업체로, 아닐린 염료를 통해 건설되고 관련 아조 염료를 통해 확장되는 합성 염료 산업의 유산을 반영한다.첫 번째 아조 염료는 아닐린 [30]옐로우였다.
의학의 발달
19세기 후반에 아세트아닐리드나 페나세틴과 같은 아닐린의 유도체가 진통제로 등장했고, 그들의 심장 억제 부작용은 종종 [31]카페인으로 대항했다.20세기 첫 10년 동안 아프리카 수면병을 치료하기 위해 합성 염료를 수정하려다 실패한 폴 에를리치는 약물에 대한 마법의 총알 접근으로 화학요법이라는 용어를 만들었고, 실패하여 최초의 유기 비소 약물인 베샹의 아톡실 수정으로 전환하여 매독 치료제를 우연히 얻었다.ilis – salvarsan – 최초의 성공적인 화학 치료제.아직 박테리아로 인식되지 않은 살바르산의 표적 미생물은 여전히 기생충으로 생각되었고, 의학 세균학자들은 박테리아가 화학 치료법에 민감하지 않다고 믿었던 1928년 페니실린의 효과에 대한 알렉산더 [32]플레밍의 보고서를 간과했다.
1932년 바이엘은 염료의 의학적 응용을 모색했다.1935년 최초의 항균제인 프론토실로 소개된 붉은 아조 염료로 항균제로 확인된 게르하르트 도마크는 곧 파스퇴르 연구소에서 생체 내에서 술파닐아미드로 분해된 프로드러그(많은 색 빠른 아조 염료의 무색 중간체)로 밝혀졌으며 1908년 비엔나에서 이미 특허가 만료됐다.그녀의 폴 겔모 박사 [32]연구로요1940년대까지 500개 이상의 술파 관련 약물이 [32]생산되었다.제2차 세계대전(1939–45년) 동안 수요가 많았던 약품, 이 최초의 기적의 약품들, 광범위한 효과의 화학 요법은 미국 제약 산업을 [33]촉진시켰다.1939년, 옥스포드 대학에서, 술파 약물의 대안을 찾기 위해 하워드 플로리는 플레밍의 페니실린을 최초의 전신 항생제인 페니실린 G로 개발했습니다. (1939년 록펠러 연구소의 르네 두보스에 의해 개발된 그라미시딘은 최초의 항생제였지만 독성은 국소적인 사용을 제한했습니다.)제2차 세계대전 후, 코넬리우스 P. Rhoads는 암 [34]치료에 대한 화학요법적 접근법을 도입했다.
로켓 연료
에어로비와 WAC 상병과 같은 일부 초기 미국 로켓은 아닐린과 푸릴 알코올을 연료로, 질산을 산화제로 혼합하여 사용했다.이 조합은 연료와 산화제 사이의 접촉에 의해 점화되는 과급성 물질입니다.또한 밀도가 높아 장기간 보관할 수 있습니다.아닐린은 나중에 히드라진으로 [35]대체되었다.
독성학 및 테스트
아닐린은 증기 흡입, 섭취 또는 경피 [36][37]흡수에 의해 독성이 있다.IARC는 이용 가능한 데이터가 제한적이고 모순되기 때문에 그룹 3(인간에 대한 발암성에 대해서는 분류할 수 없음)에 등록한다.아닐린의 초기 생산은 방광암의 발생을 증가시켰지만, 이러한 영향은 현재 아닐린이 [6]아닌 나프틸아민에 기인한다.
아닐린은 숲의 [38]역류 원인 중 하나로 알려져 있다.
아닐린의 [39]검출에는 많은 방법이 있다.
산화성 DNA 손상
쥐가 아닐린에 노출되면 종양 유발 [40]반응을 포함하여 비장에 독성이 있는 반응을 유도할 수 있다.식수에서 아날린에 노출된 쥐는 비장에 대한 산화 DNA 손상이 유의미하게 증가했으며,[40] DNA에서 8-히드록시-2'-디옥시구아노신(8-OHDG)이 2.8배 증가한 것으로 감지되었다.염기절제 복구 경로도 활성화 되었으나 활성도가 8-OHDG 축적을 막기에 충분하지 않았다.아닐린에 노출된 후 비장에 산화 DNA의 축적은 종양 발생의 기초가 되는 돌연변이 유발 사건을 증가시킬 수 있다.
메모들
- ^ Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. pp. 416, 668. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
Aniline, for C6H5-NH2, is the only name for a primary amine retained as a preferred IUPAC name for which full substitution is permitted on the ring and the nitrogen atom. It is a Type 2a retained name; for the rules of substitution see P-15.1.8.2. Substitution is limited to substituent groups cited as prefixes in accordance with the seniority of functional groups explicitly expressed or implied in the functional parent compound name. The name benzenamine may be used in general nomenclature.
- ^ a b c d e NIOSH Pocket Guide to Chemical Hazards. "#0033". National Institute for Occupational Safety and Health (NIOSH).
- ^ Vollhardt, P.; Schore, Neil (2018). Organic Chemistry (8th ed.). W. H. Freeman. p. 1031. ISBN 9781319079451.
- ^ a b c "Aniline". Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ "Aniline". cameochemicals.noaa.gov. US NOAA Office of Response and Restoration. Retrieved 2016-06-16.
- ^ a b c d e f Kahl, Thomas; Schröder, K. W.; Lawrence, F. R.; Elvers, Barbara; Höke, Hartmut; Pfefferkorn, R.; Marshall, W. J. (2007). "Aniline". In Ullmann, Fritz (ed.). Ullmann's encyclopedia of industrial chemistry. Wiley: New York. doi:10.1002/14356007.a02_303. ISBN 978-3-527-20138-9. OCLC 11469727.
- ^ "aniline Etymology, origin and meaning of aniline by etymonline". www.etymonline.com. Retrieved 2022-02-15.
- ^ Zhang, Huaiyu; Jiang, Xiaoyu; Wu, Wei; Mo, Yirong (April 28, 2016). "Electron conjugation versus π-π repulsion in substituted benzenes: why the carbon-nitrogen bond in nitrobenzene is longer than in aniline". Physical Chemistry Chemical Physics. 18 (17): 11821–11828. Bibcode:2016PCCP...1811821Z. doi:10.1039/c6cp00471g. ISSN 1463-9084. PMID 26852720.
- ^ Raczyńska, Ewa D.; Hallman, Małgorzata; Kolczyńska, Katarzyna; Stępniewski, Tomasz M. (2010-07-12). "On the Harmonic Oscillator Model of Electron Delocalization (HOMED) Index and its Application to Heteroatomic π-Electron Systems". Symmetry. 2 (3): 1485–1509. Bibcode:2010Symm....2.1485R. doi:10.3390/sym2031485. ISSN 2073-8994.
- ^ G. M. Wöjcik "Anilines의 구조적 화학"(Patai의 기능성 그룹 화학), S. Patai, Ed. 2007, Wiley-VCH, Weinheim.doi: 10.1002/9780470682531.pat0385.
- ^ Sorriso, S. (1982). "Structural chemistry". Amino, Nitrosco and Nitro Compounds and Their Derivatives: Vol. 1 (1982). pp. 1–51. doi:10.1002/9780470771662.ch1. ISBN 9780470771662.
- ^ a b Alabugin, Igor V. (2016). Stereoelectronic effects : a bridge between structure and reactivity. Chichester, UK. ISBN 978-1-118-90637-8. OCLC 957525299.
- ^ Alabugin I. V.; Manoharan, M.; Buck, M.; Clark, R. J. Anilines 대체:피라미드화와 크리스털 캐비티 안팎의 공명 사이의 줄다리기THECOEM, 2007, 813, 21-27http://dx.doi.org/10.1016/j.theochem.2007.02.016 를 참조해 주세요.
- ^ Carey, Francis A. (2008). Organic chemistry (7th ed.). Boston: McGraw-Hill Higher Education. ISBN 9780073047874. OCLC 71790138.
- ^ Caskey, Douglas C.; Chapman, Douglas W. (Apr 24, 1985), Process for the preparation of arylhydroxylamines, retrieved 2016-06-16
- ^ a b c d 치솔름 1911쪽 48쪽
- ^ "Aniline synthesis by amination (Arylation)".
- ^ McMurry, John E. (1992), Organic Chemistry (3rd ed.), Belmont: Wadsworth, ISBN 0-534-16218-5
- ^ Smith, Michael B.; March, Jerry (2007), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (6th ed.), New York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Carl N. Webb (1941). "Benzanilide". Organic Syntheses.; Collective Volume, vol. 1, p. 82
- ^ "Aniline". The Chemical Market Reporter. Archived from the original on 2002-02-19. Retrieved 2007-12-21.
- ^ Otto Unverdorben (1826). "Ueber das Verhalten der organischen Körper in höheren Temperaturen" [On the behaviour of organic substances at high temperatures]. Annalen der Physik und Chemie. 8 (11): 397–410. Bibcode:1826AnP....84..397U. doi:10.1002/andp.18260841109.
- ^ F. F. 룽지(1834) "석탄 증류 제품 중 일부에 대하여" Annalen der Physik und Chemie, 31: 65-77 (65페이지, 513-524페이지 참조), 32: 308-332 (331페이지 참조)
- ^ J. Fritzsche (1840) "Uber das Anilin, ein neues Zersetzungsproduct des Indigo", Bulletin Scientifique [publié par l'Academie Impériale des Sciences de Saint-Petbourgers], 7161.재인쇄 위치:
- J. Fritzsche(1840) "Uber das Anilin, ein neues Zersetzungsproduct des Indigo", Justus Liebigs Annalen der Chemie, 36: 84-90.
- J. Fritzsche (1840) "Uber das Anilin, ein neues Zersetzungsproduct des Indigo", 저널 für praktische Chemie, 20: 453–457.이 기사에 대한 후기에서, Erdmann(저널의 편집자 중 한 명)은 아닐린과 1826년에 Unverdorben에 의해 발견된 "크리스탈린"이 같은 물질이라고 주장한다. 457-459페이지를 참조하라.
- ^ 동의어 I anil, 궁극적으로는 산스크리트어 "n"la", 짙은 파란색에서 유래했다.
- ^ N. Zinin(1842)."Beschreibungeiniger neuer organischer시는 대로 베이슨,dargestellt durch 죽는 걸 본 셈이잖아 Einwirkung 데 Schwefelwasserstoffes Verbindungen하는 Kohlenwasserstoffe auf mit Untersalpetersäure"( 새로운 유기농 기지의 설명은, 황화 수소의 탄화 수소의 화합물과hyponitric 산성에 대한 작용으로 생산되[H2N2O3]), 보고서 사이언스 경우publié 파 l'A.없어démie Impériale des Sciences de Saint-Petersbourg, 10(18) : 272–285.N. Zinin (1842) "Beschreibung einiger neer organischer Basen, dargestellt durch einwirkung des Schweffelwasserstoffes auf Verbindung der Kohwlenasserstoffe Untersalpeture Fakche" (1842)에 전재되어 있습니다.벤지담은 150페이지에 나와있다.지닌의 동료인 프리츠는 곧 벤지담이 사실은 아닐린이라는 것을 알아챘다.참조: Fritzsche(1842) Bulletin Scientifique, 10:352.J. Fritzche(1842) "Bemerkung zu vorsteender Abhandlung des Hrn"에 있는 Zininininn의 기사에 대한 추서로 전재. Zinin" (Mr. Zinin의 전 기사에 대한 논평), 저널 füraktische Chemie, 27 (1): 153.
참고 항목: (Anon.) (1842) "Organische Salzbasen, aus Nitronaphtalose und Nitrobenzid mittelst Schwelwasserstoff entsteend"(니트로나프탈렌과 황화수소를 통해 니트로벤젠에서 유래한 유기 염기), Annalen derie Darmictie, 28–283: - ^ August Wilhelm Hofmann (1843) "Chemische Untersuchung der Organischen Basen im Steinkohlen-Theeröl"(콜타르 기름의 유기 염기에 대한 화학적 조사), Annalen der Chemie und Pharmacie, 47: 37–87.48페이지에서 Hofmann은 크리스탈린, 캬놀, 벤지담, 아닐린이 동일하다고 주장한다.
- ^ A. 베샹(1854) "프로토셀 데 페르 수르 라 니트로나프탈린 에 라 니트로벤젠의 작용. Nouvelle methode de formation des bases organiques artielles de Zininin" (니트로나프탈린 및 니트로벤젠에 대한 철 프로토살트의 작용에 대하여)Zinin의 합성 유기 염기를 형성하는 새로운 방법), Annales de Chemie et de Ficture, 세 번째 시리즈, 42:186 – 196. (주:금속 2개 이상의 뚜렷한 산화물(예:철)는 것의 경우 산화물의 산소를 금속에 가장 낮은 비율이 포함된에서 얻을 수 있는 소금 같은 철의 2산화물을 가지고 있는 경우, – 철(2세)산화(FeO)과 철분(3세)산화(까지의 Fe2O3)– FeO은"초급 산화물"protosalts을"protosalt"은 낡은 용어이다. c만들어지다자세한 내용은 Wiktionary: protosalt를 참조하십시오.
- ^ Perkin, William Henry. 1861-06-08. "화학회 진행: 1861년 5월 16일 목요일 화학회.화학 뉴스와 산업 과학 저널.2007-09-24에 취득.
- ^ 아우어바흐 G, "아조 및 나프톨 염료", 섬유 착색제, 1880년 5월;2(17):137-9, 페이지 138.
- ^ Wilcox RW, "성인의 인플루엔자 치료", 의학뉴스, 1900년 12월 15일;77():931-2, 페이지 932.
- ^ a b c D J Th Wagener, 종양학의 역사(Houten: Springer, 2009), 페이지 150-1.
- ^ 존 E 레쉬, 최초의 기적적인 약물: 술파 약물이 의학을 변화시킨 방법(뉴욕: 옥스포드 대학 출판부, 2007), 페이지 202-3.
- ^ "Medicine: Spoils of War". Time. 15 May 1950. Archived from the original on 24 June 2013. Retrieved 20 November 2020.
- ^ 브라이언 버넬, 2016년http://www.nuclear-weapons.info/cde.htm#Corporal SSM
- ^ Muir, GD(ed.) 1971, 런던 왕립 화학 연구소 화학 연구소의 위험.
- ^ Merck Index. 제10판(1983년), 페이지 96, Rahway:Merck & Co.
- ^ Krahl-Urban, B., Papke, H.E., Peters, K. (1988) 숲 감소: 북미 및 독일 연방공화국의 원인 연구.독일:율리히 원자력 연구 센터의 생물학, 생태학, 에너지 평가 그룹.
- ^ 기초 분석 독성학(1995), R. J. Flanagan, S. S. Brown, F. A. de Wolff, R. A. Braithwaite, B.Widdop:세계보건기구
- ^ a b Ma H, Wang J, Abdel-Rahman SZ, Boor PJ, Khan MF. 산화성 DNA 손상 및 아닐린에 대한 아만성 피폭 후 쥐 비장에서의 복구.독소성 애플 약초.2008년 12월 1일;233 (2):247-53.doi:10.1016/j.taap.2008.08.010.2008년 8월 22일PMID: 18793663; PMCID: PMC2614128
레퍼런스
- 이 문서에는 현재 퍼블릭 도메인에 있는 출판물의 텍스트가 포함되어 있습니다.
외부 링크
- Baynes, T. S., ed. (1878), , Encyclopædia Britannica, vol. 2 (9th ed.), New York: Charles Scribner's Sons, pp. 47–48 short=x
- 국제 화학 안전 카드 0011
- CDC - 화학적 유해 물질에 대한 NIOSH 포켓 가이드
- 아닐린 전기 중합
- 화학의 아닐린IDplus 데이터베이스