비산
Arsenic acid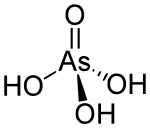 | |
 | |
| 이름 | |
|---|---|
| IUPAC 이름 비소산, 아르소산 | |
| 기타 이름 비산 오르토아르센산 방습제 L-10 조톡스 | |
| 식별자 | |
3D 모델(JSmol) | |
| 체비 | |
| 켐벨 | |
| 켐스파이더 | |
| ECHA InfoCard | 100.029.001 |
| EC 번호 |
|
| 케그 | |
펍켐 CID | |
| RTECS 번호 |
|
| 유니 | |
| UN 번호 | 1553, 1554 |
CompTox 대시보드 (EPA) | |
| |
| |
| 특성. | |
| 하소34 | |
| 어금질량 | 141.94 g/192 |
| 외관 | 흰색 반투명 크리스털, 흡습성의 |
| 밀도 | 2.5 g/cm3 |
| 녹는점 | 35.5°C(95.9°F, 308.6K) |
| 비등점 | 120 °C(248 °F, 393 K) 분해 |
| 16.7 g/100 mL | |
| 용해성 | 알코올에 녹는 |
| 증기압 | 55 hPa(50°C) |
| 산도(pKa) | 2.19, 6.94, 11.5 |
| 콘게이트 베이스 | 비소산염 |
| 구조 | |
| 사면체 | |
| 위험 | |
| 산업안전보건(OHS/OSH): | |
주요 위험 | 극독성, 발암성, 부식성 |
| GHS 라벨 표시: | |
     | |
| 위험 | |
| H301, H312, H314, H331, H350, H361, H410 | |
| P201, P202, P260, P261, P264, P270, P271, P273, P280, P281, P301+P310, P301+P330+P331, P302+P352, P303+P361+P353, P304+P340, P305+P351+P338, P308+P313, P310, P311, P312, P321, P322, P330, P363, P391, P403+P233, P405, P501 | |
| NFPA 704(화재 다이아몬드) | |
| 플래시 포인트 | 불연성 |
| 치사량 또는 농도(LD, LC): | |
LD50(중간 선량) | 48mg/kg(랫드, 구강) 6mg/kg (마약, 구강) |
| 관련 화합물 | |
기타 음이온 | 인산 |
기타 양이온 | 비소산나트륨 |
관련 화합물 | 비산 오산화 비소 |
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |
| Infobox 참조 자료 | |

비소산은 HAsO라는34 공식을 가진 화학 화합물이다. AsO(OH)라고 더 기술적으로 쓰여진 3이 무색산은 인산의 비소 아날로그다. 비소와 인산염은 매우 비슷하게 작용한다. 이와 같은 비소는 격리되지 않고 용액에서만 발견되는데, 주로 이온화된다. 헤미하이드레이트 형태(HASO34··)1/2HO2)는 안정적인 결정을 형성한다. 결정 샘플은 100 °C에서 응결로 수분을 제거한다.[1]
특성.
As-O 결합 길이가 1.66 ~ 1.71 å인 이상적인 대칭 C의3v 사면체 종이다.[2]
트리프로틱산으로서, 그것의 산성은 세 가지 평형성으로 설명된다.
- HAsO34 + HO2 ⇌ HAsO
2−
4 + HO3+(pKa1 = 2.19) - HAsO
2−
4 + HO2 ⇌ HAsO2−
4 + HO3+(pKa2 = 6.94) - HAsO2−
4 + HO2 ⇌ AsO3−
4 + HO3+(pKa3 = 11.5)
이러한 pKa 값은 인산 값에 가깝다. 고도로 기초적인 비소산 이온3−
4(AsO)은 3차 이온화의 산물이다. 인산과는 달리 비소는 산화제로 요오드화물을 요오드화합물로 전환하는 능력에서 잘 나타난다.
준비
비소는 삼산화 비소를 질산 농축으로 처리하여 제조한다. 삼산화 이질소는 부산물로 생산된다.[3]
- AsO23 + 2 HNO3 + 2 HO2 → 2 HASO34 + NO23
그 결과 용액은 히미하이드레이트 HAsO34/1/2HO의2 무색 결정체를 제공하도록 냉각된다. 단, 다이하이드레이트 HAsO34/2.HO는2 낮은 온도에서 결정화가 발생할 때 생성된다.[3]
기타 방법
비소산은 오산화비소가 물에 녹으면 서서히 형성되고 메타산이나 화로아르센산은 찬물로 처리된다. 비산 역시 원소 비소에서 직접 수분을 공급하고 오존으로 치료할 수 있다.
- 2 As + 3 HO2 + 5 O3 → 2 HASO34 + 52 O
적용들
비소의 상업적 적용은 그것의 독성에 의해 제한된다. 그것은 다양한 살충제의 전조다. 그것은 나무 방부제, 광폭 바이오시드, 유리와 금속의 마감제, 그리고 일부 다이어스터프와 유기 비소 화합물의 합성에서 시약으로 가끔 사용하는 것을 발견했다.[4]
안전
비소는 모든 비소 화합물과 마찬가지로 매우 독성이 강하고 발암성이 강하다. 또한 부식성이 있다. 토끼의 LD는50 6mg/kg(0.006g/kg)이다.[5]
참조
- ^ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5.
- ^ Lee, C.; Harrison, W. T. A. (2007). "Tetraethylammonium dihydrogenarsenate bis(arsenic acid) and 1,4-diazoniabicyclo[2.2.2]octane bis(dihydrogenarsenate) arsenic acid: hydrogen-bonded networks containing dihydrogenarsenate anions and neutral arsenic acid molecules". Acta Crystallographica C. 63 (Pt 7): m308–m311. doi:10.1107/S0108270107023967. PMID 17609552.
- ^ a b G. Brauer, ed. (1963). "Arsenic Acid". Handbook of Preparative Inorganic Chemistry. Vol. 1 (2nd ed.). New York: Academic Press. p. 601.
- ^ Minerals Yearbook, 2008, V. 1, Metals and Minerals. Government Printing Office. 2010. pp. 6–. ISBN 978-1-4113-3015-3.
- ^ Grund, Sabina C.; Hanusch, Kunibert; Wolf, Hans Uwe (2008). "Arsenic and Arsenic Compounds". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a03_113.pub2. ISBN 978-3527306732.



