고체 질소
Solid nitrogen
고체 질소는 질소 원소의 여러 고체 형태이며 1884년에 처음 관찰되었습니다.고체 질소는 주로 학술 연구 대상이지만, 저온, 저압 고체 질소는 태양계 외측 물체의 실질적인 구성 요소이며, 고온, 고압 고체 질소는 강력한 폭발물로, 다른 어떤 비핵 [1]물질보다 에너지 밀도가 높습니다.
시대
카롤 올제프키는 1884년에 처음으로 고체 질소를 관찰했는데, 먼저 수소를 증발하는 액체 질소로 액화시킨 다음 액체 수소가 [2]질소를 얼리도록 놔두었습니다.고체 질소로부터 증기를 증발시킴으로써, Olszewski는 또한 48 K의 매우 낮은 온도를 발생시켰는데, 이는 당시 [3]세계 기록이었다.
현대의 기술들은 대개 비슷한 접근법을 취한다: 고체 질소는 보통 진공상태에서 액체 질소를 증발시켜 실험실에서 만들어진다.생성된 고체는 [4]다공질입니다.
자연발생
고체 질소는 명왕성과 넵투니아 위성 트리톤 표면의 많은 부분을 형성합니다.명왕성에서는 2015년 7월 뉴호라이즌스 우주탐사선에 의해 처음으로 직접 관측되었고 트리톤에서는 1989년 [5][6][7]8월 보이저 2호 우주탐사선에 의해 직접 관측되었다.

고체 질소는 태양계 바깥쪽의 암석 형성과 관련된 몇 가지 특성을 가지고 있습니다.고체 질소의 낮은 온도에서도 상당히 휘발성이 높으며, 대기를 형성하기 위해 승화하거나 질소 서리로 다시 응축될 수 있습니다.다른 물질에 비해 고체 질소는 저압에서 응집력을 잃고 축적되면 빙하 형태로 흐른다.그러나 그것의 밀도는 얼음보다 높기 때문에 부력의 힘은 자연스럽게 얼음 덩어리를 지표로 운반할 것이다.실제로 뉴호라이즌스는 [5]명왕성 표면의 질소 얼음 위에 떠 있는 물 얼음을 관찰했다.
트리톤에서 고체 질소는 서리 결정의 형태를 취하며, 종종 "글레이즈"[7]라고 불리는 아닐 질소 얼음의 투명한 시트 층을 취한다.보이저 2는 트리톤의 남극 [8]만년설 주변 아극 지역에서 질소 가스의 간헐천이 분출되는 것을 관측했다.이 관측된 현상에 대한 가능한 설명은 태양은 투명한 질소 얼음 층을 통해 빛나면서 아래 층을 가열한다는 것이다.질소는 부화해 결국 윗층의 구멍을 통해 분출해 먼지를 운반하고 검은 줄무늬를 만든다.
유체 동소체로 전환
녹는
표준기압에서 N의2 융점은 63.23K이다.[9]
대부분의 물질과 마찬가지로 질소는 액체 질소가 [10][11]중합될 것으로 예상되는 50GPa까지 상승하는 주변 압력과 함께 더 높은 온도에서 녹습니다.이 영역 내에서 녹는점은 약 190K/[10]GPa의 속도로 증가하며, 50GPa를 초과하면 [11]녹는점이 감소합니다.
| 압력(GPA) | 온도(K) |
|---|---|
| 2.8 | 308 |
| 4 | 368 |
| 7 | 484 |
| 50 | 1920 |
| 71[11] | 1400 |
승화
질소는 63.14±0.06K와 0.1255±0.0005bar의 삼중점을 가지며, 이 압력 아래에서는 고체 질소가 [12]기체로 직접 승화한다.이러한 저압에서 질소는 α-질소(35K 이하)와 β-질소(35–63K) 두 가지 알려진 동소체에만 존재한다.20–63 K의 증기 압력 측정 결과 다음과 같은 경험적 [12]공식이 제시된다.
일반적인 극저온원에서의 용해성
고체 질소는 액체 수소에 약간 용해된다.세이달 외 연구진은 60–75K 기체 [13]내 용해도를 바탕으로 15K에서 액체 수소가 (1–10)×1010(분자2 N)/[14]cm3 용해될 수 있다고 추정했다.고형질소가 과잉인 수소의 비등점에서는 용해된 몰 분율이 10이다−8.32.5K(H의2 비등점 바로 아래), 15atm에서 용해된2 N의 최대 몰 농도는 7.0×10이다−6.[15]
결정 구조
질소 결정
주변 압력과 중간 압력에서 질소는 N개의 분자를2 형성합니다. 낮은 온도에서 런던 분산력은 이러한 [16]분자를 고화시키기에 충분합니다.
α와 β
고체 질소는 주변 압력에서 α-와 β-질소의 두 가지 상으로 이루어진다.
35.6K 이하에서 질소는 공간군이 Pa3인 입방체 구조를 채택하고 있으며, N개의 분자는 단위2 세포 입방체의 체대각선에 위치한다.저온에서는 α상이 변화하기 전에 3500atm으로 압축할 수 있으며(θ), 온도가 20K 이상으로 상승하면 이 압력이 약 4500atm까지 상승합니다.21K에서 단위 셀 치수는 5.667Ω으로 3785bar [10][17]이하에서는 5.433Ω으로 감소합니다.
질소는 35.6K 이상(용융될 때까지)에서 단위 셀비 caa 6 1.633 = 8 833의 육각형 밀착 구조를 채택한다.질소 분자는 강한 4극-4극 상호 작용으로 인해 55°의 각도로 무작위로 기울어져 있다.45K에서 단위 셀은 = 4.050Ω 및 c = 6.604Ω이지만, 4125atm 및 49K에서는 a = 3.861Ω 및 c = 6.265Ω으로 축소됩니다.높은 압력에서는 cµa에 변화가 [10][17]거의 없습니다.
γ
사각형 θ 형태는 44.5K 미만의 저온에서 0.3~3GPa 정도의 압력에서 존재한다.α/β/γ2 삼중점은 0.47 GPa와 44.5K에서 발생한다.γ-디질소의 형성은 상당한 동위원소 효과를 나타낸다.20K에서는 천연질소보다 낮은 압력 400atm(0.041Gpa)에서 동위원소 N이 γ 형태로 변환된다.
phase의 스페이스 그룹은2 P4/mnm 입니다.20K 및 4000bar에서 단위 셀의 격자 상수는 a = 3.957Ω, c = 5.170ΩΩ이다.
질소 분자 자체는 P42/mnm 패턴[Note 1] f로 배열되어 있으며, 긴 치수 4.34Ω,[Note 2] 직경 3.39Ω의 프롤레이트 구상체 모양을 하고 있다.분자는 AB면에서 최대 10°, C축 [10][17]방향으로 최대 15°까지 진동할 수 있습니다.
,, ,, εloc
고압(그러나 주변 온도)에서 디니트로겐은 공간 그룹 pm3n과 단위 셀당 8개의 분자를 갖는 입방체 δ 형태를 취한다.이 위상은 6.164Ω(300K 및 4.9GPa에서)[18]의 격자 상수를 허용한다.γ-N은2 트리플 포인트 2개를 허용한다.(γ-N2, β-N2, 액체) 삼중점은 약 8-10 GPa와 555-578K에서 [10]발생한다.(γ-N2, β-N2, β-N, γ-N2) 삼중점은 2.3 GPa 및 150 [18]K에서 발생한다.
격자 세포 내에서는 분자 자체가 방향을 [19]흐트러뜨리지만 압력의 증가는 분자 방향이 점차적으로 정렬되는 약간 다른 위상인 δ로loc 상전이 일어나며, 이는 라만 분광법을 [20]통해서만 볼 수 있는 구별이다.고압(대략 2~13 GPa) 및 저온에서,[Note 3] 디니트로겐 분자 배향은 공간 그룹 [10][19][22]R3c에 따르는 마름모꼴 δ 단계로 완전히 정렬된다.셀 치수는 a = 8.02Ω, b = 8.02Ω, c = 11.104Ω, α = β = 90°,γ = 120°, 부피 618.5Ω3, Z =[23] 24.
용해 고온 또는 저압에서 δ-N으로22 변환하여 안정화시킬 수 있다( related 관련 [19]물질 참조).
ζ
69 GPa 이상에서는 γ-N이2 6%의 부피 감소로 γ-N에2 의해 지정된 오르토롬상으로 변환된다.p-N의2 스페이스 그룹은 P222입니다1.격자 상수는 a = 4.159Ω, b = 2.765Ω, c = 5.039Ω이며 단위 셀당 원자는 8개이다.γ상 질소원자 간 분자간 거리는 0.982–1.93Ω이며, 다른 분자에서 가장 가까운 질소원자는 1.73–2.38Ω이다(압력에 따라 저압은 분자간 [1]거리가 높고 분자간 거리가 낮다).
and와 ι
추가적인 압축과 가열은 놀라운 [24]준안정성으로 질소의 두 가지 결정상을 생성합니다.
δ-N상은 952 GPa로 압축된 후 600K 이상으로 가열되면 균일한 반투명 구조인 δ-질소를 [24]생성한다.
δ상은 65 GPa에서 δ-N~750 K로2 등압가열하거나 850 [25]K에서 δ-N2~69 GPa로 등온감압하여 접근할 수 있다.γ-N2 결정 구조는 56 GPa에서 단위 셀 치수가 a = 9.899(2)Ω, b = 8.863(2)Ω, c = 8.726(2)Ω 및 β = 91.64(3)°인 원시 단사정 격자로 특징지어진다.공간 그룹은 P21/c이고 단위 셀은 48개의2 N개의 분자를 층 [26]구조로 배열합니다.
압력 방출 시, δ-N은2 약 30 GPa까지 δ-N으로2 돌아오지 않고, δ-N은2 약 23 GPa까지 [24]δ-N으로2 변환된다.
흑인 질소
질소를 120–180 GPa 압력과 4000°[27][28]C 이상의 온도로 압축할 때 질소는 흑인(정통, Cmce 공간군)[29]과 동일한 결정 구조("bp-N")를 채택한다.흑인과 마찬가지로 bp-N은 전기 [30]전도체이다.bp-N 구조의 존재는 더 무거운 피닉토겐의 거동과 일치하며, 고압에서 원소가 더 [31]낮은 압력에서 더 무거운 착향제와 동일한 구조를 채택한다는 추세를 재확인한다.
올리고머 결정
육각층 고분자 질소
육각층 고분자 질소(HLP-N)는 244 GPa 및 3300 K에서 실험적으로 합성되었다.그것은 단일 결합 질소 원자가 상호6 연결된 N 육각자의 두 층을 형성하는 사각형 단위 셀(P4bc2)을 채택한다.HPL-N은 적어도 66GPa까지 [32]전이 가능하다.
선형 형식(N6 및 N8)

고압 저온에서 히드라지늄 아지드를 분해하면 질소원자 8개(NnN-N+−=N-NnN−+)의 선형사슬(linear chain)로 이루어진 분자고체가 생성된다.시뮬레이션 결과 N은8 저온 및 압력(< 20 GPa)에서 안정적이며, 실제로 보고된8 N은 25 GPa 이하의 γ 동소체로 분해되지만 잔류물은 3 GPa의 [33][34]압력으로 유지된다.
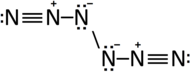
Grechner 등은 2016년에 6개의 니트로겐을 가진 유사한 동소체가 주변 [35]조건에 존재할 것이라고 예측했다.
비정질 및 네트워크 동소체
비분자 형태의 고체 질소는 알려진 가장 높은 비핵 에너지 [1]밀도를 보인다.
μ
150 GPa 이상의 상온에서 γ-N상을2 압축하면 비정질 형태가 [1]생성된다.이것은 μ상으로 명명된 협간극 반도체입니다.μ상은 먼저 100K로 [36]냉각함으로써 대기압으로 전환되었습니다.
η
γ-N은 반도체의 비정질 질소의 형태이다.약 80–270 GPa의 압력과 10–510 K의 온도에서 형성된다.반사광에서는 검은색으로 보이지만 빨간색 또는 노란색 빛을 일부 전달합니다.적외선에는 약 1700cm의−1 흡수 대역이 있습니다.약 280GPa의 더 높은 압력에서는 밴드갭이 닫히고 γ-질소가 금속화된다.[37]
큐빅 고슈
110GPa 이상의 압력과 2000K 내외의 온도에서 질소는 cg-N으로 약칭되는 입방정계 구조의 공유 결합에 의해 결합되는 네트워크 고체를 형성합니다.입방체 형태는 공간 그룹1 I23을 가진다.각 단위 셀은 가장자리 길이가 3.805Ω이며, 8개의 질소 [22]원자를 포함한다.네트워크로서 cg-N은 질소 원자의 융합 고리로 구성되어 있으며, 각 원자에서 결합 각도는 사면체에 매우 가깝다.단일 전자 쌍의 위치는 겹치는 부분이 [36]최소화되도록 범위가 정해져 있습니다.
질소에 대한 입방정-고슈 구조는 1.40Ω의 결합 길이, 114.0°의 결합 각도, -106.8°의 이면각을 가질 것으로 예측된다.gauche라는 용어는 홀수 이면각을 가리키며, 0°일 경우 cis, 180°일 경우 trans라고 합니다.이면각 δ는 sec(δ) = sec(θ) - 1에 의한 결합각 θ와 관련된다. x,x,x에 있는 단위 셀의 한 원자의 좌표도 cos(θ) = x(x-1/4)/(x2+(x-1/2[38]4)에 의해 결합각을 결정한다.
cg-N의 모든 결합은 길이가 같다: [1][39]115 GPa에서 1.346Ω.이는 모든 채권의 순서가 동일함을 시사합니다. 즉, 원자당 4.94 eV를 가진 단일 채권입니다.반면 질소 가스의 삼중 결합은 원자당 0.83 eV밖에 전달하지 않기 때문에 기체 형태에 대한 이완은 다른 어떤 비핵 [1][40]반응보다 엄청난 에너지 방출을 수반합니다.이 때문에 입방정계 질소는 폭발물과 로켓 [1]연료에 사용되는 것으로 조사되고 있다.에너지 밀도의 추정치는 다양하다. 시뮬레이션에서는 10–33 kJ/g가 예측되며, 이는 HMX의 [41][42]에너지 밀도의 160%–300%에 해당한다.
cg-N도 다이아몬드와 [39]비슷한 298 GPa 정도의 부피 계수로 매우 단단하다.
폴리N
pN은 공간 그룹 C2/c, 세포 치수 a = 5.49Ω, β = 87.68°를 가지며,[22] 2006년에는 폴리-N과 약어 pN이라는 또 다른 네트워크 고체 질소가 예측되었다.이론상으로는 다른 고압 고분자 형태가 예측되며 압력이 충분히 [43]높으면 금속 형태가 예상된다.
다른이들
그러나 고체 2질소의 다른 상은 γ'-N2 및 [36]γ-N이라고2 불린다.
대량 속성
58K에서 압축 강도는 0.24MPa입니다.온도가 낮아짐에 따라 강도가 증가하여 40.6K에서 0.54MPa가 됩니다.탄성계수는 같은 [44]범위에서 161~225MPa이다.
고체 질소의 열전도율은 0.7 W m−1−1 [45]K입니다.열 전도율은 온도에 따라 달라지며, 그 관계는 k = 0.1802×T0.1041 W m−1−1 [46]K로 나타납니다. 비열은 [46]켈빈당 킬로그램당 926.91×e0.0093T 줄입니다.50K에서는 투명하고 20K에서는 흰색입니다.
질소 서리는 0.85gcm의−3 [47]밀도를 가지고 있다.부피가 큰 물질로서 결정들은 함께 압착되어 밀도는 물의 밀도에 가깝다.이 값은 온도에 따라 다르며 given = 0.0134T2 - 0.6981T + 1038.1kg/[46]m로3 표시됩니다.팽창 부피 계수는 2×10T−62 - 0.0002T + 0.006K이다−1.[46]
6328Ω에서의 굴절률은 1.25이며 [47]온도에 따라 거의 변하지 않습니다.
고체 질소의 음속은[clarification needed] 20K에서 1452m/s, 44K에서 1222m/s이다.종방향 속도는 5K에서 1850m/s에서 35K에서 1700m/s까지 다양하다.온도 상승에 따라 질소는 위상이 변화하고 종방향 속도는 작은 온도 범위에서 1600m/s 미만으로 빠르게 하락한 다음 녹는 지점 부근에서 1400m/s로 천천히 떨어집니다.가로 속도는 동일한 온도 [16]범위에서 900~800m/s로 훨씬 낮다.
s-N의2 부피 계수는 20K에서 2.16 GPa, 44K에서 1.[16]47 GPa이다.30K 미만의 온도에서 고체 질소는 특히 변형률이 빠르게 적용될 경우 부서지기 쉬운 고장을 겪습니다.이 온도 이상의 고장 모드는 연성 고장입니다.10K를 떨어뜨리면 고체 질소가 10배 더 [16]단단해집니다.
관련 물질
압력 하에서 질소는 다른 분자와 결정성 반데르발스 화합물을 형성할 수 있다.5GPa [48]이상의 메탄과 함께 오르토롬상을 형성할 수 있습니다.헬륨과 함께 He(N2)11가 [19]형성된다.N은2 질소 포접물 중의 물과 산소 O2 및 공기 포접물 [49]중의 물과 혼합물로 결정화된다.
헬륨
고체 질소는 γ-상과 같은 무질서한 단계에서 압력 하에서 2몰 % 헬륨을 용해할 수 있다.헬륨 9몰%의 고압하에서 γ-질소와 반응하여 육각형 복굴절 결정성 반데르발스 화합물을 형성할 수 있다.단위 셀은 22개의 질소 원자와 2개의 헬륨 원자를 포함합니다.11GPa의 압력이 14GPa에서 [19]515O로3 감소했을 때 부피는 580O이다3.이것은 [50]θ-phase와 비슷합니다.14.5GPa 및 295K에서 단위 셀의 공간 그룹은3 P6/m이고 a=7.936Ω c=9.360Ω이다.28 GPa에서 N개 분자의2 배향이 보다 질서 정연해지는 전환이 일어난다.He(N2)11에 가해지는 압력이 135 GPa를 넘으면 투명한 물질에서 검은 물질로 바뀌며 γ-N과2 [51]유사한 비정질 형태를 띤다.
메탄
고체 질소는 일부 고체 메탄과 함께 결정화될 수 있다.55K에서는 몰 비율이 최대 16.354% CH에 이를 수 있으며, 40K에서는 5%에 불과합니다.상호 보완적인 상황에서, 고체 메탄은 결정에 질소를 포함할 수 있으며, 최대 17.31%의 질소를 포함할 수 있습니다.온도가 내려가면 고체 질소에서 녹을 수 있는 메탄은 줄어들고 α-N에서는2 메탄 용해도가 크게 떨어집니다.이러한 혼합물은 표면에 [52]질소와 메탄을 모두 가지고 있는 명왕성과 같은 태양계 바깥쪽 물체에서 널리 발견된다.상온에서는 메탄과 질소의 포접률이 5.6 GPa [53]이상의 압력에서 1:1 비율로 형성된다.
일산화탄소
일산화탄소 분자(CO)는 크기가 디니트로겐과 매우 비슷하며 결정 구조를 바꾸지 않고 고체 질소와 모든 비율로 섞일 수 있다.일산화탄소는 명왕성과 트리톤의 표면에서도 1% 미만의 수준에서 발견된다.일산화탄소 흡수의 적외선 선폭의 변화는 [54]농도를 나타낼 수 있다.
희가스
네온 또는 크세논 원자는 β상 및 β상 고체 질소에 포함될 수도 있다.네온의 포함은 β-γ 위상 경계를 더 높은 [55]압력으로 밀어냅니다.아르곤은 또한 고체 [55]질소에서 매우 혼합되기 쉽다.아르곤과 질소를 60~70% 함유한 질소의 조성은 육각형이 [56]0K로 안정되어 있다.제논과 질소의 반데르발스 화합물이 5.3 GPa [55]이상에 존재합니다.네온과 질소의 반데르발스 화합물은 라만 분광법을 사용하여 [55]표시되었습니다.이2 화합물은 식 (N7)6Ne이다.8 GPa의 압력에서 a=14.400 c=8.0940인 육각형 구조를 가지고 있다.아르곤을 포함한 반데르발스 화합물은 알려져 [57]있지 않다.
수소
중수소를 사용하면 포접물(N2)12D가2 약 70GPa에서 [58]나옵니다.
산소
고체 질소는 산소2 O에 의해 1/5 치환될 수 있지만 여전히 동일한 결정 [59]구조를 유지할 수 있습니다.γ-N은2 최대 952% O로 치환할 수 있으며 동일한 구조를 유지한다.고체2 O는 5% 이하의 [59]N의 고체2 용액만을 가질 수 있다.
사용하다
고체 질소는 액체 질소를 단독으로 사용하는 것보다 더 빨리 냉각하기 위해 액체 질소와 슬러시 혼합물에 사용되며, 정자 저온 [60]보존과 같은 용도에 유용합니다.반고체 혼합물은 슬러시[61] 질소 또는 SN2라고도 [62]불립니다.
고체 질소는 활성산소나 고립된 [63]원자와 같은 반응성 화학종을 저장하고 연구하기 위한 매트릭스로 사용됩니다.한 가지 용도는 금속의 디니트로겐 복합체를 다른 [64]분자와 분리하여 연구하는 것이다.
반응
고속의 양성자 또는 전자에 의해 고체 질소가 조사되면 원자 질소(N), 질소 양이온+(N), 질소 양이온(N2+), 트리니트로겐 라디칼(N3 및3+ N) 및 아지드화물3−([65]N)을 포함한 몇 가지 반응성 라디칼이 형성된다.
메모들
- ^ 단위 셀 내에서 원자는 x = (원자간 거리) / (원자간 거리) (원자간 거리) / (원자간 거리) (원자간 거리) (원자간 거리) (원자간 거리) (원자간 거리) (원자간 거리) (원자간 거리) (원자간 거리) (원자간 거리) (원자간 거리) (원자간 거리) (원자간 거리) (원자간 거리 (원자간 거리 (원자간 거리) (원자간 거리) (원자간 거리) (원자간 거리) (원자간 거리 (원자간 거리) (원자간 거리) (원자간 거리) (원자간 거리) (원자간이것은 AB 평면에서 대각선으로 끝에서 끝까지 줄지어 있는 분자에 해당합니다.이러한 행은 분자가 C축에 수직인 (001) 평면에서 층을 형성하기 위해 길이의 절반만큼 오프셋된 분자와 함께 나란히 쌓입니다.그런 다음 층이 서로 겹쳐 쌓이고, 각 층은 아래 평면에 비해 90° 회전합니다.
- ^ 불확도 원리로 인해 N에 대한2 전자파 함수는 무한대 범위를 갖는다.인용 치수는 전자 밀도 0.0135 (e−)/O에서3 임의의 컷오프에 해당합니다.
- ^ 「-」상 전이 온도는 압력에 따라 크게 변화합니다.2 GPa에서는 약 50K의 [21]이행이 발생합니다.
레퍼런스
- ^ a b c d e f g Eremets, M. I.; Gavriliuk, A. G.; Serebryanaya, N. R.; Trojan, I. A.; Dzivenko, D. A.; Boehler, R.; Mao, H. K.; Hemley, R. J. (2004). "Structural transformation of molecular nitrogen to a single-bonded atomic state at high pressures" (PDF). The Journal of Chemical Physics. 121 (22): 11296–300. Bibcode:2004JChPh.12111296E. doi:10.1063/1.1814074. PMID 15634085. S2CID 25122837.
- ^ Olszewski, K (1884). "Nouveaux essais de liquéfaction de l'hydrogène. Solidification et pression critique de l'azote". Comptes Rendus Hebdomadaires des Séances de l'Académie des Sciences (in French). 98: 913–915.
- ^ Cohen, E. G. D. (1 January 1977). "Toward Absolute Zero: During the past three centuries attempts to approach the absolute zero of temperature have led to the discovery of many important phenomena, including superconductivity and superfluidity". American Scientist. 65 (6): 752–758. Bibcode:1977AmSci..65..752C. JSTOR 27848176.
- ^ Mikhal'chenko, R. S.; Getmanets, V. F.; Arkhipov, V. T. (September 1972). "Peculiarities of heat transfer in porous solid nitrogen". Journal of Engineering Physics. 23 (3): 1075–1081. Bibcode:1972JEP....23.1075M. doi:10.1007/BF00832213. S2CID 121585322.
- ^ a b "Pluto's mysterious floating hills". NASA. 2016-02-04. Retrieved 1 May 2016.
- ^ "Flowing nitrogen ice glaciers seen on surface of Pluto after New Horizons flyby". ABC. 25 July 2015. Retrieved 6 October 2015.
- ^ a b McKinnon, William B.; Kirk, Randolph L. (2014). "Triton". In Spohn, Tilman; Breuer, Doris; Johnson, Torrence (eds.). Encyclopedia of the Solar System (3rd ed.). Amsterdam; Boston: Elsevier. pp. 861–882. ISBN 978-0-12-416034-7.
- ^ "Neptune: Moons: Triton". NASA. Archived from the original on October 15, 2011. Retrieved September 21, 2007.
- ^ Lide, David R. (1990–1991). CRC Handbook of Physics and Chemistry (71st ed.). Boca Raton, Ann Arbor, Boston: CRC Press, inc. pp. 4–22 (one page).
- ^ a b c d e f g h Tonkov, E. Yu; Ponyatovsky, E.G. (15 November 2004). Phase Transformations of Elements Under High Pressure. CRC Press. pp. 126–132. ISBN 978-0-8493-3367-5.
- ^ a b c Mukherjee, Goutam Dev; Boehler, Reinhard (30 November 2007). "High-Pressure Melting Curve of Nitrogen and the Liquid-Liquid Phase Transition". Physical Review Letters. 99 (22): 225701. Bibcode:2007PhRvL..99v5701M. doi:10.1103/PhysRevLett.99.225701. PMID 18233298.
- ^ a b Fray, N.; Schmitt, B. (December 2009). "Sublimation of ices of astrophysical interest: A bibliographic review". Planetary and Space Science. 57 (14–15): 2053–2080. Bibcode:2009P&SS...57.2053F. doi:10.1016/j.pss.2009.09.011.
- ^ Omar, M. H.; Dokoupil, Z. (1962-01-01). "Some supplementary measurements on the vapour-liquid equilibrium of the system hydrogen-nitrogen at temperatures higher than the triple point of nitrogen". Physica. 28 (1): 33–43. Bibcode:1962Phy....28...33O. doi:10.1016/0031-8914(62)90089-7. ISSN 0031-8914.
- ^ Seidel, G. M.; Maris, H. J.; Williams, F. I. B.; Cardon, J. G. (2 June 1986). "Supercooling of Liquid Hydrogen". Physical Review Letters. 56 (22): 2380–2382. Bibcode:1986PhRvL..56.2380S. doi:10.1103/PhysRevLett.56.2380. PMID 10032971.
- ^ Omar, M.H.; Dokoupil, Z. (May 1962). "Solubility of nitrogen and oxygen in liquid hydrogen at temperatures between 27 and 33°K". Physica. 28 (5): 461–471. Bibcode:1962Phy....28..461O. doi:10.1016/0031-8914(62)90033-2.
- ^ a b c d Yamashita, Yasuyuki; Kato, Manabu; Arakawa, Masahiko (June 2010). "Experimental study on the rheological properties of polycrystalline solid nitrogen and methane: Implications for tectonic processes on Triton". Icarus. 207 (2): 972–977. Bibcode:2010Icar..207..972Y. doi:10.1016/j.icarus.2009.11.032.
- ^ a b c Schuch, A. F.; Mills, R. L. (1970). "Crystal Structures of the Three Modifications of Nitrogen 14 and Nitrogen 15 at High Pressure". The Journal of Chemical Physics. 52 (12): 6000–6008. Bibcode:1970JChPh..52.6000S. doi:10.1063/1.1672899.
- ^ a b Cromer, D. T.; Mills, R. L.; Schiferi, D.; Schwalbe, L. A. (15 January 1981). "The structure of N2 at 49 kbar and 299 K". Acta Crystallographica Section B: Structural Crystallography and Crystal Chemistry. 37 (1): 8–11. doi:10.1107/S0567740881002070.
- ^ a b c d e Vos, W. L.; Finger, L. W.; Hemley, R. J.; Hu, J. Z.; Mao, H. K.; Schouten, J. A. (2 July 1992). "A high-pressure van der Waals compound in solid nitrogen-helium mixtures". Nature. 358 (6381): 46–48. Bibcode:1992Natur.358...46V. doi:10.1038/358046a0. S2CID 4313676.
- ^ Tassini, Leonardo; Gorelli, Federico; Ulivi, Lorenzo (2005-02-04). "High temperature structures and orientational disorder in compressed solid nitrogen". The Journal of Chemical Physics. 122 (7): 074701. Bibcode:2005JChPh.122g4701T. doi:10.1063/1.1849154. ISSN 0021-9606. PMID 15743259.
- ^ Mills, R. L.; Olinger, Bart; Cromer, D. T. (1986). "Structures and phase diagrams of N2 and CO to 13 GPa by x-ray diffraction". The Journal of Chemical Physics. 84 (5): 2837. Bibcode:1986JChPh..84.2837M. doi:10.1063/1.450310.
- ^ a b c Kotakoski, J.; Albe, K. (10 April 2008). "First-principles calculations on solid nitrogen: A comparative study of high-pressure phases". Physical Review B. 77 (14): 144109. Bibcode:2008PhRvB..77n4109K. doi:10.1103/PhysRevB.77.144109.
- ^ NIMS. "Atom Work Materials Database". Retrieved 3 October 2015.
- ^ a b c Goncharov, A.; Gregoryanz, E. (15 April 2004). Solid Nitrogen at Extreme Conditions of High Pressure and Temperature. Lawrence Livermore National Lab Special Collections (Report). Chemistry at Extreme Conditions. Archived (PDF) from the original on 28 January 2017. Retrieved 6 December 2021.
- ^ Gregoryanz, E.; Goncharov, A. F.; Hemley, R. J.; Mao, H. K.; Somayazulu, M.; Shen, G. (13 December 2002). "Raman, infrared, and x-ray evidence for new phases of nitrogen at high pressures and temperatures". Phys. Rev. B. 66 (22): 224108. Bibcode:2002PhRvB..66v4108G. doi:10.1103/physrevb.66.224108.
- ^ Turnbull, R.; Hanfland, M.; Binns, J.; Martinez-Canales, M.; Frost, M.; Marqués, M.; Howie, R.; Gregoryanz, E. (9 November 2018). "Unusually complex phase of dense nitrogen at extreme conditions". Nature Communications. 9 (1): 4717. Bibcode:2018NatCo...9.4717T. doi:10.1038/s41467-018-07074-4. PMC 6226474. PMID 30413685.
- ^ "Never-before-seen "black nitrogen" plugs puzzle in periodic table". New Atlas. 2 June 2020. Retrieved 16 July 2020.
- ^ "검은 질소" – 과학자들이 주기율표의 퍼즐을 푼다.SciTech Daily에 대해서2020년 6월 6일
- ^ Laniel, Dominique; Winkler, Bjoern; Fedotenko, Timofey; Pakhomova, Anna; Chariton, Stella; Milman, Victor; Prakapenka, Vitali; Dubrovinsky, Leonid; Dubrovinskaia, Natalia (2020-05-28). "High-Pressure Polymeric Nitrogen Allotrope with the Black Phosphorus Structure". Physical Review Letters. 124 (21): 216001. arXiv:2003.02758. Bibcode:2020PhRvL.124u6001L. doi:10.1103/PhysRevLett.124.216001. ISSN 0031-9007. PMID 32530671. S2CID 212414928.
- ^ Delbert, Caroline (4 June 2020). "Scientists Have Created Black Nitrogen". Popular Mechanics. Retrieved 16 July 2020.
- ^ Ultrahigh-pressure mineralogy : physics and chemistry of the earth's deep interior. Hemley, Russell J. (Russell Julian). Washington, DC: Mineralogical Society of America. 1998. ISBN 0-939950-48-0. OCLC 40542380.
{{cite book}}: CS1 유지보수: 기타 (링크) - ^ Laniel, D.; Geneste, G.; Weck, G.; Mezouar, M.; Loubeyre, P. (2019-02-11). "Hexagonal Layered Polymeric Nitrogen Phase Synthesized near 250 GPa". Physical Review Letters. 122 (6): 066001. Bibcode:2019PhRvL.122f6001L. doi:10.1103/PhysRevLett.122.066001. ISSN 0031-9007. PMID 30822079. S2CID 73462260.
- ^ a b Hirshberg, Barak; Krylov, Anna I.; Gerber, R. Benny (January 2014). "Calculations predict a stable molecular crystal of N8" (PDF). Nature Chemistry. 6 (1): 52–56. Bibcode:2014NatCh...6...52H. doi:10.1038/nchem.1818. ISSN 1755-4349. PMID 24345947.
- ^ Duwal, Sakun; Ryu, Young-Jay; Kim, Minseob; Yoo, Choong-Shik; Bang, Sora; Kim, Kyungtae; Hur, Nam Hwi (2018-04-07). "Transformation of hydrazinium azide to molecular N8 at 40 GPa". The Journal of Chemical Physics. 148 (13): 134310. Bibcode:2018JChPh.148m4310D. doi:10.1063/1.5021976. ISSN 0021-9606. OSTI 1432864. PMID 29626901.
- ^ a b 마이클 J. 그레스치너 외 (2016년 4월)"고에너지 밀도 물질로서의 질소의 새로운 동소체"물리화학 저널 A120(18) doi:10.1021/acs.jpca.6b01655.
- ^ a b c Plašienka, Dušan; Martoňák, Roman (7 March 2015). "Transformation pathways in high-pressure solid nitrogen: From molecular N2 to polymeric cg-N". The Journal of Chemical Physics. 142 (9): 094505. arXiv:1412.1246. Bibcode:2015JChPh.142i4505P. doi:10.1063/1.4908161. PMID 25747092. S2CID 119112608.
- ^ Gregoryanz, Eugene; Goncharov, Alexander F.; Hemley, Russell J.; Mao, Ho-kwang (13 July 2001). "High-pressure amorphous nitrogen". Physical Review B. 64 (5): 052103. arXiv:cond-mat/0105101v1. Bibcode:2001PhRvB..64e2103G. doi:10.1103/PhysRevB.64.052103. S2CID 119343638.
- ^ Mailhiot, C.; Yang, L. H.; McMahan, A. K. (1 December 1992). "Polymeric nitrogen". Physical Review B. 46 (22): 14419–14435. Bibcode:1992PhRvB..4614419M. doi:10.1103/PhysRevB.46.14419. PMID 10003540.
- ^ a b Boehler, Reinhard (November 2005). "Diamond cells and new materials". Materials Today. 8 (11): 34–42. doi:10.1016/S1369-7021(05)71158-5.
- ^ Eremets, Mikhail I.; Gavriliuk, Alexander G.; Trojan, Ivan A.; Dzivenko, Dymitro A.; Boehler, Reinhard (4 July 2004). "Single-bonded cubic form of nitrogen". Nature Materials. 3 (8): 558–563. Bibcode:2004NatMa...3..558E. doi:10.1038/nmat1146. PMID 15235595. S2CID 38483662.
- ^ Yoo, Choong-Shik (February 2003). "Novel Functional Extended Solids at Extreme Conditions". DTIC. p. 11. Archived from the original on March 4, 2016. Retrieved 5 October 2015.
- ^ Bondarchuk, Sergey V.; Minaev, Boris F. (2017). "Super high-energy density single-bonded trigonal nitrogen allotrope—a chemical twin of the cubic gauche form of nitrogen". Physical Chemistry Chemical Physics. 19 (9): 6698–6706. Bibcode:2017PCCP...19.6698B. doi:10.1039/C6CP08723J. PMID 28210733 – via The Royal Society of Chemistry.
- ^ Ma, Yanming; Oganov, Artem R.; Li, Zhenwei; Xie, Yu; Kotakoski, Jani (9 February 2009). "Novel High Pressure Structures of Polymeric Nitrogen". Physical Review Letters. 102 (6): 065501. Bibcode:2009PhRvL.102f5501M. doi:10.1103/PhysRevLett.102.065501. PMID 19257600.
- ^ Pederson, R. C.; Miller, C. D.; Arvidson, J. M.; Blount, K.; Schulze, M. (1998). "Problems Involved in Determining the Mechanical Properties of Solid Nitrogen and a Composite of Solid Nitrogen and Aluminum Foam (40 K – 61 K)". In Balachandran, U. B.; Gubser, D. G.; Hartwig, K. T.; Reed, R.; Warnes, W. H.; Bardos, V. A. (eds.). Advances in Cryogenic Engineering (Materials). Vol. 44. Springer Science & Business Media. pp. 339–347. ISBN 9781475790566.
- ^ Cook, T.; Davey, G. (June 1976). "The density and thermal conductivity of solid nitrogen and carbon dioxide". Cryogenics. 16 (6): 363–369. Bibcode:1976Cryo...16..363C. doi:10.1016/0011-2275(76)90217-4.
- ^ a b c d Trowbridge, A. J.; Melosh, H. J.; Steckloff, J. K.; Freed, A. M. (1 June 2016). "Vigorous convection as the explanation for Pluto's polygonal terrain". Nature. 534 (7605): 79–81. Bibcode:2016Natur.534...79T. doi:10.1038/nature18016. PMID 27251278. [ Methods ]섹션
- ^ a b Satorre, M. A.; Domingo, M.; Luna, R.; Santonja, C. (30 November 2004). "Density of Methane and Nitrogen at Different Temperatures" (PDF). Springer. Retrieved 1 October 2015.
- ^ Aldous, Catherine; Desgreniers, Serge (2008). "Novel van der Waals Solid Phases in the Methane-Nitrogen Binary System" (PDF). Retrieved 21 September 2015.
- ^ Choukroun, Mathieu; Kieffer, Susan W.; Lu, Xinli; Tobie, Gabriel (2013). "Clathrate Hydrates: Implications for Exchange Processes in the Outer Solar System". The Science of Solar System Ices. pp. 409–454. doi:10.1007/978-1-4614-3076-6_12. ISBN 978-1-4614-3075-9.
- ^ Olijnyk, H; Jephcoat, A P (15 December 1997). "High-pressure Raman studies of a nitrogen – helium mixture up to 40 GPa". Journal of Physics: Condensed Matter. 9 (50): 11219–11226. Bibcode:1997JPCM....911219O. doi:10.1088/0953-8984/9/50/022.
- ^ Ninet, S. (1 January 2011). "Structural and vibrational properties of the van der Waals compound (N2)11He up to 135 GPa". Physical Review B. 83 (13): 134107. Bibcode:2011PhRvB..83m4107N. doi:10.1103/PhysRevB.83.134107.
- ^ Protopapa, S.; Grundy, W.M.; Tegler, S.C.; Bergonio, J.M. (June 2015). "Absorption coefficients of the methane–nitrogen binary ice system: Implications for Pluto". Icarus. 253: 179–188. arXiv:1503.00703. Bibcode:2015Icar..253..179P. doi:10.1016/j.icarus.2015.02.027. S2CID 96796422.
- ^ Aldous, Catherine. "Novel van der Waals Solid Phases in the Methane-Nitrogen Binary System" (PDF). www.lightsource.ca. Retrieved 22 September 2015.
- ^ Quirico, Eric; Schmitt, Bernard (July 1997). "A Spectroscopic Study of CO Diluted in N2Ice: Applications for Triton and Pluto". Icarus. 128 (1): 181–188. Bibcode:1997Icar..128..181Q. doi:10.1006/icar.1997.5710.
- ^ a b c d Kooi, M. E.; Schouten, J. A. (1 November 1999). "High-pressure Raman investigation of mutual solubility and compound formation in Xe-N2 and NeN2" (PDF). Physical Review B. 60 (18): 12635–12643. Bibcode:1999PhRvB..6012635K. doi:10.1103/PhysRevB.60.12635.
- ^ Nosé, Shuichi; Klein, Michael L. (October 1985). "Molecular dynamics study of the alloy (N2)67(Ar)29". Canadian Journal of Physics. 63 (10): 1270–1273. Bibcode:1985CaJPh..63.1270N. doi:10.1139/p85-209.
- ^ Lotz, H. T.; Schouten, J. A. (19 June 2001). "Phase behavior of the N2-Ar system at high pressures: A Raman spectroscopy study". Physical Review B. 64 (2): 024103. Bibcode:2001PhRvB..64b4103L. doi:10.1103/PhysRevB.64.024103.
- ^ Kim, Minseob; Yoo, Choong-Shik (2011). "Highly repulsive interaction in novel inclusion D2–N2 compound at high pressure: Raman and x-ray evidence". The Journal of Chemical Physics. 134 (4): 044519. Bibcode:2011JChPh.134d4519K. doi:10.1063/1.3533957. PMID 21280760.
- ^ a b Sihachakr, D.; Loubeyre, P. (15 October 2004). "O2 / N2 mixtures under pressure: A structural study of the binary phase diagram at 295 K". Physical Review B. 70 (13): 134105. Bibcode:2004PhRvB..70m4105S. doi:10.1103/PhysRevB.70.134105.
- ^ Sansinena, M; Santos, MV; Zaritzky, N; Chirife, J (May 2012). "Comparison of heat transfer in liquid and slush nitrogen by numerical simulation of cooling rates for French straws used for sperm cryopreservation". Theriogenology. 77 (8): 1717–1721. doi:10.1016/j.theriogenology.2011.10.044. PMID 22225685.
- ^ Schutte, Eliane; Picciolo, Grace Lee; Kaplan, David S. (2004). Tissue Engineered Medical Products (TEMPs). ASTM International. p. 8. ISBN 9780803134713.
- ^ Porcu, Eleonora; Ciotti, Patrizia; Venturoli, Stefano (2012-12-06). Handbook of Human Oocyte Cryopreservation. Cambridge University Press. p. 33. ISBN 9781139851022.
- ^ Becker, Edwin D.; Pimentel, George C. (1956). "Spectroscopic Studies of Reactive Molecules by the Matrix Isolation Method". The Journal of Chemical Physics. 25 (2): 224. Bibcode:1956JChPh..25..224B. doi:10.1063/1.1742860.
- ^ Ozin, Geoffrey A.; Voet, Anthony Vander (15 October 1973). "Binary Dinitrogen Complexes of Rhodium, Rh(N2)n (where n= 1–4), in Low Temperature Matrices". Canadian Journal of Chemistry. 51 (20): 3332–3343. doi:10.1139/v73-498.
- ^ Wu, Yu-Jong; Chen, Hui-Fen; Chuang, Shiang-Jiun; Huang, Tzu-Ping (10 December 2013). "Far Ultraviolet Absorption Spectra of N3 AND N2+ Generated by Electrons Impacting Gaseous N 2". The Astrophysical Journal. 779 (1): 40. Bibcode:2013ApJ...779...40W. doi:10.1088/0004-637X/779/1/40.
외부 링크
 Wikimedia Commons의 고체 질소와 관련된 미디어
Wikimedia Commons의 고체 질소와 관련된 미디어- Jessica Orwig: 액화 질소를 얼리면 놀라운 것을 만들 수 있다.온: 비즈니스인사이드.2015년 1월 28일 - 질소 비등, 동결, 결정 형태 자연 변화 영상
- Xiaoli Wang, J. Li, N. Xu 등 (2015):고압에서3 RbN의 층상 고분자 질소.인: Scientific Reports 제5권, 문서번호: 16677.doi:10.1038/srep16677.




