선택적 글루코르티코이드 수용체 변조기
Selective glucocorticoid receptor modulator| 선택적 글루코르티코이드 수용체 변조기 | |
|---|---|
| 마약류 | |
 | |
| 클래스 식별자 | |
| 동의어 | SEGRM; SEGRA; SEGRAM; DIGRA |
| 사용하다 | 잠재적으로 아토피 피부염, 녹내장, 백내장, 눈병 등 |
| 생물학적 표적 | 글루코르티코이드수용체 |
| 케미컬 클래스 | 스테로이드, 비스테로이드 |
| 위키다타에서 | |
선택적 글루코르티코이드 수용체 조절제(SEGRMs)와 선택적 글루코르티코르티코이드 수용체 작용제(SEGRAs)는 기존의 분리형 글루코코르티코이드 수용체 작용제(DIGRAs)로 알려진 선택적 글루코코르티코이드의 바람직한 항염증, 면역억제 또는 항암 특성을 많이 공유하도록 설계된 실험 의약품의 일종이다.gs 하지만 피부 위축과 같은 부작용은 적다.SEGRAMs의 항염증 효과에 대한 임상 전 증거가 절정에 달하고 있지만,[2] 현재 암에 대한 이러한 SEGRAM의 효능은 대부분 알려져 있지 않다.
선택적 글루코르티코이드 수용체 작용제(SEGRA)는 역사적으로, 전형적으로 스테로이드 구조인 반면 선택적 글루코르티코이드 수용체 조절제(SEGRM)는 전형적으로 비스테로이드 구조다.선택적 글루코코르티코이드 수용체 작용제와 조절기를 합친 약어는 SEGRAM이다.[2]그러한 리간드가 많이 개발되어 전임상 및 임상시험에서 평가되고 있다.
SEGRAM은 글루코코르티코이드 수용체 작용 메커니즘의 부분 집합만 트리거하여 선택성을 달성한다.[3][4]
역사
SEGRA와 같은 성질을 가진 합성 스테로이드는 이미 1990년대 후반에 발견되었다.[5]2000년대에는 많은 잠재적 SEGRAM이 합성되었는데, 대부분은 비스테로이드 구조를 가지고 있다.세포 모델의 시험관내 연구에서 이러한 SEGRAM 분자는 강력한 글루코코르티코이드인 덱사메타손과 유사한 친화력과 인터루킨 6 및 프로스타글란딘 E2와 같은 염증 매개체의 생산을 억제하는 능력을 가지고 글루코르티코이드 수용체에 결합된다.[6]게다가, 체외에서 특정 SEGRAM은 전립선암과[7] 백혈병에서 사멸을 촉진할 수 있다.[8]
마우스와 랫드를 대상으로 한 생체내 연구에서는 국소 투여 SEGRAM이 항염증 활성의 두 지표인 과산화질소 활성과 오이데마의 형성을 억제하는 것으로 나타났으며, 이는 비교적으로 프레드니솔론과 비교된다.쥐나 쥐의 전신 투여는 SEGRAM이 급성 감염, 류마티스 관절염, 천식, 대장염을 감소시킬 수 있음을 나타낸다.[2]특정 SEGRAM이 암 병리학에서 고전적인 글루코코르티코이드와 유사한 효과를 이끌어낼 수 있는지에 대한 생체내 증거는 현재 부족하다.현재 임상 전 테스트에서는 지금까지 이용할 수 있는 SEGRAM이 기존의 글루코코르티코이드보다 부작용이 적거나 적어도 심각한 부작용이 적다는 것을 보여준다.[2]예를 들어, 쥐의 피부 위축은 SEGRAM Mapracorat를 사용한 연구에서 프레드니솔론보다 현저하게 덜 발현되었으며, 체중 증가나 혈당 증가와 같은 대사 효과는 실질적으로 존재하지 않았다.[9]
작용기전
비선택성 글루코르티코이드와 선택적 글루코코르티코이드 수용체 작용제는 모두 글루코코르티코이드 수용체(GR)에 결합하고 활성화하여 작용한다.GR이 (적어도) 두 개의 신호 전달 경로를 통해 작동하도록 작동하는 글루코코르티코이드와는 대조적으로,[10] SEGRAM은 가능한 두 개의 주요 경로 중 하나를 통해서만 작동하도록 GR을 활성화한다.[11]
글루코코르티코이드가 없을 때 GR은 열충격 단백질(HSP)과 면역성 섬유소가 복합된 비활성 상태의 시토솔에 상주한다.글루코코르티코이드를 GR에 결합하면 GR에 순응적인 변화를 일으켜 결합 HSP가 분리되어 수용체가 활성화된다.활성화된 GR은 다음 두 가지 경로 중 하나를 통해 유전자 발현을 조절할 수 있다.[10]
- 불활성화
- 첫 번째 (직접) 경로를 트랜스액션이라고 하는데, 활성화된 GR이 디머레이즈를 통해 핵으로 번역되어 글루코코르티코이드 반응 요소(GREs)라고 불리는 DNA의 특정 시퀀스에 결합된다.GR/DNA 콤플렉스는 다운스트림 DNA를 mRNA로 변환하고 결국 단백질을 만드는 다른 단백질을 모집한다.글루코코르티코이드 반응 유전자의 예로는 annexin A1, TSC22D3(일명 GILZ), 안지오텐신전환효소, 중성내포피디아제 및 기타 항염증 단백질을 인코딩하는 유전자가 있다.
- 트랜스프레션
- 두 번째(간접적) 경로를 트랜스프레션이라고 하는데, 활성화된 모노메릭 GR이 NF-118B, AP-1과 같은 다른 전사 요인에 결합하여 표적 유전자의 발현을 상향 조절하는 것을 방지한다.이 표적 유전자들은 사이클록시제네아제, NO 신타아제, 인지페아제 A2, 종양 괴사 인자, 성장인자 베타, ICAM-1, 그리고 많은 다른 친염증 단백질과 같은 단백질을 암호화한다.
따라서 글루코코르티코이드의 항염증 효과는 트랜스액션과 트랜스프레션 모두에서 발생한다.이와는 대조적으로 쥐와 쥐를 대상으로 한 연구에서는 당뇨병성 활동, 골다공증, 피부 위축 등 글루코코르티코이드의 부작용 대부분이 주로 트랜스액션에 의한 것으로 나타났다.[9][12][13]트랜스액션 없이 트랜스프레스가 가능한 선택적 글루코코르티코이드(glucocorticoid)는 바람직한 치료용 항염증 효과를 많이 보존하고 이러한 특정한 원치 않는 부작용을 최소화해야 한다.[11]
투압만으로 항염증 반응에 충분하다는 초기 증거는 쥐의 GR에 점 돌연변이를 도입하여 GR의 감광 및 DNA 결합을 방지하고 그에 따라 변동을 차단함으로써 제공되었다.[14][15]동시에 이 돌연변이는 전압을 방해하지 않았다.GR이 생존을 위해 필수적이지만, 이 쥐들은 여전히 생존할 수 있다.[14]그러나 이들 생쥐를 합성 글루코르티코이드 덱사메타손(dexamethasone)으로 치료할 때는 포도당의 상승이 없었다.이 덱사메타손 처리 쥐들은 염증성 자극에 내성이 있었다.[15]따라서 이러한 생쥐는 덱사메타손의 항염증 효과에 반응했지만 적어도 일부 부작용에는 내성이 있었다.
글루코코르티코이드와 마찬가지로 SEGRAM도 GR에 결합해 활성화한다.그러나 글루코코르티코이드와는 대조적으로 SEGRAM은 GR을 개선된 치료상의 이익을 산출하는 방식으로 선택적으로 활성화한다.일반적으로 특정 염증 기반 질환의 경우 SEGRAM은 불활성화보다 더 강하게 환원해야 하며, 또는 단독으로 환원하거나 환원하지 않는 것이 좋다.이러한 유형의 선택적 GR 활성화는 고전적인 글루코코르티코이드로 만성 치료와 함께 나타나는 예상 부작용보다 적은 부작용을 초래해야 한다.[16]
임상시험
후보 화합물 중 하나인 mapracorat(코드명 BOL-303242-X 및 ZK 245186[17])를 사용한 임상 2상은 2009년 여름부터 시작되었다.하나는 피부과 전문 바이엘헬스케어제약 소속인 랜디스가 시행한 아토피 예방 연고 2회 블라인드 투여 연구였다.[18]2010년 11월부터 바우쉬앤롬이 실시한 백내장 수술에 따른 염증 치료에 대한 안과 정지를 평가하는 3단계 임상시험이 시작됐다.[19]
류마티스 관절염에 대한 또 다른 불연속 글루코코르티코이드 fosdagrocorat (PF-04171327) (PF-00251802)의 인산염 에스테르 프로드러그로코라트([20][21]Phosphate ester prodrug of dagrocorat, PF-00251802)를 사용한 2상 임상시험은 2011년에 화이 시작되었다.[22]
이들 임상시험의 결과는 아직 공개되지 않았으며, 아직 임상사용 승인을 받은 SEGRAM은 없다.
잠재적 응용 프로그램
아토피성 피부염(피부), 류마티스성 관절염(관절),... 코르티코스테로이드 등의 만성 염증성 질환에서는 장기간 치료가 필요하기 때문에 코르티코스테로이드의 부작용이 문제가 된다.따라서 SEGRAMs는 대체적인 국소적 치료법으로 조사되고 있다.코르티코스테로이드로 인화물의 전신 장기 치료는 특히 대사 부작용을 일으키기 쉬우므로 구강 SEGRAM의 개발은 흥미로운 목표가 된다.[23]선택적 수용체 작용제나 조절기가 실제로 임상 적용에서 고전적인 코르티코이드보다 훨씬 적은 부작용을 일으키는지는 두고 봐야 한다.
유익한 위축효과
물론 글루코코르티코이드의 위축된 효과가 항상 단점은 아니다.건선과 같은 고프로바이벌 질병의 치료는 이 성질을 이용한다.[24]SEGRAM은 그러한 조건에서 덜 효과적일 것이다.최근의 발전은 GILZ와 DUSP1과 같이 GR 전이로부터 자극을 받은 항염증 유전자가 중요한 역할을 하는 것처럼 보이기 때문에 SEGRAMs를 사용하여 GR 전압과 전극의 완전한 분리를 위해 노력했던 전자는 뉘앙스를 가질 만하다는 것을 보여주었다.[25][26]그럼에도 불구하고, 이러한 SEGRAM의 보다 선택적인 성질은 여전히 GR 매개 부작용의 수를 감소시킬 것이며, 추가적인 임상 시험을 받을 가치가 있다.
화학


초기 SEGRA는 합성 스테로이드였다.이러한 유형의 첫 번째 화합물 중 하나인 RU 24858을 예로 들 수 있다.[5]스테로이드와의 유사성은 여전히 벤조피라노키놀린 A 276575나 옥타히드롭헤난트렌-2,7-다이올과 같은 분자에서 볼 수 있지만, 많은 새로운 SEGRA는 다른 체계를 가지고 있다.이 모든 화합물은 세포나 동물 모델에서 SEGRA 특성을 나타내는 것으로 밝혀졌다.[3]
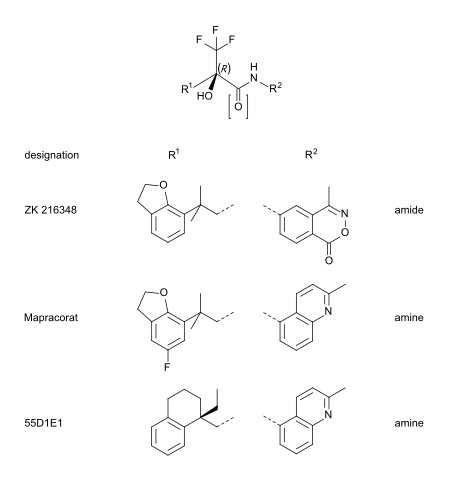
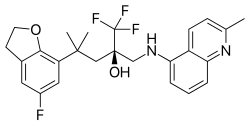
Mapracorat는 구조상 스테로이드 유사성이 덜 분명한 트리플루오로프로파놀아민과 -amides 중 하나이다.이 그룹의 다른 대표적인 예는 ZK 216348과[9] 55D1E1이다.[4]부피가 큰 자전거 방향족(R12, R)은 코르티코이드와 구조적 유사성을 설명한다.비대칭 탄소 원자의 R 순응은 GR 친화력을 위해 필수적인 것으로 보인다.[9]
SEGRM 목록
- Dagrocorat(PF-00251802, PF-251802)
- Fosdagrocorat(PF-04171327, PF-4171327)
- Mapracorat(BOL-303242-X, ZK-245186)
참고 항목
| 위키미디어 커먼스는 선택적 글루코코르티코이드 수용체 작용제와 관련된 미디어를 보유하고 있다. |
참조
- ^ Mealy N; Dulsat C (2009). "36th Annual Meeting of the Arbeitsgemeinschaft Dermatologische Forschung (ADF)". Drugs Fut. 34 (4): 341.
- ^ a b c d Sundahl N, Bridelance J, Libert C, De Bosscher K, Beck IM (May 2015). "Selective glucocorticoid receptor modulation: New directions with non-steroidal scaffolds". Pharmacology & Therapeutics. 152: 28–41. doi:10.1016/j.pharmthera.2015.05.001. PMID 25958032.
- ^ a b c Robinson RP, Buckbinder L, Haugeto AI, McNiff PA, Millham ML, Reese MR, Schaefer JF, Abramov YA, Bordner J, Chantigny YA, Kleinman EF, Laird ER, Morgan BP, Murray JC, Salter ED, Wessel MD, Yocum SA (Mar 2009). "Octahydrophenanthrene-2,7-diol analogues as dissociated glucocorticoid receptor agonists: discovery and lead exploration". Journal of Medicinal Chemistry. 52 (6): 1731–43. doi:10.1021/jm801512v. PMID 19239259.
- ^ a b Biggadike K, Boudjelal M, Clackers M, Coe DM, Demaine DA, Hardy GW, Humphreys D, Inglis GG, Johnston MJ, Jones HT, House D, Loiseau R, Needham D, Skone PA, Uings I, Veitch G, Weingarten GG, McLay IM, Macdonald SJ (Dec 2007). "Nonsteroidal glucocorticoid agonists: tetrahydronaphthalenes with alternative steroidal A-ring mimetics possessing dissociated (transrepression/transactivation) efficacy selectivity". Journal of Medicinal Chemistry. 50 (26): 6519–34. doi:10.1021/jm070778w. PMID 18038970.
- ^ a b c Vayssière BM, Dupont S, Choquart A, Petit F, Garcia T, Marchandeau C, Gronemeyer H, Resche-Rigon M (Aug 1997). "Synthetic glucocorticoids that dissociate transactivation and AP-1 transrepression exhibit antiinflammatory activity in vivo". Molecular Endocrinology. 11 (9): 1245–55. doi:10.1210/mend.11.9.9979. PMID 9259316.
- ^ a b Lin CW, Nakane M, Stashko M, Falls D, Kuk J, Miller L, Huang R, Tyree C, Miner JN, Rosen J, Kym PR, Coghlan MJ, Carter G, Lane BC (Aug 2002). "trans-Activation and repression properties of the novel nonsteroid glucocorticoid receptor ligand 2,5-dihydro-9-hydroxy-10-methoxy-2,2,4-trimethyl-5-(1-methylcyclohexen-3-y1)-1H-[1]benzopyrano[3,4-f]quinoline (A276575) and its four stereoisomers". Molecular Pharmacology. 62 (2): 297–303. doi:10.1124/mol.62.2.297. PMID 12130681.
- ^ Yemelyanov A, Czwornog J, Gera L, Joshi S, Chatterton RT, Budunova I (Jun 2008). "Novel steroid receptor phyto-modulator compound a inhibits growth and survival of prostate cancer cells". Cancer Research. 68 (12): 4763–73. doi:10.1158/0008-5472.CAN-07-6104. PMID 18559523.
- ^ Lesovaya EA, Yemelyanov AY, Kirsanov KI, Yakubovskaya MG, Budunova IV (Nov 2011). "Antitumor effect of non-steroid glucocorticoid receptor ligand CpdA on leukemia cell lines CEM and K562" (PDF). Biochemistry. Biokhimiia. 76 (11): 1242–52. doi:10.1134/S000629791111006X. PMID 22117551. S2CID 35234449.
- ^ a b c d Schäcke H, Schottelius A, Döcke WD, Strehlke P, Jaroch S, Schmees N, Rehwinkel H, Hennekes H, Asadullah K (Jan 2004). "Dissociation of transactivation from transrepression by a selective glucocorticoid receptor agonist leads to separation of therapeutic effects from side effects". Proceedings of the National Academy of Sciences of the United States of America. 101 (1): 227–32. Bibcode:2004PNAS..101..227S. doi:10.1073/pnas.0300372101. PMC 314167. PMID 14694204.
- ^ a b Rhen T, Cidlowski JA (Oct 2005). "Antiinflammatory action of glucocorticoids--new mechanisms for old drugs". The New England Journal of Medicine. 353 (16): 1711–23. doi:10.1056/NEJMra050541. PMID 16236742.
- ^ a b Newton R, Holden NS (Oct 2007). "Separating transrepression and transactivation: a distressing divorce for the glucocorticoid receptor?". Molecular Pharmacology. 72 (4): 799–809. doi:10.1124/mol.107.038794. PMID 17622575. S2CID 52803631.
- ^ Heinemann A, Schuligoi R (2008). "Glucocorticoide – potent und umstritten" [Glucocorticoids – potent and controversial]. Österreichische Apothekerzeitung (in German). 62 (23).
- ^ Coghlan MJ, Jacobson PB, Lane B, Nakane M, Lin CW, Elmore SW, Kym PR, Luly JR, Carter GW, Turner R, Tyree CM, Hu J, Elgort M, Rosen J, Miner JN (May 2003). "A novel antiinflammatory maintains glucocorticoid efficacy with reduced side effects". Molecular Endocrinology. 17 (5): 860–9. doi:10.1210/me.2002-0355. PMID 12586843.
- ^ a b Reichardt HM, Kaestner KH, Tuckermann J, Kretz O, Wessely O, Bock R, Gass P, Schmid W, Herrlich P, Angel P, Schütz G (May 1998). "DNA binding of the glucocorticoid receptor is not essential for survival". Cell. 93 (4): 531–41. doi:10.1016/S0092-8674(00)81183-6. PMID 9604929. S2CID 6524157.
- ^ a b Reichardt HM, Tronche F, Bauer A, Schütz G (2000). "Molecular genetic analysis of glucocorticoid signaling using the Cre/loxP system". Biological Chemistry. 381 (9–10): 961–4. doi:10.1515/BC.2000.118. PMID 11076028. S2CID 37837380.
- ^ Schäcke H, Berger M, Rehwinkel H, Asadullah K (Sep 2007). "Selective glucocorticoid receptor agonists (SEGRAs): novel ligands with an improved therapeutic index" (PDF). Molecular and Cellular Endocrinology. 275 (1–2): 109–17. doi:10.1016/j.mce.2007.05.014. PMID 17630119. S2CID 46020217.
- ^ Cavet ME, Harrington KL, Ward KW, Zhang JZ (2010). "Mapracorat, a novel selective glucocorticoid receptor agonist, inhibits hyperosmolar-induced cytokine release and MAPK pathways in human corneal epithelial cells". Molecular Vision. 16: 1791–800. PMC 2932489. PMID 20824100.
- ^ ClinicalTrials.gov에서 "아토피 피부염에서 ZK 245186 농도 상이한 농도의 용량 증가" 임상 시험 번호 NCT00944632
- ^ ClinicalTrials.gov의 "백내장 수술 후 안구 염증 치료를 위한 Mapracorat 안과 중지" 임상 시험 번호 NCT01230125
- ^ Stock T, Fleishaker D, Mukherjee, A, Le V, Xu J, Zeiher B (2009). "Evaluation Of Safety, Pharmacokinetics And Pharmacodynamics Of A Selective Glucocorticoid Receptor Modulator (SGRM) In Healthy Volunteers". Arthritis Rheum. 60 (Suppl 10): 420. doi:10.1002/art.25503 (inactive 28 February 2022). Archived from the original on 2016-03-03.
{{cite journal}}: CS1 maint : 2022년 2월 현재 DOI 비활성 (링크) CS1 maint : 복수이름 : 작성자 목록 (링크) - ^ Hu X, Du S, Tunca C, Braden T, Long KR, Lee J, Webb EG, Dietz JD, Hummert S, Rouw S, Hegde SG, Webber RK, Obukowicz MG (Aug 2011). "The antagonists but not partial agonists of glucocorticoid receptor ligands show substantial side effect dissociation". Endocrinology. 152 (8): 3123–34. doi:10.1210/en.2010-1447. PMID 21558312.
- ^ 임상시험 번호 NCT01393639(ClinicalTrials.gov에서 "실험적 글루코르티코이드 화합물과 류마티스 관절염의 플라시보 및 프레드니손의 선량 비교 연구"
- ^ Schäcke H, Hennekes H, Schottelius A, Jaroch S, Lehmann M, Schmees N, Rehwinkel H, Asadullah K (2002). "SEGRAs: a novel class of anti-inflammatory compounds". Ernst Schering Research Foundation Workshop (40): 357–71. doi:10.1007/978-3-662-04660-9_20. ISBN 978-3-662-04662-3. PMID 12355726.
- ^ Kerscher MJ, Hart H, Korting HC, Stalleicken D (Apr 1995). "In vivo assessment of the atrophogenic potency of mometasone furoate, a newly developed chlorinated potent topical glucocorticoid as compared to other topical glucocorticoids old and new". International Journal of Clinical Pharmacology and Therapeutics. 33 (4): 187–9. PMID 7620686.
- ^ Shah S, King EM, Chandrasekhar A, Newton R (May 2014). "Roles for the mitogen-activated protein kinase (MAPK) phosphatase, DUSP1, in feedback control of inflammatory gene expression and repression by dexamethasone". The Journal of Biological Chemistry. 289 (19): 13667–79. doi:10.1074/jbc.M113.540799. PMC 4036371. PMID 24692548.
- ^ Ayroldi E, Macchiarulo A, Riccardi C (December 2014). "Targeting glucocorticoid side effects: selective glucocorticoid receptor modulator or glucocorticoid-induced leucine zipper? A perspective". FASEB Journal. 28 (12): 5055–70. doi:10.1096/fj.14-254755. PMID 25205742. S2CID 40874311.