피하알부민증
Hypoalbuminemia| 피하알부민증 | |
|---|---|
| 기타 이름 | 하이프알부민증 |
 | |
| 알부민 구조 | |
| 전문 | 내과, 소아과 |
| 증상 | 말초부종, 승천, 용출, 피로, 일반화된 약점 |
| 합병증 | 저혈당증, 순환기 붕괴, 아연 결핍증, 고지혈증 |
| 원인들 | 부정흡수(단백질 손실 장병증) |
| 진단법 | 데킬러당 3.5g 이하 수준 |
| 치료 | 간 절제에서의 알부민 주입(>40%)과 신피질증후군(이뇨제 및 코르티코스테로이드 포함), 자연발생적인 세균성 복막염(항생제 포함), 간상증후군(테리프레신 포함) |
| 빈도 | 70%(입원자 수 감소) |
피하 알부민혈증(또는 피하 알부민혈증)은 혈중 알부민 수치가 낮은 의학적 신호다.[1] 이는 간 내 생산량 감소, 위장관이나 신장의 손실 증가, 체내 사용량 증가, 체내 구획간 이상분포 등이 원인일 수 있다. 패혈증, 간경화증, 신장의 신장신장증후군, 위장의 단백질을 감퇴시키는 장염과 같은 또 다른 질병 과정의 결과로서 피하성 알부민증을 가진 환자들이 종종 나타난다. 알부민의 역할 중 하나는 혈류 및 체내 종양압력(혈액 내 단백질 농도)의 주요 동력이 되는 것이다. 따라서, 저자극성 혈증은 신체와 그 구획 내에서 유체의 비정상적인 분배를 초래한다. 그 결과, 관련 증상은 하퇴부의 부종, 복부의 승천, 내장기 주변의 유출 등이 있다. 간 기능 평가를 목적으로 한 실험실 테스트는 피하 알부민증을 진단한다. 일단 확인되면 다양한 질환이 있는 환자에게는 좋지 않은 예후 지표다. 그러나 그것은 간경변과 신증후군을 가진 환자들에게서 매우 구체적인 적응증에서만 치료된다. 치료는 대신에 피하알루미늄혈증의 근본적인 원인에 초점을 맞춘다. Albumin은 급성 음성 단계 응답자로 영양 상태를 신뢰할 수 있는 지표가 아니다.
징후 및 증상
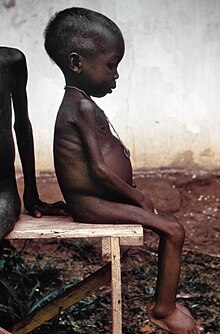
피하알메르빈혈증 환자들은 1차적인 질병 과정보다 그것을 기저 질환 과정의 표시로 제시할 가능성이 더 높다. 저자극성혈증은 단독으로 혈장의 총 단백질 농도를 감소시키며, 이를 콜로이드 삼투압이라고도 하며, 혈관을 조직으로 배출시켜 농도를 균등하게 한다. 이것은 부종이라고 알려진 사지의 유체로 인한 붓기, 복부에 유체가 쌓이고 유액으로 알려진 내부 장기를 둘러싸고 있는 유체로 이어진다. 환자들은 또한 피로와 지나친 허약과 같은 비특이적인 발견을 가지고 있다. 므라크의 라인은 피하알루미늄혈증을 나타내는 강력한 지표다. [2] 항문부민증에서 볼 수 있는 선천적이고 완전한 알부민 손실은 무증상일 수 있기 때문에 저자극성 알부민증 자체는 아무런 증상 없이 나타날 수 있다. 또는 태어나기 전 자궁에서 사망하거나 부종, 피로, 고지혈증으로 특징지어지는 성인의 질병으로 나타날 수 있다. 이러한 제시의 이질성의 이유는 잘 이해되지 않는다.[3]
합병증
그 자체로, 저자극성혈증은 저혈당증과 순환기 붕괴를 2차적으로 혈관계 내의 종양압력 감소를 유발할 수 있다.[3] 그 금속결합 특성 때문에, 저자극성 백혈병은 아연 결핍을 포함한 영양 결핍으로 이어질 수 있다.[4] 보통은 아테롬성 경화증이 없는 상태지만, 신피질 증후군과 연관된 저자극성 백혈병은 고지혈증의 발달을 초래할 수 있다.[3] 또한, 투석 중인 환자의 경우, 피하 알부민증은 더 진보된 유체 과부하와 관련이 있다.[5][6]
원인들
저자극성 알부민증은 여러 가지 다른 메커니즘을 통해 발생할 수 있으며, 각각 알부민 수치가 감소하는 최종 결과를 가지고 있다. 여기에는 (1) 간 내 합성이 손상되고 2) 조직별 활용도가 증가하며 3) 분포 문제, 4) 배설이나 손실 증가가 포함된다.[7] 간경변에서와 같이 원인은 다방면에 걸쳐 있는 경우가 많은데, 간합성 감소와 모세혈관 누출 증가가 결합되어 알부민 수치를 더욱 떨어뜨린다.[citation needed]
염증 및 감염
알부민(Ambumin)은 음의 급성 위상 반응제로 여겨지는데, 이는 염증과 다른 급성 생리학적 과정이 일어나면 수치가 감소한다는 것을 의미한다. 이는 CRP(C-reactive process)와 같은 급성 위상 반응제와는 대조적이다. 메커니즘과 관련하여 염증은 특히 IL-1, IL-6, TNF-α 등 사이토카인 수치가 증가함에 따라 알부민 생산 감소로 이어진다.[7] 패혈증과 패혈성 쇼크에 흔히 나타나는 압도적인 감염을 가진 환자의 경우, 위와 같이 합성이 감소하고, 조직에 의한 활용도가 증가하며, 혈관 투과성이 높아져 혈관에서 발생하는 대뇌피부 누설이 증가함에 따른 결합 효과의 결과로 저자극성혈증이 발생한다.[3]
간질환
알부민은 간에서 합성되며, 낮은 혈청 알부민은 간기능 장애나 간경변, 만성간염 등의 질환을 나타낼 수 있다. 만약 존재한다면, 저자극성 혈증은 일반적으로 간경변이 진전되거나 간에 돌이킬 수 없는 손상을 주는 징후로 간주된다.[3] 알부민 생산은 건강한 간보다 고도 간경변증에서 60~80% 더 낮을 수 있고 희석(소금 및 수분 보유), 유체 이동(알부민이 세포외 공간과 아스카이트 액에 축적됨에 따라), 심지어 알부민 자체에 대한 사후 변화까지 증폭될 수 있다.[8]
신장병
저자극성혈증은 신장 손상으로 소변에서 상당량의 단백질이 손실되는 신피질 증후군의 일부로도 나타날 수 있다. 정상 상태에서는 글루머룰루스를 통해 하루 30mg 미만의 알부민이 손실된다.[3] 신드롬에서는 24시간 동안 단백질 손실이 3.5g 정도까지 발생할 수 있는데, 그 대부분이 알부민인데, 그 자체로 알부민혈증을 유발한다.[3] 비록 더 많은 유전적 원인이 전체 exome 염기서열의 비용과 접근성으로 확인되고 있지만, 어린이들에게 있어서 신증후군은 대개 특발성 질환 과정이다. 이러한 신드롬은 신생검 후 일반적으로 최소한의 변화질환, 막막구연성 글로머론증, 초점구간 글로머루즈경화증 등으로 진단된다.[9] 반면 성인의 경우 다양한 선동적 요인으로 인해 흔히 2차 질환이 발생한다. 이러한 선동 요인은 독소, 약물, 중금속, 자가항체, 감염 후 항체 복합체, 다발성 골수종과 같이 악성종양 후 형성된 면역 복합체 등 다양할 수 있다.[3]
알부미누리아와 그에 따른 저자극성 알부민혈증 또한 신장병에서 볼 수 있는 것처럼 높은 단백질 손실 수준이 없는 만성 콩팥병에서 발생할 수 있다. 여기서 글루머 여과율(GFR) 감소와 그에 따른 하루 30~300mg의 알부민 손실로 신장에서 알부민 손실이 발생한다. 수개월에 걸쳐 이것은 말기 신장병의 흔한 특징인 피하알루미늄혈증을 초래할 수 있다.[3] 체액 분포의 변화와 만성 신장 질환에서 진행 중인 염증이 피하 알부민증과 함께 나타나는 것은 유체 상태 조절을 특히 어렵게 한다.[5]
영양실조 또는 중독
콰시오르코르는 단백질 섭취가 감소하고 아미노산 결핍이 발생하여 피알부민증, 특징적인 신체발현이 나타나는 영양실조의 병이다. 이것은 영양실조가 어떻게 저혈당 알부민증을 유발할 수 있는지를 보여주는 극단적인 예다.[3] 보다 대표적인 것이 노인들의 영양실조 관련 피하알메르빈혈증인데, 이들은 날씬하고 허약해 보이지만 콰시오르코르에서 볼 수 있는 둥근 복부와 부종이 나타나지 않는다. 알부민(Ambumin)은 급성 음성 단계 응답자로, 영양 상태를[citation needed] 신뢰할 수 있는 지표가 아니다.
알부민 수치가 낮다는 것은 또한 단백질이 장질환을 잃음으로써 만성적인 영양실조를 나타낼 수 있다.[3] 이는 궤양성 대장염에 의해 발생하거나 악화되는 경우가 많지만 심장질환과 전신 루푸스 홍반증에서도 볼 수 있다.[10][3] 대체로 단백질 손실 장내증은 림프강화증처럼 위장관의 림프압 증가, 크론병 및 궤양성 대장염과 같이 점막침식으로 인한 흡수부족, 그리고 셀리악병처럼 점막 에로스가 없는 다른 흡착성 질환에 의해 유발될 수 있다.[3]
Eosinophilic 위염은 후두통, 말초혈액 Eosinophilia, 빈혈, 그리고 피하알부민증을 동반한다.[11]
병리학
간은 알부민을 생산한 다음 혈류로 분비되며, 그 다음 알부민이 몸 전체에 걸쳐 조직으로 분배된다. 간에서 간은 알부민을 프리프로 알부민으로 합성하여 처음에는 프로 알부민으로, 다음에는 간세포로 알부민으로 변환하여 혈액으로 방출한다.[7] 신체는 알부민 합성을 하루 10~15g의 비율로 한다. 저자극성 알부민증이 있는 경우 간은 기준 생산률의 4배까지 생산을 증가시킬 수 있다.[8] 알부민은 일단 분비되면 혈관의 혈관 내 공간(40%)과 인체의 다른 조직 내의 혈관 외 공간(60%) 사이에 분포한다. 혈장에서는 알부민이 총 혈장단백질의 55~60%를 질량으로 구성하고, 나머지 부분은 글로불린이 대부분을 차지한다. 피하 알부민증에서는 혈관 내 공간이나 혈장 내 알부민 양을 측정하고 있는데, 이는 두 구획 내의 비정상적인 분포가 전신에 정상 수준의 혈류에서 상대적인 피하 알부민증의 원인이 될 수 있다는 것을 의미한다.[3]
일단 체내에 방출되면, 알부민은 피하알부민증에서 보이는 감소된 레벨에 의해 부정적인 영향을 받을 수 있는 많은 기능을 수행한다. 이러한 기능에는 혈장 내 콜로이드 삼투압 또는 단백질 농도의 조절, 저장 또는 이용을 위한 자유 지방산 및 기타 분자(무농축 빌리루빈, 금속, 이온)의 간 이동, 약물의 결합 및 약동학(반감기, 생물학적 활동 수준, 신진대사), b가 포함된다.uffering Plasma pH, 염증과 관련 손상을 피하기 위해 활성산소 종을 청소하고 혈압 조절을 위한 질소산화물 저장소로 기능하며, 일반적으로 사용되는 항응고제 헤파린과 유사한 작용에서 응고 및 혈소판 집적의 방지. 또한 TNF-α와 같은 염증 매개체를 억제하고 5a(C5a)를 보완하여 전체 염증 반응을 감소시킨다.[7]
많은 호르몬(예: 티록신, 코르티솔, 테스토스테론), 약물 및 기타 분자는 혈류에서 알부민에 결합되어 생물학적으로 활동하기 전에 알부민에서 방출되어야 한다. 예를 들어, 칼슘은 알부민에 결합된다; 피하알부민증에서는 생물학적으로 활성 상태인 자유 이온화 칼슘의 양이 증가한다. 피하 알부민증이 있는 경우, 이러한 기능들은 차등적으로 영향을 받으며, 그것들이 질병 결과에 영향을 미치는 메커니즘은 여전히 활발한 토론의 영역으로 남아 있다.[3]
진단
혈청 알부민 농도는 혈장 단백질, 빌리루빈, 알칼리성 인산염, 알칼리성 아미노트란스페라제(ALT), 아스파르타이트 아미노트란스페라제(AST)의 수준도 포함하는 간기능검사(LFT)의 표준패널의 일부다. 이것은 간질환이 기초대사패널(BMP)이라고 알려진 전해액패널과 함께 종합대사패널(CMP)의 일부로 의심될 때 흔히 주문된다. 신장질환의 경우 소변 딥스틱 분석으로 단백뇨가 검출되면 후속 검사로 CMP를 주문할 수 있어 피하부암 진단을 받을 수 있다.[3] 혈청 알부민 수치가 낮은 것은 데틸리터당 3.5g 미만으로 정의되는 반면 임상적으로 유의미한 피하알부민증은 일반적으로 데틸리터당 2.5g 미만으로 간주된다.[7] 저자극성 알부민혈증이 발견되면 흔한 작업에는 간질환 평가를 위한 간 기능 검사, 소변 알부민 및 신장증후군을 평가하기 위한 소변 알부민 및 단백질 수치 검사, 심부전을 평가하기 위한 뇌 내추럴 펩타이드 등이 포함된다.[3] 임상적 의심에 근거해 단백질 손실 장병증이 의심될 경우 알파-1 안티프립신 검사를 수행할 수 있다. 대변 알파-1 안티프록신이 상승하면 위장 단백질 손실이 과도하다는 의미다.[3]
관리
피하 알부민증 치료는 주로 피하 알부민증 자체에 집중되지 않고 근본적인 원인에 집중된다.[7] 알부민 주입은 비용이 많이 들고 여러 조건과 상황에서 콜로이드 용액보다 더 효과적인 것으로 보여지지는 않았지만 일반적으로 수행될 수 있고, 일반적으로 수행된다. 알부민 주입을 위해 지시의 예로는 간 절제술 을 등 주요 수술의 맥락에서 저 알부민 혈증 있으며 40%, 이뇨제와 부신 피질 호르몬과 함께 신 증후군, 항생제와 어우러져 자발적인 세균성 복막염, 급속하게 그녀와 어우러져 간신 증후군(유형 1)을 진행하고 포함한다.미스터리 한누르다[7] 또한 여러 세션에 걸쳐 1회 또는 1주일에 걸쳐 1kg당 20밀리리터 이상 볼륨 플라즈마 교환이 가능하고, 아스카이트에서 큰 부피(>5리터) 치경 후 이아트로겐성 피하부암소혈증을 예방하는 데도 사용된다.[7] 이러한 징후들은 그들의 질병에 따라 긍정적인 결과를 보여주었지만, 영양실조, 화상(최초 24시간 동안), 외상성 뇌손상으로 인한 충격과 같은 조건들은 무작위적으로 통제된 실험에서 아무런 유익성이나 위해성을 보이지 않는다.[7] 간질환과 간경변증에서는 위의 징후 외에도 자발적인 세균성 복막염, 간뇌병증, 만성적인 승천 이외의 세균 감염에 대해 알부민 사용을 고려하고 있다. 이러한 적응증에서 그것의 사용은 여전히 논쟁의 여지가 있다.[8] 신장병과 신드롬에서는 단백뇨에 대한 알부민 손실의 대체물로 알부민 주입이 선천성 신드롬의 일부 사례에서 사용된다.[9]
예후
그 자체로, 낮은 알부민 수치는 일반 인구의 사망률 증가와 관련이 있다.[8] 특히 질병 상태에서는 혈소판막혈증이 경동맥관절염 치료 실패,[3][12] 간경변증 등 여러 조건에서 좋지 않은 결과를 예측하는 요인이 사용되어 왔다.[8] 중환자실(ICU)에 입원한 환자들 중에서, 피하알메르빈혈증은 특히 ICU가 획득한 근육의 약화와 관련이 있다.[13] 만성 신장질환에서 피하알메르빈혈증은 그 자체가 합병증, 정신적 고통, 삶의 질 장애, 자원 활용, 사망률과 관련이 있는 허약성의 지표다.[14]
역학
저자극성혈증은 입원 환자, 중환자실 환자, 병원과 지역사회에서 흔히 발견된다.[3] 노인 환자들 사이에서 유병률은 서던브라질의 연구에서 보여지듯이 70%까지 높아질 수 있다. [3]
참조
- ^ Anderson, Douglas M. (2000). Dorland's illustrated medical dictionary (29. ed.). Philadelphia [u.a.]: Saunders. p. 860. ISBN 0721682618.
- ^ Williams, Vijai; Jayashree, Muralidharan (October 2017). "Muehrcke Lines in an Infant". The Journal of Pediatrics. 189: 234. doi:10.1016/j.jpeds.2017.05.039. ISSN 0022-3476. PMID 28595765.
- ^ a b c d e f g h i j k l m n o p q r s t u Gounden, Verena; Jialal, Ishwarlal (2019), "Hypoalbuminemia", StatPearls, StatPearls Publishing, PMID 30252336, retrieved 2019-11-04
- ^ Himoto, Takashi; Masaki, Tsutomu (2018-01-14). "Associations between Zinc Deficiency and Metabolic Abnormalities in Patients with Chronic Liver Disease". Nutrients. 10 (1): 88. doi:10.3390/nu10010088. ISSN 2072-6643. PMC 5793316. PMID 29342898.
- ^ a b Kooman, Jeroen P.; van der Sande, Frank M. (2019). "Body Fluids in End-Stage Renal Disease: Statics and Dynamics". Blood Purification. 47 (1–3): 223–229. doi:10.1159/000494583. ISSN 1421-9735. PMC 6492508. PMID 30517920.
- ^ Dekker, Marijke J. E.; van der Sande, Frank M.; van den Berghe, Florence; Leunissen, Karel M. L.; Kooman, Jeroen P. (2018). "Fluid Overload and Inflammation Axis". Blood Purification. 45 (1–3): 159–165. doi:10.1159/000485153. ISSN 1421-9735. PMC 6492921. PMID 29478061.
- ^ a b c d e f g h i Gatta, Angelo; Verardo, Alberto; Bolognesi, Massimo (2012). "Hypoalbuminemia". Internal and Emergency Medicine. 7 Suppl 3: S193–199. doi:10.1007/s11739-012-0802-0. ISSN 1970-9366. PMID 23073857.
- ^ a b c d e Carvalho, Joana R.; Verdelho Machado, Mariana (2018). "New Insights About Albumin and Liver Disease". Annals of Hepatology. 17 (4): 547–560. doi:10.5604/01.3001.0012.0916. ISSN 1665-2681. PMID 29893696.
- ^ a b Cil, Onur; Perwad, Farzana (2018). "Monogenic Causes of Proteinuria in Children". Frontiers in Medicine. 5: 55. doi:10.3389/fmed.2018.00055. ISSN 2296-858X. PMC 5858124. PMID 29594119.
- ^ Ungaro R, Babyatsky MW, Zhu H, Freed JS (January 2012). "Protein-losing enteropathy in ulcerative colitis". Case Reports in Gastroenterology. 6 (1): 177–82. doi:10.1159/000338191. PMC 3364098. PMID 22679407.
- ^ Collins, Margaret H.; Capocelli, Kelley; Yang, Guang-Yu (2017). "Eosinophilic Gastrointestinal Disorders Pathology". Frontiers in Medicine. 4: 261. doi:10.3389/fmed.2017.00261. ISSN 2296-858X. PMC 5775510. PMID 29379785.
- ^ Fagotti, Lorenzo; Tatka, Jakub; Salles, Mauro Jose Costa; Queiroz, Marcelo C. (2018). "Risk Factors and Treatment Options for Failure of a Two-Stage Exchange". Current Reviews in Musculoskeletal Medicine. 11 (3): 420–427. doi:10.1007/s12178-018-9504-1. ISSN 1935-973X. PMC 6105486. PMID 29934884.
- ^ Barreiro, Esther (2018). "Models of disuse muscle atrophy: therapeutic implications in critically ill patients". Annals of Translational Medicine. 6 (2): 29. doi:10.21037/atm.2017.12.12. ISSN 2305-5839. PMC 5799135. PMID 29430446.
- ^ Wu, Patrick Yihong; Chao, Chia-Ter; Chan, Ding-Cheng; Huang, Jenq-Wen; Hung, Kuan-Yu (2019). "Contributors, risk associates, and complications of frailty in patients with chronic kidney disease: a scoping review". Therapeutic Advances in Chronic Disease. 10: 2040622319880382. doi:10.1177/2040622319880382. ISSN 2040-6223. PMC 6778996. PMID 31632625.