테트라히드롭디란
Tetrahydropyran| | |||
| 이름 | |||
|---|---|---|---|
| 선호 IUPAC 이름 옥산 | |||
| 기타 이름 테트라히드롭디란 옥사시클로헥산 1,5epoxypentane | |||
| 식별자 | |||
3D 모델(JSmol) | |||
| 102436 | |||
| 체비 | |||
| 켐스파이더 | |||
| 드러그뱅크 | |||
| ECHA InfoCard | 100.005.048 | ||
| EC 번호 |
| ||
펍켐 CID | |||
| 유니 | |||
CompTox 대시보드 (EPA) | |||
| |||
| |||
| 특성. | |||
| C5H10O | |||
| 어금질량 | 86.1987 g·message−1 | ||
| 밀도 | 0.880 g/cm3 | ||
| 녹는점 | -45°C(-49°F, 228K) | ||
| 비등점 | 88°C(190°F, 361K) | ||
| 위험 | |||
| 산업안전보건(OHS/OSH): | |||
주요 위험 | 인화성, 피부 자극 유발 | ||
| NFPA 704(화재 다이아몬드) | |||
| 플래시 포인트 | -15.6°C(3.9°F, 257.5K) | ||
| 치사량 또는 농도(LD, LC): | |||
LDLo(가장 낮음) | 3000mg/kg(도덕, 랫드) | ||
달리 명시된 경우를 제외하고, 표준 상태(25°C [77°F], 100 kPa)의 재료에 대한 데이터가 제공된다. | |||
| Infobox 참조 자료 | |||
테트라히드롭레이란(THP)은 5개의 탄소 원자와 1개의 산소 원자를 함유한 포화 6-엠베이트 링으로 구성된 유기 화합물이다. 이중결합이 2개 들어 있는 피란을 참고로 하여 명명하며, 4개의 하이드로겐을 첨가하여 제작할 수도 있다. 2013년에는 선호하는 IUPAC 명칭이 옥산(玉山)으로 제정되었다.[1] 그 화합물은 색깔이 없는 휘발성 액체다. 그러나 테트라히드롭디란(Tetrahydropyran)의 파생상품은 더 흔하다. 2-테트라히드롭디라닐(THP-) 에테르와 3,4-디히드롭디란(Thydropyran)은 유기합성에서 보호그룹으로 흔히 사용된다.[2] 더욱이 테트라히드롭레이란 링 시스템, 즉 5개의 탄소 원자와 산소 한 개가 포도당과 같은 피라노오스 당질의 핵심이다.
구조 및 준비
가스 단계에서, THP는 그것의 가장 낮은 에너지s C 대칭 의자 순응에 존재한다.[3]
테트라히드롭디란의 유기적 합성을 위한 한 가지 고전적인 절차는 3,4 이소체 디히드롭디란을 래니 니켈과 함께 수소로 만드는 것이다.[4]
테트라히드롭야닐 유도체
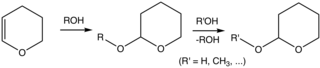
테트라히드롭이란 불분명한 화합물이지만, 유기합성에 테트라히드롭디라닐에테르가 흔히 사용된다. 구체적으로 2-테트라하이드롭드라닐(THP) 그룹은 알코올에 대한 일반적인 보호 그룹이다.[5][6] 알코올은 3,4-디드롭디란과 반응하여 2-테트라히드롭디라닐에테르를 준다. 이 에테르들은 다양한 반응에 탄력이 있다. 알코올은 나중에 산성화된 가수분해로 회복될 수 있다. 이 가수 분해는 5-hydroxypentanal뿐만 아니라 모주 알코올을 개혁한다. 치알코올에서 유래한 THP 에테르들은 분뇨제를 형성한다. 또 다른 바람직하지 않은 특징은 에테르가 복잡한 NMR 스펙트럼을 표시해 분석을 방해한다는 점이다.[2]
일반적인 시술에서 알코올은 주위 온도에서 디클로로메탄에 3,4-디히드롭란과 p-톨루엔술폰산으로 처리된다.[2]
대신에, THP 에테르는 미쓰노부 반응에 대한 조건과 유사한 조건에서 생성될 수 있다. 따라서 알코올은 테트라하이드로푸란(THF)에서 2-하이드록시테트라히드롭디라닐, 트리페닐인산염, 디에틸 아조디카르복실산염(DEAD)으로 처리된다.
일반적으로, THP 에테르들은 THF/물 용액에서 아세트산을 사용하여, 물에서 p-톨루엔설폰산 또는 에탄올에서 피리디늄 p-톨루엔설폰산(PPPTS)을 사용하여 분해된다.
황소
소는 테트라히드롭디란을 뿌리화학물질로 하는 난독성 순환 에테르 고리의 일종이다. 소는 하나 이상의 탄소 원자를 산소 원자로 대체한다.[8] IUPAC가 선호하는 테트라히드롭이란 이름은 이제 옥산이다.[9]
참고 항목
참조
- ^ "New IUPAC Organic Nomenclature - Chemical Information BULLETIN" (PDF).
- ^ a b c Wuts, Peter G. M.; Greene, Theodora W. (2006). "Protection for the Hydroxyl Group, Including 1,2‐ and 1,3‐Diols". Greene's Protective Groups in Organic Synthesis (4th ed.). pp. 16–366. doi:10.1002/9780470053485.ch2. ISBN 9780470053485.
- ^ Builth-Williams, J. D.; Bellm, S. M.; Chiari, L.; Thorn, P. A.; Jones, D. B.; Chaluvadi, H.; Madison, D. H.; Ning, C. G.; Lohmann, B. (2013). "A dynamical (e,2e) investigation of the structurally related cyclic ethers tetrahydrofuran, tetrahydropyran, and 1,4-dioxane" (PDF). Journal of Chemical Physics. 139 (3): 034306. doi:10.1063/1.4813237. hdl:2328/26887.
- ^ Andrus, D. W.; Johnson, John R. (1943). "Tetrahydropyran". Organic Syntheses. 23: 90. doi:10.15227/orgsyn.023.0090.; Collective Volume, vol. 3, p. 794
- ^ Earl, R. A.; Townsend, L. B. (1981). "Methyl 4-Hydroxy-2-butynoate". Organic Syntheses. 60: 81. doi:10.15227/orgsyn.060.0081.; Collective Volume, vol. 7, p. 334
- ^ Kluge, Arthur F. (1986). "Diethyl [(2-Tetrahydropyranyloxy)methyl]phosphonate". Organic Syntheses. 64: 80. doi:10.15227/orgsyn.064.0080.; Collective Volume, vol. 7, p. 160
- ^ Robinson, Anna; Aggarwal, Varinder K. (2010). "Asymmetric Total Synthesis of Solandelactone E: Stereocontrolled Synthesis of the 2-ene-1,4-diol Core through a Lithiation–Borylation–Allylation Sequence". Angewandte Chemie International Edition. 49 (37): 6673–6675. doi:10.1002/anie.201003236.
- ^ Ferenc Notheisz, Mihály Bartók, "Hydrogenolysis of C–O, C–N and C–X bonds", p. 416 in, R. A. Sheldon, Herman van Bekkum (eds), Fine Chemicals through Heterogeneous Catalysis, John Wiley & Sons, 2008 ISBN 3527612971.
- ^ "New IUPAC Organic Nomenclature - Chemical Information BULLETIN" (PDF).