링 개방 중합
Ring-opening polymerization주기적인 단량체가 단량체 단위를 생성하는 중합체로서, 단량체보다 더 적은 사이클을 포함한다.null
Penczek S.; Moad, G. Pure Appl. Chem., 2008, 80(10), 2163-2193
고분자 화학에서 링 개방 중합체(ROP)는 연쇄 성장 중합체의 일종으로, 고분자 사슬의 종단부가 순환 단조체를 공격하여 더 긴 중합체를 형성한다(그림 참조).반응성 중심은 급진적이거나 음이온적이거나 양이온적일 수 있다.노르보른이나 사이클로옥타디엔과 같은 일부 순환 단층체는 금속 촉매를 사용하여 고분자 중량 고분자로 중합될 수 있다.ROP는 생물폴리머의 합성을 위한 다용도 방법이다.null
순환 단량체의 고리 개방은 종종 결합 각도 변형률의 완화에 의해 추진된다.따라서 다른 중합 유형의 경우와 마찬가지로 링 개구부의 엔탈피 변화는 음이다.[3]null
모노머스
ROP에 순응할 수 있는 주기적 단량체로는 에폭시드, 주기적 삼리실록산, 일부 젖톤, 젖산, 주기적 탄산수소, 아미노산 N-카르복산 무수화물 등이 있다.[4][5][6][7]많은 변형된 사이클로알카네(예: 노르보른)는 고리 개폐 메타텍스 중합체를 통해 적합한 단량체다.null
역사
링 개방 중합체는 1900년대 초부터 폴리머를 생산하기 위해 사용되어 왔다.ROP의 가장 오래된 역사를 가진 폴리펩타이드의 합성은 렉스의 1906년 작품으로 거슬러 올라간다.[8]그 후, 무수당의 ROP는 합성 덱스트란, 크산탄 껌, 웰란 껌, 젤란 껌, 디우탄 껌, 풀란 등 다당류를 제공했다.링 개방 중합체의 메커니즘과 열역학(thermodynamics)은 1950년대에 확립되었다.[9][10]반복단위를 가진 최초의 고분자중량 고분자(Mn 최대 10개5)는 이르면 1976년 ROP가 준비했다.[11][12]null
산업용 애플리케이션은 나일론-6의 생산이다.null
메커니즘
링 개방 중합은 아래에 설명된 바와 같이 급진적, 음이온적 또는 양이온적 중합성을 통해 진행될 수 있다.[13]또한, 래디컬 ROP는 기존의 비닐 단량체의 연쇄 성장 중합으로 다른 방법으로 합성할 수 없는 백본 체인에 통합된 기능 그룹을 가진 중합체를 생산하는 데 유용하다.예를 들어, 급진적 ROP는 에테르, 에스테르, 아미드, 탄산염을 가진 중합체를 메인 체인을 따라 기능 그룹으로 생산할 수 있다.[13][14]null
음이온 링 개방 중합(AROP)

음이온 링 개방 중합체(AROP)는 핵소독 시약을 개시자로 포함한다.에폭시드, 아지리딘, 에피설피드 등 3인조 고리 구조를 가진 모노머는 음이온 ROP를 거친다.[14]
음이온 ROP의 대표적인 예는 알카산화물에 의해 시작된 ε-카프로락톤이다.[14]null
양이온 링 개방 중합
양이온 개시자 및 중간자(CRP)가 양이온 링 개방 중합(CRP) 특성화이 메커니즘을 통해 중합되는 순환 단량체의 예로는 유당, 유당, 아민, 에테르 등이 있다.[15]CROP은 S1N 또는 S2N 전파, 연쇄 성장 과정을 통해 진행된다.[13]그 메커니즘은 결과적인 양이온종의 안정성에 의해 영향을 받는다.예를 들어 양전하를 가진 원자가 전자기증 그룹에 의해 안정되면 중합은 S1N 메커니즘에 의해 진행될 것이다.[14]계양종은 이형 원자이고, 주기적인 단량체의 추가에 의해 체인이 성장하여 고리 시스템을 개방한다.null
모노머는 브론스테드산, 카르베늄 이온, 오늄 이온, 금속 양이온에 의해 활성화될 수 있다.[13]null
CROP은 살아있는 중합이 될 수 있으며 페녹시 음이온, 인산 또는 폴리아니온과 같은 핵성 시약에 의해 종료될 수 있다.[13]모노머의 양이 고갈되면 분자간 또는 내부 분자간 종단이 발생할 수 있다.액티브 엔드(active end)는 매크로 사이클을 형성하면서 체인을 "뒤집게" 할 수 있다.알킬 체인 전이도 가능하며, 알킬 체인을 다른 폴리머에 전달하여 활성 엔드를 취침시킨다.null
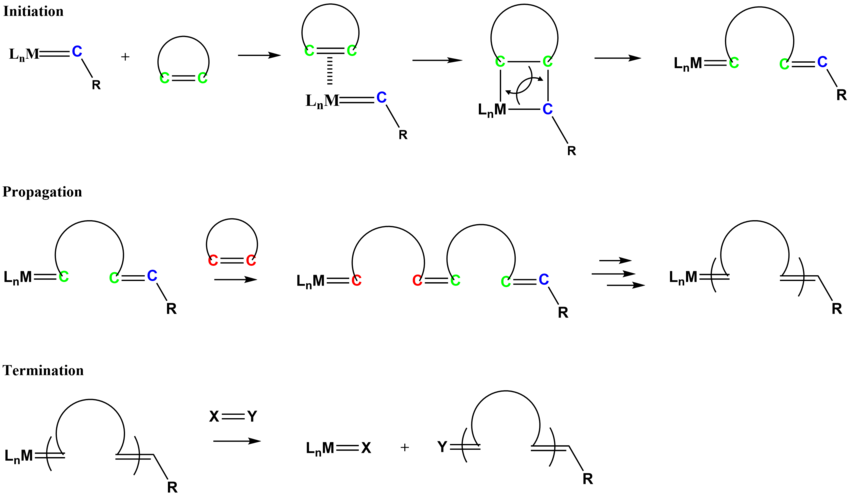
링 개구부 메타텍스 중합
링 개구부 메타텍스 중합(ROMP)은 사이클로알케네나 사이클로알케네로부터 불포화 폴리머를 생성한다.유기 촉매제를 필요로 한다.[13]null
ROMP의 메커니즘은 올레핀 메타텍스처럼 유사한 경로를 따른다.개시 과정은 알킬리덴 복합체에 대한 사이클로알켄 모노머의 조정에 수반하며, 이어 사이클로어가 새로운 알킬리덴 종을 형성하기 위해 금속성클로로부탄 중간체를 형성하는 [2+2] 타입 사이클로어덴의 조정에 따른다.[17][18]null
ROMP에 의해 합성된 상업적으로 관련성이 없는 불포화 폴리머에는 노르소렉스(폴리노르보네네), 베스테나머(폴리시클로벤틴), 메톤(폴리시클로펜타디엔) 등이 있다.[19][20]null
열역학
주어진 모노머 중합성의 형식 열역학적 기준은 중합체의 자유 엔탈피(Gibbs 자유 에너지) 기호와 관련이 있다.
where x and y indicate monomer and polymer states, respectively (x and/or y = l (liquid), g (gaseous), c (amorphous solid), c’ (crystalline solid), s (solution)), ΔHp(xy) and ΔSp(xy) are the corresponding enthalpy (SI unit: joule per kelvin) and entropy (SI unit: joule) of polymerization, and T is the absolute temperature (SI unit: kelvin).중합체의 자유 엔탈피(ΔGp)는 중합 표준 엔탈피(ΔGp°)의 합으로 표현될 수 있으며, 순간적인 단량체 분자와 증가하는 고분자 농도와 관련된 용어:
여기서 R은 기체 상수, M은 모노머, (m)i는 초기 상태의 모노머, m은* 활성 모노머다.Flory–Huggins 해결 이론은 적극적인 센터, 충분히 긴 고분자 사슬의 macromolecule에서 반응도 중합(DPi)의 정도에 달려 있는 것이 아니었고, 그 ΔGp°)ΔHp°-TΔSp°(어디 ΔHp°과 ΔSp° 각각 표준 중합 엔탈피와 엔트로피를 가리킨다), 설명한 것이다.우리가다음을 획득:
평형(ΔGp = 0)에서 중합이 완료되면 모노머 농도([M])eq는 표준 중합 파라미터(ΔHp° 및 ΔSp°)와 중합 온도에 의해 결정되는 값을 가정한다.
중합체는 0[M] > [M]eq이 되어야 가능하다.결국, [M]eq = [M]0인 이른바 천장 온도(Tc) 이상에서는 고중합체의 형성이 일어나지 않는다.null
예를 들어, 테트라하이드로푸란(THF)은c T = 84°C 이상에서 중합할 수 없으며, 사이클로-옥타설프(S8)는f T = 159°C 이하에서 중합할 수 없다.[21][22][23][24]단, 많은 모노머의 경우, 대량 중합에 대한 T와c T는f 각각 운전가능한 중합 온도를 훨씬 상회하거나 하회한다.대다수의 모노머의 중합은 대부분 변환 자유도의 손실 때문에 엔트로피 감소를 동반한다.이 상황에서 중합은 ΔG에p 대한 엔탈피학적 기여가 선행하는 경우에만 열역학적으로 허용된다(즉, ΔHp° < 0과 ΔSp° < 0, 불평등 ΔHp > -TΔS가p 필요한 경우).따라서 링 변형률이 높을수록 평형상태에서 모노머 농도가 낮아진다.null
참고 항목
추가 판독값
- Luck, edited by Rajender K. Sadhir, Russell M. (1992). Expanding Monomers: Synthesis, Characterization, and Applications. Boca Raton, Florida: CRC Press. ISBN 9780849351563.
{{cite book}}:first=일반 이름 포함(도움말) - Sugiyama, J; R. Nagahata; M. Goyal; M. Asai; M. Ueda; K. Takeuchi (1998). ACS Polymer Preprints. 1. 40: 90.
{{cite journal}}: 누락되거나 비어 있음(도움말)</ref) - Nikos Hadjichristidis, Hermis Iatrou, Marinos Pitsikalis, Georgios Sakellariou (2009). "Synthesis of Well-Defined Polypeptide-Based Materials via the Ring-Opening Polymerization of α-Amino Acid N-Carboxyanhydrides". Chemical Reviews. 109 (11): 5528–5578. doi:10.1021/cr900049t. PMID 19691359.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - Nahrain E. Kamber, Wonhee Jeong, Robert M. Waymouth, Russell C. Pratt, Bas G. G. Lohmeijer, James L. Hedrick (2007). "Organocatalytic Ring-Opening Polymerization". Chemical Reviews. 107 (12): 5813–5840. doi:10.1021/cr068415b. PMID 17988157.
{{cite journal}}: CS1 maint: 작성자 매개변수(링크) 사용(</ref) - Matsumura, Shuichi; Tsukada, Keisuke; Toshima, Kazunobu (May 1997). "Enzyme-Catalyzed Ring-Opening Polymerization of 1,3-Dioxan-2-one to Poly(trimethylene carbonate)". Macromolecules. 30 (10): 3122–3124. Bibcode:1997MaMol..30.3122M. doi:10.1021/ma961862g.
참조
- ^ IUPAC, 화학용어 종합편찬, 제2편.("금책")(1997년).온라인 수정 버전: (2006–) "링 개방 중합". doi:10.1351/골드북.R05396
- ^ Jenkins, A. D.; Kratochvíl, P.; Stepto, R. F. T.; Suter, U. W. (1996). "Glossary of basic terms in polymer science (IUPAC Recommendations 1996)". Pure and Applied Chemistry. 68 (12): 2287–2311. doi:10.1351/pac199668122287.
- ^ Young, Robert J. (2011). Introduction to Polymers. Boca Raton: CRC Press. ISBN 978-0-8493-3929-5.
- ^ JEROME, C; LECOMTE, P (2008-06-10). "Recent advances in the synthesis of aliphatic polyesters by ring-opening polymerization☆". Advanced Drug Delivery Reviews. 60 (9): 1056–1076. doi:10.1016/j.addr.2008.02.008. ISSN 0169-409X. PMID 18403043.
- ^ Yann Sarazin, Jean-François Carpentier (2015). "Discrete Cationic Complexes for Ring-Opening Polymerization Catalysis of Cyclic Esters and Epoxides". Chemical Reviews. 115 (9): 3564–3614. doi:10.1021/acs.chemrev.5b00033. PMID 25897976.
{{cite journal}}: CS1 maint: 작성자 매개변수 사용(링크) - ^ Longo, Julie M.; Sanford, Maria J.; Coates, Geoffrey W. (2016). "Ring-Opening Copolymerization of Epoxides and Cyclic Anhydrides with Discrete Metal Complexes: Structure–Property Relationships". Chemical Reviews. 116 (24): 15167–15197. doi:10.1021/acs.chemrev.6b00553. PMID 27936619.
- ^ Kricheldorf, H. R. (2006). "Polypeptides and 100 Years of Chemistry of Α-Amino Acid N-Carboxyanhydrides". Angewandte Chemie International Edition. 45 (35): 5752–5784. doi:10.1002/anie.200600693. PMID 16948174.
- ^ Leuchs, H. (1906). "Glycine-carbonic acid". Berichte der deutschen chemischen Gesellschaft. 39: 857. doi:10.1002/cber.190603901133.
- ^ Dainton, F. S.; Devlin, T. R. E.; Small, P. A. (1955). "The thermodynamics of polymerization of cyclic compounds by ring opening". Transactions of the Faraday Society. 51: 1710. doi:10.1039/TF9555101710.
- ^ Conix, André; Smets, G. (January 1955). "Ring opening in lactam polymers". Journal of Polymer Science. 15 (79): 221–229. Bibcode:1955JPoSc..15..221C. doi:10.1002/pol.1955.120157918.
- ^ Kałuz̀ynski, Krzysztof; Libiszowski, Jan; Penczek, Stanisław (1977). "Poly(2-hydro-2-oxo-1,3,2-dioxaphosphorinane). Preparation and NMR spectra". Die Makromolekulare Chemie. 178 (10): 2943–2947. doi:10.1002/macp.1977.021781017. ISSN 0025-116X.
- ^ Libiszowski, Jan; Kałużynski, Krzysztof; Penczek, Stanisław (June 1978). "Polymerization of cyclic esters of phosphoric acid. VI. Poly(alkyl ethylene phosphates). Polymerization of 2-alkoxy-2-oxo-1,3,2-dioxaphospholans and structure of polymers". Journal of Polymer Science: Polymer Chemistry Edition. 16 (6): 1275–1283. Bibcode:1978JPoSA..16.1275L. doi:10.1002/pol.1978.170160610.
- ^ a b c d e f Nuyken, Oskar; Stephen D. Pask (25 April 2013). "Ring-Opening Polymerization—An Introductory Review". Polymers. 5 (2): 361–403. doi:10.3390/polym5020361.
- ^ a b c d e Dubois, Philippe (2008). Handbook of ring-opening polymerization (1. Aufl. ed.). Weinheim: Wiley-VCH. ISBN 978-3-527-31953-4.
- ^ Cowie, John McKenzie Grant (2008). Polymers: Chemistry and Physics of Modern Materials. Boca Raton, Florida: CRC Press. pp. 105–107. ISBN 978-0-8493-9813-1.
- ^ Pruckmayr, Gerfried; Dreyfuss, P.; Dreyfuss, M. P. (1996). "Polyethers, Tetrahydrofuran and Oxetane Polymers". Kirk‑Othmer Encyclopedia of Chemical Technology. John Wiley & Sons.
- ^ Sutthasupa, Sutthira; Shiotsuki, Masashi; Sanda, Fumio (13 October 2010). "Recent advances in ring-opening metathesis polymerization, and application to synthesis of functional materials". Polymer Journal. 42 (12): 905–915. doi:10.1038/pj.2010.94.
- ^ Hartwig, John F. (2010). Organotransition metal chemistry : from bonding to catalysis. Sausalito, California: University Science Books. ISBN 9781891389535.
- ^ Love, Jennifer A.; Morgan, John P.; Trnka, Tina M.; Grubbs, Robert H. (2002-11-04). "A Practical and Highly Active Ruthenium-Based Catalyst that Effects the Cross Metathesis of Acrylonitrile". Angewandte Chemie International Edition. 41 (21): 4035–4037. doi:10.1002/1521-3773(20021104)41:21<4035::aid-anie4035>3.0.co;2-i. ISSN 1433-7851.
- ^ Walsh, Dylan J.; Lau, Sii Hong; Hyatt, Michael G.; Guironnet, Damien (2017-09-25). "Kinetic Study of Living Ring-Opening Metathesis Polymerization with Third-Generation Grubbs Catalysts". Journal of the American Chemical Society. 139 (39): 13644–13647. doi:10.1021/jacs.7b08010. ISSN 0002-7863. PMID 28944665.
- ^ Tobolsky, A. V. (July 1957). "Equilibrium polymerization in the presence of an ionic initiator". Journal of Polymer Science. 25 (109): 220–221. Bibcode:1957JPoSc..25..220T. doi:10.1002/pol.1957.1202510909.
- ^ Tobolsky, A. V. (August 1958). "Equilibrium polymerization in the presence of an ionic initiator". Journal of Polymer Science. 31 (122): 126. Bibcode:1958JPoSc..31..126T. doi:10.1002/pol.1958.1203112214.
- ^ Tobolsky, Arthur V.; Eisenberg, Adi (May 1959). "Equilibrium Polymerization of Sulfur". Journal of the American Chemical Society. 81 (4): 780–782. doi:10.1021/ja01513a004.
- ^ Tobolsky, A. V.; Eisenberg, A. (January 1960). "A General Treatment of Equilibrium Polymerization". Journal of the American Chemical Society. 82 (2): 289–293. doi:10.1021/ja01487a009.



![{\displaystyle \Delta G_{p}=\Delta G_{p}^{\circ }+RT\ln {\frac {[...-(m)_{i+1}m^{\ast }]}{[M][...-(m)_{i}m^{\ast }]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f66c66b7d35e2dacc1671504f30e5493ab91515)
![{\displaystyle \Delta G_{p}=\Delta H_{p}^{\circ }-T(\Delta S_{p}^{\circ }+R\ln[M])}](https://wikimedia.org/api/rest_v1/media/math/render/svg/220a922430e9e4f58818db0e2be969135dd4db24)
![{\displaystyle [M]_{eq}=e^{{\frac {\Delta H_{p}^{\circ }}{RT}}-{\frac {\Delta S_{p}^{\circ }}{R}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4cd104ac37a2933a91a5db8cec562cc82c93fe2d)
![{\displaystyle \ln {\frac {DP_{n}}{DP_{n}-1}}[M]_{eq}={\frac {\Delta H_{p}^{\circ }}{RT}}-{\frac {\Delta S_{p}^{\circ }}{R}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7e952ca7bef98adae8b44b05c2517e95f8506fce)
![{\displaystyle [M]_{eq}={\frac {DP_{n}-1}{DP_{n}}}e^{{\frac {\Delta H_{p}^{\circ }}{RT}}-{\frac {\Delta S_{p}^{\circ }}{R}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d81a5355102302fa1c50ae9e83c576644f628884)
![{\displaystyle T_{c}={\frac {\Delta H_{p}^{\circ }}{\Delta S_{p}^{\circ }+R\ln[M]_{0}}};(\Delta H_{p}^{\circ }<0,\Delta S_{p}^{\circ }<0)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7c536fb0309d526481b1f547f28df845bb188c9b)
![{\displaystyle T_{f}={\frac {\Delta H_{p}^{\circ }}{\Delta S_{p}^{\circ }+R\ln[M]_{0}}};(\Delta H_{p}^{\circ }>0,\Delta S_{p}^{\circ }>0)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e6df806a58eb14a0c1d2026a35060793abae2dc)


