플로리-허긴스 해 이론
Flory–Huggins solution theory
Flory-Huggins solution 이론은 혼합 엔트로피에 대한 일반적인 표현식을 적용하는 데 있어 분자 크기의 큰 차이를 고려하는 고분자 용액 열역학의 격자 모델입니다. 결과는 폴리머와 용매를 혼합하는 깁스 자유 에너지 변화 δG 믹스 rm {mix}}에 대한 방정식입니다. 가정을 단순화하기는 하지만 실험을 해석하는 데 유용한 결과를 생성합니다.
이론.
일정한 온도와 (외부) 압력에서의 혼합을 수반하는 깁스 에너지 변화에 대한 열역학적 방정식은
δ \Delta}로 표시되는 변화는 용액 또는 혼합물에 대한 변수 값에서 별도로 고려되는 순수 성분에 대한 값을 뺀 값입니다. 목적은 공정과 관련된 엔탈피 및 엔트로피 증가인δ믹스 \rm {}} δS 믹스 {\\DeltaS_{\rm {mix}}에 대한 명시적인 공식을 찾는 것입니다.
우측은 용매의 몰 1 및 부피 분율ϕ 1 {1}}의 함수입니다(1 {\ 1}), 몰 수 및 부피 분율ϕ 2 {2 폴리머( 2 2})의 수. 폴리머와 용매 분자 간의 에너지를 고려하기 위한 χdisplaystyle \chi}의 도입. R은 가스 상수이고 T은 절대 온도입니다. 부피 분율은 몰 분율과 비슷하지만 분자의 상대적인 크기를 고려하여 가중치를 부여합니다. 작은 용질의 경우, 몰 분율이 대신 나타날 것이고, 이 수정은 플로리와 허긴스로 인한 혁신입니다. 가장 일반적인 경우 혼합 파라미터인χ {\displaystylechi}는 자유 에너지 파라미터이므로 엔트로피 성분을 포함합니다.
파생
우리는 먼저 혼합의 엔트로피, 즉 분자가 산재해 있을 때 분자의 위치에 대한 불확실성의 증가를 계산합니다. 용매와 고분자와 같은 순수 응축된 상에서 우리는 어디를 보아도 분자를 발견합니다.[3] 물론 분자 크기의 공간적 위치를 실제로 조사할 수 없기 때문에 주어진 위치에서 분자를 "찾는" 개념은 사고 실험입니다. 용질이 거대분자 사슬일 때 작은 분자들의 혼합 엔트로피를 몰 분율로 표현하는 것은 더 이상 합리적이지 않습니다. 우리는 개별 폴리머 세그먼트와 개별 용매 분자가 격자의 위치를 차지한다고 가정함으로써 분자 크기의 이러한 비대칭성을 고려합니다. 각 부위는 정확히 용매의 분자 하나 또는 고분자 사슬의 단량체 하나가 차지하므로 전체 부위 수는
는 용매 분자의 수이고 는 고분자 분자의 수이며, 각각은 x의 세그먼트를 갖습니다.[4]
격자[3] 위를 무작위로 걷는 경우, 우리는 용질과 용매를 혼합한 결과로 엔트로피 변화(공간 불확실성 증가)를 계산할 수 있습니다.
여기서 는 볼츠만 상수입니다. 격자 부피 분율ϕ 1 {}}및 ϕ 2 \phi_{2}}를 정의합니다.
이것들은 또한 임의로 선택된 주어진 격자 부위가 각각 용매 분자 또는 고분자 세그먼트에 의해 점유될 확률입니다. 따라서
분자가 격자 부위 하나만을 차지하는 작은 용질의 x 는 1이고 부피 분율은 분자 또는 몰 분율로 감소하며 혼합의 일반적인 엔트로피를 회복합니다.
엔트로픽 효과 외에도 엔탈피 변화를 기대할 수 있습니다.[5] 용매-용매 단량체-모노머 {\공유 결합이 아니라 서로 다른 사슬 섹션 사이), {\의 세 가지 분자 상호작용이 고려됩니다 마지막 각각은 다른 두 개의 평균을 희생하여 발생하므로 단량체-용매 접촉당 에너지 증가량은
그러한 연락처의 총 수는
여기서 는 격자 부위에 대한 가장 가까운 이웃의 수이며, 각각은 하나의 사슬 세그먼트 또는 용매 분자가 차지합니다. 즉, 는 용액 내 폴리머 세그먼트들(단량체들)의 총 개수이므로, z 는 모든 폴리머 세그먼트들에 가장 가까운 이웃 사이트들의 개수입니다. 부위가 용매 분자에 의해 된다는 확률ϕ 1 displaystyle\phi_{1}}을 곱하면 고분자-용매 분자 상호작용의 총 수를 얻을 수 있습니다. 평균 필드 이론을 따르는 근사는 이 절차를 따라 만들어지며, 따라서 많은 상호 작용의 복잡한 문제를 하나의 상호 작용이라는 더 간단한 문제로 줄입니다.
엔탈피 변화는 폴리머 모노머-용매 상호작용 당 에너지 변화에 그러한 상호작용의 수를 곱한 것과 같습니다.
고분자-용매 상호작용 매개변수 chi는 다음과 같이 정의됩니다.
이는 용매와 용질의 특성에 따라 다르며 모델의 유일한 재료별 파라미터입니다. 엔탈피 변화는
용어를 조합하면, 총 자유 에너지 변화는
where we have converted the expression from molecules and to moles and by transferring the Avogadro constant to the gas constant R{\
교호작용 매개변수의 값은 Hildebrand 용해도 매개변수δ {\displaystyle _{}}및 δ b {\displaystyle\delta _{b}}에서 추정할 수 있습니다.
서 V 은(는) 폴리머 세그먼트의 실제 볼륨입니다.
가장 일반적인 경우 교호작용δ {\displaystyle} 및 그에 따른 혼합 χ \chi}는 자유 에너지 파라미터이므로 엔트로피 성분을 포함합니다. 이것은 규칙적인 혼합 엔트로피 외에도 용매와 단량체 사이의 상호작용으로부터 또 다른 엔트로피 기여가 있다는 것을 의미합니다. 이러한 기여는 열역학적 특성을 정량적으로 예측하기 위해 매우 중요한 경우가 있습니다.
플로리-크리그바움 이론과 같은 더 발전된 해 이론이 존재합니다.
액-액 상분리
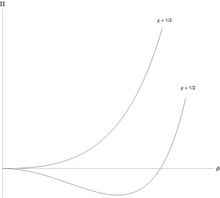
폴리머는 용매로부터 분리될 수 있으며, 특징적인 방식으로 그렇게 할 수 있습니다.[4] 개의 단량체를 갖는 중합체의 경우 단위 부피당 Flory-Huggins 자유 에너지는 단순한 무차원 형태로 기록될 수 있습니다.
ϕ{\\phi} 단량체의 부피 분율 및 N ≫ 1 {\displaystyle N\gg 1}. 삼투압(감소 단위)은 π ϕ = ϕ N-ln 1 - ϕ) - χ ϕ - χ ϕ 2{\displaystyle \Pi = {\tfrac {\phi}{N}-\ln(1-\phi )-\phi -\chi \phi ^{2}입니다.
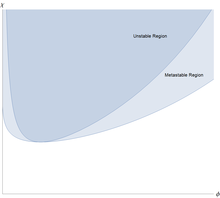
이 자유 에너지의 2차 도함수가 양수일 때 고분자 용액은 작은 변동에도 안정적입니다. 이 2차 도함수는
그리고 이것과 3차 ‴ = -1 N ϕ 2 + 1 (1 - ϕ) 2 {\displaystyle f'"=-{\tfrac {1}{N\phi ^{2}}+{\tfrac {1}{(1-\phi )^{2}}}가 둘 다 0일 때 해가 먼저 불안정해집니다. 그리고 약간의 대수학은 폴리머 용액이 먼저 다음의 임계점에서 불안정해지는 것을 보여줍니다.
이것은 <χ ≲ 1/ 2 {\displaystyle 0<\chi \lesssim 1/2}의 모든 값에 대해 단량체-용매 효과적인 상호작용이 약하게 반발하지만 이는 액체/액체 분리를 유발하기에는 너무 약하다는 것을 의미합니다. 그러나χ> 1 / 2 > 1/2}일 때 두 개의 공존하는 상으로 분리됩니다. 하나는 폴리머가 더 풍부하지만 용매가 더 빈약한 상입니다.
액/액상 분리의 특이한 특징은 매우 비대칭적이라는 것입니다: 임계점에서 단량체의 부피 분율은 N- / 이며 이는 큰 폴리머의 경우 매우 작습니다. 용매가 풍부한/고분자가 부족한 공존상의 고분자의 양은 긴 고분자의 경우 극히 적습니다. 용매가 풍부한 상은 순수 용매에 가깝습니다. 이것은 폴리머의 독특한 점으로, 분자의 혼합물은 N= N = 과 함께 Flory-Huggins 식을 사용하여 근사화할 수 있으며ϕ CP = 1/2 {\ _{}= 1/2}이며 공존하는 두 상은 순수와는 거리가 있습니다.
폴리머 블렌드
합성 고분자는 용매에서 균일한 길이의 사슬로 구성되는 경우가 거의 없습니다. Flory-Huggins free energy density는 가 인 폴리머의 N성분[5] 혼합물로 일반화할 수 있습니다.
한 종이 단량체로 구성되고 다른 단량체로 구성되는 이진 폴리머 블렌드의 경우, 이는 다음과 같이 단순화됩니다.
묽은 고분자 용액의 경우와 마찬가지로 오른쪽 첫 두 항은 혼합의 엔트로피를 나타냅니다. ≫ 1 {\A}\gg 1} 및 NB ≫ 1 {\displaystyle N_{B}\gg 1}의 대형 폴리머의 경우 이러한 항은 무시할 수 있을 정도로 작습니다. 이것은 안정적인 혼합물이χ <0 \chi 0} 이 존재하기 위해서는 폴리머 A와 B가 세그먼트를 혼합하기 위해서는 서로를 끌어당겨야 한다는 것을 의미합니다.
한계
Flory-Huggins 이론은 반희석 농축 체제에서의 실험과 잘 일치하는 경향이 있으며 고농도의 더욱 복잡한 혼합에 대한 데이터를 적합시키는 데 사용될 수 있습니다. 이 이론은 상분리, 고분자량 종의 혼합 경향,χ ∝ T- 1 {\displaystyle \chi \proptto T^{-1}} 상호작용-온도 의존성 및 폴리머 혼합물에서 일반적으로 관찰되는 기타 특징을 정성적으로 예측합니다. 그러나 수정되지 않은 Flory-Huggins 이론은 일부 폴리머 블렌드에서 관찰되는 더 낮은 임계 용액 온도와 사슬 길이 에 대한 임계 온도 의 의존성 부족을 예측하지 못합니다[7] 또한, 동일한 사슬 길이를 가진 고분자 종의 이진 혼합=)(N_{A=N_{B})}의 경우 임계 농도는 ψ c = 1 / 2 {\displaystyle \psi _{c}= 1/2}이어야 함을 보여줄 수 있습니다. 그러나 이 매개변수가 매우 비대칭적인 고분자 혼합이 관찰되었습니다. 특정 혼합물에서는 혼합 엔트로피가 단량체 상호작용보다 우세할 수 있습니다. 평균 필드 근사를 채택하여 온도, 블렌드 구성 및 체인 길이에 대한χ {\displaystyle chi} 파라미터 복합 의존성을 폐기했습니다. 특히, 가장 가까운 이웃을 넘어서는 상호 작용은 혼합물의 거동과 매우 관련이 있을 수 있고 폴리머 세그먼트의 분포가 반드시 균일할 필요는 없으므로 특정 격자 부위는 평균 필드 이론에 의해 근사화된 것과 다른 상호 작용 에너지를 경험할 수 있습니다.
수정되지 않은 Flory Huggins 이론에 의해 무시된 상호 작용 에너지에 대한 잘 연구된[4][6] 효과 중 하나는 연쇄 상관입니다. 사슬이 잘 분리된 묽은 고분자 혼합물에서는 고분자 사슬의 단량체 사이의 분자 내 힘이 지배하고 고분자 농도가 높은 영역으로 이어지는 탈혼합을 유도합니다. 고분자 농도가 증가할수록 사슬이 겹치는 경향이 있어 효과가 덜 중요해집니다. 사실 묽은 용액과 반희석 용액 사이의 경계는 일반적으로 다음과 같이 추정할수 c ∗ {\ c^{*}}을 중합체가 겹치기 시작하는 농도에 의해 정의됩니다.
여기서 m은 단일 고분자 사슬의 질량이고, 는 사슬의 회전 반경입니다.
참고문헌
- ^ a b Burchard, W (1983). "Solution Thermodyanmics of Non-Ionic Water Soluble Polymers.". In Finch, C. (ed.). Chemistry and Technology of Water-Soluble Polymers. Springer. pp. 125–142. ISBN 978-1-4757-9661-2.
- ^ a b Franks, F (1983). "Water Solubility and Sensitivity-Hydration Effects.". In Finch, C. (ed.). Chemistry and Technology of Water-Soluble Polymers. Springer. pp. 157–178. ISBN 978-1-4757-9661-2.
- ^ Dijk, Menno A. van; Wakker, Andre (1998-01-14). Concepts in Polymer Thermodynamics. CRC Press. pp. 61–65. ISBN 978-1-56676-623-4.
- ^ a b de Gennes, Pierre-Gilles (1979). Scaling concepts in polymer physics. Ithaca, N.Y.: Cornell University Press. ISBN 080141203X. OCLC 4494721.
- ^ Berry, J; et al. (2018). "Physical principles of intracellular organization via active and passive phase transitions". Reports on Progress in Physics. 81 (46601): 046601. Bibcode:2018RPPh...81d6601B. doi:10.1088/1361-6633/aaa61e. PMID 29313527. S2CID 4039711.
- ^ a b Doi, Masao (2013). Soft Matter Physics. Great Clarendon Street, Oxford, UK: Oxford University Press. ISBN 9780199652952.
- ^ Schmid, Friederike (2010). "Theory and Simulation of Multiphase Polymer Systems". arXiv:1001.1265 [cond-mat.soft].
외부 링크
각주
- ^"고분자 용액의 열역학", Paul J. Flory Journal of Chemical Physics, 1941년 8월 9권, 8호, 660쪽 초록. 플로리는 허긴스가 몇 달 전에 발표했기 때문에 허긴스의 이름이 먼저여야 한다고 제안했습니다. 플로리, P.J., "고분자 용액의 열역학", J. Chem. 물리학 10:51-61 (1942) 인용 클래식 제18호, 1985년 5월 6일
- ^"긴 사슬 화합물의 솔루션", 모리스 L. 허긴스 화학물리학 저널, 1941년 5월 9권, 5호, 440쪽 초록
- ^우리는 결정에 비해 액체와 비정질 고체의 분자 장애로 인한 자유 부피를 무시하고 있습니다. 이것과 단량체와 용질 분자가 실제로 같은 크기라는 가정이 이 모델의 주요 기하학적 근사치입니다.
- ^실제 합성 고분자의 경우 사슬 길이에 대한 통계적 분포가 있으므로 x{\ x는 평균입니다.
- ^엔탈피는 일정한 (외부) 에서 압력 부피 작업에 대해 보정된 내부 에너지입니다 우리는 여기서 어떤 구별도 하지 않습니다. 이를 통해 플로리-허긴스 격자 이론에서 자유 에너지의 자연스러운 형태인 헬름홀츠 자유 에너지를 깁스 자유 에너지로 근사할 수 있습니다.
- ^사실, 폴리머 세그먼트에 인접한 부위 중 2개는 사슬의 일부이기 때문에 다른 폴리머 세그먼트가 차지하고, 하나는 분기 부위의 경우 3개를 더 만들지만, 말단의 경우 1개만 차지합니다.

![{\displaystyle \Delta G_{\rm {mix}}=RT[\,n_{1}\ln \phi _{1}+n_{2}\ln \phi _{2}+n_{1}\phi _{2}\chi _{12}\,]\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/043a3377fef83a6b6ec3f97120538f2aaafec284)



 용매 분자의 수이고
용매 분자의 수이고  고분자 분자의 수이며, 각각은
고분자 분자의 수이며, 각각은 
![{\displaystyle \Delta S_{\rm {mix}}=-k_{\rm {B}}\left[N_{1}\ln {\tfrac {N_{1}}{N}}+N_{2}\ln {\tfrac {xN_{2}}{N}}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1f4a5b0bcda7d8f77d6a52cbfbcee2ce149b9586)


![{\displaystyle \Delta S_{\rm {mix}}=-k_{\rm {B}}[\,N_{1}\ln \phi _{1}+N_{2}\ln \phi _{2}\,]\,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b9a58a81330833f0cec1b7cc8cf68ab86476dce6)





 격자 부위에 대한 가장 가까운 이웃의 수이며, 각각은 하나의 사슬 세그먼트 또는 용매 분자가 차지합니다. 즉,
격자 부위에 대한 가장 가까운 이웃의 수이며, 각각은 하나의 사슬 세그먼트 또는 용매 분자가 차지합니다. 즉,  용액 내 폴리머 세그먼트들(단량체들)의 총 개수이므로,
용액 내 폴리머 세그먼트들(단량체들)의 총 개수이므로,  모든 폴리머 세그먼트들에 가장 가까운 이웃 사이트들의 개수입니다.
모든 폴리머 세그먼트들에 가장 가까운 이웃 사이트들의 개수입니다. 






 (는) 폴리머 세그먼트의 실제 볼륨입니다.
(는) 폴리머 세그먼트의 실제 볼륨입니다. 








 대한 임계 온도
대한 임계 온도 
 사슬의
사슬의 


