분자신경과학
Molecular neuroscience분자신경과학은 동물의 신경계에 적용되는 분자생물학의 개념을 관찰하는 신경과학의 한 분야이다.이 과목의 범위는 분자 신경 해부학, 신경계의 분자 신호 전달 메커니즘, 신경 발달에 대한 유전학과 후생 유전학의 영향, 신경 가소성 및 신경 [1]변성 질환에 대한 분자 기반과 같은 주제를 다룬다.분자생물학과 마찬가지로 분자신경과학은 상당히 역동적인 비교적 새로운 분야이다.
신경전달물질의 위치 확인
분자생물학에서, 뉴런들 사이의 통신은 전형적으로 시냅스라고 불리는 세포들 사이의 틈 사이로 화학적인 전달에 의해 일어난다.신경전달물질로 알려진 전달된 화학물질은 중요한 신체 [2]기능의 중요한 부분을 조절합니다.라벨링 기법을 사용하여 해부학적으로 신경전달물질을 찾을 수 있습니다.신경조직 단면을 포름알데히드로 고정함으로써 카테콜아민과 같은 특정 신경전달물질을 화학적으로 식별할 수 있다.이는 자외선에 노출되면 포름알데히드에 의한 형광을 일으킬 수 있다.카테콜아민인 도파민은 이 [3]기술을 사용하여 선충 C. 엘레건에서 확인되었다.표적 화학 또는 생물학적 실체에 대해 항체를 키우는 것을 포함하는 면역 세포 화학은 몇 가지 다른 관심 기술을 포함합니다.표적 신경전달물질은 자동방사선촬영에 의해 신경전달물질을 식별하기 위해 방사성 라벨 부착 1차 및 2차 항체에 의해 구체적으로 태그될 수 있다.신경전달물질(반드시 위치는 아니지만)의 존재는 효소결합형 면역세포화학 또는 효소결합형 면역흡수물질(ELISA)에서 관찰될 수 있으며, 효소결합형 면역흡수물질은 효소분석의 기질결합이 침전물, 형광체 또는 화학발광을 유도할 수 있다.신경전달물질이 조직화학적으로 식별될 수 없는 경우, 다른 방법은 신경흡수 [1]메커니즘에 의해 신경전달물질을 찾는 것이다.
전압 게이트 이온 채널

생물의 흥분성 세포는 전압 개폐 이온 채널을 가지고 있다.이것들은 뉴런의 신경계 전체에서 관찰될 수 있다.최초로 특징지어진 이온 채널은 A.L.에 의한 나트륨 및 칼륨 이온 채널이었다. 호지킨과 A.F. 1950년대 Huxley는 오징어속 Loligo의 거대한 축삭을 연구했다.그들의 연구는 생리학적 조건에 따라 세포막의 선택적 투과성과 활동 [4]전위를 생성하기 위해 이러한 투과성으로 인한 전기적 효과를 보여주었다.
나트륨 이온 채널
나트륨 채널은 1984년 쇼사쿠 누마가 뱀장어 일렉트로포러스 일렉트릭투스로부터 분리한 최초의 전압 게이트 이온 채널이었다.나트륨 채널 차단제인 복어독소 테트로도톡신(TTX)을 사용하여 나트륨 채널 단백질을 컬럼 크로마토그래피(column cromatography) 기술을 사용하여 결합함으로써 분리하였다.단백질의 아미노산 배열을 Edman 분해에 의해 분석하여 채널 단백질을 복제하는 데 사용할 수 있는 cDNA 라이브러리를 구축하는 데 사용하였습니다.채널 자체를 복제하면 다른 [1]동물에서 동일한 채널을 식별하는 등의 응용 프로그램이 가능했습니다.나트륨 채널은 단계별 전위 및 활동 전위 개발 중에 칼륨 채널과 함께 작동하는 것으로 알려져 있습니다.나트륨 채널은 Na 이온의+ 뉴런으로의 유입을 허용하여 뉴런의 휴지막 전위로부터의 탈분극이 일어나 [5]탈분극의 정도에 따라 등급화된 전위 또는 활동 전위로 이어진다.
칼륨 이온 채널
칼륨 채널은 다양한 형태로 나타나며, 대부분의 진핵 세포에 존재하며, 전형적으로 칼륨 평형 전위에서 세포막을 안정화시키는 경향이 있습니다.나트륨 이온과 마찬가지로 등급별 전위 및 활동 전위도 칼륨 채널에 의존합니다.Na 이온의+ 뉴런으로의 유입이 세포 탈분극을 유도하는 반면, 뉴런으로부터의 K 이온의+ 유출은 세포가 휴지막 전위로 재분극을 일으킨다.칼륨 이온 채널의 활성화 자체는 활동 [1]전위 중의 Na 유입으로 인한+ 탈분극에 의존합니다.나트륨 채널과 마찬가지로 칼륨 채널은 단백질의 작용을 차단하는 독소를 가지고 있습니다.그러한 독소의 예로는 대형 양이온인 테트라에틸암모늄(TEA)이 있지만, 여러 종에 걸쳐 다양한 채널 유형을 고려할 때 모든 칼륨 채널에서 동일한 작용 메커니즘을 가지고 있지 않은 것이 눈에 띈다.칼륨 채널의 존재는 비정상적인 뉴런과 근육 전기생리학으로 이어진 세포 재분극의 문제로 인해 마취 시 걷잡을 수 없이 흔들리는 드로소필라 멜라노가스터 돌연변이 파리에게서 처음 확인되었다.칼륨 채널은 발견 [1][6]당시 칼륨 채널(예: TEA)에 대해 알려진 고친화성 리간드가 없었기 때문에 채널 단백질 정화를 수행하는 대신 (파리의) 분자 유전학을 조작하여 처음 확인되었다.
칼슘 이온 채널
칼슘 채널은 축삭 말단에서의 신경 전달 물질 방출뿐만 아니라 특정 세포 신호 전달 캐스케이드에 중요합니다.다양한 종류의 칼슘 이온 채널이 흥분성 세포에서 발견됩니다.나트륨 이온 채널과 마찬가지로 칼슘 이온 채널은 크로마토그래피 정제 기술로 분리 및 복제되었습니다.신경전달물질 방출의 경우와 마찬가지로 칼슘 채널이 세포 내 단백질과 상호작용할 수 있고 특히 근육 [1]세포의 석소체와 같은 위치에서 신호 전달에 강한 역할을 한다는 것은 주목할 만하다.
수용체
세포 신호 전달 및 통신에 다양한 유형의 수용체를 사용할 수 있으며, 이온성 수용체 및 메타로픽 수용체를 포함할 수 있다.이러한 세포 표면 수용체 유형은 빠른 신호 전송과 관련된 이온 자극성 수용체와 느린 신호 전송과 관련된 메타 자극성 수용체로 작용 메커니즘과 지속 시간에 의해 구별된다.메타로트로픽 수용체는 현저하게 다른 신호 [1][5]캐스케이드로 다양한 세포 표면 수용체를 덮는다.
이온성 수용체
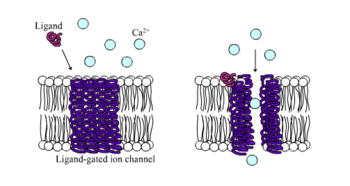
리간드 게이트 이온 채널로 알려진 이온 자극성 수용체는 리간드 결합으로 이온 채널 흐름에 의해 신경 및 생리적인 기능을 중재하는 빠르게 작용하는 수용체이다.니코틴 수용체, GABA 수용체 및 글루탐산 수용체는 리간드 게이트 이온 채널 흐름에 의해 조절되는 세포 표면 수용체 중 일부이다.GABA는 뇌의 주요 억제 신경전달물질이고 글루탐산염은 뇌의 주요 흥분성 신경전달물질이다.[1]
GABA수용체
GABAA 및 GABAC 수용체는 이온성인 것으로 알려져 있으며, GABAB 수용체는 대사성입니다.GABAA 수용체는 중추신경계(CNS)에서 빠른 억제 반응을 매개하며 뉴런, 신경교과세포, 부신수질세포에서 발견됩니다.Cl 이온의 세포 유입을 유도하여− 등급화된 전위 또는 활동 전위가 도래할 때 막 탈분극이 발생할 확률을 감소시킵니다.GABA 수용체는 또한 활동에 영향을 미치기 위해 비내생 리간드와 상호작용할 수 있다.예를 들어 화합물 디아제팜(발륨으로 판매)은 GABA에 대한 수용체의 친화력을 높이는 알로스테릭 작용제이다.GABA 결합의 증가로 인한 생리적 억제 효과의 증가는 디아제팜을 유용한 신경안정제 또는 항경련제(항경화제)로 만든다.한편, GABA 수용체는 피크로톡신 등의 경련 효과와 함께 Cl세포 유입을 감소시킴으로써− 표적이 될 수도 있다.이 화합물에 대한 길항 작용 메커니즘은 GABA 수용체에 직접 있는 것은 아니지만, T-부틸비시클로포로티온산염(TBPS) 및 펜티렌테트라졸(PZT)을 포함하여 알로스테릭 불활성화가 가능한 다른 화합물이 있다.GABA에C 비해A GABA 수용체는 GABA에 대한 친화력이 높고 활성이 더 오래 지속될 가능성이 높으며 GABA [1]농도가 낮으면 반응이 생성될 가능성이 높다.
글루탐산수용체
이오노트로픽 글루탐산 수용체는 NMDA, AMPA 및 카이네이트 수용체를 포함할 수 있다.이 수용체들은 글루탐산염 활동을 촉진하는 작용제의 이름을 따왔다.NMDA 수용체는 뇌졸중과 뇌전증과 같은 신경병리학뿐만 아니라 학습과 기억의 신경 가소성에 영향을 미치는 흥분 메커니즘으로 유명하다.NDMA 수용체들은 이온방향성 GABA 수용체와 마찬가지로 다중 결합 부위를 가지며 글리신 신경전달물질 또는 펜시클리딘(PCP)과 같은 공동 작용제에 의해 영향을 받을 수 있다.NMDA 수용체는 Ca 이온에 의해2+ 전류를 전달하며 전압과 막 전위에 따라 세포외2+ Mg 이온에 의해 차단될 수 있다.이2+ Ca 유입은 NMDA 수용체에 의해 생성된 흥분성 시냅스 후 전위(EPSPs)에 의해 증가하여 Ca2+ 기반 신호 캐스케이드(신경전달물질 방출 등)를 활성화한다.AMPA는 다른 이오노트로픽 글루타메이트 [5]수용체보다 짧고 큰 자극성 시냅스 후 전류를 생성한다.
니코틴성 ACh 수용체
니코틴 수용체는 아세틸콜린(ACH) 신경전달물질을 결합시켜 흥분성 시냅스 후 반응을 생성하는 비선택적 양이온 채널 흐름을 생성한다.니코틴 섭취에 의해 영향을 받을 수 있는 수용체 활동은 높은 [5]수준의 행복감, 이완감, 그리고 필연적으로 중독감을 일으킨다.
대사성 수용체
메타트로픽 수용체는 시냅스 후 세포의 느린 반응 수용체이다.전형적으로 이러한 느린 반응은 생화학에서 더 정교한 세포 내 변화로 특징지어진다.메타보트로픽 수용체에 의한 신경전달물질 흡수의 반응은 G 단백질 연결 수용체의 경우와 마찬가지로 2차 전달자를 포함하는 세포내 효소와 캐스케이드의 활성화를 초래할 수 있다.다양한 메타보트로픽 수용체에는 특정 글루탐산 수용체, 무스카린성 ACh 수용체B, GABA 수용체 및 수용체 티로신 키나아제 등이 포함될 수 있다.
G단백질결합수용체
G단백질 연결 신호 캐스케이드는 특정 신경전달물질의 신호를 현저하게 증폭시켜 세포 내에서 수백에서 수천 초의 메신저를 생성할 수 있다.G 단백질 연결 수용체가 신호 캐스케이드를 일으키는 작용 메커니즘은 다음과 같다.
- 신경전달물질이 수용체에 결합하다
- 수용체는 G-단백질 복합 결합을 가능하게 하는 구조 변화를 겪는다.
- G단백질복합체가 수용체에 결합하면 GDP는 GTP와 교환된다.
- G단백질 복합체의 α-서브유닛은 GTP에 결합하고 아데닐산 시클라아제와 같은 표적 단백질과 결합하기 위해 분리된다.
- 표적 단백질에 대한 결합은 두 번째 메신저(예: 순환 AMP) 생산 속도를 증가시키거나 감소시킨다.
- GTPase는 α-서브유닛을 가수분해하여 GDP에 결합하고 α-서브유닛은 비활성 G 단백질 복합체로 돌아간다.
신경전달물질 방출
신경전달물질은 한 뉴런의 축삭 말단에서 다른 뉴런의 수상돌기로 시냅스를 통해 퀀타라고 알려진 이산패킷으로 방출된다.이 퀀텀들은 전자현미경 검사를 통해 시냅스 소포로 확인되었다.두 가지 유형의 소포는 직경이 약 40-60nm인 소형 시냅스 베시클(SSV)과 직경이 [1]약 120-200nm인 대형 고밀도 코어 베시클(LDCV)이다.전자는 엔도솜에서 유래하며 아세틸콜린, 글루탐산, GABA, 글리신 등의 신경전달물질을 함유하고 있다.후자는 골지 기구에서 파생되어 카테콜아민과 다른 펩타이드 신경전달물질과 [7]같은 더 큰 신경전달물질을 포함하고 있다.신경전달물질은 축삭 말단에서 방출되어 다음 행렬에서 [5]시냅스 후 수상돌기에 결합됩니다.
- 세포골격에서 시냅스 소포를 동원/재취득
- 시냅스 전막에 대한 소포(결합) 도킹
- ATP에 의한 소포의 프라이밍(상대적으로 느린 단계)
- 수용된 신경전달물질의 시냅스 전막 및 세포외이입과 프라이밍된 소포의 융합
- 시냅스 후 세포의 수용체에서 신경전달물질의 흡수
- 신경전달물질이 흥분성인지 억제성인지에 따라 시냅스 후 세포에서 활동전위의 개시 또는 억제(시냅스 후 막의 탈분극이 발생한다)
신경전달물질 방출은 칼슘에 의존합니다
신경 전달 물질 방출은 전압 게이트 칼슘 채널을 통해 축삭 말단으로 들어가는 Ca 이온의 외부2+ 공급에 의존합니다.말단막과의 소포융합 및 신경전달물질의 방출은 유입되는 활동전위에 의해 유도되는 Ca구배 발생에2+ 의해 발생한다.Ca 이온은2+ 이 막융합을 수행하기 위해 예비 풀에서 새로 합성된 소포를 이동시킵니다.이 작용 메커니즘은 오징어 거대 [8]축삭에서 발견되었다.세포2+ 내 Ca 이온을 낮추는 것은 신경전달물질 [1]방출에 직접적인 억제 효과를 제공한다.신경전달물질의 방출이 발생한 후, 소포막은 생산원점까지 재활용된다.칼슘 이온 채널은 발생 위치에 따라 달라질 수 있습니다.예를 들어 축삭 말단의 채널은 세포체의 일반적인 칼슘 채널과 다릅니다(신경 여부에 관계없이).축삭 말단에서도 P형 칼슘 채널이 신경근 접합부에 [1]있는 경우와 마찬가지로 칼슘 이온 채널 유형이 다를 수 있다.
신경유전자발현
성별의 차이
성별 결정의 차이는 성염색체에 의해 조절된다.성호르몬 분비는 뇌의 성적 이형성(성징의 비정형적 분화)에 큰 영향을 미친다.최근의 연구는 이러한 이형성을 조절하는 것이 정상적이고 비정상적인 뇌 기능을 이해하는 데 영향을 미친다는 것을 시사하는 것으로 보인다.성적 이형성은 종마다 다른 성에 기초한 뇌 유전자 발현에 의해 크게 영향을 받을 수 있다.
설치류, Drosophila melanogaster, Caenorhabditis elegans와 같은 동물 모델은 동물의 호르몬을 생성하는 생식선에 대한 뇌의 성편향의 기원 및/또는 범위를 관찰하기 위해 사용되어 왔다.설치류에서, 성염색체의 유전자 조작에 대한 연구는 다른 성별의 영향과는 완전히 반대되는 효과를 낳았다.예를 들어, 특정 유전자의 녹아웃은 단지 남성들에게 불안과 같은 효과를 가져왔다.D. menlanogaster에 대한 연구를 통해 생식선이 제거된 후에도 큰 뇌 성편향이 발생했으며, 이는 성편향이 특정 측면에서 호르몬 조절과 [9]독립적일 수 있음을 시사한다.
성편향 유전자를 관찰하는 것은 뇌의 생리를 관찰하는 임상적 의미와 관련된 (직접 또는 간접적으로) 신경학적 장애의 가능성을 가지고 있다.발달에 있어서 성편견이 있는 질병으로는 헌팅턴병, 뇌허혈,[9] 알츠하이머병이 있다.
뇌의 후생유전학
많은 뇌 기능은 세포와 분자 수준에서 유기체의 DNA 서열을 바꾸지 않고 유전자 발현의 변화와 변화에 의해 영향을 받을 수 있습니다.이것은 후생유전학적 조절로 알려져 있다.후생유전 메커니즘의 예는 히스톤 수식 및 DNA 메틸화를 포함한다.이러한 변화는 뇌질환, 정신질환, [10]중독 발생률에 강한 영향을 미치는 것으로 밝혀졌다.후생성 조절은 초기 발달에서 높은 수준의 가소성에 관여하는 것으로 나타나 유기체의 임계 [11]시기에 그것의 중요성을 정의한다.후생유전학적 변화가 인간의 뇌에 어떤 영향을 미칠 수 있는지에 대한 예는 다음과 같습니다.
- 뇌의 해마에서 rRNA 유전자의 높은 메틸화 수준은 단백질의 낮은 생산을 초래하고, 따라서 제한된 해마 기능은 학습과 기억 장애와 그로 인한 자살 [12]경향을 야기할 수 있습니다.
- 건강한 사람과 정신과 환자 사이의 유전적 차이를 비교한 연구에서 뇌세포 신호 전달과 관련된 60개의 다른 후생유전학적 마커가 발견되었다.[12]
- 아동학대와 같은 환경적 요인은 자살 [12]피해자에게서 발견되지 않은 (스트레스 반응과 관련된) 글루코콜티코이드 수용체에 후생유전학적 태그의 발현을 일으키는 것으로 보인다.이것은 경험에 의존한 가소성의 예입니다.
- 개인의 환경적 풍요는 해마 유전자 히스톤 아세틸화의 증가와 관련이 있으며, 따라서 기억 통합(특히 공간적 기억)[11]이 개선된다.
신경변성 질환의 분자 메커니즘
흥분독성 및 글루탐산수용체
엑시토독성은 글루탐산 수용체가 부적절하게 활성화되는 현상이다.그것은 높은 수준의 글루탐산 신경 전달 물질이 시냅스 후 뉴런의 죽음을 초래할 수 있는 과도한 활성화를 야기하는 흥분성 시냅스 전달의 장기화에 의해 야기될 수 있다.(허혈로 인한) 뇌손상에 이어 흥분독성이 신경손상의 중요한 원인이라는 것이 밝혀졌습니다.이것은 허혈 기간 동안 글루탐산염과 [5][13]아스파르트산염의 증가에 의해 야기되는 과도한 시냅스 활동을 야기할 수 있는 경우에 이해할 수 있다.
알츠하이머병
알츠하이머병은 가장 흔한 신경변성 질환이며 노인들에게 가장 흔한 치매의 형태이다.그 장애는 기억력의 점진적인 상실과 다양한 인지 기능을 특징으로 한다.아밀로이드β펩타이드(아미노산잔기 40~42개)의 뇌 퇴적은 알츠하이머병 발생에 필수적이라는 가설이 있다.축적은 해마의 장기강화를 막는 것으로 알려져 있다.또한 아밀로이드-β 올리고머 수용체가 프리온 [14]단백질일 수도 있다.
파킨슨병
파킨슨병은 알츠하이머병 다음으로 흔한 신경변성 질환이다.인간의 뇌 흑질에서 도파민 작동성 뉴런이 손실되어 발생하는 운동저하증 기저신경절 질환입니다.따라서 기저신경절의 억제성 유출이 감소하지 않기 때문에 시상에 의해 매개되는 상부운동뉴런이 적시에 활성화되지 않는다.특정 증상으로는 경직, 자세 문제, 느린 움직임, 떨림 등이 있습니다.중간 가시가 있는 뉴런에서 망막 세포로 GABA 수용체 입력을 차단하는 것은 [5]파킨슨병에서 일어나는 억제와 유사한 상부 운동 뉴런의 억제를 일으킨다.
헌팅턴병
헌팅턴병은 기저신경절의 중간 가시가 있는 뉴런에서 정상적인 억제 입력이 부족하여 발생하는 과운동성 기저신경절 질환이다.이것은 상부 운동 뉴런의 부적절한 활성화를 포함한 파킨슨병과 관련된 것과 반대되는 효과를 나타낸다.파킨슨병과 관련하여 관찰된 GABAergic 메커니즘과 마찬가지로, GABA 작용제는 실질적으로 흑상부에 주입된 상위 운동 뉴런의 억제를 감소시켜 헌팅턴병의 [5]증상과 유사한 탄도 비자발적 운동 운동을 일으킨다.
레퍼런스
- ^ a b c d e f g h i j k l Longstaff, Alan; Revest, Patricia (1998). Molecular Neuroscience. Garland Science. ISBN 978-1859962503.
- ^ "What are Neurotransmitters?". Archived from the original on 25 September 2019. Retrieved 1 November 2013.
- ^ Riddle, Donald (1998). C. Elegans II. New York: Cold Spring Harbor Laboratory Press. ISBN 978-0879695323.
- ^ Hodgkin, Allan L.; Andrew F. Huxley (1952). "The dual effect of membrane potential on sodium conductance in the giant axon of Loligo". The Journal of Physiology. 116 (4): 497–506. doi:10.1113/jphysiol.1952.sp004719. PMC 1392212. PMID 14946715.
- ^ a b c d e f g h Purves, Dale (2012). Neuroscience (5th ed.). Massachusetts, USA: Sinauer Associates, Inc. p. 80. ISBN 978-0-87893-695-3.
- ^ Kamb, Alexander; Linda E. Iverson; Mark A. Tanouye (31 July 1987). "Molecular characterization of Shaker, a Drosophila gene that encodes a potassium channel". Cell. 50 (3): 405–413. doi:10.1016/0092-8674(87)90494-6. PMID 2440582. S2CID 31247228.
- ^ Davies, R. Wayne; Brian J. Morris (1997). Molecular Biology of the Neuron. Oxford, UK: BIOS Scientific Publishers Ltd. ISBN 978-1859962404.
- ^ Dipolo, R.; C. Caputo; F. Bezanilla (March 1983). "Voltage-dependent calcium channel in the squid axon". Proc Natl Acad Sci U S A. 80 (6): 1743–1745. Bibcode:1983PNAS...80.1743D. doi:10.1073/pnas.80.6.1743. PMC 393680. PMID 6300873.
- ^ a b Jazin, E.; Cahill, L. (January 2010). "Sex differences in molecular neuroscience: from fruit flies to humans". Nature Reviews Neuroscience. 11 (1): 9–17. doi:10.1038/nrn2754. PMID 20019686. S2CID 2545405.
- ^ "Epigenetics and the Human Brain". Genetics Science and Learning Center at The University of Utah. Retrieved 10 November 2013.
- ^ a b Fagiolini, Michela; Catherin L. Jensen; Frances A. Champagne (2009). "Epigenetic Influences on brain development and plasticity" (PDF). Current Opinion in Neurobiology. 19 (2): 1–6. doi:10.1016/j.conb.2009.05.009. PMC 2745597. PMID 19545993. Archived from the original (PDF) on 22 June 2010. Retrieved 14 November 2013.
- ^ a b c Tsankova, Nadia; Renthal, William; Kumar, Arvind; Nestler, Eric J. (2007). "Epigenetic Regulation in Psychiatric Disorders". Nature Reviews Neuroscience. 8 (5): 355–367. doi:10.1038/nrn2132. PMID 17453016. S2CID 34125955.
- ^ Lau, A.; M. Tymianski (2010). "Glutamate receptors, neurotoxicity and neurodegeneration". Pflügers Arch. 460 (2): 525–542. doi:10.1007/s00424-010-0809-1. PMID 20229265. S2CID 12421120.
- ^ Laren, Juha; David A. Gimbel; Haakon B. Nygaard; John W. Gilbert (February 2009). "Cellular prion protein mediates impairment of synaptic plasticity by amyloid-β oligomers". Nature. 457 (7233): 1128–1132. Bibcode:2009Natur.457.1128L. doi:10.1038/nature07761. PMC 2748841. PMID 19242475.