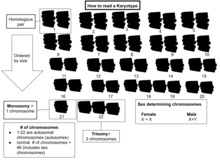
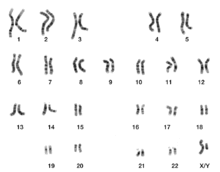
핵형
Karyotype핵형은 길이, 동원체 위치 및 기타 특징에 따라 분류된 종이나 개별 유기체의 세포에 있는 메타기 염색체 전체 세트를 준비하여 이 보체를 검출하거나 염색체 수를 [1][2][3][4]세는 테스트를 위한 것이다.핵형성은 염색체 사진으로부터 핵형을 만들어 염색체의 수와 이상을 포함한 개인의 염색체 보체를 결정하는 과정이다.
핵형은 유기체의 염색체 수와 이 염색체들이 빛 현미경으로 봤을 때 어떻게 생겼는지 묘사한다.이들의 길이, 동원체의 위치, 밴딩 패턴, 성염색체 간의 차이, 그리고 다른 신체적 [5]특징에 주의를 기울인다.핵형의 준비와 연구는 세포유전학의 일부이다.

염색체 전체 세트에 대한 연구는 때때로 핵학으로 알려져 있다.염색체는 (사진 현미경을 재배열함으로써) 카리오그램 또는 이디오그램으로 알려진 표준 포맷으로 묘사된다: 같은 크기의 염색체에 대한 동원체의 크기와 위치에 따라 쌍으로 정렬된다.
개인이나 종의 체세포에 있는 기본 염색체 수를 체수라고 하며 2n이라고 한다.생식선(성세포)에서 염색체 수는 n(n =[3]p28 23)이다.따라서 인간의 경우 2n = 46이다.
정상적인 이배체 유기체에서는 상염색체가 두 개의 복사본으로 존재합니다.성염색체가 있을 수도 있고 없을 수도 있다.다배체 세포는 여러 개의 염색체를 가지고 있고, 반배체 세포는 단일 복제를 가지고 있다.
핵형은 염색체 이상, 세포 기능, 분류학적 관계, 의학을 연구하고 과거의 진화적 사건(핵계통학)[6]에 대한 정보를 수집하는 것과 같은 다양한 목적으로 사용될 수 있다.
핵형 연구의 역사
염색체는 1842년 칼 빌헬름 폰 나겔리에 의해 식물 세포에서 처음 관찰되었다.동물 세포에서의 그들의 행동은 1882년 유사분열의 발견자인 발터 플레밍에 의해 설명되었습니다.이 이름은 1888년 또 다른 독일 해부학자 하인리히 폰 발데이어에 의해 만들어졌다.고대 그리스어 카리온, "커널", "씨드" 또는 "핵"과 "일반형"의 새로운 라틴어이며, "일반형"의 오타이다.
다음 단계는 20세기 초 유전학의 발전 후에 일어났는데, 이때 염색체는 유전자의 운반체라는 것이 인식되었다.1922년 Lev Delaunay[ru는 유전자 [7][8]내용과 대조적으로 핵형을 체세포 염색체의 표현형 외관으로 정의한 최초의 사람으로 보인다.이 개념의 후속 역사는 C. D. Darlington과[9] Michael JD [3][10]White의 작품에서 이어질 수 있다.
인간의 핵형에 대한 연구는 가장 기본적인 의문을 해결하기 위해 수년이 걸렸다: 정상적인 이배체 인간 세포는 몇 개의 염색체를 [11]포함하고 있는가?1912년 한스 폰 위니워터는 XX/XO 성별 결정 [12]메커니즘을 결론짓고 정조세포 47개, 난조세포 48개 염색체를 보고했다.1922년 화가는 인간의 이중배수가 46인지 48인지 처음에는 [13]46인지 확신하지 못하다가 46에서 48로 의견을 수정하고 XX/[14]XY 시스템을 가진 인간을 올바르게 주장했다.당시의 기술을 고려하면, 이러한 결과는 주목할 만했다.
Albert Levan의 연구실에서[15] 일하는 Joe Hin Tjio는 당시 이용 가능한 새로운 기술을 사용하여 염색체 수가 46이라는 것을 알아냈다.
- 조직 배양에서 세포 사용
- 저혈압 용액에서 세포를 전처리하면 세포가 부풀어오르고 염색체가 퍼진다.
- 코르히틴 용액에 의한 중기의 유사분열 억제
- 슬라이드의 준비물을 뭉개어 염색체를 단일 평면으로 만드는 것
- 현미경을 잘라내고 그 결과를 논란의 여지가 없는 핵그래프로 배열하는 것.
이 작품은 1955년에 출판되었고 1956년에 출판되었다.인간의 핵형은 46개의 [16][17]염색체만을 포함하고 있다.다른 유인원들은 48개의 염색체를 가지고 있다.인간 2번 염색체는 현재 두 개의 조상 유인원 [18][19]염색체의 종단간 융합의 결과로 알려져 있다.
핵형 관측
염색
핵형 연구는 염색으로 가능하다.보통 젤사와 [20]같은 적절한 염료는 세포가 세포 분열 중에 콜히틴 용액에 의해 가장 많이 응축되었을 때 보통 중기와 프로메타파아제에 의해 정지된 후에 도포된다.젬사 염색체가 올바르게 부착되기 위해서는 모든 염색체 단백질이 소화되고 제거되어야 한다.인간에게 백혈구는 [21]조직 배양에서 쉽게 분열되고 성장하도록 유도되기 때문에 가장 자주 사용된다.때때로 비분할(상간) 세포에 대한 관찰이 이루어질 수 있습니다.태아의 성별은 간상세포를 관찰하여 결정할 수 있다(양수 천자 및 바 신체 참조).
관찰.
핵형에는 보통 6가지 특성이 관찰되고 [22]비교된다.
- 염색체의 절대 크기 차이.염색체는 같은 과의 속들 사이에서 절대 크기가 20배까지 차이가 날 수 있다.예를 들어, 콩류인 Lotus tenuis와 Vicia faba는 각각 6쌍의 염색체를 가지고 있지만, V. faba 염색체는 몇 배 더 크다.이러한 차이는 아마도 다른 양의 DNA 복제를 반영한다.
- 동원체의 위치 차이이러한 차이는 아마 환승을 통해 생겨났을 것이다.
- 염색체의 상대적 크기 차이.이러한 차이는 길이가 동일하지 않은 세그먼트 교환에서 비롯되었을 가능성이 있습니다.
- 기본 염색체 수의 차이.이러한 차이는 염색체에서 모든 필수 유전 물질을 제거한 연속적인 불균등한 전이로 인해 유기체(탈구 가설) 또는 융합을 통한 손실 없이 발생할 수 있다.인간은 유인원보다 염색체가 한 쌍 적다.인간 2번 염색체는 두 개의 조상 염색체의 융합으로 생겨난 것으로 보이며, 이 두 개의 원래 염색체의 유전자 중 많은 부분이 다른 염색체로 옮겨졌다.
- 인공위성의 수와 위치 차이인공위성은 염색체에 가는 실로 연결된 작은 물체이다.
- 이색 영역의 정도와 분포의 차이.헤테로크로마틴이 에크로마틴보다 더 진하게 변했어요헤테로크로마틴은 촘촘히 채워져 있습니다.헤테로크로마틴은 주로 유전적으로 비활동적이고 반복적인 DNA 배열로 구성되며 더 많은 양의 아데닌-티민 쌍을 포함한다.에크로마틴은 보통 활발하게 전사되며 젬사 [23]염색에 대한 친화력이 떨어지기 때문에 훨씬 더 옅게 염색된다.에크로마틴 지역은 더 많은 양의 구아닌-시토신 쌍을 포함합니다.Giemsa 염색을 사용하는 염색 기술은 G 밴딩이라고 불리며, 따라서 전형적인 "G 밴드"[23]를 생성합니다.
따라서 핵형의 완전한 설명은 염색체의 수, 종류, 형태 및 밴딩과 다른 세포유전학적 정보를 포함할 수 있다.
변동은 자주 볼 수 있습니다.
인간핵형
전형적인 인간 핵형은 22쌍의 상염색체와 1쌍의 성염색체를 포함한다.여성의 가장 일반적인 핵형은 두 개의 X염색체를 포함하고 있으며 46,XX로 표기되어 있다.남성은 보통 46,XY로 표기된 X염색체와 Y염색체를 모두 가지고 있다.인간의 약 0.018%는 간성이며, 때때로 성 [24]염색체의 변화로 인해 발생한다.
핵형은 자가 염색체든 알로솜이든 일부 변형은 발달 이상을 일으킨다.
핵형의 다양성과 진화
DNA의 복제와 전사는 진핵생물에서 고도로 표준화 되어 있지만, 그들의 핵형은 매우 가변적이라고 말할 수 없다.동일한 고분자로부터 구성되었음에도 불구하고 염색체 수와 상세한 조직에서는 종 간에 차이가 있다.이러한 변화는 진화 세포학 연구의 기초를 제공한다.
어떤 경우에는 종에 따라 상당한 차이가 있다.리뷰에서 Godfrey와 Masters는 다음과 같이 결론지었다.
우리가 보기에, 한 과정 또는 다른 과정이 관찰된 광범위한 핵형 구조를 독립적으로 설명할 수 있을 것 같지는 않다.그러나, 다른 계통학 데이터와 함께 사용하면, 핵형 분열은 이전에는 설명할 [25]수 없었던 밀접하게 관련된 종들 사이의 이배체 수의 극적인 차이를 설명하는 데 도움이 될 수 있다.
핵형에 대해 기술적인 수준에서 많이 알려져 있고 핵형 구성의 변화가 많은 종의 진화 과정에 영향을 미친 것은 분명하지만, 일반적인 의미가 무엇인지 매우 불확실합니다.
우리는 핵형 진화의 원인에 대해 많은 신중한 조사에도 불구하고 매우 잘 이해하지 못하고 있다.핵형 진화의 일반적인 의미는 불분명하다.
--
개발 중 변경
일반적인 유전자 억제 대신에, 일부 생물들은 헤테로크로마틴의 대규모 제거나 핵형에 대한 다른 가시적인 조절을 선호한다.
- 염색체 제거.몇몇 종에서, 많은 파리들과 같이,[27] 염색체 전체가 발달하는 동안 제거된다.
- 염색질 감소(창시 아버지:테오도르 보베리).이 과정에서 아스카리스 수움과 같은 요각류나 회충에서 발견되는 염색체의 일부는 특정 세포에서 버려집니다.이 과정은 새로운 텔로미어가 구성되고 특정 헤테로크로마틴 영역이 [28][29]손실되는 치밀하게 조직된 게놈 재배치이다.A. suum에서는 모든 체세포 전구체가 염색질 감소를 [30]겪는다.
- X-비활성화한 X 염색체의 불활성화는 포유류의 초기 발달 과정에서 일어난다(바 신체 및 용량 보상 참조).태반 포유동물에서 불활성화는 2개의 X 사이에서 무작위적이다. 따라서 포유동물 암컷은 X 염색체에 관해 모자이크이다.유대류에서는 항상 아버지 X가 비활성화되어 있다.인간 여성의 경우 체세포의 약 15%가 [31]불활성화에서 벗어나며 불활성화 X염색체에 영향을 미치는 유전자의 수는 세포마다 다르다. 섬유아세포의 경우 Bar body에 있는 유전자의 약 25%가 [32]불활성화에서 벗어납니다.
집합 내 염색체 수
밀접하게 연관된 종들 사이의 변이의 멋진 예는 Kurt Benirschke와 Doris Wurster에 의해 조사된 문작이다.중국 문티악 리베시의 이중배체 수는 모두 말단 중심인 46으로 밝혀졌다.그들이 가까운 관계인 인도 문티악 문티악의 핵형을 보았을 때, 그들은 그것이 암컷 = 6, 수컷 [33]= 7개의 염색체를 가지고 있다는 것을 알고 놀랐다.
그들은 그저 그들이 본 것을 믿을 수 없었다...그들은 조직 배양에 뭔가 문제가 있다고 생각했기 때문에 2, 3년 동안 침묵을 지켰다.그러나 그들이 몇 가지 표본을 더 얻었을 때, 그들은[그들의 발견을] 확인했다.
--
(상대적으로) 관련이 없는 종들 사이의 핵형 염색체의 수는 매우 다양하다.낮은 기록은 반수체 n=1인 선충 Parascaris 유니발렌스와 개미 Myrmecia pilosula가 [34]보유하고 있다.가장 높은 기록은 양치식물 어딘가에 있을 것이며, 평균 1262개의 [35]염색체가 있는 첨가자의 혀 양치식물 Ophioglossum 앞에 있을 것이다.동물들의 최고 점수는 372 [36]염색체의 키가 작은 철갑상어 Acipenser brevirostrum일 수 있다.과잉 또는 B 염색체의 존재는 하나의 이종 교배 집단 내에서도 염색체 수가 달라질 수 있다는 것을 의미한다; 그리고 이 경우 그들은 집단의 정상적인 구성원으로 간주되지 않지만, 무배체는 또 다른 예이다.
기본수
핵형의 기본 수인 FN은 염색체 [37][38]세트당 눈에 보이는 주요 염색체 팔의 수이다.따라서 FN ≤ 2 x 2n은 단일 팔(자핵 중심 또는 말단 중심)로 간주되는 염색체 수에 따른 차이이다.인간은 13, 14, 15, 21, 22의 5개의 직교중심 염색체 쌍이 존재하기 때문에 FN [39]= 82를 갖는다.핵형의 기본 상염색체 번호 또는 상염색체 기본 번호 FNa[40] 또는 [41]AN은 자가 염색체 세트(비성 연결 염색체)당 눈에 보이는 주요 염색체 팔의 수이다.
배수성
배수는 세포에 있는 염색체의 전체 집합의 수입니다.
- 세포에 상동 염색체가 2세트 이상 있는 다배체는 주로 식물에서 발생한다.스테빈스에 [42][43][44][45]따르면 그것은 식물 진화에 있어 중요한 의미를 가지고 있다.Stebins는 다배체인 현화식물의 비율을 30-35%로 추정했지만, 풀의 경우 평균 약 [46]70%로 훨씬 더 높다.하등식물(고사리, 말꼬리, 선충류)의 다배체도 흔하며, 일부 양치류는 꽃식물에서 알려진 최고 수준을 훨씬 초과하는 다배체 수준에 도달했다.동물에서 다배체는 훨씬 덜 흔하지만, 몇몇 [47]집단에서는 심각하다.
단일 기본수의 배수로만 구성된 관련 종의 배수 계열을 이배체라고 한다.
- 하플로이배체, 한쪽 성은 이배체, 다른 한쪽은 반배체입니다.그것은 청록조류나 다른 집단에서 흔히 볼 수 있는 배열이다.
- 내분화세포는 성인의 분화조직에서 세포들이 유사분열로 분열하는 것을 멈추었지만 핵은 원래의 체세포 수보다 더 많은 [48]염색체를 포함하고 있을 때 발생한다.'쉬고 있는' 핵의 내핵(내복제 또는 내복제) 염색체에서는 딸 염색체가 온전한 [49]핵막 안에서 서로 분리되는 증식을 겪는다.
많은 경우에, 내분배체 핵은 수만 개의 염색체를 포함하고 있다.세포들이 항상 정확한 배수(2의 거듭제곱)를 포함하는 것은 아니기 때문에 '세포 분열 없이 복제로 인한 염색체 집합의 수 증가'라는 단순한 정의는 정확하지 않다.
이 과정(특히 곤충과 옥수수 같은 일부 고등 식물에서 연구됨)은 [50]생합성에 매우 활발한 조직의 생산성을 높이기 위한 개발 전략일 수 있다.
그 현상은 원생동물에서 인간에 이르기까지 진핵생물의 왕국에서 산발적으로 일어난다; 그것은 다양하고 복잡하며, 여러 [51]가지 방법으로 분화와 형태 형성을 한다. - 고대 핵형 복제에 대한 조사는 고엽 용배체를 참조하십시오.
무배수성
무배수증은 세포의 염색체 수가 종의 전형적인 숫자가 아닌 상태이다.이것은 여분의 염색체나 하나 이상의 염색체 손실과 같은 염색체 이상을 야기할 것이다.염색체 수의 이상은 보통 발달 장애를 일으킨다.다운증후군과 터너증후군이 그 예이다.
무배수성은 또한 밀접하게 관련된 종의 그룹 내에서 발생할 수 있다.식물의 고전적인 예는 배우자(= 반수체) 수가 x = 3, 4, 5, 6, 7 시리즈를 형성하는 크레피스속과 x = 3에서 x = 15까지의 모든 숫자가 적어도 하나의 종으로 표현되는 크로커스속이다.다양한 종류의 증거는 진화의 추세가 다른 [52]집단에서 다른 방향으로 진행되어 왔다는 것을 보여준다.영장류에서 유인원은 24x2 염색체를 가지고 있는 반면 인간은 23x2 염색체를 가지고 있다.인간 2번 염색체는 조상 염색체의 합성으로 형성되어 그 [53]수가 감소하였다.
염색체 다형
어떤 종들은 다른 염색체 구조 [54]형태에 대해 다형성이다.이러한 구조적 변화는 무당벌레 칠로코러스라는 낙인,[citation needed] 아멜레스속의 사마귀, 유럽산 랫슈렉스 [55]아라네우스에서 발생하는 다른 개체들의 염색체 수와 관련이 있을 수 있습니다.브르타뉴 해안에 사는 연체동물 타이 라필루스(개 골뱅이)의 사례에서 두 염색체 형태가 다른 [56]서식지에 적응했다는 증거가 있다.
종나무
폴리텐 염색체를 가진 곤충의 염색체 밴딩에 대한 자세한 연구는 밀접하게 연관된 종들 사이의 관계를 밝힐 수 있습니다: 고전적인 예는 햄프턴 L. 카슨의 하와이 드로포필리드에서의 염색체 밴딩 연구입니다.
약 6,500 평방 마일(17,0002 킬로미터)의 하와이 제도에는 열대 우림에서 아고산 초원까지 사는 세계에서 가장 다양한 드로소필류 파리들이 서식하고 있습니다.약 800여 종의 하와이 드로소필라과 드로소필라과 드로소필라과와 스카토미자의 2개 속으로 분류된다.
하와이 드로소필리드 중 가장 잘 연구된 그룹인 '그림 날개' 그룹의 폴리텐 밴딩은 Carson이 게놈 분석이 실용화되기 훨씬 전에 진화 나무를 연구할 수 있게 해주었다.어떤 의미에서 유전자 배열은 각 염색체의 밴딩 패턴에서 볼 수 있다.염색체 재배열, 특히 반전은 어떤 종이 밀접하게 관련되어 있는지 알 수 있게 해준다.
결과는 명확합니다.반전은 나무 형태로 표시되었을 때(그리고 다른 모든 정보와 무관하게), 오래된 섬에서 새로운 섬으로 가는 종의 분명한 "흐름"을 보여준다.오래된 섬으로 다시 이주하거나 섬을 건너뛴 사례도 있지만 이런 사례는 훨씬 적다.K-Ar 연대 측정법을 사용하여, 현재의 섬은 0.4백만 년 전(마우나 케아)부터 10억 년 전(네커)까지 거슬러 올라간다.아직 바다 위에 있는 하와이 군도의 가장 오래된 구성원은 쿠레 환초이며, 이 환초는 30mya로 추정됩니다.(태평양 판이 핫스팟 위를 이동하면서 생성된) 군도 자체는 적어도 백악기까지 훨씬 더 오래 존재해왔다.이전의 섬들(가요트)이 현재 황제 [57]해산을 이루고 있다.
하와이에 사는 모든 드로소필라와 스카토미자 종은 아마도 2천만 년 전에 이 섬을 식민지로 삼았던 단일 조상 종족의 후손인 것으로 보인다.후속 적응 방사선은 경쟁의 부족과 다양한 틈새에 의해 촉진되었다.비록 단일 중력 암컷이 섬을 식민지로 만드는 것이 가능할지라도, 그것은 같은 [58][59][60][61]종에서 온 집단이었을 가능성이 더 높다.
하와이 군도에는 더 화려하지는 않지만 유사한 적응 [62][63]방사선을 거친 다른 동식물이 있다.
염색체 밴딩
염색체는 약간의 얼룩으로 치료하면 띠 모양의 패턴을 보인다.띠는 염색체의 길이를 따라 나타나는 밝은 줄무늬와 어두운 줄무늬를 번갈아 보여줍니다.고유한 밴딩 패턴은 염색체를 식별하고 염색체 파괴, 손실, 복제, 전위 또는 반전 세그먼트를 포함한 염색체 이상을 진단하기 위해 사용된다.다양한 염색체 처리방법은 G-밴드, R-밴드, C-밴드, Q-밴드, T-밴드 및 NOR-밴드 등 다양한 밴드 패턴을 생성한다.
핵형 묘사
밴딩의 종류
세포유전학은 염색체의 [21]다른 측면을 시각화하기 위해 여러 기술을 사용한다.
- G밴딩은 트립신에 의한 염색체 소화 후 젬사염색을 통해 얻어진다.일련의 옅은 색과 어두운 색상의 띠가 생성됩니다.어두운 영역은 이색성이 있고, 늦게 재현되며, AT가 풍부합니다.밝은 영역은 색소 침착, 조기 복제 및 GC가 풍부한 경향이 있습니다.이 방법은 보통 정상적인 인간 게놈에서 300-400개의 밴드를 생성합니다.
- R-밴딩은 G-밴딩의 반대입니다(R은 "역"을 의미합니다).어두운 영역은 에우크로매틱(구아닌-시토신이 풍부한 영역)이고 밝은 영역은 헤테로크로매틱(티민-아데닌이 풍부한 영역)입니다.
- C-밴딩 : 젬사는 구성성 헤테로크로마틴과 결합하기 때문에 센트로미어를 염색합니다.그 이름은 구심성 또는 구성성 헤테로크로마틴에서 유래되었다.제제는 염색하기 전에 알칼리 변성을 거쳐 DNA가 거의 완전히 제거된다.탐촉자를 세척한 후 남은 DNA를 다시 재증식하여 메틸렌 애저, 메틸렌 바이올렛, 메틸렌 블루, 에오신으로 이루어진 젬사 용액으로 염색한다.헤테로크로마틴은 염료를 많이 결합하지만 나머지 염색체들은 염료를 거의 흡수하지 않는다.C 결합은 식물 염색체의 특성화에 특히 적합한 것으로 입증되었다.
- Q밴딩은 퀴나크린을 염색에 사용한 형광 패턴이다.밴드 패턴은 G밴딩과 매우 유사합니다.그것들은 다른 강도의 노란색 형광으로 알아볼 수 있다.염색된 DNA의 대부분은 헤테로크로마틴이다.퀴나크린(아테브린)은 AT가 풍부한 영역과 GC가 모두 결합하지만 AT-퀴나크린 복합체 형광체만 결합합니다.AT가 풍부한 영역은 에우크로마틴보다 헤테로크로마틴에서 더 흔하기 때문에 이들 영역은 우선적으로 라벨링된다.단일 대역의 다른 강도는 AT의 다른 내용을 반영합니다.DAPI나 Hoechst 33258과 같은 다른 형광색소도 특징적이고 재현 가능한 패턴을 가져옵니다.각각의 패턴은 고유의 패턴을 만들어냅니다.즉, AT가 풍부한 영역에 대한 친화력에 의한 결합의 특성과 불소크롬의 특이성만이 아니다.오히려 AT의 분포와 히스톤과 같은 다른 분자와 AT의 연관성은 불소크롬의 결합 특성에 영향을 미친다.
- T밴딩 : 텔로미어를 시각화합니다.
- 은염색: 질산은 핵조직 영역 관련 단백질을 염색합니다.이것은 은이 퇴적되는 어두운 영역을 만들어 NOR 내의 rRNA 유전자의 활동을 나타낸다.
고전핵형세포유전학
"고전적인" 핵형에서는 염색체의 띠를 염색하기 위해 염료, 종종 G-밴딩(G-banding)인 메파크린(Quinacrine)이 사용된다.젬사는 DNA의 인산염 그룹에 특이하다.퀴나크린은 아데닌티민이 풍부한 지역에 결합한다.각각의 염색체는 그들을 식별하는데 도움을 주는 특징적인 밴딩 패턴을 가지고 있다; 한 쌍의 두 염색체는 같은 밴딩 패턴을 가질 것이다.
핵형은 염색체의 짧은 팔과 긴 팔로 배열되어 있다.일부 핵형은 짧은 팔과 긴 팔을 각각 p, q라고 부른다.또한 염색체 팔의 근위부에서 원위부로 다른 착색 영역 및 하위 영역이 수치적으로 지정된다.예를 들어, Cri du chat 증후군은 5번 염색체의 짧은 팔에 결실을 수반한다.46,XX,5p-라고 쓰여져 있습니다.이 증후군의 핵심 부위는 p15.2(염색체상의 위치)의 결실이며, 46,XX,del(5)(p15.2)[64]로 표기된다.
다색 FISH(mFISH) 및 스펙트럼 핵형(SKY 기술)
다색 FISH와 오래된 스펙트럼 카리오타이핑은 유기체의 모든 염색체 쌍을 다른 색상으로 동시에 시각화하는 데 사용되는 분자 세포 유전학 기술이다.각 염색체에 대한 형광표지 프로브는 염색체 특이적 DNA에 서로 다른 형광구를 부착함으로써 만들어진다.스펙트럼적으로 구별되는 형광체의 수가 한정되어 있기 때문에 조합 라벨링 방법을 사용하여 많은 다른 색상을 생성한다.형광구 조합은 최대 7개의 협대역 형광필터를 이용한 형광현미경으로 포착해 분석하거나, 분광핵형식의 경우에는 형광현미경에 부착된 간섭계를 이용해 분석한다.mFISH 화상의 경우, 전용 화상 해석 소프트웨어에서는, 그 결과 발생하는 원화상으로부터의 불소 색상의 모든 편성을 의사 색상으로 치환한다.따라서 염색체 또는 염색체 단면을 시각화하고 식별할 수 있어 염색체 [65]재배열을 분석할 수 있다.스펙트럼 카리오타이핑의 경우, 화상 처리 소프트웨어는, 스펙트럼이 다른 각 조합에 의사색을 할당해, 개별적으로 착색된 [66]염색체를 시각화할 수 있다.
다색 FISH는 젬사 밴딩이나 다른 기술이 충분히 정확하지 않을 때 암세포와 다른 질병 조건의 구조적 염색체 이상을 식별하기 위해 사용된다.
디지털 카리오타이핑
디지털 카리오타이핑은 DNA 복사 번호를 게놈 척도로 정량화하는 데 사용되는 기술이다.게놈 전체의 특정 위치로부터 짧은 DNA 배열이 분리되고 [67]열거된다.이 방법은 가상 키리타이핑이라고도 합니다.이 기술을 사용하면 중기 염색체를 이용한 방법으로는 검출할 수 없는 인간 게놈의 작은 변화를 검출할 수 있다.몇몇 위치결손은 암의 발생과 관련이 있는 것으로 알려져 있다.이러한 결실은 [68]암 발생과 관련된 위치를 사용하는 디지털 핵형 입력을 통해 발견됩니다.
염색체 이상
염색체 이상은 추가 또는 누락된 염색체의 존재와 같이 수치적일 수 있으며, 유도체 염색체, 전위, 반전, 대규모 결실 또는 복제와 같이 구조적일 수 있다.배우자의 형성 감수분열 중 비접합의 결과로 종종 비배수로 알려진 수치적 이상은 발생한다; 일반적인 두 개의 염색체 대신 세 개의 염색체 복사본이 존재하는 삼분체는 일반적인 수치적 이상이다.구조적 이상은 종종 상동 재조합의 오류에서 발생한다.두 가지 유형의 이상 모두 생식체에서 발생할 수 있고, 따라서 영향을 받는 사람의 모든 세포에 존재할 수도 있고, 유사분열 중에 발생할 수도 있고, 정상 세포와 비정상적인 세포를 가진 유전자 모자이크 개체를 낳을 수도 있다.
인간에게는
인간의 질병을 일으키는 염색체 이상은 다음을 포함한다.
- 터너 증후군은 단일 X 염색체(45,X 또는 45,X0)에서 발생한다.
- 47,XXY로 알려진 가장 흔한 남성 염색체 질환인 클라인펠터 증후군은 여분의 X 염색체에 의해 발생한다.
- Edwards 증후군은 18번 염색체의 삼출술에 의해 발생한다.
- 흔한 염색체 질환인 다운증후군은 21번 염색체의 삼출에 의해 발생한다.
- 파타우 증후군은 13번 염색체의 삼출에 의해 발생한다.
- 트리소미 9는 4번째로 흔한 트리소미 9로 여겨지는 많은 영향을 받은 개체들이 오래 살았지만 트리소미 9p 증후군이나 모자이크 트리소미 9와 같은 완전한 트리소미 이외의 형태로만 살아왔다.그들은 종종 꽤 잘 기능하지만, 말하는데 어려움을 겪는 경향이 있다.
- 또한 트리소미8과 트리소미16도 기록되지만 일반적으로 그들은 태어날 때까지 살아남지 못한다.
어떤 장애는 염색체 한 조각의 손실에서 발생합니다.
- 5번 염색체의 잘린 짧은 팔부터 고양이 울음소리까지.그 이름은 후두의 비정상적인 형성에 의해 야기되는 아기들의 독특한 울음소리로부터 유래되었다.
- 1p36 염색체 1의 짧은 팔의 일부 상실로 인한 결실 증후군.
- 엔젤만 증후군 – 사례의 50%가 15번 염색체의 긴 팔 부분을 잃었습니다; 모체 유전자의 결실, 각인 장애의 예입니다.
- Prader-Willi 증후군 – 사례의 50%가 15번 염색체의 긴 팔 부분이 누락되었습니다; 아버지 유전자의 결실, 각인 장애의 예입니다.
- 염색체 이상은 유전적으로 정상적인 개인의 암세포에서도 발생할 수 있다; 잘 문서화된 한 예는 필라델피아 염색체이다. 필라델피아 염색체는 만성 골수성 백혈병과 일반적으로 관련되며 급성 림프성 백혈병과 덜 자주 관련된다.
「 」를 참조해 주세요.
레퍼런스
- ^ Judd, Walter S.; Campbell, Christopher S.; Kellogg, Elizabeth A.; Stevens, Peter F.; Donoghue, Michael J. (2002). Plant systematics, a phylogenetic approach (2 ed.). Sunderland MA, USA: Sinauer Associates Inc. p. 544. ISBN 0-87893-403-0.
- ^ 간결한 옥스퍼드 사전
- ^ a b c 화이트 1973, 페이지 35
- ^ Stebbins, G.L. (1950). "Chapter XII: The Karyotype". Variation and evolution in plants. Columbia University Press. ISBN 9780231017336.
- ^ King, R.C.; Stansfield, W.D.; Mulligan, P.K. (2006). A dictionary of genetics (7th ed.). Oxford University Press. p. 242.
- ^ "Karyosystematics".
- ^ Delaunay L. N. Muscari Mill.과 Bellevalia Lapeyr 종의 비교핵학적 연구.티플리스 식물원 회보. 1922년, 대 2, 제1, 페이지 1-32(러시아어))
- ^ Battaglia, Emilio (1994). "Nucleosome and nucleotype: a terminological criticism". Caryologia. 47 (3–4): 193–197. doi:10.1080/00087114.1994.10797297.
- ^ 1939년 달링턴 C.D.유전체계의 진화.케임브리지 대학 출판부 제2판, 1958년 개정 증보올리버 & 보이드, 에든버러
- ^ a b 1973년 화이트 MJD동물 세포학과 진화.케임브리지 대학 출판부 제3판
- ^ MJ, Kottler (1974). "From 48 to 46: cytological technique, preconception, and the counting of human chromosomes". Bull Hist Med. 48 (4): 465–502. PMID 4618149.
- ^ von Winiwarter H. (1912). "Études sur la spermatogenèse humaine". Archives de Biologie. 27 (93): 147–9.
- ^ Painter T.S. (1922). "The spermatogenesis of man". Anat. Res. 23: 129.
- ^ Painter T.S. (1923). "Studies in mammalian spermatogenesis II". J. Exp. Zoology. 37 (3): 291–336. doi:10.1002/jez.1400370303.
- ^ Wright, Pearce (11 December 2001). "Joe Hin Tjio The man who cracked the chromosome count". The Guardian.
- ^ Tjio J.H.; Levan A. (1956). "The chromosome number of man". Hereditas. 42 (1–2): 1–6. doi:10.1111/j.1601-5223.1956.tb03010.x. PMID 345813.
- ^ a b 허 T.C. 1979년인간과 포유류의 세포유전학: 역사적 관점.스프링거-발락, 뉴욕
- ^ 인간 2번 염색체는 두 조상의 융합이다. Alex MacAndrew 염색체, 2006년 5월 18일 접근.
- ^ 공통 조상의 증거: 인간 염색체 2(비디오) 2007
- ^ 메틸렌블루, 에오신Y 및 아쥬레A,B,C 염료를 함유하는 제제
- ^ a b 구스타쇼 K.M. 1991년염색체 얼룩이요ACT 세포유전학 실험실 매뉴얼 2nd Ed. M.J. Barch.뉴욕 레이븐 프레스 세포유전학 기술자 협회
- ^ Stebbins, G.L. (1971). Chromosomal evolution in higher plants. London: Arnold. pp. 85–86. ISBN 9780713122879.
- ^ a b 톰슨 & 톰슨 제네틱스 의학 제7호
- ^ "How Common is Intersex?". PubMed.
- ^ Godfrey LR, Masters JC (August 2000). "Kinetochore reproduction theory may explain rapid chromosome evolution". Proc. Natl. Acad. Sci. U.S.A. 97 (18): 9821–3. Bibcode:2000PNAS...97.9821G. doi:10.1073/pnas.97.18.9821. PMC 34032. PMID 10963652.
- ^ 메이나드 스미스 J. 1998진화 유전학.옥스포드 2차 페이지 218-9
- ^ Goday C, Esteban MR (March 2001). "Chromosome elimination in sciarid flies". BioEssays. 23 (3): 242–50. doi:10.1002/1521-1878(200103)23:3<242::AID-BIES1034>3.0.CO;2-P. PMID 11223881. S2CID 43718856.
- ^ Müller F, Bernard V, Tobler H (February 1996). "Chromatin diminution in nematodes". BioEssays. 18 (2): 133–8. doi:10.1002/bies.950180209. PMID 8851046. S2CID 24583845.
- ^ Wyngaard GA, Gregory TR (December 2001). "Temporal control of DNA replication and the adaptive value of chromatin diminution in copepods". J. Exp. Zool. 291 (4): 310–6. doi:10.1002/jez.1131. PMID 11754011.
- ^ 길버트 S.F. 2006발달생물학.시나우어 어소시에이츠, 스탬포드 CT. 제8판, 제9장
- ^ King, Stansfield & Mully
- ^ Carrel L, Willard H (2005). "X-inactivation profile reveals extensive variability in X-linked gene expression in females". Nature. 434 (7031): 400–404. Bibcode:2005Natur.434..400C. doi:10.1038/nature03479. PMID 15772666. S2CID 4358447.
- ^ Wurster DH, Benirschke K (June 1970). "Indian muntjac, Muntiacus muntjak: a deer with a low diploid chromosome number". Science. 168 (3937): 1364–6. Bibcode:1970Sci...168.1364W. doi:10.1126/science.168.3937.1364. PMID 5444269. S2CID 45371297.
- ^ Crosland M.W.J.; Crozier, R.H. (1986). "Myrmecia pilosula, an ant with only one pair of chromosomes". Science. 231 (4743): 1278. Bibcode:1986Sci...231.1278C. doi:10.1126/science.231.4743.1278. PMID 17839565. S2CID 25465053.
- ^ Khandelwal S. (1990). "Chromosome evolution in the genus Ophioglossum L". Botanical Journal of the Linnean Society. 102 (3): 205–217. doi:10.1111/j.1095-8339.1990.tb01876.x.
- ^ Kim, D.S.; Nam, Y.K.; Noh, J.K.; Park, C.H.; Chapman, F.A. (2005). "Karyotype of North American shortnose sturgeon Acipenser brevirostrum with the highest chromosome number in the Acipenseriformes". Ichthyological Research. 52 (1): 94–97. doi:10.1007/s10228-004-0257-z. S2CID 20126376.
- ^ Matthey, R. (15 May 1945). "L'evolution de la formule chromosomiale chez les vertébrés". Experientia (Basel). 1 (2): 50–56. doi:10.1007/BF02153623. S2CID 38524594.
- ^ de Oliveira, R.R.; Feldberg, E.; dos Anjos, M. B.; Zuanon, J. (July–September 2007). "Karyotype characterization and ZZ/ZW sex chromosome heteromorphism in two species of the catfish genus Ancistrus Kner, 1854 (Siluriformes: Loricariidae) from the Amazon basin". Neotropical Ichthyology. 5 (3): 301–6. doi:10.1590/S1679-62252007000300010.
- ^ Pellicciari, C.; Formenti, D.; Redi, C.A.; Manfredi, M.G.; Romanini (February 1982). "DNA content variability in primates". Journal of Human Evolution. 11 (2): 131–141. doi:10.1016/S0047-2484(82)80045-6.
- ^ Souza, A.L.G.; de O. Corrêa, M.M.; de Aguilar, C.T.; Pessôa, L.M. (February 2011). "A new karyotype of Wiedomys pyrrhorhinus (Rodentia: Sigmodontinae) from Chapada Diamantina, northeastern Brazil" (PDF). Zoologia. 28 (1): 92–96. doi:10.1590/S1984-46702011000100013.
- ^ Weksler, M.; Bonvicino, C.R. (3 January 2005). "Taxonomy of pygmy rice rats genus Oligoryzomys Bangs, 1900 (Rodentia, Sigmodontinae) of the Brazilian Cerrado, with the description of two new species" (PDF). Arquivos do Museu Nacional, Rio de Janeiro. 63 (1): 113–130. ISSN 0365-4508. Archived from the original (PDF) on 26 March 2012. Retrieved 22 April 2012.
- ^ Stebbins, G.L. (1940). "The significance of polyploidy in plant evolution". The American Naturalist. 74 (750): 54–66. doi:10.1086/280872. S2CID 86709379.
- ^ 스테빈스 1950
- ^ Comai L (November 2005). "The advantages and disadvantages of being polyploid". Nat. Rev. Genet. 6 (11): 836–46. doi:10.1038/nrg1711. PMID 16304599. S2CID 3329282.
- ^ Adams KL, Wendel JF (April 2005). "Polyploidy and genome evolution in plants". Curr. Opin. Plant Biol. 8 (2): 135–41. doi:10.1016/j.pbi.2005.01.001. PMID 15752992.
- ^ 스테빈스 1971
- ^ Gregory, T.R.; Mable, B.K. (2011). "Ch. 8: Polyploidy in animals". In Gregory, T. Ryan (ed.). The Evolution of the Genome. Academic Press. pp. 427–517. ISBN 978-0-08-047052-8.
- ^ White, M.J.D. (1973). The chromosomes (6th ed.). London: Chapman & Hall. p. 45.
- ^ Lilly M.A.; Duronio R.J. (2005). "New insights into cell cycle control from the Drosophila endocycle". Oncogene. 24 (17): 2765–75. doi:10.1038/sj.onc.1208610. PMID 15838513.
- ^ Edgar BA, Orr-Weaver TL (May 2001). "Endoreplication cell cycles: more for less". Cell. 105 (3): 297–306. doi:10.1016/S0092-8674(01)00334-8. PMID 11348589. S2CID 14368177.
- ^ Nagl W. 1978년분화와 진화에 있어서의 내분배와 폴리테니: 존재발생과 계통발생에서 핵 DNA의 양적, 질적 변화를 이해하기 위해.엘세비어, 뉴욕
- ^ 스테빈스, G. 레들리, 1972년고등 식물에서의 염색체 진화.넬슨, 런던.p 18
- ^ IJdo JW, Baldini A, Ward DC, Reeders ST, Wells RA (October 1991). "Origin of human chromosome 2: an ancestral telomere-telomere fusion". Proc. Natl. Acad. Sci. U.S.A. 88 (20): 9051–5. Bibcode:1991PNAS...88.9051I. doi:10.1073/pnas.88.20.9051. PMC 52649. PMID 1924367.
- ^ Rieger, R.; Michaelis, A.; Green, M.M. (1968). A glossary of genetics and cytogenetics: Classical and molecular. New York: Springer-Verlag. ISBN 9780387076683.
- ^ Searle, J. B. (1 June 1984). "Three New Karyotypic Races of the Common Shrew Sorex Araneus (Mammalia: Insectivora) and a Phylogeny". Systematic Biology. 33 (2): 184–194. doi:10.1093/sysbio/33.2.184. ISSN 1063-5157.
- ^ 화이트 1973, 페이지 169
- ^ Clague, D.A.; Dalrymple, G.B. (1987). "The Hawaiian-Emperor volcanic chain, Part I. Geologic evolution" (PDF). In Decker, R.W.; Wright, T.L.; Stauffer, P.H. (eds.). Volcanism in Hawaii. Vol. 1. pp. 5–54. U.S. Geological Survey Professional Paper 1350.
- ^ Carson HL (June 1970). "Chromosome tracers of the origin of species". Science. 168 (3938): 1414–8. Bibcode:1970Sci...168.1414C. doi:10.1126/science.168.3938.1414. PMID 5445927.
- ^ Carson HL (March 1983). "Chromosomal sequences and interisland colonizations in Hawaiian Drosophila". Genetics. 103 (3): 465–82. doi:10.1093/genetics/103.3.465. PMC 1202034. PMID 17246115.
- ^ Carson H.L. (1992). "Inversions in Hawaiian Drosophila". In Krimbas, C.B.; Powell, J.R. (eds.). Drosophila inversion polymorphism. Boca Raton FL: CRC Press. pp. 407–439. ISBN 978-0849365478.
- ^ Kaneshiro, K.Y.; Gillespie, R.G.; Carson, H.L. (1995). "Chromosomes and male genitalia of Hawaiian Drosophila: tools for interpreting phylogeny and geography". In Wagner, W.L.; Funk, E. (eds.). Hawaiian biogeography: evolution on a hot spot archipelago. Washington DC: Smithsonian Institution Press. pp. 57–71.
- ^ Craddock E.M. (2000). "Speciation processes in the adaptive radiation of Hawaiian plants and animals". In Hecht, Max K.; MacIntyre, Ross J.; Clegg, Michael T. (eds.). Evolutionary Biology. Vol. 31. pp. 1–43. doi:10.1007/978-1-4615-4185-1_1. ISBN 978-1-4613-6877-9.
- ^ Ziegler, Alan C. (2002). Hawaiian natural history, ecology, and evolution. University of Hawaii Press. ISBN 978-0-8248-2190-6.
- ^ Lisa G. Shaffer; Niels Tommerup, eds. (2005). ISCN 2005: An International System for Human Cytogenetic Nomenclature. Switzerland: S. Karger AG. ISBN 978-3-8055-8019-9.
- ^ Liehr T, Starke H, Weise A, Lehrer H, Claussen U (January 2004). "Multicolour FISH probe sets and their applications". Histol. Histopathol. 19 (1): 229–237. PMID 14702191.
- ^ Schröck E, du Manoir S, Veldman T, et al. (July 1996). "Multicolor spectral karyotyping of human chromosomes". Science. 273 (5274): 494–7. Bibcode:1996Sci...273..494S. doi:10.1126/science.273.5274.494. PMID 8662537. S2CID 22654725.
- ^ Wang TL, Maierhofer C, Speicher MR, et al. (December 2002). "Digital karyotyping". Proc. Natl. Acad. Sci. U.S.A. 99 (25): 16156–61. Bibcode:2002PNAS...9916156W. doi:10.1073/pnas.202610899. PMC 138581. PMID 12461184.
- ^ Leary, Rebecca J; Cummins, Jordan; Wang, Tian-Li; Velculescu, Victor E (August 2007). "Digital karyotyping". Nature Protocols. 2 (8): 1973–1986. doi:10.1038/nprot.2007.276. ISSN 1754-2189. PMID 17703209. S2CID 33337972.
외부 링크
 Wikimedia Commons의 Karyotype 관련 미디어
Wikimedia Commons의 Karyotype 관련 미디어- 유타 대학 유전과학 학습 센터의 온라인 활동인 핵형 제작.
- 애리조나 대학의 생물학 프로젝트의 사례 이력을 포함한 카리오타이핑 활동.
- 생물학 및 과학 교사를 위한 자원 사이트인 Biology Corner에서 인쇄 가능한 핵형 프로젝트.
- 염색체 염색 및 밴딩 기술
- 카리오타이핑과 FISH를 위한 비요른 바이오시스템