EZH2
EZH2제스테 호몰로로그 2의 엔한서(EZH2)는 EZH2 유전자에 의해 인코딩된 히스톤-리신 N-메틸전달효소(EC 2.1.1.43)로 히스톤 메틸화 및 궁극적으로 전사 억제에 참여한다.[5] EZH2는 공동 인자 S-adenosyl-L-methionine을 사용하여 [6]Lysine 27에서 히스톤 H3에 메틸 그룹의 첨가를 촉진한다. EZH2의 메틸화 활성은 이질 색소 침착을 촉진하여 유전자 기능을 침묵시킨다.[5] 세포 유사시 EZH2에 의한 염색체 이염색체의 리모델링도 필요하다.
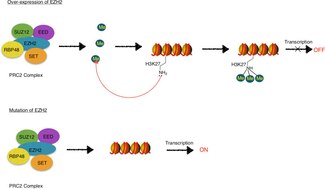
EZH2는 PRC2(Polycomb Repression Complex 2)의 기능성 효소 성분으로, 개발 및 분화 조절을 담당하는 유전자의 후생유전적 정비를 통해 건강한 배아 발달을 책임진다.[7] EZH2는 PRC2의 메틸화 활성을 담당하며, 복합체에는 최적의 기능에 필요한 단백질(EED, SUSZ12, JARID2, AEBP2, RbAp46/48, PCL)도 포함되어 있다.[8]
EZH2의 돌연변이나 과다 발현은 많은 형태의 암과 연관되어 있다.[9] EZH2는 종양 발달을 억제하는 역할을 하는 유전자를 억제하며, EZH2 활동을 차단하면 종양 성장이 느려질 수 있다. EZH2는 유방암,[10] 전립선암,[11] 흑색종,[12] 방광암을 포함하되 이에 국한되지 않는 여러 암에서 상향 조절되기 때문에 억제 대상이다.[13] EZH2 유전자의 돌연변이는 희귀 선천성 질환인 위버 증후군과도 관련이 있으며,[14] EZH2는 신경계 장애인 아탁시아 텔랑게릭타시아에서 신경퇴행 증상을 일으키는 데 관여한다.[15]
함수
| 히스톤리신N메틸전달효소 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| EC 번호 | 2.1.1.43 | ||||||||
| 데이터베이스 | |||||||||
| 인텐츠 | IntEnz 뷰 | ||||||||
| 브렌다 | 브렌다 입력 | ||||||||
| 엑스퍼시 | 나이스자이메 뷰 | ||||||||
| 케그 | KEG 입력 | ||||||||
| 메타사이크 | 대사통로 | ||||||||
| 프리암 | 프로필 | ||||||||
| PDB 구조 | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
EZH2는 PRC2(Polycomb Repression Complex 2)의 촉매 소단위다.[16] EZH2의 촉매 활성도는 최소 두 개의 다른 PRC2 구성 요소인 SUZ12와 EED가 있는 복합체의 형성에 의존한다.[17]
As a histone methyltransferase (HMTase), EZH2's primary function is to methylate Lys-27 on histone 3 (H3K27me) by transferring a methyl group from the cofactor S-adenosyl-L-methionine (SAM). EZH2 is capable of mono-, di-, and tri-methylation of H3K27 and has been associated with a variety of biological functions, including transcriptional regulat조혈, 발달, 세포 분화의 [17][18][19][20]이온
최근의 연구는 EZH2가 또한 비히스토네이트 단백질을 메틸 수 있다는 것을 보여주었다.[17][18]
전사억제
EZH2는 PRC2의 일부로서 히스톤 코드의 일부로 특징지어지는 히스톤 수정인 H3K27(H3K27me3)의 트리메틸화를 촉매로 한다.[16][20][21][22] 히스톤 코드는 히스톤 단백질의 메틸화, 아세틸화, 편재화 등의 화학적 변화가 유전자 전사의 후생유전적 조절에 뚜렷한 역할을 한다는 이론이다. EZH2 매개 H3K27me3 강직성은 장기 전사 억제와 관련이 있다.[16][20][21]
EZH2는 물론 다른 폴리콤 그룹 단백질도 세포분열을 통한 유전자 억제의 확립과 유지에 관여하고 있다.[17][20] 이러한 전사적 억제 상태는 PRC2/EZH2-EED 매개 H3K27 메틸화 및 이후 PRC1의 모집으로 인해 염색질의 응축과 헤테로크로마틴의 형성을 촉진하는 것으로 생각된다.[20] 헤테로크로마틴은 빽빽하게 채워져 있는 염색체로, 전사 기계의 기저 DNA로의 접근성을 제한하여 전사를 억제한다.[23]
세포분열 중 적절한 염색체 분리를 위해서는 이염색체 형성이 필요하다.[24] PRC2/EED-EZH2 복합체는 DNA 메틸전달효소(DNMTs)의 모집에도 관여할 수 있으며, 이는 전사 억제의 또 다른 후생유전층인 DNA 메틸화 증가를 초래한다.[16][17] EZH2 매개 전사 억제 대상으로 확인된 특정 유전자는 HOXA9, HOXC8, MYT1, CDKN2A, 레티노산 표적 유전자 등이다.[16]
전사 활성화
암에서 EZH2는 PRC2와 독립적으로 전사 활성화에 역할을 할 수 있다.[17] 유방암 세포에서 EZH2는 자극에 대한 반응에 관여하는 NF-κB 표적 유전자를 활성화하는 것으로 입증되었다.[17] 이 활동의 기능적 역할과 그 메커니즘은 여전히 알려져 있지 않다.
개발 및 세포 분화
EZH2는 개발에 필수적인 역할을 한다. 특히 세포 분화를 조절하는 유전자의 전사적 억압을 조절하는 데 도움을 준다.[17][18][20][21] 배아줄기세포에서는 발달 유전자가 포함된 지역의 H3K27me3의 EZH2 매개 트리메틸화가 정상 세포 분화의 유지에 중요한 것으로 보인다.[20] H3K27me3는 또한 X-불활성화를 추진하는데 중요하다. X-크롬은 개발 중에 암컷에서 1개의 X-크롬을 침묵시킨다.[22] X-비활성화 중에는 EZH2가 H3K27을 트리메틸화하여 헤테로크로마틴 형성을 시작하는 데 관여하고, 다른 히스톤 메틸전달물질과 히스톤 마크가 음소거 상태를 유지하는 데 관여할 수 있다고 생각된다.[25]
또한 EZH2는 B세포와 T세포의 개발과 분화에 관여하는 필수 단백질로 확인되었다.[18] H3K27me3는 분화를 촉진하는 유전자를 억제하여 B세포와 T세포의 미분화 상태를 유지하고 조혈증을 조절하는 데 중요한 역할을 한다.[18]
EZH2 활동 규정
EZH2의 활성도는 EZH2에 있는 세린 잔류물과 트레오닌의 변환 후 인산염에 의해 조절된다.[26] 구체적으로 T350의 인산화효과는 EZH2 활성의 증가와 연계되어 있는 반면 T492와 S21의 인산화효과는 EZH2 활성의 감소와 연계되어 있다.[21][26] T492의 인산화 작용은 PRC2 복합체에서 인간 EZH2와 결합 파트너 사이의 접촉을 방해하여 촉매작용을 방해하는 것으로 제안되었다.[21]
인화작용 외에도 H3K27(H3K27ac)의 아세틸화(Acetylation), H3K36(H3K36me)의 메틸화(H3K36me) 등 전사활성 히스톤 마크에 의해 PRC2/EZH2-EED 활성화가 반감되는 것으로 나타났다.[21][27]
효소 활성
EZH2 기능은 PRC2 단지에 의한 채용 의존도가 높다. 특히 히스톤 기질과의[28][29] EZH2의 상호작용을 안정화시키기 위해서는 제스테 12(SUZ12)의 WD40-반복 단백질 배아 엑토더름 개발(EED)과 아연 핑거 단백질 억제기가 필요하다 최근 인간에서 대체 스플리싱에서 생성된 EZH2의 두 가지 등소형(EZH2α와 EZH2β)이 확인되고 있다.[30] 두 가지 이소양식 모두 보존된 SET 도메인뿐만 아니라 핵 지역화 신호, EED 및 SUSZ12 바인딩 사이트를 포함하여 EZH2 기능에 중요하다고 확인된 요소를 포함하고 있다.[30] 지금까지 대부분의 연구는 보다 긴 이소성형 EZH2α에 초점을 맞췄지만, 엑손 4와 8이 부족한 EZH2β는 활성 상태인 것으로 나타났다.[30] 또한 PRC2/EZH2β 복합체는 PRC2/EZH2α와 상이한 유전자에 작용하며, 각 이소형태가 특정 유전자의 부분집합을 조절하는 작용을 할 수 있음을 시사하는 바는 PRC2/EZH2α 복합체들은 PRC2/EZH2α의 그것과 구별되는 유전자에 작용한다.[30] 추가적인 증거는 또한 EZH2가 높은 상향 조정된 경우 PRC2와 무관하게 리신 메틸화가 가능할 수 있음을 시사한다.[17]
리신 메틸레이션
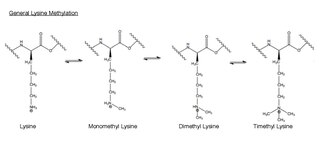
메틸화는 다른 분자에 -CH3 또는 메틸 그룹을 추가하는 것이다. 생물학에서 메틸화는 일반적으로 효소에 의해 촉매되며, 메틸 그룹은 일반적으로 단백질이나 핵산에 첨가된다. EZH2 촉매 메틸화에서 히스톤 h3의 아미노산 리신은 메틸화된다. 이 아미노산 잔류물은 말단 암모늄 그룹에서 최대 3회까지 메틸이 가능하다. 이러한 메틸화 라이신은 포유류 유전자 발현을 통제하는 데 중요하며 이질색성형성, X-크롬 불활성화 및 전사 조절에 기능적 역할을 한다.[31] 포유류 염색체에서 히스톤 리신 메틸화는 메틸화 부위에 따라 유전자를 활성화하거나 억제할 수 있다. 최근 연구에서는 EZH2 복합체의 음소거 기능 중 적어도 일부가 라이신 27에 히스톤 H3의 메틸화라는 것이 밝혀졌다.[32] 메틸레이션과 다른 수정은 히스톤에서 일어난다. 메틸 수정은 이러한 히스톤에 단백질을 결합하는 데 영향을 미칠 수 있으며 전사를 활성화하거나 억제할 수 있다.[24]
카탈루션
EZH2는 기질단백질의 리신측 체인에 메틸 그룹을 추가하는 기능을 하는 리신메틸전달효소의 SET 도메인 계열의 일원이다.[33] SETyl transferase는 S-Adenosyl methionine(SAM) 공작용제에 의존하여 촉매 활성의 메틸 공여자 역할을 한다. SET 도메인 단백질은 효소의 활성 부위의 반대편에 기질과 SAM의 공동 작용을 결합시킨다는 점에서 다른 SAM 의존 메틸전달효소와 다르다. 이러한 기질 및 공actor의 방향성을 통해 SAM은 기질 결합을 방해하지 않고 분리할 수 있으며 기질 분리 없이 리신 메틸화의 여러 라운드를 초래할 수 있다.[33]
비록 EZH2에 대한 기질 결합 결정 구조나 SAM 결합 결정 구조는 결정되지 않았지만, 인간 SET7/9 메틸전달효소와의 스탬프 구조 정렬은 EZH2의 투입 활성 부위 내에서 거의 동일한 위치에 보존된 타이로신 잔류물을 보여준다.
이전에는 EZH2 활성 사이트의 티로신 726이 기질 라이신을 디프로토네이션하는 일반적인 베이스로 작용하고 있다고 제안되었지만, 운동 동위원소 효과는 활성 사이트 잔류물이 메틸전달효소 반응의 화학에 직접 관여하지 않는다는 것을 보여주었다.[34] 대신 이 실험은 잔여물이 기질 라이신 잔여물의 pKa를 낮추는 메커니즘을 지원하는 동시에 활성 현장의 내부 내 리신 측 체인에 물이 접근할 수 있는 채널을 제공한다. 대량 용매수는 리신측 체인을 쉽게 감압하여 S2와N 유사한 반응에서 SAM의 핵포화성 공격에 대해 활성화하여 SAM에서 라이신측 체인으로 메틸 그룹을 이전할 수 있다.[34]
EZH2는 주로 H3K27의 모노 및 디-메틸화를 촉진하지만 잔류물 타이로신 641과 페닐알라닌(Y641F)의 임상적으로 관련 돌연변이는 H3K27 3-메틸화 활성도를 높인다.[34] Y641의 히드록실 집단을 제거하면 강장 장애물이 제거되고 기질 라이신에 제3의 메틸 집단을 수용하는 것이 제안된다.
임상적 유의성
암
EZH2는 암세포의 분열과 증식을 도와주기 때문에 항암치료의 매력적인 대상이다. 유방암, 전립선암, 방광암, 자궁암, 신장암, 흑색종, 림프종 등 광범위한 암에서 건강한 세포보다 더 많은 양이 발견된다. EZH2는 유전자 억제기여서 과압되면 정상적으로 켜지는 종양 억제기 유전자가 많이 꺼진다. EZH2 기능의 억제는 일부 보고된 경우에서 악성 종양을 감소시킨다. 왜냐하면 그러한 종양 억제기 유전자는 EZH2에 의해 침묵되지 않기 때문이다.[35] EZH2는 일반적으로 건강한 성인에게서 표현되지 않는다; 그것은 태아 발달 동안에 활동적인 세포처럼 세포를 활발하게 나누는 것에서만 발견된다.[36] 이러한 특성 때문에 EZH2의 과다압박은 암과 일부 신경퇴행장애의 진단표시로 사용될 수 있다.[15] 그러나 EZH2의 과다압박이 병의 원인인지, 단순히 결과인지 구분하기 어려운 경우가 있다. 결과일 뿐이라면, 억제하기 위해 EZH2를 목표로 하는 것이 병을 치료하지 못할 수도 있다. EZH2가 역할을 하는 암 경로의 한 예는 pRB-E2F 경로다. pRB-E2F 경로에서 다운스트림되며, 이 경로에서 나오는 신호는 EZH2 과다압박으로 이어진다.[37] EZH2의 또 다른 중요한 특징은 EZH2가 과압되었을 때 PRC2를 형성하지 않고도 유전자를 활성화할 수 있다는 점이다. 이는 효소의 메틸화 활성도가 복잡한 형성에 의해 매개되지 않는다는 것을 의미하기 때문에 문제가 되는 것이다. 유방암 세포에서 EZH2는 세포 증식과 생존을 촉진하는 유전자를 활성화시킨다.[17] 또한 Wnt 신호인자와 상호작용하여 c-myc, cyclin D1과 같은 규제 유전자를 활성화할 수 있다.[38] 중요한 것은 활성 SET영역에서 티로신 641의 돌연변이가 여러 가지 다른 아미노산으로 변하는 것이 일부 B세포 림프종의 공통된 특징이다.[39]
억제제
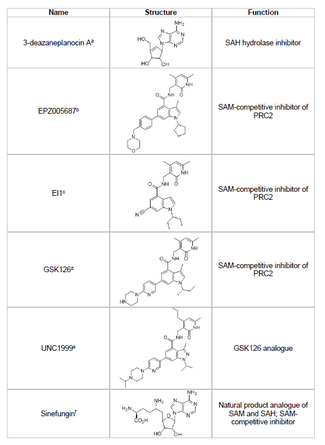
EZH2 억제제를 개발하고 원치 않는 종양 억제기 유전자의 히스톤 메틸화를 막는 것이 암 연구의 실행 가능한 영역이다. EZH2 억제제 개발은 단백질의 SET 도메인 활성 사이트를 목표로 하는 데 초점을 맞추었다. EZH2의 억제제는 2015년 현재 3-데이지안플라노신 A(DZNep), EPZ005687, EI1, GSK126, UNC1999 등 여러 가지가 개발되었다. DZNep은 EZH2 수치를 낮추고 유방암과 대장암 세포의 세포사멸을 유도하기 때문에 항바이러스 및 항암효과가 잠재적으로 있다.[40] DZNep은 모든 단백질 메틸전달효소에 대한 제품 기반 억제제인 S-adenosyl-L-homocysteine(SAH)의 가수분해를 억제하여 SAH의 세포 농도를 증가시켜 EZH2를 억제한다. 그러나 DZNep은 EZH2에만 국한되지 않으며 다른 DNA 메틸전달효소를 억제하기도 한다.
Epizyme라는 회사는 2012년 DZNep보다 선택성이 높은 S-adenosylmethionine(SAM) 경쟁억제제인 EPZ005687을 공개했으며, EZH1에 비해 EZH2 선택성이 50배 높아졌다. 이 약은 효소의 SET 도메인 활성 사이트에 결합하여 EZH2 활동을 차단한다. 또한 EPZ005687은 EZH2의 Y641 및 A677 돌연변이를 억제할 수 있으며, 이는 비호지킨 림프종 치료에 적용될 수 있다.[41] 2013년 에피지메는 B세포 림프종 환자를 위해 또 다른 EZH2 억제제인 타제메토스타트(EPS-6438)로 임상 1상을 시작했다.[45] 2020년, 트레이드네임 타즈베리크와 함께 Tazemetostat은 전이성 또는 국지적으로 발달한 상피성 육종 치료를 위해 FDA 승인을 받았고, 그해 말 다시 재발한 엽 림프종 환자들의 치료를 위해 승인되었다.[46]
Sinefungin은 또 다른 SAM 경쟁 억제제지만, DZNep와 마찬가지로 EZH2에 특정되지 않는다.[44] DNA메틸전달효소의 공작용제 결합 주머니에서 결합해 메틸전달을 차단하는 방식으로 작동한다. EI1은 노바티스가 개발한 또 다른 억제제로 Y641 돌연변이를 가진 세포를 포함한 임파종양 세포에서 EZH2 억제 활성을 보였다.[42] 또한 이 억제제의 메커니즘은 EZH2에 대한 결합을 위한 SAM 공동 인자와의 경쟁을 포함한다.[42] GSK126은 GlaxoSmithKline이 개발한 강력한 SAM 경쟁적 EZH2 억제제로 EZH1에 비해 150배 선택성과 0.5-3nM의 K를i 가지고 있다.[43] UNC1999는 GSK126의 아날로그로 개발되었으며, 구전으로 생물학적으로 이용 가능한 최초의 EZH2 억제제로 활동성을 보였다. 다만 상대 GSK126에 비해 선택성이 떨어지고 EZH1에도 바인딩돼 오프타깃 효과 가능성이 높아진다.
조합요법은 1차 치료가 실패하기 시작할 때 가능한 치료법으로 연구되고 있다. Topooside 억제제인 EZH2 억제제와 결합하면 BRG1과 EGFR 돌연변이를 동반한 비소세포 폐암에 더욱 효과적이다.[35] 그러나 EZH2와 리신 메틸레이션은 예를 들어 골수분열증후군에서와 같이 종양 억제 활동을 할 수 있어 EZH2 억제가 모든 경우에 이롭지 않을 수 있음을 나타낸다.[47]
위버 증후군
EZH2 유전자의 돌연변이는 고도 골연령, 거시건조증, 비대증으로 특징지어지는 희귀질환인 위버 증후군과 연관되어 있다.[14] 야생형 EZH2 활성 부위의 히스티딘 잔여물은 위버 증후군으로 진단된 환자에서 티로신(tyrosine)으로 변이되었다.[14] 이 돌연변이는 공동 인자 결합을 방해하고 단백질의 자연 기능에 장애를 일으킬 가능성이 있다.[14]
분류학 분포

제스트의 엔한서(E(z))는 원래 드로필라 멜라노가스터에서 확인되었고, 그 포유동물의 호몰로로그를 후속적으로 식별하여 EZH1(제스트 호몰로컬 1)과 EZH2(제스트 호몰로컬 2)로 명명하였다.[49] EZH2는 진화를 통해 매우 보존된다. 그것은 식물, 곤충, 어류, 포유류에서 발달, 세포분화, 세포분열에 필수적인 역할을 한다.[17][21][50][51] 다음의 분류법 트리는 다양한 종에 걸친 EZH2의 분포를 묘사한 것이다.[52][53]
참고 항목
참조
- ^ a b c GRCh38: 앙상블 릴리스 89: ENSG00000106462 - 앙상블, 2017년 5월
- ^ a b c GRCm38: 앙상블 릴리스 89: ENSMUSG000029687 - 앙상블, 2017년 5월
- ^ "Human PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ "Mouse PubMed Reference:". National Center for Biotechnology Information, U.S. National Library of Medicine.
- ^ a b Viré E, Brenner C, Deplus R, Blanchon L, Fraga M, Didelot C, et al. (2006). "The Polycomb group protein EZH2 directly controls DNA methylation". Nature. 439 (7078): 871–4. doi:10.1038/nature04431. PMID 16357870. S2CID 4409726.
- ^ Cao R, Wang L, Wang H, Xia L, Erdjument-Bromage H, Tempst P, Jones RS, Zhang Y (2002). "Role of histone H3 lysine 27 methylation in Polycomb-group silencing". Science. 298 (5595): 1039–43. doi:10.1126/science.1076997. PMID 12351676. S2CID 6265267.
- ^ Morey L, Helin K (2010). "Polycomb group protein-mediated repression of transcription". Trends Biochem. Sci. 35 (6): 323–32. doi:10.1016/j.tibs.2010.02.009. PMID 20346678.
- ^ Margueron R, Reinberg D (2011). "The Polycomb complex PRC2 and its mark in life". Nature. 469 (7330): 343–9. doi:10.1038/nature09784. PMC 3760771. PMID 21248841.
- ^ Kim, Kimberly; Roberts, Charles (18 December 2015). "Targeting EZH2 in cancer". Nature Medicine. 22 (2): 128–134. doi:10.1038/nm.4036. PMC 4918227. PMID 26845405.
- ^ Yoo KH, Hennighausen L (2012). "EZH2 methyltransferase and H3K27 methylation in breast cancer". Int. J. Biol. Sci. 8 (1): 59–65. doi:10.7150/ijbs.8.59. PMC 3226033. PMID 22211105.
- ^ Varambally S, Dhanasekaran SM, Zhou M, Barrette TR, Kumar-Sinha C, Sanda MG, Ghosh D, Pienta KJ, Sewalt RG, Otte AP, Rubin MA, Chinnaiyan AM (2002). "The polycomb group protein EZH2 is involved in progression of prostate cancer" (PDF). Nature. 419 (6907): 624–9. doi:10.1038/nature01075. hdl:2027.42/62896. PMID 12374981. S2CID 4414767. Lay summary – Scientific American.
{{cite journal}}: Cite는 사용되지 않는 매개 변수를 사용한다.lay-url=(도움말) - ^ Zingg D, Debbache J, Schaefer SM, Tuncer E, Frommel SC, Cheng P, et al. (2015). "The epigenetic modifier EZH2 controls melanoma growth and metastasis through silencing of distinct tumour suppressors". Nat Commun. 6: 6051. doi:10.1038/ncomms7051. PMID 25609585. Lay summary – MedicalResearch.com.
{{cite journal}}: Cite는 사용되지 않는 매개 변수를 사용한다.lay-url=(도움말) - ^ Arisan S, Buyuktuncer ED, Palavan-Unsal N, Caşkurlu T, Cakir OO, Ergenekon E (2005). "Increased expression of EZH2, a polycomb group protein, in bladder carcinoma". Urol. Int. 75 (3): 252–7. doi:10.1159/000087804. PMID 16215315. S2CID 26843362.
- ^ a b c d Gibson WT, Hood RL, Zhan SH, Bulman DE, Fejes AP, Moore R, et al. (2012). "Mutations in EZH2 cause Weaver syndrome". Am. J. Hum. Genet. 90 (1): 110–8. doi:10.1016/j.ajhg.2011.11.018. PMC 3257956. PMID 22177091.
- ^ a b Li J, Hart RP, Mallimo EM, Swerdel MR, Kusnecov AW, Herrup K (2013). "EZH2-mediated H3K27 trimethylation mediates neurodegeneration in ataxia-telangiectasia". Nat. Neurosci. 16 (12): 1745–53. doi:10.1038/nn.3564. PMC 3965909. PMID 24162653.
- ^ a b c d e UniProt의 범용 단백질 자원 접근 번호 Q15910.
- ^ a b c d e f g h i j k Tan JZ, Yan Y, Wang XX, Jiang Y, Xu HE (2014). "EZH2: biology, disease, and structure-based drug discovery". Acta Pharmacol. Sin. 35 (2): 161–74. doi:10.1038/aps.2013.161. PMC 3914023. PMID 24362326.
- ^ a b c d e Lund K, Adams PD, Copland M (2014). "EZH2 in normal and malignant hematopoiesis". Leukemia. 28 (1): 44–9. doi:10.1038/leu.2013.288. PMID 24097338. S2CID 736796.
- ^ "RefSeq". RefSeq Gene EZH2. Retrieved February 1, 2015.
- ^ a b c d e f g Ding X, Wang X, Sontag S, Qin J, Wanek P, Lin Q, Zenke M (2014). "The polycomb protein Ezh2 impacts on induced pluripotent stem cell generation". Stem Cells Dev. 23 (9): 931–40. doi:10.1089/scd.2013.0267. PMC 3996971. PMID 24325319.
- ^ a b c d e f g O'Meara MM, Simon JA (2012). "Inner workings and regulatory inputs that control Polycomb repressive complex 2". Chromosoma. 121 (3): 221–34. doi:10.1007/s00412-012-0361-1. PMC 3351537. PMID 22349693.
- ^ a b "Histone H3K27". EpiGenie.
- ^ Grewal SI, Jia S (2007). "Heterochromatin revisited". Nat. Rev. Genet. 8 (1): 35–46. doi:10.1038/nrg2008. PMID 17173056. S2CID 31811880.
- ^ a b Stewart MD, Li J, Wong J (2005). "Relationship between histone H3 lysine 9 methylation, transcription repression, and heterochromatin protein 1 recruitment". Mol. Cell. Biol. 25 (7): 2525–2538. doi:10.1128/MCB.25.7.2525-2538.2005. PMC 1061631. PMID 15767660.
- ^ Jeanteur, Philippe (2008). Epigenetics and Chromatin. Springer. ISBN 9783540852360.
- ^ a b Kaneko S, Li G, Son J, Xu CF, Margueron R, Neubert TA, Reinberg D (2010). "Phosphorylation of the PRC2 component Ezh2 is cell cycle-regulated and up-regulates its binding to ncRNA". Genes Dev. 24 (23): 2615–20. doi:10.1101/gad.1983810. PMC 2994035. PMID 21123648.
- ^ Tie F, Banerjee R, Stratton CA, Prasad-Sinha J, Stepanik V, Zlobin A, Diaz MO, Scacheri PC, Harte PJ (2009). "CBP-mediated acetylation of histone H3 lysine 27 antagonizes Drosophila Polycomb silencing". Development. 136 (18): 3131–41. doi:10.1242/dev.037127. PMC 2730368. PMID 19700617.
- ^ Cao R, Zhang Y (2004). "SUZ12 is required for both the histone methyltransferase activity and the silencing function of the EED-EZH2 complex". Mol. Cell. 15 (1): 57–67. doi:10.1016/j.molcel.2004.06.020. PMID 15225548.
- ^ Denisenko O, Shnyreva M, Suzuki H, Bomsztyk K (1998). "Point mutations in the WD40 domain of Eed block its interaction with Ezh2". Mol. Cell. Biol. 18 (10): 5634–42. doi:10.1128/MCB.18.10.5634. PMC 109149. PMID 9742080.
- ^ a b c d Grzenda A, Lomberk G, Svingen P, Mathison A, Calvo E, Iovanna J, Xiong Y, Faubion W, Urrutia R (February 28, 2013). "Functional characterization of EZH2β reveals the increased complexity of EZH2 isoforms involved in the regulation of mammalian gene expression". Epigenetics & Chromatin. 6 (1): 3. doi:10.1186/1756-8935-6-3. PMC 3606351. PMID 23448518.
- ^ Martin C, Zhang Y (2005). "The diverse functions of histone lysine methylation". Nat. Rev. Mol. Cell Biol. 6 (11): 838–849. doi:10.1038/nrm1761. PMID 16261189. S2CID 31300025.
- ^ Brien GL, Gambero G, O'Connell DJ, Jerman E, Turner SA, Egan CM, et al. (2012). "Polycomb PHF19 binds H3K36me3 and recruits PRC2 and demethylase NO66 to embryonic stem cell genes during differentiation". Nat. Struct. Mol. Biol. 19 (12): 1273–1281. doi:10.1038/nsmb.2449. PMID 23160351. S2CID 1017805.
- ^ a b Dillon SC, Zhang X, Trievel RC, Cheng X (2005). "The SET-domain protein superfamily: protein lysine methyltransferases" (PDF). Genome Biol. 6 (8): 227. doi:10.1186/gb-2005-6-8-227. PMC 1273623. PMID 16086857. Retrieved February 1, 2015.
- ^ a b c Kipp DR, Quinn CM, Fortin PD (2013). "Enzyme-dependent lysine deprotonation in EZH2 catalysis". Biochemistry. 52 (39): 6866–78. doi:10.1021/bi400805w. PMID 24000826.
- ^ a b "Window of Vulnerability". Harvard Medical School.
- ^ a b Konze KD, Ma A, Li F, Barsyte-Lovejoy D, Parton T, Macnevin CJ, Liu F, Gao C, Huang XP, Kuznetsova E, Rougie M, Jiang A, Pattenden SG, Norris JL, James LI, Roth BL, Brown PJ, Frye SV, Arrowsmith CH, Hahn KM, Wang GG, Vedadi M, Jin J (2013). "An orally bioavailable chemical probe of the Lysine Methyltransferases EZH2 and EZH1". ACS Chem. Biol. 8 (6): 1324–34. doi:10.1021/cb400133j. PMC 3773059. PMID 23614352.
- ^ Bracken AP, Pasini D, Capra M, Prosperini E, Colli E, Helin K (2003). "EZH2 is downstream of the pRB-E2F pathway, essential for proliferation and amplified in cancer". EMBO J. 22 (20): 5323–35. doi:10.1093/emboj/cdg542. PMC 213796. PMID 14532106.
- ^ Shi B, Liang J, Yang X, Wang Y, Zhao Y, Wu H, Sun L, Zhang Y, Chen Y, Li R, Zhang Y, Hong M, Shang Y (2007). "Integration of estrogen and Wnt signaling circuits by the polycomb group protein EZH2 in breast cancer cells". Mol. Cell. Biol. 27 (14): 5105–19. doi:10.1128/MCB.00162-07. PMC 1951944. PMID 17502350.
- ^ Morin RD, Johnson NA, Severson TM, Mungall AJ, An J, Goya R, et al. (2010). "Somatic mutations altering EZH2 (Tyr641) in follicular and diffuse large B-cell lymphomas of germinal-center origin". Nat. Genet. 42 (2): 181–5. doi:10.1038/ng.518. PMC 2850970. PMID 20081860.
- ^ a b Tan J, Yang X, Zhuang L, Jiang X, Chen W, Lee PL, Karuturi RK, Tan PB, Liu ET, Yu Q (2007). "Pharmacologic disruption of Polycomb-repressive complex 2-mediated gene repression selectively induces apoptosis in cancer cells". Genes Dev. 21 (9): 1050–63. doi:10.1101/gad.1524107. PMC 1855231. PMID 17437993.
- ^ a b Knutson SK, Wigle TJ, Warholic NM, Sneeringer CJ, Allain CJ, Klaus CR, et al. (2012). "A selective inhibitor of EZH2 blocks H3K27 methylation and kills mutant lymphoma cells". Nat. Chem. Biol. 8 (11): 890–6. doi:10.1038/nchembio.1084. PMID 23023262.
- ^ a b c Qi W, Chan H, Teng L, Li L, Chuai S, Zhang R, et al. (2012). "Selective inhibition of Ezh2 by a small molecule inhibitor blocks tumor cells proliferation". Proc. Natl. Acad. Sci. U.S.A. 109 (52): 21360–5. doi:10.1073/pnas.1210371110. PMC 3535655. PMID 23236167.
- ^ a b McCabe MT, Ott HM, Ganji G, Korenchuk S, Thompson C, Van Aller GS, et al. (2012). "EZH2 inhibition as a therapeutic strategy for lymphoma with EZH2-activating mutations". Nature. 492 (7427): 108–12. doi:10.1038/nature11606. PMID 23051747. S2CID 4385729.
- ^ a b Couture JF, Hauk G, Thompson MJ, Blackburn GM, Trievel RC (2006). "Catalytic roles for carbon-oxygen hydrogen bonding in SET domain lysine methyltransferases". J. Biol. Chem. 281 (28): 19280–7. doi:10.1074/jbc.M602257200. PMID 16682405.
- ^ Epizyme EPORTC-NCI-AACR 심포지엄에서 발표될 EZH2 억제제 EPZ-6438(E7438)의 1단계 임상 데이터를 발표했다. (2014년 10월 1일).
- ^ "FDA granted accelerated approval to tazemetostat for follicular lymphoma". FDA. 18 June 2020.
- ^ Nikoloski G, Langemeijer SM, Kuiper RP, Knops R, Massop M, Tönnissen ER, et al. (2010). "Somatic mutations of the histone methyltransferase gene EZH2 in myelodysplastic syndromes". Nat. Genet. 42 (8): 665–7. doi:10.1038/ng.620. PMID 20601954. S2CID 5814891.
- ^ "Ensembl". Gene Tree EZH2. Retrieved February 19, 2015.
- ^ Laible G, Wolf A, Dorn R, Reuter G, Nislow C, Lebersorger A, Popkin D, Pillus L, Jenuwein T (1997). "Mammalian homologues of the Polycomb-group gene Enhancer of zeste mediate gene silencing in Drosophila heterochromatin and at S. cerevisiae telomeres". EMBO J. 16 (11): 3219–32. doi:10.1093/emboj/16.11.3219. PMC 1169939. PMID 9214638.
- ^ "NCBI UniGene". Enhancer of zeste homolog 2 (Drosophila) (EZH2). Retrieved February 1, 2015.
- ^ "GeneCards". Enhancer Of Zeste Homolog 2 (Drosophila). Retrieved February 1, 2015.
- ^ "Ensembl". Gene Tree EZH2. Retrieved February 1, 2015.
- ^ Flicek P, Amode MR, Barrell D, Beal K, Billis K, Brent S, et al. (2014). "Ensembl 2014". Nucleic Acids Res. 42 (Database issue): D749–55. doi:10.1093/nar/gkt1196. PMC 3964975. PMID 24316576.
추가 읽기
- Zeidler M, Kleer CG (Sep 2006). "The Polycomb group protein Enhancer of Zeste 2: its links to DNA repair and breast cancer". Journal of Molecular Histology. 37 (5–7): 219–23. doi:10.1007/s10735-006-9042-9. PMID 16855786. S2CID 2332105.
- De Haan G, Gerrits A (Jun 2007). "Epigenetic control of hematopoietic stem cell aging the case of Ezh2". Annals of the New York Academy of Sciences. 1106 (1): 233–9. doi:10.1196/annals.1392.008. PMID 17332078. S2CID 25177748.
- Hobert O, Jallal B, Ullrich A (Jun 1996). "Interaction of Vav with ENX-1, a putative transcriptional regulator of homeobox gene expression". Molecular and Cellular Biology. 16 (6): 3066–73. doi:10.1128/MCB.16.6.3066. PMC 231301. PMID 8649418.
- Bonaldo MF, Lennon G, Soares MB (Sep 1996). "Normalization and subtraction: two approaches to facilitate gene discovery". Genome Research. 6 (9): 791–806. doi:10.1101/gr.6.9.791. PMID 8889548.
- Abel KJ, Brody LC, Valdes JM, Erdos MR, McKinley DR, Castilla LH, Merajver SD, Couch FJ, Friedman LS, Ostermeyer EA, Lynch ED, King MC, Welcsh PL, Osborne-Lawrence S, Spillman M, Bowcock AM, Collins FS, Weber BL (Oct 1996). "Characterization of EZH1, a human homolog of Drosophila Enhancer of zeste near BRCA1". Genomics. 37 (2): 161–71. doi:10.1006/geno.1996.0537. PMID 8921387.
- Laible G, Wolf A, Dorn R, Reuter G, Nislow C, Lebersorger A, Popkin D, Pillus L, Jenuwein T (Jun 1997). "Mammalian homologues of the Polycomb-group gene Enhancer of zeste mediate gene silencing in Drosophila heterochromatin and at S. cerevisiae telomeres". The EMBO Journal. 16 (11): 3219–32. doi:10.1093/emboj/16.11.3219. PMC 1169939. PMID 9214638.
- Cardoso C, Timsit S, Villard L, Khrestchatisky M, Fontès M, Colleaux L (Apr 1998). "Specific interaction between the XNP/ATR-X gene product and the SET domain of the human EZH2 protein". Human Molecular Genetics. 7 (4): 679–84. doi:10.1093/hmg/7.4.679. PMID 9499421.
- van Lohuizen M, Tijms M, Voncken JW, Schumacher A, Magnuson T, Wientjens E (Jun 1998). "Interaction of mouse polycomb-group (Pc-G) proteins Enx1 and Enx2 with Eed: indication for separate Pc-G complexes". Molecular and Cellular Biology. 18 (6): 3572–9. doi:10.1128/MCB.18.6.3572. PMC 108938. PMID 9584197.
- Sewalt RG, van der Vlag J, Gunster MJ, Hamer KM, den Blaauwen JL, Satijn DP, Hendrix T, van Driel R, Otte AP (Jun 1998). "Characterization of interactions between the mammalian polycomb-group proteins Enx1/EZH2 and EED suggests the existence of different mammalian polycomb-group protein complexes". Molecular and Cellular Biology. 18 (6): 3586–95. doi:10.1128/mcb.18.6.3586. PMC 108940. PMID 9584199.
- Denisenko O, Shnyreva M, Suzuki H, Bomsztyk K (Oct 1998). "Point mutations in the WD40 domain of Eed block its interaction with Ezh2". Molecular and Cellular Biology. 18 (10): 5634–42. doi:10.1128/MCB.18.10.5634. PMC 109149. PMID 9742080.
- van der Vlag J, Otte AP (Dec 1999). "Transcriptional repression mediated by the human polycomb-group protein EED involves histone deacetylation". Nature Genetics. 23 (4): 474–8. doi:10.1038/70602. PMID 10581039. S2CID 6748531.
- Cardoso C, Mignon C, Hetet G, Grandchamps B, Fontes M, Colleaux L (Mar 2000). "The human EZH2 gene: genomic organisation and revised mapping in 7q35 within the critical region for malignant myeloid disorders". European Journal of Human Genetics. 8 (3): 174–80. doi:10.1038/sj.ejhg.5200439. PMID 10780782.
- Raaphorst FM, Otte AP, van Kemenade FJ, Blokzijl T, Fieret E, Hamer KM, Satijn DP, Meijer CJ (May 2001). "Distinct BMI-1 and EZH2 expression patterns in thymocytes and mature T cells suggest a role for Polycomb genes in human T cell differentiation". Journal of Immunology. 166 (10): 5925–34. doi:10.4049/jimmunol.166.10.5925. PMID 11342607.
- O'Connell S, Wang L, Robert S, Jones CA, Saint R, Jones RS (Nov 2001). "Polycomblike PHD fingers mediate conserved interaction with enhancer of zeste protein". The Journal of Biological Chemistry. 276 (46): 43065–73. doi:10.1074/jbc.M104294200. PMID 11571280.
- Varambally S, Dhanasekaran SM, Zhou M, Barrette TR, Kumar-Sinha C, Sanda MG, Ghosh D, Pienta KJ, Sewalt RG, Otte AP, Rubin MA, Chinnaiyan AM (Oct 2002). "The polycomb group protein EZH2 is involved in progression of prostate cancer" (PDF). Nature. 419 (6907): 624–9. doi:10.1038/nature01075. hdl:2027.42/62896. PMID 12374981. S2CID 4414767.
- Kleer CG, Cao Q, Varambally S, Shen R, Ota I, Tomlins SA, Ghosh D, Sewalt RG, Otte AP, Hayes DF, Sabel MS, Livant D, Weiss SJ, Rubin MA, Chinnaiyan AM (Sep 2003). "EZH2 is a marker of aggressive breast cancer and promotes neoplastic transformation of breast epithelial cells". Proceedings of the National Academy of Sciences of the United States of America. 100 (20): 11606–11. doi:10.1073/pnas.1933744100. PMC 208805. PMID 14500907.