단백질분해효소
Protease단백질 분해효소(펩티다아제 또는 단백질 분해효소라고도 함)는 단백질 분해를 촉매하고 단백질을 더 작은 폴리펩타이드 또는 단일 아미노산으로 분해하여 새로운 단백질 생성물의 [1]형성을 촉진하는 효소이다.그들은 물이 결합을 깨는 반응인 가수 분해에 의해 단백질 내의 펩타이드 결합을 분해함으로써 이것을 한다.단백질 분해 효소는 섭취한 단백질의 소화, 단백질 [2][3]이화 작용, 그리고 세포 신호를 포함한 많은 생물학적 기능에 관여합니다.
기능성 촉진제가 없다면 단백질 분해는 매우 [4]느릴 것이고 수백 년이 걸릴 것이다.단백질 분해 효소는 모든 형태의 생물과 바이러스에서 발견될 수 있다.그들은 독립적으로 여러 번 진화했고, 다른 종류의 단백질 분해 효소는 완전히 다른 촉매 메커니즘에 의해 동일한 반응을 수행할 수 있습니다.
단백질 분해효소 계층
촉매 잔류물 기준
단백질 분해 효소는 크게 7가지 [5]그룹으로 분류할 수 있습니다.
- 세린단백질가수분해효소 - 세린알코올 사용
- 시스테인 단백질 분해효소 - 시스테인 티올 사용
- 트레오닌 단백질 분해효소 - 트레오닌 2차 알코올 사용
- 아스파르트 단백질 분해효소 - 아스파르트산 카르본산 사용
- 글루탐산카르본산 사용 글루탐산단백질가수분해효소
- 금속단백질가수분해효소 - 금속(일반적으로[2][3] 아연) 사용
- 아스파라긴펩타이드분해효소 - 아스파라긴을 사용하여 제거반응(물 불필요)
단백질 분해 효소는 1993년 진화 관계에 따라 84개 계열로 분류되었으며, 세린, 시스테인, 아스파르트, 메탈로 단백질 분해 [6]효소의 4가지 촉매 유형으로 분류되었다.트레오닌과 글루탐산 단백질 분해효소는 각각 1995년과 2004년까지 기술되지 않았다.펩타이드 결합을 절단하는 데 사용되는 메커니즘은 시스테인과 트레오닌(단백질분해효소)을 가진 아미노산 잔류물 또는 물 분자(아스파르트산, 금속단백질분해효소)를 친핵성으로 만들어 펩타이드 카르보닐기를 공격할 수 있도록 한다.친핵체를 만드는 한 가지 방법은 히스티딘 잔기가 친핵체로서 세린, 시스테인 또는 트레오닌을 활성화하기 위해 사용되는 촉매 삼합체에 의한 것이다.그러나 친핵성 유형은 서로 다른 슈퍼패밀리에서 수렴적으로 진화해 왔고, 일부 슈퍼패밀리는 서로 다른 여러 핵 친핵성으로 발산되는 진화를 보여주기 때문에 이것은 진화적 그룹이 아니다.
펩타이드분해효소
단백질 분해 효소의 일곱 번째 촉매 유형인 아스파라긴 펩타이드 리아제는 2011년에 설명되었다.단백질 분해 메커니즘은 가수 분해가 아니라 제거 [7]반응을 하기 때문에 특이하다.이 반응 동안 촉매 아스파라긴은 적절한 조건에서 단백질의 아스파라긴 잔류물에서 스스로를 분해하는 순환 화학 구조를 형성한다.근본적으로 다른 메커니즘으로 인해 펩티드가수분해효소로서의 포함은 논란의 [7]여지가 있을 수 있다.
진화 계통학
단백질분해효소 진화 [8]슈퍼패밀리의 최신 분류는 MEROPS 데이터베이스에서 찾을 수 있다.본 데이터베이스에서 단백질 분해 효소는 구조, 메커니즘 및 촉매 잔류 순서(예를 들어 P가 친핵성 패밀리의 혼합물을 나타내는 PA 클랜)에 따라 먼저 '클란'(슈퍼 패밀리)으로 분류된다.각 '클랜' 내에서 단백질 분해효소는 배열 유사성에 따라 군으로 분류된다(예를 들어 PA 클랜 내의 S1 및 C3 군).각 패밀리는 수백 개의 관련 단백질 분해효소(예: S1 패밀리의 트립신, 엘라스타아제, 트롬빈 및 스트렙토그리신)를 포함할 수 있다.
현재 50개 이상의 씨족이 알려져 있으며, 각 씨족은 단백질 [8]분해의 독립적인 진화적 기원을 나타낸다.
최적 pH에 따른 분류
또는 단백질 분해 효소는 활성 상태인 최적 pH로 분류할 수 있다.
- 산단백질가수분해효소
- 중성단백질가수분해효소(type 1 과민증)여기서, 이것은 비만 세포에 의해 방출되어 보체와 [9]키닌의 활성화를 일으킨다.이 그룹에는 캘레인이 포함됩니다.
- 염기성 단백질분해효소(또는 알칼리성 단백질분해효소)
효소 기능 및 메커니즘
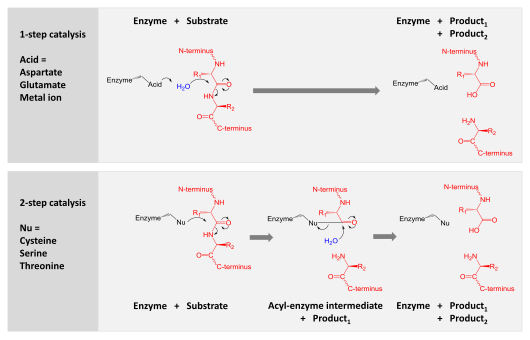
단백질 분해 효소는 아미노산 잔기를 연결하는 펩타이드 결합을 분할하여 긴 단백질 사슬을 짧은 조각으로 소화시키는 데 관여합니다.어떤 것들은 단백질 사슬에서 말단 아미노산을 분리하고(아미노펩티다아제, 카르복시펩티다아제 A와 같은 엑소펩티다아제) 다른 것들은 단백질의 내부 펩타이드 결합을 공격한다(트립신, 키모트립신, 펩신, 파파인, 엘라스타제 등).
촉매 작용
촉매 작용은 다음 두 가지 메커니즘 중 하나로 이루어집니다.
- 아스파르트, 글루탐 및 금속단백질가수분해효소는 물 분자를 활성화하고, 물 분자는 펩타이드 결합을 가수분해하기 위해 친핵 공격을 실시한다.
- 세린, 트레오닌 및 시스테인 단백질 분해효소는 (대개 촉매 삼합체 내에서) 친핵성 잔류물을 사용한다.이 잔류물은 단백질 분해 효소를 기질 단백질과 공유 결합하기 위해 친핵성 공격을 수행하며, 생성물의 전반을 방출합니다.이 공유가 아실 효소 중간체는 활성화된 물에 의해 가수분해되어 제품의 후반부를 방출하고 유리 효소를 재생함으로써 촉매 작용을 완료한다.
특이성
단백질 분해는 광범위한 단백질 기질이 가수분해되도록 고도로 문란해질 수 있다.이것은 작은 펩타이드 조각으로 섭취된 단백질의 배열을 쪼갤 수 있어야 하는 트립신과 같은 소화 효소의 경우이다.혼합단백질가수분해효소는 전형적으로 기질상의 단일 아미노산에 결합하기 때문에 그 잔류물에 대한 특이성만 가지고 있다.예를 들어, 트립신은 시퀀스에 고유합니다.K\... 또는...R\... ('\'=사이트 [10]분리).
반대로 일부 단백질 분해 효소는 매우 특이적이며 특정 배열의 기질만 절단한다.혈액 응고(트롬빈 등) 및 바이러스성 폴리단백질 처리(TEV 단백질 분해효소 등)는 정확한 절단 이벤트를 달성하기 위해 이 수준의 특이성을 필요로 한다.이는 특정 잔류물에 결합하는 여러 개의 포켓이 있는 긴 결합 균열 또는 터널을 가진 단백질 분해 효소에 의해 달성됩니다.예를 들어, TEV 단백질 분해효소는 배열에 특이적입니다.ENLYFQ\S...('\'=사이트 [11]삭제).
열화 및 자가 분해
단백질 분해 효소는 그 자체로 단백질이며, 때로는 같은 종류의 다른 단백질 분해 효소 분자에 의해 분해됩니다.이것은 단백질 분해효소 활성을 조절하는 방법으로 작용한다.일부 단백질 분해효소(예: TEV 단백질 분해효소)는 자가 분해 후 활성이 낮은 반면, 다른 단백질 분해효소(예: 트립시노겐)는 더 활성적이다.
단백질 분해효소의 생물다양성
단백질 분해효소는 원핵생물부터 진핵생물, 바이러스까지 모든 생물에서 발생한다.이러한 효소는 식품 단백질의 단순 소화에서 고도로 조절된 계단식까지 다양한 생리 반응에 관여한다(예: 혈액 응고 계단식, 보체 시스템, 아포토시스 경로, 그리고 무척추 동물 프로페놀옥시다아제 활성화 계단식).단백질 분해효소는 단백질의 아미노산 배열에 따라 특정 펩타이드 결합을 파괴하거나(제한 단백질 분해), 펩타이드를 아미노산으로 완전히 분해할 수 있다(제한 단백질 분해).활성은 파괴적인 변화일 수 있고(단백질의 기능을 폐지하거나 주요 성분으로 소화), 기능의 활성화일 수도 있고 신호 전달 경로의 신호가 될 수도 있습니다.
식물
채식주의 레넷이라고 불리는 프로테아제를 함유한 식물 용액은 유럽과 중동에서 수백 년 동안 코셔와 할랄 치즈를 만드는데 사용되어 왔다.Withania cogulans의 채식주의 레넷은 인도 아대륙에서 소화 및 당뇨병에 대한 아유르베다 치료제로 수천 년 동안 사용되어 왔습니다.또한 Paner를 만드는 데도 사용됩니다.
식물 게놈은 수백 개의 단백질 분해 효소를 암호화하는데, 주로 알려지지 않은 기능을 가지고 있다.알려진 기능을 가진 사람들은 주로 개발 [12]규제에 관여한다.식물단백질가수분해효소는 광합성을 [13]조절하는 역할도 한다.
동물
단백질 분해 효소는 다양한 신진대사 과정을 위해 유기체 전체에 사용된다.위장으로 분비되는 산단백질가수분해효소(예: 펩신)와 십이지장에 존재하는 세린단백질가수분해효소(트립신과 키모트립신)는 우리가 음식에서 단백질을 소화할 수 있게 해준다.혈청에 존재하는 단백질 분해효소(트롬빈, 플라즈민, 헤이지만 인자 등)는 혈액 응고, 응괴의 용해 및 면역계의 올바른 작용에 중요한 역할을 한다.다른 단백질 분해 효소는 백혈구(탄성효소, 카테프신 G)에 존재하며 대사 조절에 여러 가지 다른 역할을 한다.일부 뱀 독은 또한 Pit viper hemotoxin과 같은 단백질 분해효소이며 희생자의 혈액 응고를 방해합니다.단백질 분해 효소는 호르몬, 항체, 또는 다른 효소들과 같은 중요한 생리적인 역할을 하는 다른 단백질의 수명을 결정합니다.이것은 유기체의 생리학에서 가장 빠른 "켜는" 조절 메커니즘 "끄기" 중 하나입니다.
복잡한 협력 작용에 의해 단백질 분해 효소는 캐스케이드 반응을 촉매할 수 있으며, 이는 생리적 신호에 대한 유기체의 반응을 빠르고 효율적으로 증폭시키는 결과를 낳는다.
박테리아
박테리아는 단백질의 펩타이드 결합을 가수 분해하기 위해 단백질 분해 효소를 분비하여 단백질을 구성 아미노산으로 분해합니다.박테리아와 곰팡이 단백질 분해효소는 단백질의 재활용에서 전지구적인 탄소와 질소 순환에 특히 중요하며, 그러한 활동은 이러한 [14]유기체의 영양 신호에 의해 조절되는 경향이 있습니다.단백질은 탄소, 질소 [15]또는 유황 제한에 반응하여 분해되므로 토양에 존재하는 수천 종의 단백질 분해효소 활성의 영양 조절의 순 영향은 전체 미생물 군집 수준에서 관찰될 수 있습니다.
박테리아는 펴지거나 잘못 접힌 단백질을 분해하여 일반적인 단백질 품질 관리(예: AAA+ 단백질)를 담당하는 단백질 분해 효소를 포함합니다.
분비된 세균단백질가수분해효소는 또한 엑소톡신으로서 작용할 수 있으며, 세균병원성에서의 독성인자(예를 들어 각질독소)의 예가 될 수 있다.세균성 외독성 단백질 분해효소는 세포외 구조를 파괴한다.
바이러스
일부 바이러스의 게놈은 하나의 거대한 폴리단백질을 암호화하는데, 이것은 이것을 기능 단위로 분해하기 위해 단백질 분해 효소가 필요하다.[16]이러한 단백질 분해효소(예: TEV 단백질 분해효소)는 높은 특이성을 가지며 매우 제한된 일련의 기질 염기서열만 분해한다.따라서 그들은 단백질분해효소 억제제의 [17][18]공통 표적이다.
사용하다
단백질 분해효소 연구 분야는 거대하다.2004년 이후,[19] 이 분야와 관련된 논문은 매년 약 8000편 발행되었습니다.단백질 분해 효소는 산업, 의학 및 기본적인 생물학적 연구 [20][21]도구로 사용됩니다.
소화 단백질 분해 효소는 많은 세탁 세제의 일부이며 빵 산업에서 빵 개량제에 광범위하게 사용됩니다.다양한 단백질 분해효소는 의학적으로 원어민 기능(예: 혈액 응고 제어) 또는 완전한 인공 기능(예: 병원성 단백질의 표적 분해)에 모두 사용된다.TEV단백질가수분해효소 및 트롬빈과 같은 고특이성 단백질 분해효소는 일반적으로 융합단백질 및 친화력 태그를 제어된 방식으로 절단하는 데 사용됩니다.
억제제
프로테아제 활성은 프로테아제 억제제에 [22]의해 억제된다.단백질분해효소 억제제의 한 예는 세르핀 슈퍼패밀리이다.알파1-안티트립신(자체 염증성 단백질 분해효소의 과도한 효과로부터 신체를 보호하는 것), 알파1-안티키모트립신(똑같이), C1-인히비터(자체 보체계의 과도한 단백질 분해효소 유발 활성화로부터 신체를 보호하는 것), 안티트롬빈(자체 응고로부터 신체를 보호하는 것), 플라스마를 포함한다.minogen 활성화제 억제제-1(단백질분해효소-피브리노 분해를 차단하여 부적절한 응고로부터 신체를 보호함) 및 neuroserpin.[23]
자연단백질가수분해효소 억제제는 세포조절과 분화에 역할을 하는 리포칼린 단백질군을 포함한다.리포칼린 단백질에 부착된 친유성 리간드는 종양단백질가수분해효소 억제 특성을 가지고 있는 것으로 밝혀졌다.천연단백질가수분해효소 억제제는 항레트로바이러스 치료에 사용되는 단백질분해효소 억제제와 혼동해서는 안 된다.HIV/AIDS를 포함한 일부 바이러스는 생식 주기 동안 단백질 분해 효소에 의존합니다.따라서 단백질분해효소 억제제는 항바이러스 치료제로 개발된다.
다른 천연단백질가수분해효소억제제가 방어기제로 사용된다.일반적인 예로는 몇몇 식물의 씨앗에서 발견되는 트립신 억제제가 있는데, 인간에게 가장 주목되는 것은 주요 식량 작물인 콩이며, 콩은 포식자를 단념시키는 역할을 한다.생콩은 그들이 함유하고 있는 단백질 분해효소 억제제가 변성될 때까지 인간을 포함한 많은 동물들에게 독성이 있다.
「 」를 참조해 주세요.
- 리가아제
- 단백질분해효소
- PA 클랜
- 수렴 진화
- 단백질 분해
- 촉매 삼합체
- 단백질 분해 지도
- 혈관신생의 단백질분해효소
- 망내단백질가수분해효소
- 단백질분해효소억제제(약리학)
- 단백질분해효소억제제(생물학)
- TopFIND - 단백질 분해효소 특이성, 기질, 제품 및 억제제 데이터베이스
- MEROPS - 단백질분해효소 진화군 데이터베이스
레퍼런스
- ^ López-Otín, Carlos; Bond, Judith S. (November 2008). "Proteases: Multifunctional Enzymes in Life and Disease". Journal of Biological Chemistry. 283 (45): 30433–30437. doi:10.1074/jbc.R800035200. PMC 2576539. PMID 18650443.
- ^ a b King, John V.; Liang, Wenguang G.; Scherpelz, Kathryn P.; Schilling, Alexander B.; Meredith, Stephen C.; Tang, Wei-Jen (2014-07-08). "Molecular basis of substrate recognition and degradation by human presequence protease". Structure. 22 (7): 996–1007. doi:10.1016/j.str.2014.05.003. ISSN 1878-4186. PMC 4128088. PMID 24931469.
- ^ a b Shen, Yuequan; Joachimiak, Andrzej; Rosner, Marsha Rich; Tang, Wei-Jen (2006-10-19). "Structures of human insulin-degrading enzyme reveal a new substrate recognition mechanism". Nature. 443 (7113): 870–874. Bibcode:2006Natur.443..870S. doi:10.1038/nature05143. ISSN 1476-4687. PMC 3366509. PMID 17051221.
- ^ Radzicka A, Wolfenden R (July 1996). "Rates of Uncatalyzed Peptide Bond Hydrolysis in Neutral Solution and the Transition State Affinities of Proteases". JACS. 118 (26): 6105–6109. doi:10.1021/ja954077c.
To assess the relative proficiencies of enzymes that catalyze the hydrolysis of internal and C-terminal peptide bonds [...]
- ^ Oda K (2012). "New families of carboxyl peptidases: serine-carboxyl peptidases and glutamic peptidases". Journal of Biochemistry. 151 (1): 13–25. doi:10.1093/jb/mvr129. PMID 22016395.
- ^ Rawlings ND, Barrett AJ (February 1993). "Evolutionary families of peptidases". The Biochemical Journal. 290 (Pt 1) (Pt 1): 205–18. doi:10.1042/bj2900205. PMC 1132403. PMID 8439290.
- ^ a b Rawlings ND, Barrett AJ, Bateman A (November 2011). "Asparagine peptide lyases: a seventh catalytic type of proteolytic enzymes". The Journal of Biological Chemistry. 286 (44): 38321–8. doi:10.1074/jbc.M111.260026. PMC 3207474. PMID 21832066.
- ^ a b Rawlings ND, Barrett AJ, Bateman A (August 2010). "MEROPS: the peptidase database". Nucleic Acids Res. 38 (Database issue): D227–33. doi:10.1093/nar/gkp971. PMC 2808883. PMID 19892822.
- ^ Mitchell RS, Kumar V, Abbas AK, Fausto N (2007). Robbins Basic Pathology (8th ed.). Philadelphia: Saunders. p. 122. ISBN 978-1-4160-2973-1.
- ^ Rodriguez J, Gupta N, Smith RD, Pevzner PA (January 2008). "Does trypsin cut before proline?". Journal of Proteome Research. 7 (1): 300–5. doi:10.1021/pr0705035. PMID 18067249.
- ^ Renicke C, Spadaccini R, Taxis C (2013-06-24). "A tobacco etch virus protease with increased substrate tolerance at the P1' position". PLOS ONE. 8 (6): e67915. Bibcode:2013PLoSO...867915R. doi:10.1371/journal.pone.0067915. PMC 3691164. PMID 23826349.
- ^ van der Hoorn RA (2008). "Plant proteases: from phenotypes to molecular mechanisms" (PDF). Annual Review of Plant Biology. 59: 191–223. doi:10.1146/annurev.arplant.59.032607.092835. hdl:11858/00-001M-0000-0012-37C7-9. PMID 18257708.
- ^ Zelisko A, Jackowski G (October 2004). "Senescence-dependent degradation of Lhcb3 is mediated by a thylakoid membrane-bound protease". Journal of Plant Physiology. 161 (10): 1157–70. doi:10.1016/j.jplph.2004.01.006. PMID 15535125.
- ^ Sims GK (2006). "Nitrogen Starvation Promotes Biodegradation of N-Heterocyclic Compounds in Soil". Soil Biology & Biochemistry. 38 (8): 2478–2480. doi:10.1016/j.soilbio.2006.01.006.
- ^ Sims GK, Wander MM (2002). "Proteolytic activity under nitrogen or sulfur limitation". Appl. Soil Ecol. 568: 1–5.
- ^ Tong L (2002). "Viral Proteases". Chemical Reviews. 102 (12): 4609–4626. doi:10.1021/cr010184f. PMID 12475203.
- ^ Skoreński M, Sieńczyk M (2013). "Viral proteases as targets for drug design". Current Pharmaceutical Design. 19 (6): 1126–53. doi:10.2174/13816128130613. PMID 23016690.
- ^ Yilmaz NK, Swanstrom R, Schiffer CA (July 2016). "Improving Viral Protease Inhibitors to Counter Drug Resistance". Trends in Microbiology. 24 (7): 547–557. doi:10.1016/j.tim.2016.03.010. PMC 4912444. PMID 27090931.
- ^ Barrett AJ, Rawlings ND, Woessnerd JF (2004). Handbook of proteolytic enzymes (2nd ed.). London, UK: Elsevier Academic Press. ISBN 978-0-12-079610-6.
- ^ Hooper NM, ed. (2002). Proteases in biology and medicine. London: Portland Press. ISBN 978-1-85578-147-4.
- ^ Feijoo-Siota L, Villa TG (28 September 2010). "Native and Biotechnologically Engineered Plant Proteases with Industrial Applications". Food and Bioprocess Technology. 4 (6): 1066–1088. doi:10.1007/s11947-010-0431-4. S2CID 84748291.
- ^ Southan C (July 2001). "A genomic perspective on human proteases as drug targets". Drug Discovery Today. 6 (13): 681–688. doi:10.1016/s1359-6446(01)01793-7. PMID 11427378.
- ^ Puente XS, López-Otín C (April 2004). "A genomic analysis of rat proteases and protease inhibitors". Genome Research. 14 (4): 609–22. doi:10.1101/gr.1946304. PMC 383305. PMID 15060002.
외부 링크
| 라이브러리 리소스 정보 단백질분해효소 |



