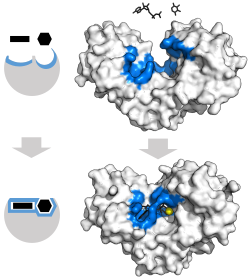
효소 촉매 작용
Enzyme catalysis효소 촉매 작용은 생물학적 분자인 "효소"에 의한 과정 속도의 증가이다.대부분의 효소는 단백질이고, 그러한 과정은 화학 반응이다.효소 내에서, 일반적으로 촉매 작용은 활성 부위라고 불리는 국소적인 부위에서 일어납니다.
대부분의 효소는 단백질, 단일 단백질 사슬 또는 다중 서브유닛 복합체의 많은 그러한 사슬들로 주로 만들어진다.효소는 또한 종종 금속 이온이나 보조 인자로 알려진 특수 유기 분자(예: 아데노신 삼인산)와 같은 비단백질 성분을 포함합니다.많은 보조 인자는 비타민이며, 비타민으로서의 역할은 신진대사에서 생물학적 과정의 촉매 작용에 사용되는 것과 직접적으로 관련이 있습니다.세포 내 생화학적 반응의 촉매 작용은 필수적이지만 많은 대사상 필수적인 반응들이 촉매를 거치지 않았을 때 매우 낮은 속도를 가지기 때문에 중요하다.단백질 진화의 한 동인은 그러한 촉매 활동의 최적화이다. 비록 가장 중요한 효소만이 촉매 효율 한계 근처에서 작동하고 많은 효소는 최적과는 거리가 멀다.효소 촉매 작용의 중요한 요소에는 단백질[1] 역학을 포함한 운동 효과뿐만 아니라 일반 산 및 염기 촉매 작용, 안와 조향, 엔트로픽 제한, 방향 효과(잠금 및 주요 촉매 작용)가 포함된다.
효소 촉매 작용의 메커니즘은 다양하지만, 중요한 요인은 반응물(또는 기질)을 제품에서 분리하는 에너지 장벽의 감소라는 점에서 원칙적으로 다른 유형의 화학 촉매 작용과 유사하다.활성화 에너지(Ea)의 감소는 이러한 장벽을 극복하고 생성물을 형성할 수 있는 반응 물질 분자의 비율을 증가시킵니다.중요한 원칙은 효소는 생성물과 반응물 사이의 에너지 장벽만 감소시키기 때문에 항상 양방향으로 반응을 촉매하고 반응을 진행시키거나 평형 위치에 영향을 줄 수 없다는 것입니다. 즉, 효소가 달성된 속도만 해당됩니다.다른 촉매와 마찬가지로 효소는 (기질처럼) 반응에 의해 소비되거나 변화하지 않고 단일 효소가 여러 라운드의 촉매 작용을 수행하도록 재활용된다.
효소는 종종 매우 특이하며 특정 기질에만 작용한다.어떤 효소는 그들이 하나의 기질에만 작용한다는 절대적인 특정한 의미인 반면, 다른 효소는 그룹 특이성을 보여주고 다른 분자의 펩타이드 결합과 같이 유사하지만 동일하지 않은 화학 그룹에 작용할 수 있다.많은 효소들은 입체화학적 특이성을 가지고 있고 하나의 입체 이성질체에 작용하지만 [2]다른 입체 이성질체에 작용하지는 않는다.
유도 핏
효소-기질 상호작용의 고전적 모델은 유도 적합 모델이다.[3]이 모델은 효소와 기질 사이의 초기 상호작용이 상대적으로 약하지만, 이러한 약한 상호작용이 결합을 강화하는 효소의 구조 변화를 빠르게 유도한다고 제안한다.
유도적합 메커니즘의 장점은 강력한 효소 결합의 안정화 효과로 인해 발생한다.기판결합에는 강력한 기판결합을 가진 균일한 결합과 강한 전이상태결합을 가진 차동결합의 두 가지 다른 메커니즘이 있다.균일한 결합의 안정화 효과는 기질과 전이 상태 결합 친화력을 모두 증가시키는 반면, 미분 결합은 전이 상태 결합 친화력만 증가시킨다.둘 다 효소에 의해 사용되며 반응의 활성화 에너지를 최소화하기 위해 진화적으로 선택되었다.포화상태, 즉 높은 친화성 기질 결합을 가진 효소는 활성화 에너지를 줄이기 위해 차등 결합을 필요로 하는 반면, 작은 기질 결합되지 않은 효소는 미분 결합 또는 균일한 [4]결합을 사용할 수 있다.
이러한 효과는 대부분의 단백질로 하여금 활성화 에너지를 줄이기 위해 미분 결합 메커니즘을 사용하게 하여, 대부분의 기질들은 전이 상태일 때 효소에 대한 높은 친화력을 가진다.미분결합은 유도적합기구에 의해 수행되며, 먼저 기질이 약하게 결합하고, 그 후 효소가 배형을 변화시켜 전이상태에 대한 친화력을 증가시키고 안정화시킴으로써 도달하기 위한 활성화 에너지를 감소시킨다.
그러나 유도 적합 개념을 촉매 작용을 합리화하는 데 사용할 수 없다는 점을 명확히 하는 것이 중요하다.즉, 화학적 촉매 작용은 (효소가 없는) 물에서 비촉매 반응에서 E에 대한‡a‡ E의 감소로a‡ 정의된다.유도 적합은 효소의 닫힌 형태에서 장벽이 더 낮음을 나타낼 뿐 장벽 감소의 이유가 무엇인지 우리에게 말해주지 않는다.
유도 적합은 구조 교정 [5]메커니즘을 통해 경쟁과 노이즈의 존재에서 분자 인식의 충실도에 이롭습니다.
대체 반응 경로의 메커니즘
이러한 구조 변화는 활성 부위의 촉매 잔류물을 반응으로 변화되는 기질의 화학 결합에 가깝게 만듭니다.결합이 일어난 후, 하나 이상의 촉매 작용 메커니즘은 반응을 위한 대체 화학적 경로를 제공함으로써 반응 전이 상태의 에너지를 낮춥니다."장벽 너머" 촉매 작용과 "장벽을 통과하는" 메커니즘에는 6가지 가능한 메커니즘이 있습니다.
근접성과 방향성
효소-기질 상호작용은 반응하는 화학 그룹을 정렬하고 최적의 기하학으로 서로 가깝게 유지시켜 반응 속도를 증가시킵니다.이것은 두 개의 반응물이 하나의 생성물이 되었을 때 전체적인 엔트로피가 감소하기 때문에 반응물의 엔트로피를 감소시키고, 따라서 첨가 또는 전달 반응을 덜 불리하게 만든다.그러나 이는 일반적인 효과이며 시약의 "유효 농도" 증가로 인해 발생하는 비첨가 또는 전이 반응에서 나타난다.이것은 농도의 증가가 어떻게 반응 속도의 증가로 이어지는지를 고려할 때 이해된다. 즉, 기본적으로 반응 물질이 더 집중될 때 더 자주 충돌하므로 더 자주 반응한다.효소 촉매 작용에서 시약의 효소에 대한 결합은 원하는 반응을 촉진하기 위해 더 자주 그리고 정확한 기하학적 구조를 가지고 충돌하도록 반응물의 구성 공간을 제한하고, '적절한 방향'으로 서로 근접하게 유지한다."유효 농도"는 동일한 충돌 빈도를 경험하기 위해 반응물이 용액에서 자유로워야 하는 농도입니다.종종 그러한 이론적인 유효 농도는 비물리적이며 현실에서 실현이 불가능하며, 이는 많은 효소의 촉매력이 크다는 증거이며, 촉매되지 않은 상태에서 엄청난 속도가 증가한다.
| 예를 들어 다음과 같습니다. |
| 유사한 반응은 분자 내 반응일 경우 훨씬 더 빨리 일어날 것이다. |
 |
| 분자내 반응에서 아세테이트의 유효 농도는 k/k1 = 2 x5 10 Molar로2 추정할 수 있다. |
그러나, 현대의 컴퓨터 연구는 근접 효과의 전통적인 예가 효소 엔트로피 [6][7][8]효과와 직접적으로 관련될 수 없다는 것을 밝혀냈기 때문에 상황은 더 복잡할 수 있다.또한 원래의 엔트로피[9] 제안은 촉매 [10]작용에 대한 배향 엔트로피의 기여도를 크게 과대평가하는 것으로 밝혀졌다.
양성자 공여체 또는 수용체
양성자 기증자와 수용체, 즉 산과 염기는 전이 상태에서 현상 전하를 안정시키기 위해 양성자를 기증하고 수용한다.이는 촉매 작용의 전반적인 원리, 즉 에너지 장벽을 줄이는 원리와 관련이 있는데, 일반적으로 전이 상태는 높은 에너지 상태이며, 이를 안정화함으로써 높은 에너지가 감소하여 장벽을 낮춘다.많은 비생물적 촉매에 대한 효소 촉매의 주요 특징은 산 촉매와 염기 촉매가 모두 동일한 반응으로 결합될 수 있다는 것이다.많은 비생물 시스템에서, 산이나 염기는 반응 속도를 증가시킬 수 있습니다; 하지만 물론 환경은 하나의 전체적인 pH만을 가질 수 있습니다.그러나 효소는 큰 분자이기 때문에 활성 부위에 산성기와 염기성기를 모두 배치하여 기질과 상호작용할 수 있으며, 부피 pH와는 무관하게 두 가지 모드를 모두 사용할 수 있다.
흔히 친핵성 및/또는 친전자성 그룹을 활성화하거나 이탈 그룹을 안정화하기 위해 일반 산 또는 염기 촉매 작용이 사용된다.활성 부위에는 세린과 트레오닌뿐만 아니라 글루탐산, 아스파라긴산, 히스티딘, 시스틴, 티로신, 리신 및 아르기닌과 같은 산성 또는 염기성 아미노산이 많이 사용된다.또한 카르보닐기 및 아미드N기를 가진 펩타이드 골격을 이용하는 경우가 많다.시스틴과 히스티딘은 둘 다 중성 pH에 가까운 pKa를 가지고 있기 때문에 양성자를 받아들이고 기증할 수 있기 때문에 매우 일반적으로 관여한다.
산/염기 촉매 작용과 관련된 많은 반응 메커니즘은 실질적으로 변경된 pKa를 가정한다.이러한 pKa의 변경은 잔류물의[citation needed] 국소 환경을 통해 가능합니다.
| 조건들 | 산 | 베이스 |
|---|---|---|
| 소수성 환경 | pKa 증가 | pKa 감소 |
| 유사한 전하의 인접 잔류물 | pKa 증가 | pKa 감소 |
| 염교(및 수소) 결합)형성 | pKa 감소 | pKa 증가 |
pKa는 또한 용액에서 기본적인 잔류물이 양성자 공여자로 작용할 수 있고, 그 반대도 마찬가지일 정도로 주변 환경의 영향을 크게 받을 수 있다.
| 예를 들어 다음과 같습니다. |
| 세린단백질가수분해효소 촉매삼중합체 |
 |
| 세린 단백질 분해효소 촉매 메커니즘의 첫 번째 단계는 활성 부위의 히스티딘이 세린 잔류물로부터 양성자를 받아들이는 것을 포함한다.이것은 기질의 아미드 결합을 공격하기 위한 친핵체로서의 세린을 준비시킨다.이 메커니즘에는 세린(염기, pKa 14)에서 히스티딘(산, pKa 6)으로의 양성자 기증이 포함되며, 이는 염기의 국소적인 환경 때문에 가능하다. |
pKa의 수정은 정전 [11]메커니즘의 순수 부분임을 명확히 하는 것이 중요합니다.또한 상기 예시의 촉매 효과는 주로 옥시아니온의 pKa 감소 및 히스티딘의 pKa 증가와 관련되며, 세린에서 히스티딘으로의 양성자 전달은 속도 결정 [12]장벽이 아니기 때문에 크게 촉매되지 않는다.표시된 예에서 히스티딘 복합산은 사면체 중간체로부터 아민의 후속 손실을 위한 일반적인 산 촉매로 작용한다는 점에 유의하십시오.그러나 이 제안된 메커니즘을 뒷받침하는 증거(참고문헌 [13]13의 그림 4)는 [14]수정되었다.
정전 촉매 작용
하전 전이 상태의 안정화는 활성 부위에서 중간체와의 이온 결합(또는 부분 이온 전하 상호작용)을 형성하는 잔류물에 의해서도 이루어질 수 있다.이러한 결합은 리신, 아르기닌, 아스파라긴산 또는 글루탐산과 같은 아미노산에서 발견되는 산성 또는 염기성 곁사슬에서 나올 수 있고 아연과 같은 금속 보조인자에서 나올 수 있습니다.금속 이온은 특히 효과적이며 물의 pKa를 감소시켜 효과적인 친핵성을 만들 수 있습니다.
체계적인 컴퓨터 시뮬레이션 연구는 정전 효과가 촉매 [11]작용에 가장 큰 기여를 한다는 것을 밝혀냈다.이것은 반응 속도를 최대7 [15]10배까지 증가시킬 수 있다.특히 효소는 물보다 극성이 높은 환경을 제공하고, 이온 전이 상태는 고정 쌍극자에 의해 안정화된다는 것이 밝혀졌다.이는 물 분자가 "재조직 에너지"[16]로 비용을 지불해야 하는 물에서의 전이 상태 안정화와는 매우 다릅니다.이온과 충전 상태를 안정시키기 위해.따라서, 촉매 작용은 효소 극성 그룹이 사전에 조직되어 있다는 사실과 관련이 있다.
효소의 활성 부위가 발휘하는 정전장의 크기는 효소의 촉매 속도 [18]향상과 높은 상관 관계가 있는 것으로 나타났다.
기질의 결합은 일반적으로 활성부위로부터의 물을 배제하고, 따라서 국소 유전율을 유기용매의 유전율까지 낮춘다.이렇게 하면 대전/극성 기판과 활성 부위 간의 정전 상호작용이 강화됩니다.또한 활성 부위에 대한 전하 분포는 촉매 반응의 전이 상태를 안정시키기 위해 배치된다는 연구결과가 있다.몇몇 효소에서, 이러한 전하 분포는 극성 기질을 결합 부위로 유도하여 이러한 효소 반응의 속도가 명백한 확산 제어[citation needed] 한계보다 커지도록 하는 역할을 한다.
| 예를 들어 다음과 같습니다. |
| 카르복시펩티드가수분해효소촉매기구 |
 |
| 사면체 중간체는 Zn2+ 이온과 산소의 음전하 사이의 부분 이온 결합에 의해 안정화된다. |
공유 촉매 작용
공유가 촉매 작용은 효소 활성 부위 내 잔류물 또는 공동 인자와 함께 일시적인 공유 결합을 형성하는 기질을 포함한다.이것은 반응에 추가적인 공유 중간체를 추가하고 반응의 이후 전이 상태의 에너지를 감소시키는 데 도움이 됩니다.효소를 재생하기 위해서는 반응의 후반 단계에서 공유 결합이 파괴되어야 한다.이 메커니즘은 키모트립신 및 트립신과 같은 단백질 분해 효소의 촉매 삼합체에 의해 이용되며, 여기서 아실 효소 중간체가 형성된다.대체기구는 해당과정 중 알돌라아제 효소에서 볼 수 있는 리신잔기로부터의 유리아민을 이용한 시프염기 형성이다.
일부 효소는 피리독살 인산염(PLP) 또는 티아민 피로인산염(TPP)과 같은 비아미노산 보조 인자를 사용하여 반응물 [19][20]분자와 공유 중간체를 형성합니다.이러한 공유 중간체는 활성 부위 아미노산 잔기로 형성된 공유 중간체가 안정화를 가능하게 하는 방법과 유사하게 이후의 전이 상태의 에너지를 감소시키는 기능을 하지만, 보조 인자의 기능은 효소가 아미노산 측면 잔기로서는 수행할 수 없는 반응을 수행하도록 한다.이러한 보조인자를 이용한 효소는 PLP 의존성 효소 아스파르트산 트랜스아미나아제 [21][22]및 TPP 의존성 효소인 피루브산탈수소효소를 포함한다.
반응 경로에 대한 활성화 에너지를 낮추는 대신, 공유 촉매 작용은 (공유 중간체를 통해) 반응을 위한 대체 경로를 제공하므로 진정한 촉매 [11]작용과는 구별된다.예를 들어 키모트립신에서 세린 분자에 대한 공유 결합의 에너지학은 비촉매 용액 반응에서 친핵체에 대한 잘 알려진 공유 결합과 비교되어야 한다.공유 촉매(용액의 해당 장벽보다 낮은 장벽)의 진정한 제안은 예를 들어 효소 그룹에 의한 전이 상태에 대한 부분 공유 결합(예: 매우 강한 수소 결합)을 필요로 하며, 그러한 효과는 촉매 작용에 유의하게 기여하지 않는다.
금속 이온 촉매 작용
활성부위 내의 금속이온은 전하 안정화 및 차폐를 조정함으로써 촉매작용에 관여한다.금속은 양전하를 띠기 때문에 [23]금속 이온을 통해 음전하만 안정화시킬 수 있습니다.그러나 금속 이온은 [24]pH의 변화에 영향을 받지 않기 때문에 생물학적 촉매 작용에 유리하다.금속 이온은 또한 루이스 [25]산의 역할을 함으로써 물을 이온화하는 역할을 할 수 있다.금속 이온은 산화 및 [26]환원 작용제일 수도 있습니다.
본드 변형률
이것은 효소의 전이 상태에 대한 친화력이 기질 자체보다 더 큰 유도 적합 결합의 주요 효과이다.이것은 기판 결합을 변형시키는 구조적 재배열을 유도하여 기판과 전이 상태 사이의 에너지 차이를 낮추고 반응을 촉매하는 데 도움을 준다.
그러나 스트레인 효과는 사실상 전이 상태 안정화 [11][27][page needed]효과가 아니라 지반 상태 불안정 효과이다.또한 효소는 매우 유연하여 큰 변형 효과를 [28]낼 수 없다.
활성부위의 잔류물을 활성화하기 위해 기질 중의 결합 변형 외에 효소 자체 내에서 결합 변형도 유도할 수 있다.
| 예를 들어 다음과 같습니다. |
| 리소자임의 기질, 결합 기질 및 전이 상태 구조. |
| 결합 시 기질은 (적도 c6이 축방향 위치에 있도록 강요하는 단백질의 아미노산이 있는 입체 장애로 인해) 헥소스 고리의 반의자 [29]형태에서 전환 상태와 유사한 형태로 변형된다.</ref>[page needed] |
양자 터널링
이러한 전통적인 "장벽을 넘는" 메커니즘은 "장벽을 통과하는" 메커니즘의 모델과 관찰(양자 터널링)에 의해 일부 경우에 문제가 제기되었다.일부 효소는 기존의 δG에‡ 의해 예측되는 속도보다 빠른 속도 동태로 작동한다."장벽을 통과하는" 모델에서는 양성자나 전자가 활성화 [30][31]장벽을 통해 터널을 뚫을 수 있다.양성자에 대한 양자 터널링은 [32]방향족 아민 탈수소효소에 의한 트립타민 산화에서 관찰되었다.
양자 터널링은 용액에서 촉매 [31][33][34][35]반응과 비촉매 반응에서 터널링 기여도가 유사하기 때문에 촉매적 이점을 크게 제공하지 않는 것으로 보인다.그러나 터널링 기여(일반적으로 '장벽 너머' 경로의 반응 속도에 비해 속도 상수를 약 1000배[32] 향상)는 생물학적 유기체의 생존에 매우 중요하다.이것은 생물학에서 터널링 반응의 일반적인 중요성을 강조한다.
1971-1972년 효소 촉매 작용의 첫 양자역학 모델이 [36][37][third-party source needed]공식화되었습니다.
활성효소
효소-기질 복합체의 결합 에너지는 기질 활성화에 필요한 외부 에너지로 간주할 수 없다.반응제(또는 두번째 그룹의 단일 반응제)활성 부위에 제품에 기질 변환을 끝낼 이동해야 하 높은 에너지 콘텐츠의 효소로 효소의 촉매 사이트에서 첫번째 바인딩 된 물질, 그 후 또 다른 그룹 X2의 마지막 장소로 묶었다 2에 나와 있는 특정 에너지가 넘치는 그룹 X1전송할 수 있다. a그리고 효소 재생.[38]
전체 효소 반응을 두 가지 결합 반응으로 나타낼 수 있습니다.
- S1 + EX1 → SEX11 → P1 + EP2
(1)
- S2 + EP2 → SEP22 → P2 + EX2
(2)
반응 (1)에서 효소의 X군이1 생성물에 나타나는 것을 알 수 있는데, 이는 원자의 정전기 억제와 반발을 피하기 위한 효소 내부의 교환 반응 가능성 때문이다.활성 효소를 효소 반응의 강력한 반응물로 나타냅니다.반응(2)은 X군이2 효소 내부에 남아 있기 때문에 기질의 불완전한 변환을 나타낸다.아이디어로서의 이 접근법은 이전에는 가설적으로 매우 높은 효소 변환(촉매적으로 완벽한 효소)[39]에 의존하여 제안되었다.
현재 접근법의 검증을 위한 중요한 점은 촉매가 반응의 전달기와 효소의 복합체여야 한다는 것이다.이러한 화학적 측면은 여러 효소 반응의 잘 연구된 메커니즘에 의해 뒷받침된다.세린단백질가수분해효소 계열의 잘 연구된 구성원인 순수 단백질 α-키모트립신(보조인자 없이 작용하는 효소)에 의해 촉매되는 펩타이드 결합 가수분해 반응을 고려해보자.[40]
우리는 이 반응에 대한 실험 결과를 두 가지 화학적 단계로 제시한다.
- S1 + EH → P1 + EP2
(3)
- EP2 + H-O-H → EH + P2
(4)
여기서1 S는 폴리펩타이드, P와12 P는 생성물입니다.첫 번째 화학공정(3)은 공유가 아실효소 중간체의 형성을 포함한다.두 번째 단계(4)는 탈아실화 단계입니다.처음에 효소에서 발견되었지만 물에서는 발견되지 않은 H+ 그룹은 가수분해 단계 전에 생성물에 나타나므로 효소 반응의 추가 그룹으로 간주될 수 있습니다.
따라서 (3) 반응은 효소가 반응의 강력한 반응물질로 작용함을 보여준다.제안된 개념에 따르면 효소로부터의 H수송은 첫 번째 반응물 변환, 첫 번째 초기 화학 결합의 분해를 촉진한다(그룹 P와1 P 사이2).가수분해 단계는 두 번째 화학 결합의 분해와 효소의 재생으로 이어진다.
제안된 화학적 메커니즘은 배지의 기질 또는 생성물의 농도에 의존하지 않는다.그러나, 농도 변화는 수용액에서 S 또는 P를 불문하고 모든 분자의 자유 에너지 함량의 변화로 인해 (1) 및 (2) 반응의 첫 번째 및 마지막 단계에서 자유 에너지 변화를 주로 일으킨다.이 접근법은 다음과 같은 근육 수축 메커니즘을 따릅니다.골격근에서 ATP 가수분해의 마지막 단계는 미오신 헤드와 액틴의 [41]결합에 의해 야기되는 생성물 방출이다.결합 반응 중 액틴 결합 균열의 닫힘은 구조적으로 미오신 활성 [42]부위의 뉴클레오티드 결합 포켓의 개방과 결합된다.
특히 ATP 가수분해의 마지막 단계는 인산염의 빠른 방출과 ADP의 [43][44]느린 방출을 포함한다.인산 음이온은 분자량이 낮기 때문에 결합 ADP 음이온에서 수용액으로의 방출은 발기성 반응으로 간주될 수 있다.
따라서 무기 인산염24− HPO의 일차 방출은 ATP 가수분해 자유 에너지의 상당 부분을 용매화된 인산염의 운동 에너지로 변환하여 활성 스트리밍을 생성한다는 결론에 도달했다.이러한 국소 기계-화학 변환의 가정은 근육 수축의 Tirosh 메커니즘과 일치하며, 여기서 근육력은 ATP 가수 [45][46]분해에 의해 생성된 활성 흐름의 통합된 작용에서 파생된다.
촉매 메커니즘의 예
실제로 대부분의 효소 메커니즘은 몇 가지 다른 유형의 촉매작용의 조합을 포함한다.
트리오스인산 이성질화효소
인산트리오스 이성질화효소(EC 5.3.1.1)는 인산디히드록시아세톤과 3-인산디글리세랄데히드의 가역적 상호변환을 촉매한다.
트립신
트립신(EC 3.4.21.4)은 리신 또는 아르기닌 잔기 후 단백질 기질을 분해하여 공유가자 촉매를 실시하고, 전이 상태에서 전하 축적을 안정시키기 위한 옥시 음이온 구멍을 이용하여 분해하는 세린 단백질 분해효소이다.
알돌라아제
알돌라아제(EC 4.1.2.13)는 과당 1,6-이인산(F-1,6-BP)을 글리세린알데히드 3-인산 및 디히드록시아세톤인산(DHAP)으로 분해하는 것을 촉매한다.
효소확산성
2010년대 단분자 연구의 등장으로 기질 농도가 높아지고 반응 엔탈피가 [47]증가함에 따라 구속되지 않은 효소의 움직임이 증가한다는 관측이 나왔다.후속 관찰에 따르면 이러한 확산성의 증가는 효소의 질량 중심이 일시적으로 변위되어 "효소를 추진시키는 리코일 효과"[48]를 가져온다.
반응 유사성
효소 반응(EC) 간의 유사성은 결합 변화, 반응 중심 또는 하위 구조 메트릭을 사용하여 계산할 수 있습니다(EC-BLAST Archived at the Wayback Machine [49]2019년 5월 30일).
「 」를 참조해 주세요.
- 촉매 삼합체
- 효소 분석
- 효소억제제
- 효소역학
- 효소 문란성
- 단백질 역학
- 촉매 불활성에도 불구하고 편재성이 오믹 함의를 시사하는 의사 효소
- 양자 터널링
- 단백질 분해 지도
- 시간 분해 결정학
레퍼런스
- ^ Kamerlin SC, Warshel A (May 2010). "At the dawn of the 21st century: Is dynamics the missing link for understanding enzyme catalysis?". Proteins. 78 (6): 1339–1375. doi:10.1002/prot.22654. PMC 2841229. PMID 20099310.
- ^ Laidler KJ (1978). Physical Chemistry with Biological Applications. Benjamin/Cummings. p. 427. ISBN 978-0-8053-5680-9.
- ^ Koshland DE (February 1958). "Application of a Theory of Enzyme Specificity to Protein Synthesis". Proceedings of the National Academy of Sciences of the United States of America. 44 (2): 98–104. Bibcode:1958PNAS...44...98K. doi:10.1073/pnas.44.2.98. PMC 335371. PMID 16590179.

- ^ Anslyn EV, Dougherty DA (2006). Modern Physical Organic Chemistry. University Science Books. ISBN 978-1-891389-31-3.
- ^ Savir Y, Tlusty T (May 2007). Scalas E (ed.). "Conformational proofreading: the impact of conformational changes on the specificity of molecular recognition". PLOS ONE. 2 (5): e468. Bibcode:2007PLoSO...2..468S. doi:10.1371/journal.pone.0000468. PMC 1868595. PMID 17520027.

- ^ Stanton RV, Peräkylä M, Bakowies D, Kollman PA (1998). "Combined ab initio and Free Energy Calculations To Study Reactions in Enzymes and Solution: Amide Hydrolysis in Trypsin and Aqueous Solution". J. Am. Chem. Soc. 120 (14): 3448–3457. doi:10.1021/ja972723x.
- ^ Kuhn B, Kollman PA (2000). "QM-FE and Molecular Dynamics Calculations on Catechol O-Methyltransferase: Free Energy of Activation in the Enzyme and in Aqueous Solution and Regioselectivity of the Enzyme-Catalyzed Reaction". J. Am. Chem. Soc. 122 (11): 2586–2596. doi:10.1021/ja992218v.
- ^ Bruice TC, Lightstone FC (1999). "Ground State and Transition State Contributions to the Rates of Intramolecular and Enzymatic Reactions". Acc. Chem. Res. 32 (2): 127–136. doi:10.1021/ar960131y.
- ^ Page MI, Jencks WP (August 1971). "Entropic contributions to rate accelerations in enzymic and intramolecular reactions and the chelate effect". Proceedings of the National Academy of Sciences of the United States of America. 68 (8): 1678–1683. Bibcode:1971PNAS...68.1678P. doi:10.1073/pnas.68.8.1678. PMC 389269. PMID 5288752.
- ^ Warshel A, Parson WW (November 2001). "Dynamics of biochemical and biophysical reactions: insight from computer simulations". Quarterly Reviews of Biophysics. 34 (4): 563–679. doi:10.1017/s0033583501003730. PMID 11852595. S2CID 28961992.
- ^ a b c d Warshel A, Sharma PK, Kato M, Xiang Y, Liu H, Olsson MH (August 2006). "Electrostatic basis for enzyme catalysis". Chemical Reviews. 106 (8): 3210–3235. doi:10.1021/cr0503106. PMID 16895325.
- ^ Warshel A, Naray-Szabo G, Sussman F, Hwang JK (May 1989). "How do serine proteases really work?". Biochemistry. 28 (9): 3629–3637. doi:10.1021/bi00435a001. PMID 2665806.
- ^ Fersht AR, Requena Y (December 1971). "Mechanism of the -chymotrypsin-catalyzed hydrolysis of amides. pH dependence of k c and K m . Kinetic detection of an intermediate". Journal of the American Chemical Society. 93 (25): 7079–7087. doi:10.1021/ja00754a066. PMID 5133099.
- ^ Zeeberg B, Caswell M, Caplow M (April 1973). "Concerning a reported change in rate-determining step in chymotrypsin catalysis". Journal of the American Chemical Society. 95 (8): 2734–2735. doi:10.1021/ja00789a081. PMID 4694533.
- ^ Voet D, Voet JG (2011). Biochemistry. John Wiley & Sons. OCLC 808679090.
- ^ Marcus RA (1965). "On the Theory of Electron-Transfer Reactions. VI. Unified Treatment for Homogeneous and Electrode Reactions" (PDF). J. Chem. Phys. 43 (2): 679–701. Bibcode:1965JChPh..43..679M. doi:10.1063/1.1696792.
- ^ Warshel A (November 1978). "Energetics of enzyme catalysis". Proceedings of the National Academy of Sciences of the United States of America. 75 (11): 5250–5254. Bibcode:1978PNAS...75.5250W. doi:10.1073/pnas.75.11.5250. PMC 392938. PMID 281676.
- ^ Fried SD, Bagchi S, Boxer SG (December 2014). "Extreme electric fields power catalysis in the active site of ketosteroid isomerase". Science. New York, N.Y. 346 (6216): 1510–4. Bibcode:2014Sci...346.1510F. doi:10.1126/science.1259802. PMC 4668018. PMID 25525245.
- ^ 토니, M.D. "피리독살 효소의 반응 특이성"생화학 및 생물물리학 아카이브 (2005) 433: 279-287
- ^ 오리건 주립 대학교 미량 영양 정보 센터
- ^ Voet D, Voet JG (2004). Biochemistry. John Wiley & Sons Inc. pp. 986–989. ISBN 978-0-471-25090-6.
- ^ Voet D, Voet JG (2004). Biochemistry. John Wiley & Sons Inc. pp. 604–606. ISBN 978-0-471-25090-6.
- ^ Piccirilli JA, Vyle JS, Caruthers MH, Cech TR (January 1993). "Metal ion catalysis in the Tetrahymena ribozyme reaction". Nature. 361 (6407): 85–88. Bibcode:1993Natur.361...85P. doi:10.1038/361085a0. PMID 8421499. S2CID 4326584.
- ^ Bender ML (1 January 1962). "Metal Ion Catalysis of Nucleophilic Organic Reactions in Solution". Reactions of Coordinated Ligands. Advances in Chemistry. Vol. 37. American Chemical Society. pp. 19–36. doi:10.1021/ba-1963-0037.ch002. ISBN 978-0-8412-0038-8.
- ^ Fife TH, Przystas TJ (1 February 1985). "Divalent metal ion catalysis in the hydrolysis of esters of picolinic acid. Metal ion promoted hydroxide ion and water catalyzed reactions". Journal of the American Chemical Society. 107 (4): 1041–1047. doi:10.1021/ja00290a048. ISSN 0002-7863.
- ^ Stadtman ER (1 January 1990). "Metal ion-catalyzed oxidation of proteins: biochemical mechanism and biological consequences". Free Radical Biology & Medicine. 9 (4): 315–325. doi:10.1016/0891-5849(90)90006-5. PMID 2283087.
- ^ Jencks WP (1987) [1969]. Catalysis in Chemistry and Enzymology. McGraw-Hill series in advanced chemistry (reprint ed.). New York: Dover Publications. ISBN 978-0-486-65460-7.
- ^ Warshel A, Levitt M (May 1976). "Theoretical studies of enzymic reactions: dielectric, electrostatic and steric stabilization of the carbonium ion in the reaction of lysozyme". Journal of Molecular Biology. 103 (2): 227–249. doi:10.1016/0022-2836(76)90311-9. PMID 985660.

- ^ Voet D, Voet JG, Pratt CW (2013). Fundamentals of Biochemistry: Life at the Molecular Level (Fourth ed.). Hoboken, NJ: Wiley. ISBN 978-0-470-54784-7.
- ^ Garcia-Viloca M, Gao J, Karplus M, Truhlar DG (January 2004). "How enzymes work: analysis by modern rate theory and computer simulations". Science. 303 (5655): 186–195. Bibcode:2004Sci...303..186G. doi:10.1126/science.1088172. PMID 14716003. S2CID 17498715.
- ^ a b Olsson MH, Siegbahn PE, Warshel A (March 2004). "Simulations of the large kinetic isotope effect and the temperature dependence of the hydrogen atom transfer in lipoxygenase". Journal of the American Chemical Society. 126 (9): 2820–2828. doi:10.1021/ja037233l. PMID 14995199.
- ^ a b Masgrau L, Roujeinikova A, Johannissen LO, Hothi P, Basran J, Ranaghan KE, et al. (April 2006). "Atomic description of an enzyme reaction dominated by proton tunneling". Science. 312 (5771): 237–241. Bibcode:2006Sci...312..237M. doi:10.1126/science.1126002. PMID 16614214. S2CID 27201250.
- ^ Hwang JK, Warshel A (1996). "How important are quantum mechanical nuclear motions in enzyme catalysis". J. Am. Chem. Soc. 118 (47): 11745–11751. doi:10.1021/ja962007f.
- ^ Ball P (September 2004). "Enzymes: by chance, or by design?". Nature. 431 (7007): 396–397. Bibcode:2004Natur.431..396B. doi:10.1038/431396a. PMID 15385982. S2CID 228263.
- ^ Olsson MH, Parson WW, Warshel A (May 2006). "Dynamical contributions to enzyme catalysis: critical tests of a popular hypothesis". Chemical Reviews. 106 (5): 1737–1756. doi:10.1021/cr040427e. PMID 16683752.
- ^ Vol'kenshtein MV, Dogonadze RR, Madumarov AK, Urushadze ZD, Kharkats YI (1972). "The theory of enzyme catalysis". Molecular Biology. Moscow. 6 (3): 347–353. PMID 4645409.
- ^ Volkenshtein MV, Dogonadze RR, Madumarov AK, Urushadze ZD, Kharkats Yu I (1973). "Electronic and Conformational Interactions in Enzyme Catalysis.". Konformatsionnie Izmenenia Biopolimerov v Rastvorakh. Moscow: Nauka Publishing House. pp. 153–157.
- ^ Foigel AG (June 2011). "Is the enzyme a powerful reactant of the biochemical reaction?". Molecular and Cellular Biochemistry. 352 (1–2): 87–89. doi:10.1007/s11010-011-0742-4. PMID 21318350. S2CID 11133081.
- ^ Fogel AG (August 1982). "Cooperativity of enzymatic reactions and molecular aspects of energy transduction". Molecular and Cellular Biochemistry. 47 (1): 59–64. doi:10.1007/bf00241567. PMID 7132966. S2CID 21790380.
- ^ Hengge AC, Stein RL (January 2004). "Role of protein conformational mobility in enzyme catalysis: acylation of alpha-chymotrypsin by specific peptide substrates". Biochemistry. 43 (3): 742–747. doi:10.1021/bi030222k. PMID 14730979.
- ^ Lymn RW, Taylor EW (December 1971). "Mechanism of adenosine triphosphate hydrolysis by actomyosin". Biochemistry. 10 (25): 4617–4624. doi:10.1021/bi00801a004. PMID 4258719.
- ^ Holmes KC, Angert I, Kull FJ, Jahn W, Schröder RR (September 2003). "Electron cryo-microscopy shows how strong binding of myosin to actin releases nucleotide". Nature. 425 (6956): 423–427. Bibcode:2003Natur.425..423H. doi:10.1038/nature02005. PMID 14508495. S2CID 2686184.
- ^ Siemankowski RF, Wiseman MO, White HD (February 1985). "ADP dissociation from actomyosin subfragment 1 is sufficiently slow to limit the unloaded shortening velocity in vertebrate muscle". Proceedings of the National Academy of Sciences of the United States of America. 82 (3): 658–662. Bibcode:1985PNAS...82..658S. doi:10.1073/pnas.82.3.658. PMC 397104. PMID 3871943.
- ^ White HD, Belknap B, Webb MR (September 1997). "Kinetics of nucleoside triphosphate cleavage and phosphate release steps by associated rabbit skeletal actomyosin, measured using a novel fluorescent probe for phosphate". Biochemistry. 36 (39): 11828–11836. doi:10.1021/bi970540h. PMID 9305974.
- ^ Tirosh R, Low WZ, Oplatka A (March 1990). "Translational motion of actin filaments in the presence of heavy meromyosin and MgATP as measured by Doppler broadening of laser light scattering". Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology. 1037 (3): 274–280. doi:10.1016/0167-4838(90)90025-b. PMID 2178685.
- ^ Tirosh R (2006). "Ballistic protons and microwave-induced water solutions (solitons) in bioenergetic transformations". Int. J. Mol. Sci. 7 (9): 320–345. doi:10.3390/i7090320.
- ^ Muddana HS, Sengupta S, Mallouk TE, Sen A, Butler PJ (February 2010). "Substrate catalysis enhances single-enzyme diffusion". Journal of the American Chemical Society. 132 (7): 2110–2111. doi:10.1021/ja908773a. PMC 2832858. PMID 20108965.

- ^ Riedel C, Gabizon R, Wilson CA, Hamadani K, Tsekouras K, Marqusee S, et al. (January 2015). "The heat released during catalytic turnover enhances the diffusion of an enzyme". Nature. 517 (7533): 227–230. Bibcode:2015Natur.517..227R. doi:10.1038/nature14043. PMC 4363105. PMID 25487146.

- ^ Rahman SA, Cuesta SM, Furnham N, Holliday GL, Thornton JM (February 2014). "EC-BLAST: a tool to automatically search and compare enzyme reactions". Nature Methods. 11 (2): 171–174. doi:10.1038/nmeth.2803. PMC 4122987. PMID 24412978.
추가 정보
- Fersht A (1998). Structure and Mechanism in Protein Science : A Guide to Enzyme Catalysis and Protein Folding. New York: W.H. Freeman. ISBN 978-0-7167-3268-6.
- Sutcliffe M, Munro A (August 2006). "Quantum catalysis in enzymes—beyond the transition state theory". Philosophical Transactions B. 361 (1472): 1291–1455. doi:10.1098/rstb.2006.1879.
외부 링크
 Wikimedia Commons 효소 촉매 관련 매체
Wikimedia Commons 효소 촉매 관련 매체