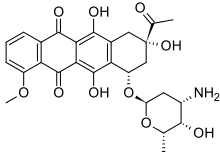
안트라퀴논
Anthraquinones모분자 9,10-안트라퀴논은 안트라퀴논을 참조한다.
안트라퀴논(Antraquinones, 일명 안트라퀴노이드)은 9,10안트라퀴논 골격을 기반으로 자연적으로 발생하는 페놀성 화합물의 일종이다. 그것들은 산업적으로 널리 사용되고 자연적으로 발생한다.
식물에서의 발생
안트라퀴논의 유도체인 천연색소가 알로에 라텍스, 세나, 대황, 캐스카라 벅톤, 곰팡이, 이끼, 그리고 몇몇 곤충에서 발견된다. 타입 II 폴리케티드 신타제는 포토하브두스 루민센스 박테리아에서 안트라퀴논 생합성을 담당한다.[1] 식생통로에서 이소초리스마이트 싱타아제에 의해 형성된 초리스마이트는 모린다 구시리폴리아에 있는 안트라퀴논의 전구체다.[2] 천연 추출물에 함유된 안트라퀴논에 대한 테스트가 확립되었다.[3]
- 세나 글리코시드는 세나에서 나온다.
- 프랑굴라 알누스의 프랑굴린.
- 알로에 수지에 알로에에모딘.
- 카민, 곤충에서 유래한 밝은 붉은 색소.[4]
- 헤라티시닌과 파고피린은 나프토디안트로네, 안트라퀴논 데리브제다.
적용들
과산화수소 생산에 있어서
안트라퀴논의 대규모 산업 적용은 과산화수소 생산을 위한 것으로, 안트라퀴논 그 자체보다는 2-에틸-9,10-안트라퀴논 또는 관련 알킬파생물이 사용된다.[5]
수백만 톤의 과산화수소가 안트라퀴논 공정에 의해 제조된다.[6]
펄핑
2안트라퀴논설폰산나트륨(AMS)은 수용성 안트라퀴논 유도체로, 알칼리성 펄핑 과정에서 촉매작용을 하는 것으로 밝혀진 최초의 안트라퀴논 유도체다.[7]
다이스터프 전구체
9,10안트라퀴논 해골은 알리자린과 같은 많은 염료에서 발생한다.[8] 9,10안트라퀴논의 중요한 파생상품은 1-니트로안트라퀴논, 안트라퀴논-1-술폰산, 디니트로안트라퀴논이다.[9]
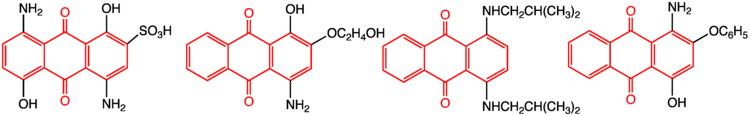
약
9,10안트라퀴논의 파생상품은 무연탄화물과 화학요법 약물의 무연탄화과를 포함한 많은 중요한 약물을 포함한다. 후자의 약들은 이탈리아에서 아드리아 바다 근처의 토양 샘플을 발견한 스트렙토미세스 페우세티우스 박테리아에서 유래되었다. 안트라퀴논 계열의 약으로는 원형 다우노루비신, 독소루비신, 미톡산트론, 로소산트론, 픽산트론 등이 있다. 픽산트론을 제외한 이들 약물의 대부분은 극도의 카디톡스성으로, 돌이킬 수 없는 심근증을 유발해 암 치료에서 실질적인 유용성을 제한할 수 있다.[9]
무연탄은 또한 다음을 포함한다.
- 루피갈롤과 같은 말라리아 퇴치물
- DRAQ5, DRAQ7 및 Cy와 같은 DNA 염료/핵 계수TRAK Orange for flow cytometry and fluoroscence 현미경.
- 안트라퀴논 유도체: 레인, 에모딘, 알로에 에모딘, 파리에틴(피시온), 카시아 후시덴탈리스에서 추출한 크리소파놀은 독성이 있으며 어린이들에게 간뇌성 뇌병증을 유발하는 것으로 알려져 있다.[10]
| |
|
단트론, 에모딘, 알로에 에모딘, 그리고 세나 글리코사이드 중 몇몇은 이완제 효과를 가지고 있다. 장기간 사용하고 남용하면 대장균이 발생한다.[11][12] 5개의 안트라퀴논은 알츠하이머병 진행에 중요한 것으로 생각되는 두 개의 나선형 필라멘트를 쥐 모델과 체외 테스트 모두에서 타우 골재의 형성을 억제하고 용해시키는 것으로 나타났지만 치료제로 연구되지는 않았다.[13]
참조
- ^ Brachmann, AO; Joyce, SA; Jenke-Kodama, H; Schwär, G; Clarke, DJ; Bode, HB (2007). "A type II polyketide synthase is responsible for anthraquinone biosynthesis in Photorhabdus luminescens". ChemBioChem. 8 (14): 1721–8. doi:10.1002/cbic.200700300. PMID 17722122.
- ^ Stalman, M; Koskamp, AM; Luderer, R; Vernooy, JH; Wind, JC; Wullems, GJ; Croes, AF (2003). "Regulation of anthraquinone biosynthesis in cell cultures of Morinda citrifolia". Journal of Plant Physiology. 160 (6): 607–14. doi:10.1078/0176-1617-00773. PMID 12872482.
- ^ Akinjogunla OJ, Yah CS, Eghafona NO, Ogbemudia FO (2010). "Antibacterial activity of leave extracts of Nymphaea lotus (Nymphaeaceae) on Methicillin resistant Staphylococcus aureus (MRSA) and Vancomycin resistant Staphylococcus aureus (VRSA) isolated from clinical samples". Annals of Biological Research. 1 (2): 174–184.
- ^ Dapson, R. W.; Frank, M.; Penney, D. P.; Kiernan, J. A. (2007). "Revised procedures for the certification of carmine (C.I. 75470, Natural red 4) as a biological stain". Biotechnic & Histochemistry. 82 (1): 13–15. doi:10.1080/10520290701207364. PMID 17510809.
- ^ Goor, G.; Glenneberg, J.; Jacobi, S. (2007). "Hydrogen Peroxide". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a13_443.pub2. ISBN 978-3527306732.
- ^ Campos-Martin, Jose M.; Blanco-Brieva, Gema; Fierro, Jose L. G. (2006). "Hydrogen Peroxide Synthesis: An Outlook beyond the Anthraquinone Process". Angewandte Chemie International Edition. 45 (42): 6962–6984. doi:10.1002/anie.200503779. PMID 17039551.
- ^ "Anthraquinone / Alkali Pulping - A Literature Review" (PDF). Project 3370. Appleton, Wisconsin: The Institute of Paper Chemistry. 1978-07-05.
- ^ Bien, H.-S.; Stawitz, J.; Wunderlich, K. (2005). "Anthraquinone Dyes and Intermediates". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a02_355.
- ^ a b Vogel, A. "Anthraquinone". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a02_347.
- ^ Panigrahi, G.K.; Suthar, M.K.; Verma, N.; Asthana, S.; Tripathi, A.; Gupta, S.K.; Saxena, J. K.; Raisuddin, S.; Das, M. (2015). "Investigation of the interaction of anthraquinones of Cassia occidentalis seeds with bovine serum albumin by molecular docking and spectroscopic analysis: Correlation to their in vitro cytotoxic potential". Food Research International. 77: 368–377. doi:10.1016/j.foodres.2015.08.022.
- ^ Müller-Lissner, S. A. (1993). "Adverse Effects of Laxatives: Fact and Fiction". Pharmacology. 47 (Suppl 1): 138–145. doi:10.1159/000139853. PMID 8234421.
- ^ Moriarty, K. J.; Silk, D. B. (1988). "Laxative Abuse". Digestive Diseases. 6 (1): 15–29. doi:10.1159/000171181. PMID 3280173.
- ^ Pickhardt, M.; Gazova, Z.; von Bergen, M.; Khlistunova, I.; Wang, Y.; Hascher, A.; Mandelkow, E. M.; Biernat, J.; Mandelkow, E. (2005). "Anthraquinones Inhibit Tau Aggregation and Dissolve Alzheimer's Paired Helical Filaments in vitro and in Cells" (PDF). The Journal of Biological Chemistry. 280 (5): 3628–3635. doi:10.1074/jbc.M410984200. PMID 15525637.